ТЕМА НОМЕРА: РЕКОМБИНАНТНЫЕ ТЕРАПЕВТИЧЕСКИЕ БЕЛКИ
ВВЕДЕНИЕ. При создании биотехнологических лекарственных препаратов ключевое значение имеет разработка высокопродуктивных клеточных линий-продуцентов рекомбинантных белков. Отработка протоколов селекции и подходов для эффективного скрининга линий-продуцентов целевых белков — необходимый этап разработки технологии производства рекомбинантных белков с высоким выходом целевого продукта.
ЦЕЛЬ. Получение высокопродуктивных клеточных линий-продуцентов рекомбинантного белка деносумаба на основе суспензионной клеточной линии СНО.
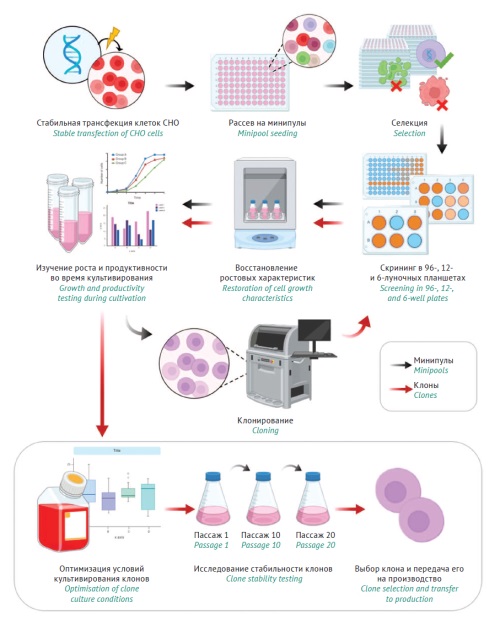
МАТЕРИАЛЫ И МЕТОДЫ. Использовалась суспензионная клеточная линия СНО-К1. Для культивирования применялись среды и подпитки без использования сыворотки или других компонентов животного происхождения. Клетки линии СНО трансфицировали плазмидами, содержащими гены легкой и тяжелой цепей деносумаба, с использованием метода электропорации с помощью системы MaxCyte STX. Селекцию трансфицированных клеток проводили с добавлением антибиотиков (гигромицин, генетицин). Моноклональные клеточные линии получали с использованием системы ClonePix FL. Проводили периодическое культивирование с добавлением подпитки и определение концентрации деносумаба методом иммуноферментного анализа (ИФА) в культуральной жидкости для выявления лидерных моноклональных клеточных линий.
РЕЗУЛЬТАТЫ. Оптимальная концентрация антибиотиков для селекции клеточных линий-продуцентов на основе клеток СНО составила 600 мг/л гигромицина и 600 мг/л генетицина. После проведения трансфекции из 1920 минипулов селекцию прошел 1041 (около 54%). Отбор минипулов-продуцентов деносумаба проводили путем скрининга проб культуральной жидкости с использованием ИФА из 96-, 24- и 6-луночных планшетов. Отобранные 23 лидерных минипула были адаптированы к условиям шейкерного культивирования. С учетом показателей ростовых и продукционных характеристик минипулов определен лидерный минипул (mp-19) с продуктивностью 1,92 г/л (на 7 сут периодического культивирования). На основе mp-19 получены моноклональные клеточные линии-продуценты деносумаба с продуктивностью до 6,5 г/л на 9 сут культивирования с подпиткой.
ВЫВОДЫ. Получены высокопродуктивные моноклональные клеточные линии-продуценты деносумаба. Предложенный подход к созданию клеток-продуцентов может быть применен для получения различных рекомбинантных белков, включая моноклональные антитела, ферменты, факторы свертывания крови.
ВВЕДЕНИЕ. Нехватка систематических сравнительных данных об активности промоторов в Saccharomyces cerevisiae является фактором, ограничивающим повышение эффективности биосинтеза рекомбинантного проинсулина человека. Настоящая работа направлена на экспериментальное сравнение активности ряда конститутивных промоторов в стандартных технологических условиях для определения наиболее продуктивного регуляторного элемента, применимого в промышленных штаммах-продуцентах.
ЦЕЛЬ. Оценить влияние промоторов TEF1, ADH2, ALD4, TDH3 (GPD), TPI1 на экспрессию рекомбинантного проинсулина человека в Saccharomyces cerevisiae и ранжировать их по силе для выбора оптимального промотора, обеспечивающего максимальную продуктивность.
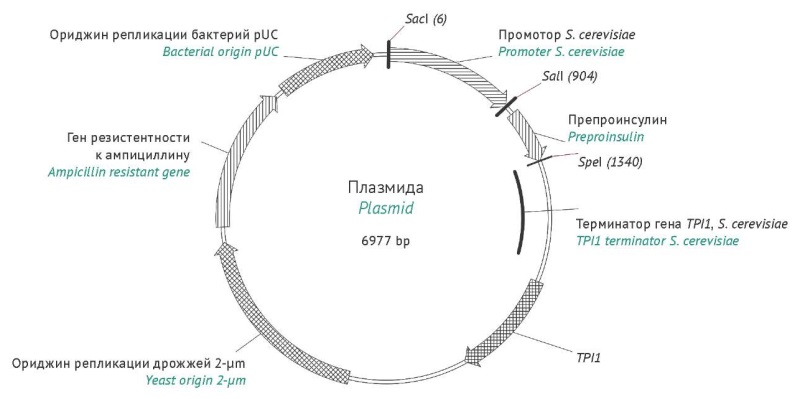
МАТЕРИАЛЫ И МЕТОДЫ. Для экспрессии предшественника инсулина (проинсулина) человека использовали диплоидный штамм S. cerevisiae YS3, полученный слиянием гаплоидных клеток. Векторная система на основе плазмиды pRS425 включала в себя синтетические промоторы (TPI1, TEF1, ADH2, ALD4, TDH3) и сигнальную последовательность. Конструкции вводили в клетки методом электропорации. Сравнительный анализ экспрессии белка проводили при культивировании S. cerevisiae YS3 в колбах и биореакторах с использованием среды YPD. Определение содержания проинсулина и этанола осуществляли с помощью спектрофотометрии, высокоэффективной жидкостной хроматографии (ВЭЖХ) и газовой хроматографии. Подтверждение экспрессии проводили методом ВЭЖХ, совмещенной с масс-спектрометрией. Статистическая обработка данных выполнялась при помощи дисперсионного и корреляционного анализов.
РЕЗУЛЬТАТЫ. Получены штаммы-продуценты S. cerevisiae YS3/pF1145 (TPI1), YS3/pF1157 (TEF1), YS3/pF1199 (ADH2), YS3/pF1200 (ALD4), YS3/pF1201 (TDH3), и проведено сравнение уровня экспрессии рекомбинантного белка. Штамм YS3/pF1201, в котором экспрессия проинсулина находилась под контролем промотора TDH3, обладал максимальной продуктивностью (15,51±0,57 мг/л). В процессе ферментации в лабораторных биореакторах продуктивность штамма YS3/pF1201 (TDH3) достигла 139,17 мг/л через 72 ч культивирования при значении биомассы 154,50 г/л.
ВЫВОДЫ. Промоторы для экспрессии проинсулина в клетках S. cerevisiae можно распределить по их силе в следующем порядке: TDH3≈ALD4>ADH2>TEF1>TPI1. В процессе ферментации при использовании промотора TDH3 достигнута продуктивность, превышающая в 6,1 раза продуктивность штамма-продуцента с классическим промотором TPI1, который используется для экспрессии проинсулина.
ВВЕДЕНИЕ. В ряде случаев лечение ромиплостимом пациентов с идиопатической тромбоцитопенической пурпурой сопряжено с образованием антилекарственных антител (АЛА), что часто приводит к развитию серьезных неблагоприятных явлений. Для определения связывающих (общих) АЛА (оАЛА) к ромиплостиму в сыворотке крови человека предлагается методика, основанная на биослойной интерферометрии. С технической точки зрения использующие данный принцип приборы имеют некоторые преимущества (высокая пропускная способность, увеличенные межсервисные интервалы, низкий уровень контаминации оборудования при анализе биообразцов) перед приборами на основе поверхностного плазмонного резонанса, которые применяются для мониторинга оАЛА при проведении клинических исследований оригинального препарата. Для обеспечения воспроизводимости измерений и стандартизации лабораторного этапа клинических исследований иммуногенности биоаналогичного препарата необходима валидация методики.
ЦЕЛЬ. Установить ключевые валидационные характеристики методики, основанной на биослойной интерферометрии, для определения общих антилекарственных антител к ромиплостиму в сыворотке крови человека.
МАТЕРИАЛЫ И МЕТОДЫ. Принцип метода заключается в детектировании специфического взаимодействия связывающих антител, содержащихся в исследуемых образцах, с иммобилизованным на поверхности стрептавидиновых биосенсоров биотинилированным ромиплостимом. Методика состоит из этапа скрининг-теста, в котором определяется наличие или отсутствие оАЛА в образцах; подтверждающего теста для проверки специфичности связывания оАЛА с ромиплостимом; этапа определения титра антител, то есть предельного разведения, при котором оАЛА могут быть обнаружены в образцах. В работе использовались положительные контрольные образцы, содержащие различные концентрации поликлональных кроличьих антител к ромиплостиму. Детектирование белкового комплексообразования проводилось в режиме реального времени с использованием интерферометра Octet® QKe.
РЕЗУЛЬТАТЫ. Значения фактора биологической вариабельности и предельного значения незначимого ингибирования составили 1,481 и 34,2% соответственно. Подтверждены прецизионность и специфичность методики. Нижний предел детекции оАЛА в отсутствие ромиплостима составил 622 нг/мл. При оценке эффекта матрицы в скрининг-тесте аналитический сигнал 8 из 10 образцов сыворотки крови после добавления оАЛА увеличился более чем в 1,481 раза; в подтверждающем тесте значение показателя «процент ингибирования» превышало 34,2% при анализе 8 из 10 образцов с добавлением оАЛА. Эффект высокой дозы оАЛА в концентрации от 0,8 до 50 мкг/мл отсутствовал. Результаты определения оАЛА в скрининг-тесте были устойчивы к присутствию 1 нг/мл ромиплостима в образцах. Стрептавидиновые биосенсоры с иммобилизованным ромиплостимом сохраняли стабильность после 14 сут хранения при температуре 5±3 °С и не менее 20 циклов регенерации.
ВЫВОДЫ. Анализ полученных результатов валидации подтвердил пригодность методики на основе биослойной интерферометрии для достоверного и воспроизводимого определения связывающих (общих) антител к ромиплостиму в сыворотке крови человека.
ВВЕДЕНИЕ. Афлиберцепт применяется для лечения неоваскулярной возрастной макулярной дегенерации, приводящей к потере зрения. К числу существенных побочных эффектов афлиберцепта относится его иммуногенность, проявляющаяся в виде выработки антилекарственных антител (АЛА). В рамках оценки иммуногенности препарата актуальной представляется разработка методики определения АЛА к афлиберцепту.
ЦЕЛЬ. Разработка и валидация аналитической методики для иммуноферментного обнаружения и поэтапной характеристики общих антилекарственных антител к афлиберцепту в сыворотке крови человека.
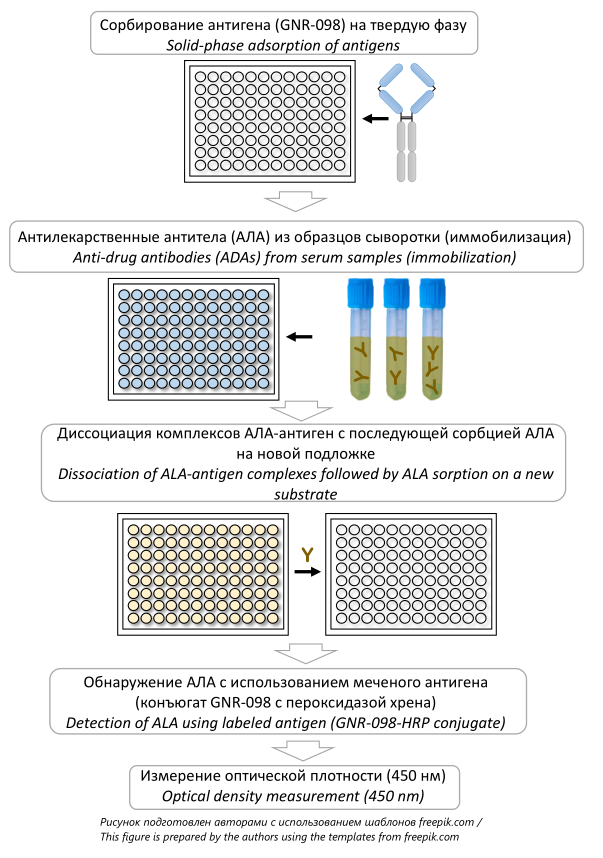
МАТЕРИАЛЫ И МЕТОДЫ. Разработку методики проводили с применением метода твердофазного иммуноферментного анализа (ИФА). Использовали афлиберцепт (GNR-098, АО «ГЕНЕРИУМ», Россия) и конъюгат GNR-098 с пероксидазой хрена. Поликлональные антитела к GNR-098 получали путем иммунизации крыс, последующего отбора сыворотки крови и выделения из нее антител при помощи метода аффинной хроматографии. Обнаружение АЛА осуществляли с использованием меченого GNR-098 при постановке мостикового ИФА. Модельные образцы готовили, используя пулированные сыворотки здоровых доноров с добавлением крысиных поликлональных антител. Валидацию методики проводили по следующим параметрам: пределы исключения методик; прецизионность; предел обнаружения; устойчивость к присутствию в образцах растворимой мишени терапевтического белка; специфичность; эффект матрицы; минимальное необходимое разведение; стабильность; устойчивость к замене ключевого компонента; эффект сверхдозы (хук-эффект).
РЕЗУЛЬТАТЫ. Аналитическая методика включала скрининг-тест для определения возможного наличия АЛА, подтверждающий тест — для установления специфичности обнаруженных АЛА, тест для определения титра АЛА и их принадлежности к классу IgE. Пределы исключения методик для скрининг-теста и для теста определения АЛА класса IgE составили 1,3 и 1,2 соответственно; для подтверждающего теста — 15,2%. Предел обнаружения скрининг-теста составил 185 нг/мл. Продемонстрирована устойчивость методики к присутствию в образцах до 2000 пг/мл растворимой мишени терапевтического белка (hrVEGF165). Отсутствие эффекта матрицы установлено в скрининг-тесте и подтверждающем тесте 13 испытуемых образцов, содержащих АЛА в концентрации 280 нг/мл. Эффект сверхдозы не был установлен в скрининг-тесте и подтверждающем тесте образцов, содержащих АЛА в концентрации, пятикратно превышающей высокоположительный образец.
ВЫВОДЫ. Разработана комплексная аналитическая методика для иммуноферментного обнаружения и поэтапной характеристики общих антилекарственных антител к афлиберцепту (препарат GNR-098) в сыворотке крови человека. Пригодность методики к применению подтверждена в ходе валидации. Разработанная аналитическая система позволит провести оценку иммуногенности афлиберцепта.
СТАНДАРТИЗАЦИЯ И КОНТРОЛЬ КАЧЕСТВА
ВВЕДЕНИЕ. Медицинское применение лекарственных препаратов иммуноглобулинов человека (ЛП ИГЧ) обусловлено их высокой эффективностью в терапии аутоиммунных, иммунодефицитных, воспалительных заболеваний и профилактике заболеваний различной этиологии. Гармонизация национальных стандартов качества на ЛП ИГЧ с мировыми стандартами — одно из приоритетных направлений совершенствования принципов лекарственного обеспечения населения Российской Федерации. Действующие стандарты качества на ЛП ИГЧ нуждаются в актуализации из-за существенных различий в оценке показателей качества с ведущими фармакопеями мира.
ЦЕЛЬ. Систематизация и анализ национальных и международных фармакопейных требований к контролю показателей качества ЛП ИГЧ в рамках гармонизации Государственной фармакопеи Российской Федерации с мировыми стандартами качества для разработки проектов фармакопейных статей по иммуноглобулинам человека.
ОБСУЖДЕНИЕ. Проанализированы монографии зарубежных фармакопей на ЛП ИГЧ: 14 монографий в Европейской и Британской фармакопеях, 7 — Индийской фармакопеи, 12 — Китайской фармакопеи. Показана обеспеченность по количеству стандартами качества на ЛП ИГЧ в региональных и ряде национальных фармакопей мира. Установлено, что в Европейской, Британской, Индийской фармакопеях отсутствуют общие монографии на ЛП ИГЧ, тогда как Китайская фармакопея включает 2 общие монографии. Наибольшее количество монографий на специфические ИГЧ представлены в Европейской и Британской фармакопеях. В настоящее время в фармакопее США отсутствуют монографии на ЛП ИГЧ. Учитывая современные тенденции гармонизации национальных фармакопейных требований с региональными, проведен анализ фармакопейных требований к качеству ЛП ИГЧ Государственной фармакопеи Российской Федерации и Европейской фармакопеи, которая признана базовой. В ходе сравнительного анализа российских стандартов качества выявлено различие по наиболее важным показателям качества, таким как активатор прекалликреина, антитела к поверхностному антигену вируса гепатита В, иммуноглобулин А (для ИГЧ нормального для внутримышечного и подкожного введения), антитела к вирусу гепатита А (для ИГЧ для внутримышечного введения). Показаны различия существующих подходов к оценке качества и, следовательно, необходимость гармонизации российских стандартов качества ЛП ИГЧ с международными требованиями по некоторым показателям качества, а также в части совершенствования подходов к обеспечению их качества и унификации методов контроля. На основе проведенного анализа фармакопейных требований к качеству ЛП ИГЧ подготовлены проекты общей фармакопейной статьи и фармакопейных статей на ЛП ИГЧ нормальных по способу применения.
ЗАКЛЮЧЕНИЕ. Результаты сравнительного анализа фармакопейных требований указали на необходимость гармонизации российских стандартов качества ЛП ИГЧ с фармакопеями ведущих стран мира, в первую очередь с Европейской фармакопеей. Разработанные проекты фармакопейных статей были гармонизированы с мировыми аналогами и предусматривают использование современных методов оценки показателей качества. Для дальнейшей стандартизации методик определения отдельных показателей качества ЛП ИГЧ требуется разработка фармакопейных стандартных образцов.
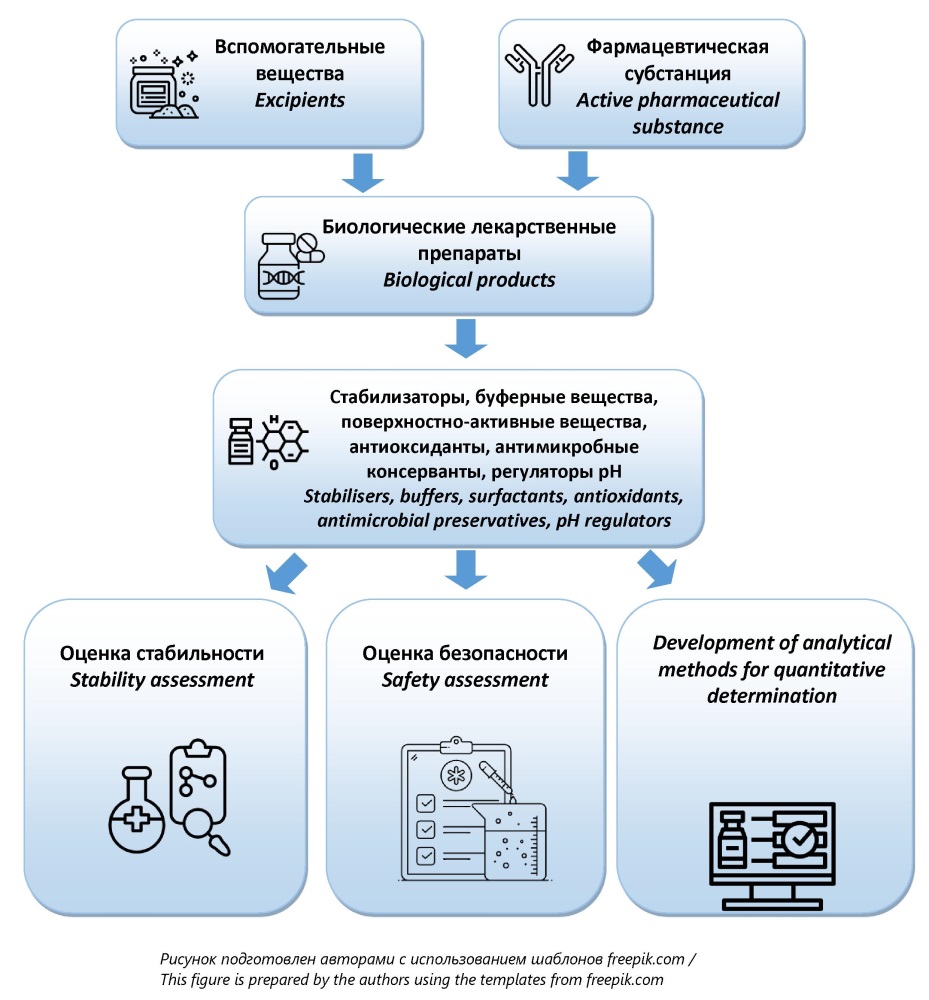
ВВЕДЕНИЕ. Потенциальное нежелательное действие вспомогательных веществ (ВВ) биологических лекарственных препаратов (БЛП) и сложности их аналитического контроля представляют значительную проблему при разработке и экспертизе лекарственных средств. Современные аналитические методы и инновационные подходы к подбору ВВ позволяют минимизировать риски и усовершенствовать контроль качества БЛП.
ЦЕЛЬ. Анализ современных методов количественного определения вспомогательных веществ в биологических лекарственных препаратах и оценка перспектив их применения для совершенствования лабораторной экспертизы при регистрации и подтверждения соответствия качества препаратов при вводе в гражданский оборот.
ОБСУЖДЕНИЕ. Поиск литературы проводился с использованием баз данных SciFinder, PubMed, eLIBRARY.RU. Представлены данные о функциональной классификации ВВ. Проведен анализ потенциального нежелательного действия ВВ: риск сахарозной нефропатии при применении внутривенных препаратов иммуноглобулинов, содержащих сахарозу; гипогликемия, изменение метаболизма аминокислот, снижение синтеза нуклеиновых кислот и угнетение функциональной активности тромбоцитов вследствие высокой концентрации натрия каприлата в препаратах альбумина. Важным аспектом оценки безопасности использования ВВ является изучение продуктов их деградации. Представлены данные о путях решения проблем, связанных с деградацией ВВ, включая снижение содержания или замену ВВ, как в случае с натрия каприлатом, которые многие производители исключают из состава рецептур БЛП. Рассмотрены инновационные подходы к поиску новых адъювантов (MF59, АS01, АS03, AS04, RC-529), совмещающих функции индукторов иммунного ответа и систем доставки. Представлены данные об использовании математического моделирования при выборе состава композиции ВВ. Проведен анализ современных аналитических методов количественного определения ВВ, включая жидкостную и газожидкостную хроматографию, спектрофотометрические методы для количественной оценки наиболее значимых ВВ в БЛП (аминокислоты, полисорбаты, фенол, феноксиэтанол, бензиловый спирт, натрия каприлат). Рассмотрены перспективные методики, такие как эксклюзионная ВЭЖХ для оценки полисорбата 80, HILIC ВЭЖХ для селективного количественного определения аминокислот в составе композиции, гидрофильная ВЭЖХ с рефрактометрическим детектированием и ионообменная ВЭЖХ с амперометрическим детектированием для анализа стабилизаторов углеводной природы (сорбит, маннит, трегалоза, глюкоза, лактоза, сахароза, мальтоза), а также газожидкостная хроматография для идентификации и количественной оценки 2-феноксиэтанола и м-крезола.
ЗАКЛЮЧЕНИЕ. Выбор ВВ для БЛП представляет собой комплексную задачу, требующую разработки стратегии контроля не только установленных норм их содержания, но и возможных продуктов деградации. Разработка унифицированных аналитических методик для количественного определения ВВ является основным направлением для обеспечения качества БЛП на этапах регистрационной экспертизы и ввода в гражданский оборот.
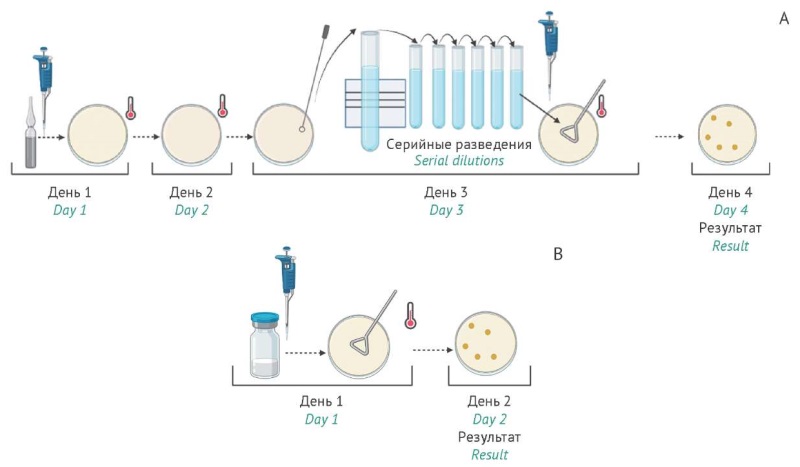
ВВЕДЕНИЕ. Микробиологический контроль качества лекарственных препаратов основан на использовании эталонных тест-штаммов, характеризующихся стабильными культуральноморфологическими свойствами. Применение стандартизированных по количеству жизнеспособных клеток тест-штаммов микроорганизмов в лиофилизированном виде позволяет снизить трудоемкость проведения испытаний в сравнении с традиционным методом приготовления микробных суспензий.
ЦЕЛЬ. Сравнительная оценка воспроизводимости, однородности и стабильности результатов при контроле ростовых свойств питательных сред с использованием традиционного метода приготовления микробных суспензий и метода на основе лиофилизированных тест-штаммов «ЛИОШТАММ», стандартизированных по числу жизнеспособных клеток.
МАТЕРИАЛЫ И МЕТОДЫ. В работе использовали два тест-штамма — Salmonella enterica subsp. enterica serovar Abony IHE 103/39 и Staphylococcus aureus ATCC 6538. Сравнивали метод, основанный на использовании стандартизированных лиофилизированных образцов «ЛИОШТАММ» (по одной серийной партии каждого штамма, стандартизированной по числу жизнеспособных клеток), и референс-метод, основанный на использовании микробных суспензий, приготовленных согласно требованиям Государственной фармакопеи Российской Федерации (общая фармакопейная статья «Микробиологическая чистота»). Исследование проводили в семи независимых лабораториях в течение 3 сут. Всего получено 378 индивидуальных результатов для каждой серии «ЛИОШТАММ» и 126 — для референс-метода.
РЕЗУЛЬТАТЫ. При исследовании ростовых свойств питательных сред оба тест-штамма, приготовленные с использованием образцов «ЛИОШТАММ», продемонстрировали соответствие всем критериям приемлемости: количество колониеобразующих единиц (КОЕ) на чашку составило 10–100, также были подтверждены типичные культурально-морфологические свойства и время роста. Внутрилабораторная прецизионность (RSD) варьировала от 7 до 21% для метода с использованием «ЛИОШТАММ» и от 2 до 36% для референсметода. Показатель межлабораторной прецизионности для метода с использованием образцов «ЛИОШТАММ» составил 15–17%, тогда как для референс-метода — 38–45%. Время появления видимых колоний (≈18 ч) и их культурально-морфологические свойства не имели значимых отличий между методами. Анализ межфлаконной однородности показал совпадение средних значений и относительных стандартных отклонений (RSD) в рамках внутрилабораторного производственного контроля (n=5) и в ходе межлабораторных испытаний (n=63), что свидетельствует о стабильности серии «ЛИОШТАММ» (RSD≤17%).
ВЫВОДЫ. Метод контроля питательных сред с использованием стандартизированных лиофилизированных тест-штаммов «ЛИОШТАММ» обеспечивает получение результатов, сопоставимых с традиционным методом по ростовым и морфологическим характеристикам. Ключевым преимуществом метода является значительное повышение межлабораторной воспроизводимости за счет снижения вариабельности более чем в два раза. Тест-штаммы «ЛИОШТАММ» могут быть рекомендованы в качестве стандартизированных образцов для рутинного микробиологического контроля и валидации аналитических методик.
МОЛЕКУЛЯРНАЯ ДИАГНОСТИКА И ГЕНОТИПИРОВАНИЕ ВИРУСОВ
ВВЕДЕНИЕ. Вирус папилломы человека (ВПЧ) высокого канцерогенного риска (ВПЧ ВКР) является доказанным этиологическим фактором развития рака шейки матки. Проведение скрининга с генотипированием ВПЧ среди женщин и выявлением значимых для региона генотипов вируса важно для реализации программ вакцинации против ВПЧ.
ЦЕЛЬ. Изучить распространенность, спектр и региональные особенности ВПЧ ВКР у женщин из разных районов Гомельской области за 2018–2023 гг. до начала кампании массовой вакцинопрофилактики в Республике Беларусь.
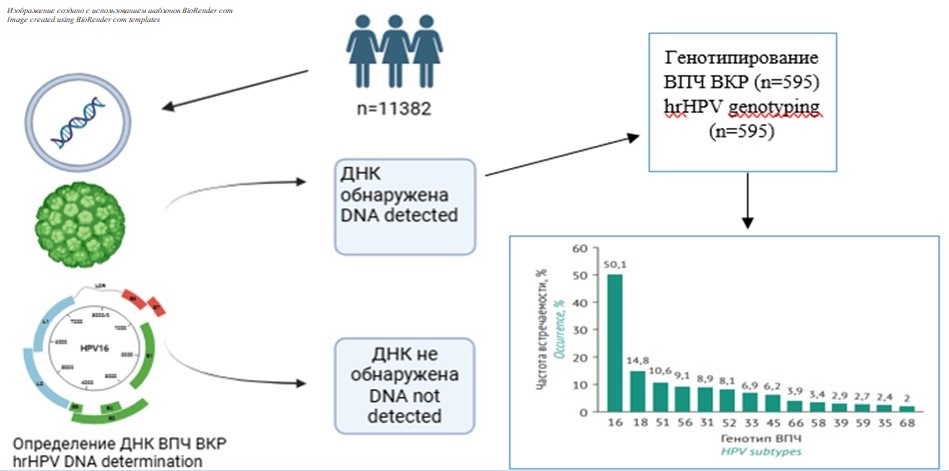
МАТЕРИАЛЫ И МЕТОДЫ. За 2018–2023 гг. обследовано 11382 женщины из Гомельской области и г. Гомеля в возрасте от 18 до 79 лет. У каждой участницы исследования забирались образцы биоматериала (соскобы из цервикального канала шейки матки) для последующего молекулярно-генетического анализа методом полимеразной цепной реакции.
РЕЗУЛЬТАТЫ. Всего было обнаружено 14 разных генотипов ВПЧ. Частота встречаемости ВПЧ ВКР составила 9% в общей популяции женщин и 9,7% у женщин репродуктивного возраста. Высокая частота встречаемости ВПЧ ВКР отмечена у женщин раннего репродуктивного возраста в группе 18–24 года — 18,8% (95% ДИ 16,8–20,9), 25–29 лет — 12,1% (95% ДИ 10,3–14,1), 30–34 года — 9,2% (95% ДИ 7,8–10,7). Один генотип ВПЧ был обнаружен с частотой 78,6%, сочетание двух генотипов ВПЧ — 14,5%, три и более генотипов — 6,9%. Наиболее распространены ВПЧ 16 (52,2%), 18 (15,1%), 51 (18,9%), 56 (9,8%) и 31 (9,7%) генотипов. Вклад в инфицирование женщин ВПЧ ВКР вносят группы α9 (16 и 31 генотипы), α7 (18 генотип), α5 (51 генотип) и α6 (56 генотип). Выявлено изменение структуры доминирующих генотипов ВПЧ ВКР за последние 10 лет в Гомельской области.
ВЫВОДЫ. Установлена высокая распространенность ВПЧ ВКР среди женщин репродуктивного возраста в Гомельском регионе. Данные о геномном разнообразии ВПЧ в регионе имеют большое значение для молекулярно-эпидемиологического надзора и помогут оценить эффективность программы вакцинации против ВПЧ-инфекции в Республике Беларусь, которая стартовала в 2025 г.
КЛЕТОЧНАЯ И ЭКЗОСОМАЛЬНАЯ ТЕРАПИЯ
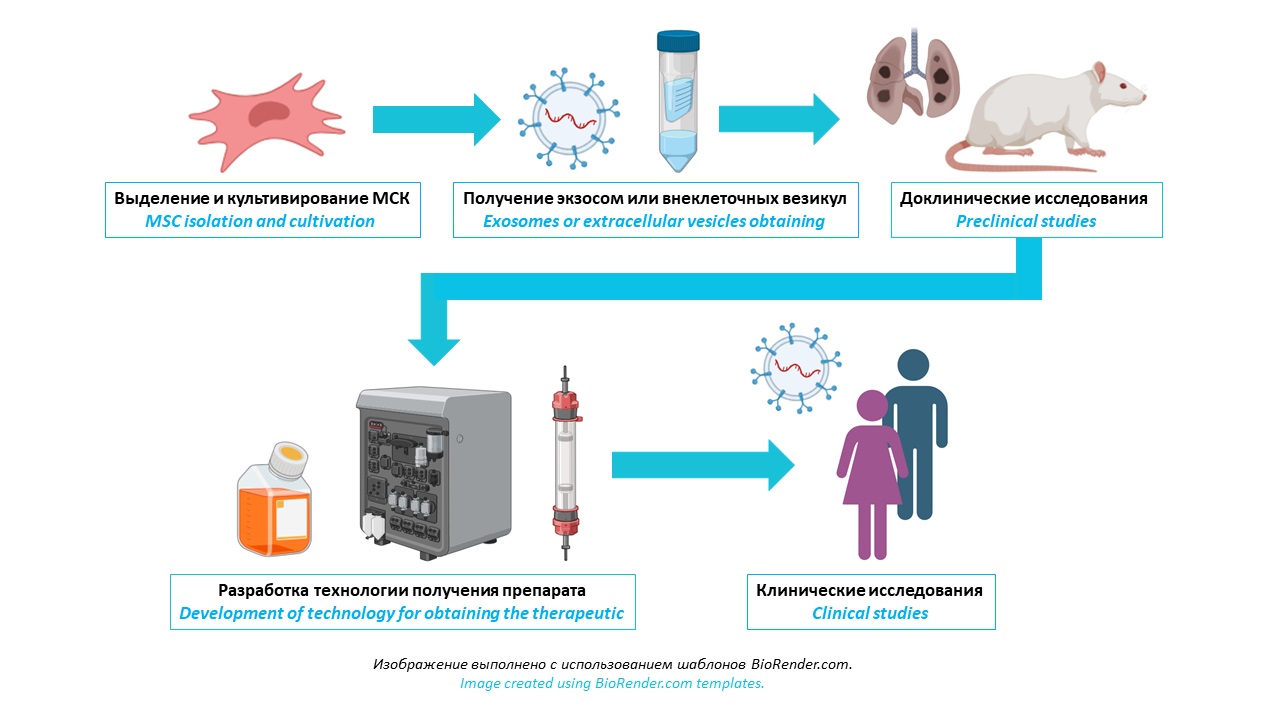
ВВЕДЕНИЕ. В период пандемии COVID-19 диагноз острый респираторный дистресссиндром (ОРДС) констатировали у 15–33% пациентов, госпитализированных с заболеваниями легких. Вследствие возросших показателей больничной летальности и недостаточной эффективности существовавших на тот момент лекарственных средств возникла необходимость применения терапии мезенхимальными стромальными клетками (МСК). Содержащиеся в секретоме МСК экзосомы обладают регенеративной активностью, как и МСК, причем введение последних может быть сопряжено с риском тромбообразования. Обнадеживающие результаты доклинических испытаний препаратов на основе экзосом обусловливают их клиническое применение. Анализ актуальных данных по безопасности и эффективности инновационных препаратов на основе экзосом позволит выработать протоколы получения, хранения, транспортировки, а также оптимальные схемы применения препаратов для бесклеточной терапии ОРДС и других заболеваний легких.
ЦЕЛЬ. Анализ результатов доклинических и клинических исследований безопасности и эффективности препаратов на основе экзосом, продуцируемых МСК и предназначенных для бесклеточной терапии ОРДС и других заболеваний легких в качестве альтернативы медикаментозному лечению.
ОБСУЖДЕНИЕ. Экзосомы, важнейший компонент секретомов различных клеток, осуществляют горизонтальный перенос генетической информации и биологически активных молекул. В доклинических испытаниях установлено, что полученные из секретома МСК экзосомы обладают выраженными регенеративными свойствами, схожими с МСК, и имеют ряд преимуществ: малые размеры, исключающие тромбообразование в легочных капиллярах; проникновение через гематоэнцефалический барьер; отсутствие тератогенности; обеспечение обмена эпигеномной информацией при межклеточных взаимодействиях. Введение препаратов на основе экзосом способствует регенерации поврежденной легочной ткани при ОРДС и других заболеваниях легких. Клинические исследования подтвердили безопасность и эффективность препаратов при ингаляционном, внутривенном или сочетанном введении. Эффективность препаратов может быть повышена при совместном применении экзосом c МСК или при использовании экзосом, обогащенных гликопротеином СD24 (ключевая молекула врожденного иммунитета). Препараты на основе экзосом купируют ОРДС и другие заболевания легких благодаря своей регенеративной и иммуномодулирующей активности, а также способности снижать уровень «цитокинового шторма» и апоптоза и рассматриваются как перспективная бесклеточная (cells free) терапевтическая стратегия в лечении ОРДС.
ЗАКЛЮЧЕНИЕ. Проведенный анализ данных доклинических и клинических исследований свидетельствует о высокой эффективности терапевтического действия препаратов на основе экзосом, однако целесообразны дальнейшие исследования безопасности препаратов и определения оптимальных схем лечения ОРДС.
ISSN 2619-1156 (Online)