Перейти к:
Сравнительная оценка контроля качества питательных сред с использованием лиофилизированных тест-штаммов «ЛИОШТАММ»: результаты межлабораторных испытаний
https://doi.org/10.30895/2221-996X-2025-25-3-321-331
Резюме
ВВЕДЕНИЕ. Микробиологический контроль качества лекарственных препаратов основан на использовании эталонных тест-штаммов, характеризующихся стабильными культуральноморфологическими свойствами. Применение стандартизированных по количеству жизнеспособных клеток тест-штаммов микроорганизмов в лиофилизированном виде позволяет снизить трудоемкость проведения испытаний в сравнении с традиционным методом приготовления микробных суспензий.
ЦЕЛЬ. Сравнительная оценка воспроизводимости, однородности и стабильности результатов при контроле ростовых свойств питательных сред с использованием традиционного метода приготовления микробных суспензий и метода на основе лиофилизированных тест-штаммов «ЛИОШТАММ», стандартизированных по числу жизнеспособных клеток.
МАТЕРИАЛЫ И МЕТОДЫ. В работе использовали два тест-штамма — Salmonella enterica subsp. enterica serovar Abony IHE 103/39 и Staphylococcus aureus ATCC 6538. Сравнивали метод, основанный на использовании стандартизированных лиофилизированных образцов «ЛИОШТАММ» (по одной серийной партии каждого штамма, стандартизированной по числу жизнеспособных клеток), и референс-метод, основанный на использовании микробных суспензий, приготовленных согласно требованиям Государственной фармакопеи Российской Федерации (общая фармакопейная статья «Микробиологическая чистота»). Исследование проводили в семи независимых лабораториях в течение 3 сут. Всего получено 378 индивидуальных результатов для каждой серии «ЛИОШТАММ» и 126 — для референс-метода.
РЕЗУЛЬТАТЫ. При исследовании ростовых свойств питательных сред оба тест-штамма, приготовленные с использованием образцов «ЛИОШТАММ», продемонстрировали соответствие всем критериям приемлемости: количество колониеобразующих единиц (КОЕ) на чашку составило 10–100, также были подтверждены типичные культурально-морфологические свойства и время роста. Внутрилабораторная прецизионность (RSD) варьировала от 7 до 21% для метода с использованием «ЛИОШТАММ» и от 2 до 36% для референсметода. Показатель межлабораторной прецизионности для метода с использованием образцов «ЛИОШТАММ» составил 15–17%, тогда как для референс-метода — 38–45%. Время появления видимых колоний (≈18 ч) и их культурально-морфологические свойства не имели значимых отличий между методами. Анализ межфлаконной однородности показал совпадение средних значений и относительных стандартных отклонений (RSD) в рамках внутрилабораторного производственного контроля (n=5) и в ходе межлабораторных испытаний (n=63), что свидетельствует о стабильности серии «ЛИОШТАММ» (RSD≤17%).
ВЫВОДЫ. Метод контроля питательных сред с использованием стандартизированных лиофилизированных тест-штаммов «ЛИОШТАММ» обеспечивает получение результатов, сопоставимых с традиционным методом по ростовым и морфологическим характеристикам. Ключевым преимуществом метода является значительное повышение межлабораторной воспроизводимости за счет снижения вариабельности более чем в два раза. Тест-штаммы «ЛИОШТАММ» могут быть рекомендованы в качестве стандартизированных образцов для рутинного микробиологического контроля и валидации аналитических методик.
Ключевые слова
Для цитирования:
Воропаев А.А., Фадейкина О.В., Валюхова Р.М., Крысанова Ю.И., Давыдов Д.С., Овсиенко С.В. Сравнительная оценка контроля качества питательных сред с использованием лиофилизированных тест-штаммов «ЛИОШТАММ»: результаты межлабораторных испытаний. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(3):321-331. https://doi.org/10.30895/2221-996X-2025-25-3-321-331
For citation:
Voropaev A.A., Fadeikina O.V., Valyukhova R.M., Krysanova J.I., Davydov D.S., Ovsienko S.V. Comparative evaluation of nutrient media quality control using LYOSHTAMM lyophilised test strains: Results of interlaboratory trials. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(3):321-331. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-3-321-331
ВВЕДЕНИЕ
Микробиологический контроль является критически важным элементом фармацевтического производства, подтверждая качество и безопасность лекарственных средств1 [1–3]. Основные аспекты микробиологического контроля включают мониторинг производственной среды, тестирование препаратов на стерильность или микробиологическую чистоту, а также использование тест-штаммов микроорганизмов для валидации методик и оценки качества питательных сред [4][5]. Каждая партия питательных сред подлежит обязательному тестированию с использованием тест-штаммов для подтверждения способности поддерживать рост соответствующих микроорганизмов, что особенно важно для эффективного обнаружения микробного загрязнения, вызванного даже единичными клетками [6–8].
В соответствии с требованиями Государственной фармакопеи Российской Федерации (ГФ РФ)2 производители должны получать тест-штаммы из официальных коллекций и поддерживать рабочие культуры, ограничивая число последовательных пассажей, чаще всего не более пяти, что минимизирует риск накопления мутационных изменений и фенотипического дрейфа [9–11]. Поддержание рабочих культур тест-штаммов в лабораторных условиях представляет собой ресурсоемкую задачу, требующую значительных временных затрат со стороны персонала.
Для оптимизации процесса испытаний в мировой практике широко применяют готовые к использованию лиофилизированные тест-штаммы, такие как BioBall (Biomerieux)3, Vitroids (Merck)4 или MicroQuant5 (American Type Culture Collection). Однако данные тест-штаммы производятся преимущественно иностранными компаниями из США и Европы, что создает для российских производителей устойчивую зависимость от импортных поставок [12].
Для решения данной проблемы в Государственной коллекции патогенных микроорганизмов (ГКПМ) ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России (ФГБУ «НЦЭСМП» Минздрава России) был разработан инновационный продукт «ЛИОШТАММ» для микробиологического контроля. Его применение обеспечивает высокое качество испытаний при значительном снижении временных и трудовых затрат. Схематическое сравнение традиционного метода подготовки культур и метода с использованием образцов «ЛИОШТАММ» представлено на рисунке 1.

Рис. 1. Схема процессов подготовки микробиологических культур при оценке ростовых свойств питательных сред: традиционный метод (А); метод с использованием лиофилизированных образцов «ЛИОШТАММ» (В).
Fig. 1. Preparing microbial cultures for assessment of growth-promoting properties in nutrient media: (A) traditional approach; (B) use of LYOSHTAMM in culture preparation for assessment of growth-promoting properties of nutrient media.
В отличие от существующих коммерческих аналогов (BioBall, Vitroids), образцы «ЛИОШТАММ» произведены в ГКПМ из исходных культур тест-штаммов со строгим контролем пассажного уровня. Такой подход позволяет минимизировать риск накопления генетических мутаций и изменения культурально-морфологических свойств тест-штаммов.
Стандартизированные по числу жизнеспособных клеток тест-штаммы рассматриваются в настоящее время как ключевой инструмент обеспечения однородности инокулюма и сопоставимости результатов микробиологических испытаний между различными лабораториями, что существенно снижает неопределенность контроля качества лекарственных препаратов [13–15]. Среди альтернативных методов подготовки культур (глубокое замораживание, периодические пересевы) лиофилизация признана оптимальной технологией, так как она позволяет получать крупные партии однородного материала, значительно снижает риск генетического дрейфа, обеспечивает длительную сохранность жизнеспособности при температуре 4 °C и более высокой, а также упрощает логистику [16–19]. Дополнительным преимуществом лиофилизированных эталонов является их доказанная стабильность в течение нескольких лет хранения [20–22].
Цель работы — сравнительная оценка воспроизводимости, однородности и стабильности результатов при контроле ростовых свойств питательных сред с использованием традиционного метода приготовления микробных суспензий и метода на основе лиофилизированных тест-штаммов «ЛИОШТАММ», стандартизированных по числу жизнеспособных клеток.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы:
- специальным образом подготовленные тест-штаммы микроорганизмов, рекомендованные для проведения испытаний согласно требованиям ОФС.1.2.4.0002.186, ОФС.1.2.4.0003.157и ОФС.1.1.0021.188, Salmonella entericа subsp. entericа serovar Abony IHE 103/39 (ГКПМ 100329); Staphylococcus aureus ATCC 6538 (ГКПМ 201108) [23];
- питательные среды: № 1 ГРМ (кат. № 039-К-193, серия 039-К-186, ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии» Роспотребнадзора), триптиказеино-соевый агар (Condalab, Испания); триптон-соевый агар (HiMedia, Индия); соево-казеиновый агар (Biomerieux, Франция);
- стандартные образцы мутности: фармакопейный стандартный образец (ФСО) мутности бактериальных взвесей 20 МЕ (ФСО.3.1.00085, серия S-2/8-010122, ФГБУ «НЦЭСМП» Минздрава России); ФСО мутности бактериальных взвесей 10 МЕ (ФСО.3.1.00084); стандарт мутности по МакФарланду (HiMedia, Индия); стандартный образец мутности бактерийных взвесей (ООО «Ормет», Россия);
- раствор натрия хлорида 0,9% («Бормовский завод медицинских препаратов», Беларусь; ООО «Гематек», Россия; ООО ТК «Красная звезда», Россия; ООО ТД «Химмед», Россия).
Оборудование:
- шкаф ламинарный БАВп-01-1,2 класса защиты II(ЗАО «Ламинарные системы», Россия);
- термогигрометр ИВА-6 (ООО НТK«Микрофор», Россия);
- дозаторы пипеточные механические одноканальные 100–1000 мкл (Sartorius, Финляндия; Sartorius Biohit Liquihg, Франция; ЗАО «Термо Фишер Сайентифик», Россия; ООО «Ленпипет», Россия);
- СО2-инкубатор СО2cell(МММ Group, Германия);
- инкубаторы LIB-300М (Labtech, Корея) и BD400 (BinderGmbH, Германия);
- инкубатор с естественной конвекцией Binder BD240 (Binder, Германия);
- термостаты суховоздушные ТС-1/80 СПУ (ОАО «Смоленское СКТБ СПУ», Россия) и ST1/1/1 (Pol-EcoAparatura, Польша).
Методы
Определение количества жизнеспособных микробных клеток. Методика посева. Испытания проводили бактериологическим методом9 в течение 3 сут. Ежедневно анализировали три флакона с лиофилизированными образцами «ЛИОШТАММ» (S. Abony IHE 103/39 и S. aureus ATCC 6538). Лиофилизат ресуспендировали в стерильной воде или 0,9% растворе натрия хлорида в течение 1 мин в объеме 1,0 мл для штамма S. Abony IHE 103/39 и 2,0 мл для штамма S. aureus ATCC 6538. Полученную суспензию из каждого флакона инокулировали на три чашки с питательной средой (объем посева 0,1 мл); процедуру проводили два независимых оператора.
Количество проведенных испытаний. Исследование выполняли в семи испытательных центрах (табл. 1). Ежедневно в каждом центре анализировали три флакона каждого тест-штамма, что соответствовало учету 18 чашек в 1 сут. За 3 сут в каждом центре было испытано 9 флаконов и получено 54 результата подсчета колониеобразующих единиц (КОЕ). Всего было протестировано 63 флакона и получено 378 результатов подсчета КОЕ для каждого тест-штамма.
Таблица 1. Испытательные центры — участники исследования
Table 1. Test centers participating in the study
|
№ |
Испытательный центр Test center |
Город City |
|
1 |
ООО «КоАЛФарманализ» CoAL Pharmanaliz LLC |
Москва Moscow |
|
2 |
ООО «Испытательный центр лекарственных средств «Биотехнология» ICLS Biotechnology LLC |
Видное Vidnoe |
|
3 |
ООО Научно-испытательный центр «ФАРМОБОРОНА» Farmoborona Research and Testing Center, LLC |
Королев Korolev |
|
4 |
Лаборатория антибиотиков ФГБУ «НЦЭСМП» Минздрава России Antibiotic Laboratory, Scientific Centre for Expert Evaluation of Medicinal Products |
Москва Moscow |
|
5 |
Ярославский филиал ФГБУ «ИМЦЭУАОСМП» Росздравнадзора Information and Methodological Center for Examination, Accounting and Analysis of Circulation of Medicinal Products, Yaroslavl branch |
Ярославль Yaroslavl |
|
6 |
Красноярский филиал ФГБУ «ИМЦЭУАОСМП» Росздравнадзора Information and Methodological Center for Examination, Accounting and Analysis of Circulation of Medicinal Products, Krasnoyarsk branch |
Красноярск Krasnoyarsk |
|
7 |
Московский филиал ФГБУ «ИМЦЭУАОСМП» Росздравнадзора Information and Methodological Center for Examination, Accounting and Analysis of Circulation of Medicinal Products, Moscow branch |
Москва Moscow |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ФГБУ «НЦЭСМП» Минздрава России — ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России; ФГБУ «ИМЦЭУАОСМП» Росздравнадзора — ФГБУ «Информационно-методический центр по экспертизе, учету и анализу обращения средств медицинского применения» Росздравнадзора.
В качестве референс-метода использовали стандартную методику подготовки культуры согласно ГФ РФ ОФС.1.2.4.0002.1810. Референс-штаммы активировали двумя последовательными пассажами на питательных средах. Из суточной культуры второго пассажа готовили суспензию с мутностью 10 МЕ по стандартным образцам мутности. Далее из исходной суспензии готовили серию десятикратных разведений; инокуляцию проводили посевом 0,1 мл из шестого разведения на три чашки с питательной средой. Всего было приготовлено 42 суспензии, что обеспечило получение 126 результатов подсчета КОЕ для каждого тест-штамма.
Превосходящий объем данных при испытании образцов «ЛИОШТАММ» по сравнению с референс-методом обусловлен задачей исследования по оценке пригодности стандартизированных образцов «ЛИОШТАММ» в качестве альтернативы традиционному методу.
Учет результатов проводили через 18, 24 и 48 ч инкубации путем подсчета количества колоний на чашке. Критерием приемлемости результатов считали наличие от 10 до 100 колоний на чашке, что соответствует требуемой концентрации 10³ КОЕ/мл в суспензии.
Определение культурально-морфологических свойств видимых колоний и время их появления оценивали визуально.
Статистическая обработка данных. Статистический анализ выполняли с использованием программы Minitab11. Рассчитывали среднее арифметическое значение (X), стандартное отклонение (SD), относительное стандартное отклонение (RSD, %). Для количественной оценки влияния лабораторных условий на результаты количественного определения жизнеспособных клеток был проведен однофакторный анализ ANOVA. Значимость факторов определяли при уровне p<0,05. Величину вклада фактора R² рассчитывали как отношение суммы квадратов отклонений по фактору к общей сумме квадратов.
Критерии приемлемости микробиологических испытаний с использованием стандартизированных тест-штаммов «ЛИОШТАММ»:
- концентрация жизнеспособных клеток в восстановленном препарате из флакона должна находиться в пределах 10³КОЕ/мл;
- культурально-морфологические свойства тест-штаммов и время появления колоний должны быть идентичны таковым при использовании референс-метода;
- прецизионность методики (воспроизводимость) должна соответствовать установленным критериям для микробиологических методов анализа — RSD между результатами не должно превышать 35%12.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сравнение культурально-морфологических свойств тест-штаммов и времени появления колоний
Культурально-морфологические свойства колоний обоих штаммов (S. Abony IHE 103/39 и S. aureus ATCC 6538) были идентичны независимо от метода подготовки инокулюма — как для образцов «ЛИОШТАММ», так и для образцов, подготовленных с использованием референс-метода. Колонии S. Abony IHE 103/39 имели круглую форму, были полупрозрачными, блестящими, с ровным или слегка волнистым краем. Колонии S. aureus ATCC 6538 характеризовались круглой формой, были выпуклые, блестящие, золотистого цвета.
Во всех испытательных центрах был зарегистрирован видимый рост колоний обоих тест-штаммов через 18 ч инкубации как в случае образцов, подготовленных с использованием референс-метода, так и при использовании образцов «ЛИОШТАММ». Это свидетельствует об отсутствии задержки роста у лиофилизированных образцов и подтверждает их функциональную эквивалентность традиционному методу. Важно отметить, что, в соответствии с фармакопейными требованиями к тестированию ростовых свойств питательных сред, учет результатов проводится в интервале до 48 ч13.
Сравнение внутрилабораторной прецизионности
Во всех испытательных центрах (табл. 2) использование образцов «ЛИОШТАММ» при определении количества жизнеспособных клеток позволило получить результаты, соответствующие критериям приемлемости (10–100 колоний на чашку). Внутрилабораторная прецизионность метода, оцененная по RSD, при использовании образцов «ЛИОШТАММ» составила от 7 до 21%, а при использовании образцов, подготовленных по референс-методу, — от 2 до 36%.
Таблица 2. Результаты оценки внутрилабораторной прецизионности при определении количества жизнеспособных клеток с использованием образцов «ЛИОШТАММ» и образцов, подготовленных по референс-методу
Table 2. Results of the in-lab precision assessment for the viable cell count using LYOSHTAMM samples and samples prepared by the reference method
|
Испытательный центр, № Test centre, No. |
Количество колоний S. Abony IHE 103/39, шт. Number of S. Abony IHE 103/39 colonies, pcs |
Количество колоний S. aureus ATCC 6538, шт. Number of S. aureus ATCC 6538 colonies, pcs |
||||||
|
«ЛИОШТАММ» LYOSHTAMM |
Референс-метод Reference method |
«ЛИОШТАММ» LYOSHTAMM |
Референс-метод Reference method |
|||||
|
X±SD, n=54 |
RSD, % |
X±SD, n=18 |
RSD, % |
X±SD, n=54 |
RSD, % |
X±SD, n=18 |
RSD, % |
|
|
1 |
61±9 |
14 |
59±9 |
15 |
50±9 |
17 |
55±9 |
16 |
|
2 |
70±10 |
14 |
94±4 |
4 |
48±7 |
14 |
84±4 |
5 |
|
3 |
79±7 |
10 |
37±4 |
12 |
44±7 |
17 |
32±8 |
27 |
|
4 |
60±6 |
9 |
85±2 |
2 |
51±5 |
10 |
94±3 |
3 |
|
5 |
76±14 |
19 |
87±5 |
6 |
48±5 |
9 |
60±4 |
7 |
|
6 |
56±4 |
7 |
64±3 |
5 |
57±4 |
7 |
59±4 |
7 |
|
7 |
67±14 |
21 |
27±8 |
31 |
53±8 |
15 |
16±6 |
36 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. X±SD — среднеарифметическое значение ± стандартное отклонение; n — количество результатов испытаний; RSD — относительное стандартное отклонение.
Note. X±SD, arithmetic mean ± standard deviation; n, number of test results; RSD, relative standard deviation.
Применение стандартизированных образцов «ЛИОШТАММ» позволило добиться большей стабильности и воспроизводимости результатов определения ростовых свойств питательных сред, что подтверждается узким диапазоном значений количества жизнеспособных клеток. Так, для тест-штамма S. Abony IHE 103/39 количество колоний при использовании «ЛИОШТАММ» варьировало в узком диапазоне значений (56–79 колоний), тогда как при использовании референс-метода был зафиксирован широкий разброс значений (27–94 колонии). Повышенная вариабельность референс-метода может быть обусловлена необходимостью выполнения многоэтапной процедуры подготовки инокулюма, включающей доведение мутности суспензии до 10 МЕ и приготовление серийных разведений. Отсутствие этих этапов при работе с образцами «ЛИОШТАММ» способствует снижению совокупной лабораторной неопределенности и повышению воспроизводимости. Показатели вариабельности, полученные при испытании образцов «ЛИОШТАММ», сопоставимы с данными коммерческих аналогов: BioBalls (9–16%) и EZ-AccuShot (10%) [13][14].
Сравнение межлабораторной воспроизводимости
Для оценки межлабораторной воспроизводимости был проведен однофакторный дисперсионный анализ (ANOVA), где в качестве влияющего фактора выступал испытательный центр, а откликом служило количество колоний. Результаты представлены в таблице 3 и на рисунке 2. Вклад межлабораторного фактора при использовании референс-метода составил 95% для обоих тест-штаммов, что свидетельствует о практически полной зависимости результатов от условий конкретного испытательного центра. Использование образцов «ЛИОШТАММ» позволило значительно снизить влияние этого фактора до 27–32%.
Таблица 3. Результаты оценки межлабораторной воспроизводимости с помощью однофакторного дисперсионного анализа (ANOVA) при использовании образцов «ЛИОШТАММ» и образцов, приготовленных по референс-методу
Table 3. Results of the interlaboratory reproducibility assessment using one-way analysis of variance (ANOVA) with LYOSHTAMM samples and samples prepared by the reference method
|
Метод Method |
Тест-штамм Test strain |
p-значение p-value |
f-критерий f-value |
Вклад влияющего фактора R², % Contribution of the influencing factor R², % |
|
«ЛИОШТАММ» LYOSHTAMM |
S. Abony IHE 103/39 |
<0,001 |
28,89 |
31,84 |
|
Референс-метод Reference method |
S. Abony IHE 103/39 |
<0,001 |
389,82 |
95,16 |
|
«ЛИОШТАММ» LYOSHTAMM |
S. aureus ATCC 6538 |
<0,001 |
23,35 |
27,41 |
|
Референс-метод Reference method |
S. aureus ATCC 6538 |
<0,001 |
389,41 |
95,12 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Рисунок подготовлен авторами по собственным данным с помощью программы Minitab / The figure is prepared by the authors with Minitab program using their own data
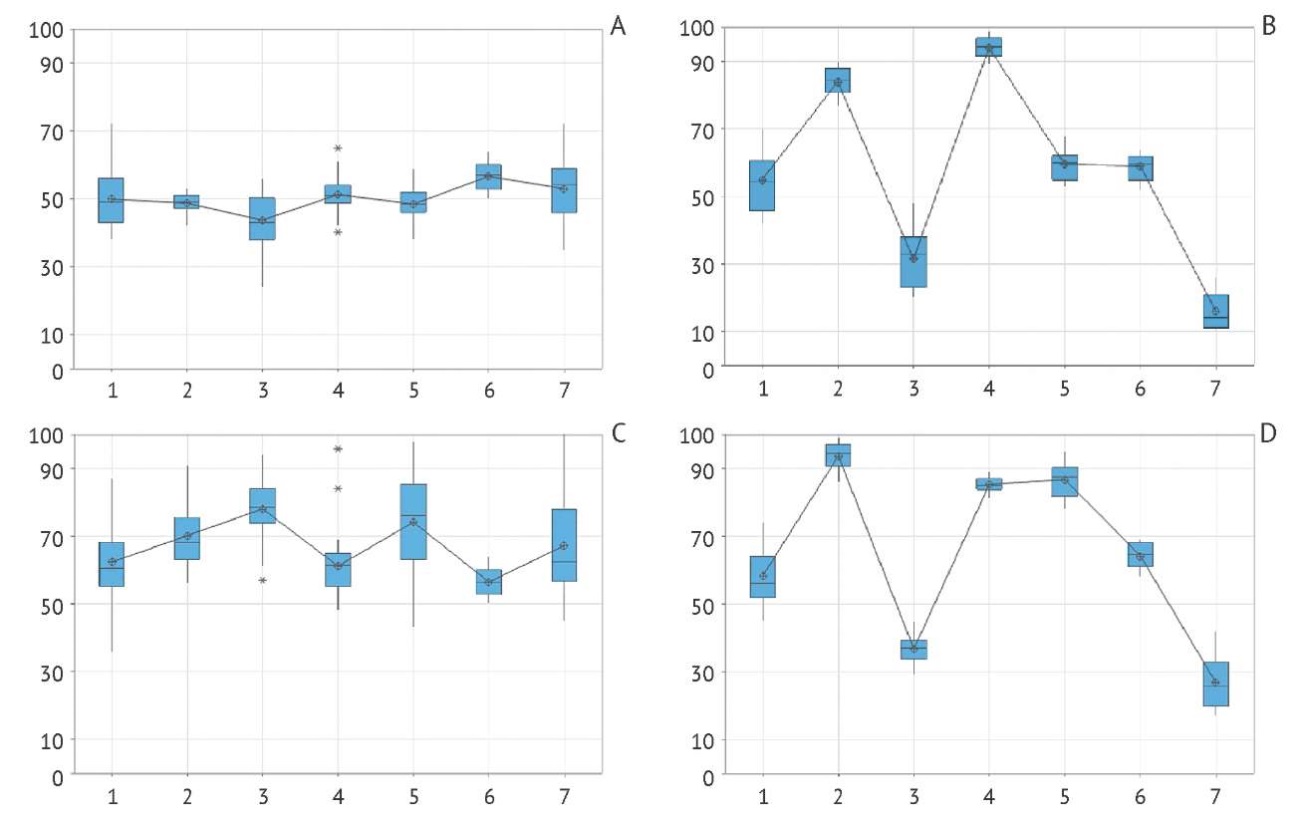
Рис. 2. Сравнение межлабораторной воспроизводимости с использованием образцов «ЛИОШТАММ» (n=54) и образцов, подготовленных с помощью референс-метода (n=18). Ось X — номер испытательного центра; ось Y — количество колоний, шт. Данные получены с использованием тест-штамма S. aureus ATCC 6538: образцов «ЛИОШТАММ» (A) и образцов, приготовленных по референс-методу (В); и тест-штамма S. Abony IHE 103/39: образцов «ЛИОШТАММ» (С) и образцов, приготовленных по референс-методу (D).
Fig. 2. Comparison of interlaboratory reproducibility using LYOSHTAMM samples (n=54) and samples prepared by the reference method (n=18). X axis: test centre code; Y axis: colony count, pcs. Data obtained with test strain S. aureus ATCC 6538: LYOSHTAMM samples (A) and reference method samples (B); test strain S. Abony IHE 103/39: LYOSHTAMM samples (C) and reference method samples (D).
Общая вариабельность результатов между испытательными центрами (межлабораторное RSD) при использовании референс-метода составила 38% для S. Abony IHE 103/39 и 45% для S. aureus ATCC 6538. При использовании «ЛИОШТАММ» эти показатели были существенно ниже — 17 и 15% соответственно (рис. 3). Эти данные подтверждают практическую значимость стандартизированных образцов для обеспечения устойчивости и воспроизводимости результатов микробиологического контроля в различных лабораториях.
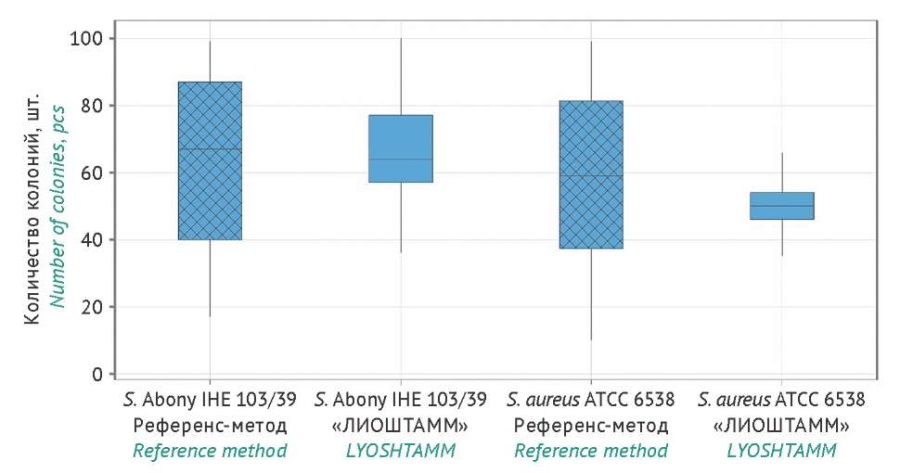
Рисунок подготовлен авторами по собственным данным с помощью программы Minitab / The figure is prepared by the authors with Minitab program using their own data
Рис. 3. Сравнение вариабельности результатов при определении количества жизнеспособных клеток, полученных с использованием образцов «ЛИОШТАММ» (n=378) и образцов, приготовленных по референс-методу (n=126), для каждого тест-штамма.
Fig. 3. Comparison of variability in viable cell count results obtained using LYOSHTAMM samples (n=378) and samples prepared by the reference method (n=126) for each test strain.
Оценка однородности серии «ЛИОШТАММ» при производстве
Каждая производственная серия «ЛИОШТАММ» проходит контроль однородности по количеству жизнеспособных микроорганизмов на выборке из пяти флаконов. Для оценки репрезентативности такого объема выборки данные в ходе внутрилабораторного контроля при изготовлении серии сравнивали с результатами межлабораторных испытаний, проведенных на большом количестве образцов (табл. 4). Такое сопоставление является ключевым элементом обоснования возможности использования выборки из ограниченного числа флаконов (пять флаконов) при контроле однородности серии. Этот подход особенно важен для препаратов, содержащих патогенные микроорганизмы, для которых недопустим избыточный расход материала.
Таблица 4. Сравнение результатов определения количества жизнеспособных клеток в серии «ЛИОШТАММ», полученных при внутрилабораторном контроле производства серии образцов и в ходе межлабораторных испытаний
Table 4. Comparison of viable cell count results for LYOSHTAMM series obtained during in-house production control of the sample series and interlaboratory testing
|
Наименование тест-штамма Test strain |
Количество испытуемых образцов (флаконы), шт. Number of test samples (vials), pcs. |
Количество жизнеспособных клеток в образце, X±SD, КОЕ/мл Mean number of viable cells in the sample, X±SD,CFU/ml |
RSD, % |
|
Результаты, полученные при производстве серии образцов Results obtained from the production of a series of samples |
|||
|
S. Abony IHE 103/39 |
5 |
660±110 |
17 |
|
S. aureus ATCC 6538 |
5 |
560±60 |
11 |
|
Результаты, полученные в ходе межлабораторных испытаний Results obtained during interlaboratory studies |
|||
|
S. Abony IHE 103/39 |
63 |
670±111 |
17 |
|
S. aureus ATCC 6538 |
63 |
501±53 |
10 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Сравнение показало сходимость значений RSD (17% для S. Abony IHE 103/39 и 10–11% для S. aureus ATCC 6538) и приемлемое соответствие средних значений, несмотря на незначительное снижение в условиях межлабораторных испытаний. Последнее может быть обусловлено различиями в условиях восстановления и культивирования лиофилизата в разных лабораториях (например, использовались питательные среды различных производителей).
Таким образом, полученные данные подтверждают, что оценка однородности серии по выборке из пяти флаконов является репрезентативной и достаточной. Это позволяет применять серии «ЛИОШТАММ» не только для проведения рутинного микробиологического контроля, но и в качестве стандартизированных образцов для валидации аналитических микробиологических методик.
ВЫВОДЫ
- Стандартизированные по количеству жизнеспособных клеток образцы тест-штаммов «ЛИОШТАММ» обеспечивают получение надежных и воспроизводимых результатов, сопоставимых с данными, полученными референс-методом. Внутрилабораторная вариабельность (RSD) для образцов «ЛИОШТАММ» составила 7–21%, в то время как для референс-метода разброс значений был значительно шире (2–36%).
- Применение образцов «ЛИОШТАММ» исключает трудоемкие этапы подготовки культур традиционным методом (активация тест-штамма, стандартизация по мутности и приготовление серийных разведений), что приводит к значительному снижению вариабельности результатов (межлабораторное RSD для образцов «ЛИОШТАММ» 15–17% против 38–45% для образцов, приготовленных по референс-методу) и сокращению временных затрат персонала.
- Сравнение результатов межлабораторных испытаний с данными, полученными при внутрилабораторном контроле производства серии образцов «ЛИОШТАММ» на пяти флаконах, показало их статистическую сопоставимость, что подтверждает репрезентативность выбранного объема выборки для оценки однородности серии.
- Образцы тест-штаммов «ЛИОШТАММ» могут быть рекомендованы к применению в качестве стандартизированных образцов для рутинного микробиологического контроля и валидации аналитических методик. Использование данного продукта будет способствовать повышению качества микробиологических испытаний и снижению зависимости от импортной продукции.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.А. Воропаев — концепция и дизайн исследования, написание текста рукописи, формулировка выводов; О.В. Фадейкина — написание текста рукописи, формулировка выводов, статистическая обработка данных; Р.М. Валюхова — написание текста рукописи; Ю.И. Крысанова — поиск и систематизация данных литературы; Д.С. Давыдов — участие в формулировке выводов, утверждение окончательной версии статьи для публикации; С.В. Овсиенко — концепция исследования, утверждение окончательной версии статьи для публикации.
Благодарности. Авторы выражают искреннюю благодарность коллегам за высокий профессионализм в проведении микробиологических испытаний в соответствии со стандартизированными протоколами и консультативную поддержку в интерпретации результатов.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.A. Voropaev developed the concept, wrote the manuscript, and formulated conclusions. O.V. Fadeikina wrote the manuscript, formulated conclusions and performed statistical calculations. R.M. Valyukhova wrote the manuscript. Ju.I. Krysanova worked with literature sources. D.S. Davydov participated in formulating conclusions and approved the final version for publication. S.V. Ovsienko organised the testing and approved the final version for publication.
Acknowledgements. The authors are grateful to the colleagues for their high level of professionalism in microbiological testing in accordance with standardised protocols and for their advisory support in interpreting the results.
1. Hock SC, Dong HS, Chan Rui JT, Chan L.W. Contamination trends & proposed solutions. Pharmaceutical Engineering; 2023. https://ispe.org/pharmaceutical-engineering/march-april-2023/contamination-trends-proposed-solutions
2. ОФС.1.2.4.0002.18 Микробиологическая чистота. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
3. https://www.mediray.co.nz/media/15675/br_biomerieux_test-kits_bioballs-booklet-english-0315-march-2015-new-rev-g-8.pdf
4. https://www.sigmaaldrich.cn/deepweb/assets/sigmaaldrich/product/documents/906/730/vitroids-datasheet.pdf
5. https://www.atcc.org/resources/application-notes/development-and-performance-evaluation-of-microquant
6. ОФС.1.2.4.0002.18 Микробиологическая чистота. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
7. ОФС.1.2.4.0003.15 Стерильность. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
8. ОФС.1.1.0021.18 Валидация микробиологических методик. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
9. ОФС.1.2.4.0002.18 Микробиологическая чистота. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
10. ОФС.1.2.4.0002.18 Микробиологическая чистота. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
11. https://www.minitab.com/fr-fr/
12. ОФС.1.1.0021.18 Валидация микробиологических методик. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
13. ОФС.1.2.4.0002.18 Микробиологическая чистота. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
Список литературы
1. Gupta D, Bhatt S, Shulka P, Kumar A. Microbial contamination in pharmaceutical manufacturing. J Drug Discov Health Sci. 2024;1(01):21–7. https://doi.org/10.21590/yafz5353
2. Tyski S, Burza M, Laudy AE. Microbiological contamination of medicinal products — Is it a significant problem? Pharmaceuticals (Basel). 2025;18(7):946. https://doi.org/10.3390/ph18070946
3. de Sousa Lima CM, Fujishima MAT, de Paula Lima B, et al. Microbial contamination in herbal medicines: a serious health hazard to elderly consumers. BMC Complement Med Ther. 2020;20(1):17. https://doi.org/10.1186/s12906-019-2723-1
4. Han-Min O. Selection of bacterial strains in a testing microbiology laboratory for quality assurance purposes: ISO/ IEC 17025: 2017 standard point of view. Accred Qual Assur. 2025;30:95–101. https://doi.org/10.1007/s00769-024-01615-9
5. Moira DJ. A simple and rapid test for quality control of liquid media, using the bioscreen microbiological growth analyser. J Microbiol Methods. 1998;32(1):37–43. https://doi.org/10.1016/S0167-7012(98)00007-4
6. Суханова СМ. Стандартизация требований к питательным средам, используемым для оценки качества лекарственных средств (обзор). Разработка и регистрация лекарственных средств. 2023;12(1):123–30. https://doi.org/10.33380/2305-2066-2023-12-1-123-130
7. Кулешова СИ, Процак СА, Лисунова СА, Романюк ГЮ. Стабильность готовых и приготовленных в лаборатории питательных сред. Ведомости Научного центра экспертизы средств медицинского применения.2021;11(2):130–4. https://doi.org/10.30895/1991-2919-2021-11-2-130-134
8. Basu S, Pal A, Desai PK. Quality control of culture media in a microbiology laboratory. Indian J Med Microbiol. 2005;23(3):159–63. https://doi.org/10.1016/S0255-0857(21)02585-8
9. Moser AI, Campos-Madueno EI, Perreten V, Endimiani A. Genome stability during serial subculturing in hyperepidemic multidrug-resistant Klebsiella pneumoniae and Escherichia coli. J Glob Antimicrob Resist. 2022;31:152–61. https://doi.org/10.1016/j.jgar.2022.08.014
10. Wassenaar TM, Zimmermann K. How industrial bacterial cultures can be kept stable over time. Lett Appl Microbiol. 2020;71(3):220–8. https://doi.org/10.1111/lam.13309
11. Sabol A, Joung YJ, Van Tubbergen C, et al. Assessment of genetic stability during serial in vitro passage and in vivo carriage. Foodborne Pathog Dis. 2021;18(12):894–901. https://doi.org/10.1089/fpd.2021.0029
12. Singh KA, Rai R, Nair SS. Review on development of assigned value microbiological reference materials used in food testing. Food Microbiol. 2022;102:103904. https://doi.org/10.1016/j.fm.2021.103904
13. Verdonk GP, Willemse MJ, Hoefs SG, et al. The most probable limit of detection (MPL) for rapid microbiological methods. J Microbiol Methods. 2010;82(3):193–7. https://doi.org/10.1016/j.mimet.2010.04.012
14. Kurniawan YN, Yuji S, Koji S. Evaluation of a microbiological reference standard (EZ-AccuShotTM) as test material for proficiency testing (PT) scheme in the breweries. J Am Soc Brew Chem. 201876(4):219–22. https://doi.org/10.1080/03610470.2018.1502010
15. Hong SK, Choi SJ, Shin S, et al. Establishing quality control ranges for antimicrobial susceptibility testing of Escherichia coli, Pseudomonas aeruginosa, and Staphylococcus aureus: a cornerstone to develop reference strains for Korean clinical microbiology laboratories. Ann Lab Med. 2015;35(6):635–8. https://doi.org/10.3343/alm.2015.35.6.635
16. Liu K, Ma W, Jin G. Research progress on improving the survival rate and extending the storage period of lactic acid bacteria through vacuum freeze-drying. Food Sci. 2024, 45(2):325–33. https://doi.org/10.7506/spkx1002-6630-20230801-002
17. Dias FRS, Lourenço FR. Measurement uncertainty evaluation and risk of false conformity assessment for microbial enumeration tests. J Microbiol Methods. 2021;189:106312. https://doi.org/10.1016/j.mimet.2021.106312
18. Bernal-Mercado AT, Gutierrez-Pacheco MM, Encinas-Basurto D, et al. Synergistic mode of action of catechin, vanillic and protocatechuic acids to inhibit the adhesion of uropathogenic Escherichia coli on silicone surfaces. J Appl Microbiol. 2020;128(2):387–400. https://doi.org/10.1080/03610470.2018.1502010
19. Boyd P, Eaton S, Magee J. The stability of micro-organisms preserved in LENTICULE discs, demonstrated by repeat sample distributions of the EQUAL Scheme for Indicator Organisms (water microbiology). J Appl Microbiol. 2006;100(2):272–8. https://doi.org/10.1111/j.1365-2672.2005.02774.x
20. Kupletskaya MB, Netrusov AI. Viability of lyophilized microorganisms after 50-year storage. Microbiology. 2011;80(6):850–3. https://doi.org/10.1134/S0026261711060129
21. Miyamoto-Shinohara Y, Sukenobe J, Imaizumi T, Nakahara T. Survival curves for microbial species stored by freezedrying. Cryobiology. 2006;52(1):27–32. https://doi.org/10.1016/j.cryobiol.2005.09.002
22. Morgan CA, Herman N, White PA, Vesey G. Preservation of micro-organisms by drying; a review. J Microbiol Methods. 2006;66(2):183–93. https://doi.org/10.1016/j.mimet.2006.02.017
23. Воропаев АА, Крысанова ЮИ, Фадейкина ОВ и др. Лиофилизация стандартизированных по количеству жизнеспособных клеток микроорганизмов в низкой концентрации: разработка режима высушивания. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):193–202. https://doi.org/10.30895/2221-996X-2025-25-2-193-202
Об авторах
А. А. ВоропаевРоссия
Воропаев Андрей Андреевич
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. В. Фадейкина
Россия
Фадейкина Ольга Васильевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Р. М. Валюхова
Россия
Валюхова Рузиля Маратовна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Ю. И. Крысанова
Россия
Крысанова Юлия Игоревна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Д. С. Давыдов
Россия
Давыдов Дмитрий Сергеевич, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
С. В. Овсиенко
Россия
Овсиенко Сергей Васильевич, канд. фарм. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Воропаев А.А., Фадейкина О.В., Валюхова Р.М., Крысанова Ю.И., Давыдов Д.С., Овсиенко С.В. Сравнительная оценка контроля качества питательных сред с использованием лиофилизированных тест-штаммов «ЛИОШТАММ»: результаты межлабораторных испытаний. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(3):321-331. https://doi.org/10.30895/2221-996X-2025-25-3-321-331
For citation:
Voropaev A.A., Fadeikina O.V., Valyukhova R.M., Krysanova J.I., Davydov D.S., Ovsienko S.V. Comparative evaluation of nutrient media quality control using LYOSHTAMM lyophilised test strains: Results of interlaboratory trials. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(3):321-331. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-3-321-331


































