Перейти к:
Опыт производства и клинического применения биомедицинского клеточного продукта Изитенс® для восстановления повреждений хрящевой ткани коленного сустава человека
https://doi.org/10.30895/2221-996X-2024-24-2-172-187
Резюме
ВВЕДЕНИЕ. Существующие клеточные методы восстановления хрящевой ткани, такие как аутологичная трансплантация хондроцитов, недостаточно эффективны, а хирургическое вмешательство болезненно и травматично. Поэтому требуется разработка более эффективного продукта для клеточной терапии с малоинвазивной хирургической процедурой его имплантации пациенту.
ЦЕЛЬ. Разработка технологии производства аутологичного биомедицинского клеточного продукта (БМКП), содержащего трехмерные структуры (3D-сфероиды) на основе хондроцитов, выделенных из хрящевой ткани пациента, и оценка клинической эффективности его применения.
МАТЕРИАЛЫ И МЕТОДЫ. Аутологичные хондроциты, выделенные из биоптата хрящевой ткани пациента, культивировали в монослойной культуре для получения необходимого количества клеток. Дальнейшее культивирование хондроцитов проводили с использованием неадгезивного покрытия для формирования 3D-сфероидов. Все этапы производства БМКП проводили в асептических условиях в изоляторах клеточных культур. Для характеристики фенотипа хондроцитов на разных этапах культивирования использовали фазово-контрастную микроскопию и иммуногистохимическое окрашивание с применением специфических флуоресцентно меченных антител. Генетическую стабильность контролировали кариологическим методом. В рамках клинического исследования (КИ) проводили оценку эффективности БМКП Изитенс® при помощи специализированных функциональных тестов и по Шкале оценки восстановления хрящевой ткани по результатам магнитно-резонансной томографии (MOCART). Основным критерием эффективности было изменение общего балла по Шкале оценки исхода травмы и остеоартроза коленного сустава (KOOS).
РЕЗУЛЬТАТЫ. Разработана технология производства аутологичного БМКП Изитенс® из собственных клеток пациента без применения сыворотки животных, ростовых факторов, цитокинов и других добавок. С использованием кариологического метода подтверждено сохранение генетической стабильности хондроцитов на протяжении 3 пассажей культивирования в монослойной культуре. При 3D-культивировании в виде сфероидов хондроциты продуцируют характерные для матрикса хрящевой ткани белки (коллаген типа II, аггрекан), приобретая таким образом способность к восстановлению поврежденного хряща. В ходе КИ продемонстрировано статистически значимое улучшение состояния хрящевой ткани коленных суставов через 12 мес. после трансплантации 3D-сфероидов из аутологичных хондроцитов. Среднее изменение общего балла KOOS составило 23,8±15,9.
ВЫВОДЫ. Продемонстрирована высокая эффективность БМКП Изитенс® для восстановления хрящевой ткани. На основании результатов клинических исследований данный БМКП зарегистрирован на территории Российской Федерации, введен в клиническую практику и может стать альтернативой эндопротезированию и дорогостоящим операциям за рубежом.
Ключевые слова
Для цитирования:
Зоричева А.С., Звонова Е.А., Агапова Л.С., Лыкова М.С., Маркова О.А., Леонов В.С. Опыт производства и клинического применения биомедицинского клеточного продукта Изитенс® для восстановления повреждений хрящевой ткани коленного сустава человека. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(2):172-187. https://doi.org/10.30895/2221-996X-2024-24-2-172-187
For citation:
Zoricheva A.S., Zvonova E.A., Agapova L.S., Lykova M.S., Markova O.A., Leonov V.S. Experience in the production and clinical application of the cell-based medicinal product Easytense® for the repair of cartilage defects of the human knee. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(2):172-187. https://doi.org/10.30895/2221-996X-2024-24-2-172-187
ВВЕДЕНИЕ
Основной причиной ограниченной регенеративной способности хряща является малое количество хондроцитов в ткани, а также их низкий пролиферативный потенциал. После повреждения вследствие травмы или заболевания (рассекающий остеохондрит, остеоартроз и др.) хрящевая ткань практически не восстанавливается.
Наиболее часто встречается повреждение хряща коленного сустава, симптомы которого (боль, отек, скованность и ограничение в движении) сильно снижают качество жизни пациентов. Несмотря на существование множества хирургических подходов для восстановления поврежденного хряща сустава, проблема лечения данной патологии требует поиска новых технологических решений.
В последние годы перспективным направлением является разработка клеточных методов восстановления хрящевой ткани, таких как аутологичная трансплантация хондроцитов (АТХ). Принцип АТХ основан на получении собственных клеток пациента, которые наращивают in vitro, а затем переносят в область повреждения хряща, где они интегрируются в ткань реципиента, заполняя поврежденную область. Считается, что АТХ значительно превосходит ранее применявшиеся методы терапии [1–3].
Несмотря на прогресс в области развития клеточных технологий для восстановления хрящевой ткани, многие вопросы остаются нерешенными. Одной из основных проблем АТХ является дедифференцировка хондроцитов в процессе культивирования, проявляющаяся изменением фенотипа и снижением способности синтезировать белки внеклеточного матрикса (аггрекан, коллаген типа II и др.). При трансплантации таких дедифференцированных хондроцитов вместо гиалинового хряща формируется волокнистый хрящ с недостаточными для физических нагрузок биомеханическими свойствами [4]. Это стимулировало поиск новых условий культивирования, инициирующих повторную дифференцировку хондроцитов in vitro. В литературе описаны различные методические подходы, направленные на индукцию редифференцировки хондроцитов в культуре, включая использование факторов роста [5–7], ингибиторов и индукторов различных сигнальных путей [8], генетические модификации клеток с регулируемой экспрессией генов [9][10]. Во многих исследованиях продемонстрировано, что использование трехмерных матриксов для культивирования хондроцитов индуцирует их редифференцировку в функционально активные хондроциты [11][12]. Вместе с тем посторонний материал в составе трансплантата может вызывать иммунные и воспалительные реакции. Кроме того, использование объемных матриксов часто делает невозможным осуществление операции малоинвазивным методом, усложняя тем самым хирургическое вмешательство. Следующим этапом развития технологии АТХ стало получение трехмерной культуры клеток без использования матриксов или иных стимулирующих воздействий [13–15].
В настоящее время в Российской Федерации зарегистрирован первый биомедицинский клеточный продукт (БМКП) Изитенс® (АО «ГЕНЕРИУМ»). Клинические исследования (КИ) БМКП проводились в рамках проспективного открытого многоцентрового КИ эффективности и безопасности трансплантации препарата в ходе терапии пациентов с дефектами хряща коленного сустава 1–10 см². БМКП представляет собой сфероиды из аутологичных хондроцитов человека, связанных матриксом, синтезированным этими клетками de novo (рис. 1). Одним из основных преимуществ БМКП является то, что это полностью аутологичный продукт. При его производстве в качестве исходных материалов используют только биоптаты собственных тканей пациента и сыворотку крови. Применение любых компонентов животного происхождения в процессе культивирования хондроцитов и формирования сфероидов исключено. Процедура культивирования без использования добавок (факторы роста, ингибиторы и др.) обеспечивает преимущества данного БМКП с точки зрения эффективности и безопасности по сравнению с другими известными продуктами на основе хондроцитов. Еще одним преимуществом препарата является его способность самостоятельно прикрепляться к поверхности поврежденного хряща без какого-либо внешнего воздействия. Это делает метод лечения малоинвазивным и позволяет отказаться от использования дополнительных этапов фиксации, сократить длительность хирургического вмешательства, снизить боль и улучшить течение послеоперационного периода, сократить время пребывания пациента в стационаре.
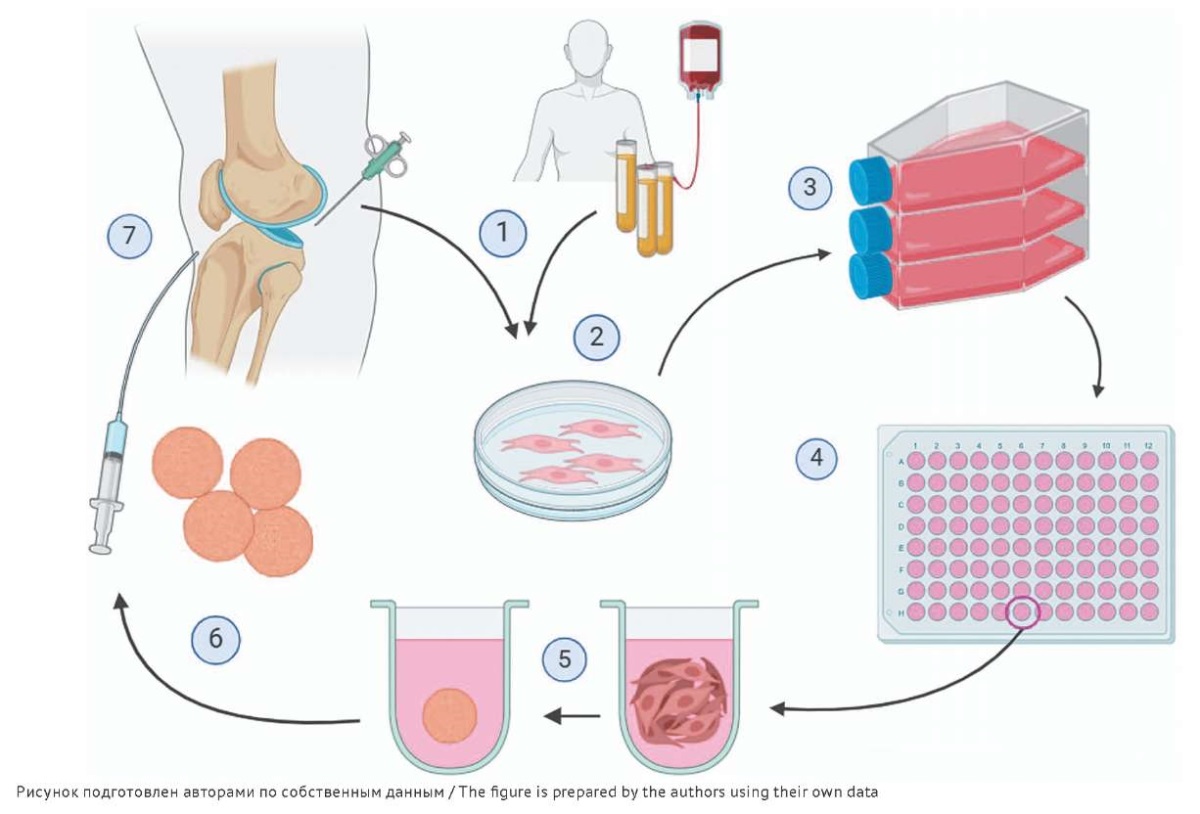
Рис. 1. Схема получения биомедицинского клеточного продукта (БМКП) на основе аутологичных хондроцитов человека в виде сфероидов. 1 — отбор биоптата хряща, получение аутологичной сыворотки крови; 2 — выделение хондроцитов из биоптата; 3 — культивирование хондроцитов в монослойной культуре; 4 — пересев хондроцитов в 96-луночный планшет с неадгезивным покрытием для получения сфероидов; 5 — формирование сфероидов из хондроцитов; 6 — изготовление готовой формы БМКП; 7 — трансплантация препарата БМКП пациенту.
Fig. 1. Scheme for the production of a cell-based medicinal product (CBMP) from autologous human chondrocytes formed as spheroids. 1, collection of a cartilage biopsy and autologous serum; 2, isolation of chondrocytes from the biopsy material; 3, cultivation of the chondrocytes in monolayer culture; 4, transfer of the chondrocytes to a 96-well plate with a non-adhesive coating to obtain spheroids; 5, formation of chondrocyte spheroids; 6, production of the finished CBMP dosage form; 7, transplantation of the CBMP into the patient.
Цель работы — разработка технологии производства аутологичного БМКП, содержащего трехмерные структуры (3D-сфероиды) на основе хондроцитов, выделенных из хрящевой ткани пациента, и оценка клинической эффективности его применения.
МАТЕРИАЛЫ И МЕТОДЫ
Все этапы производства БМКП Изитенс® проводили в асептических условиях в изоляторах клеточных культур (Comecer, Италия), оснащенных СО2-инкубаторами, центрифугами, микроскопами [16].
Выделение хондроцитов из биоптата хрящевой ткани и культивирование in vitro
Хондроциты выделяли из биоптата хрящевой ткани человека путем механического измельчения и обработки коллагеназой (Nordmark, Германия) при постоянном перемешивании. После центрифугирования осадок, содержащий хондроциты, инкубировали в культуральных флаконах при 37 °С и 5% СО2 в среде Ham’s F-12 (Corning, США) и αMEM (Corning, США) (в соотношении 1:1) с добавлением 2 мМ L-глутамина (Corning, США) и 10–15% аутологичной сыворотки крови. Среду обновляли каждые 3–4 сут. При достижении субконфлюэнтного состояния (80–90%) клетки диссоциировали TrypLE™ (Gibco, США). Далее проводили следующий пассаж клеток в плотности 5000–7000 клеток/см². Конфлюэнтность оценивали визуально с помощью инвертированного микроскопа (Nikon, Япония). Для подсчета клеток использовали трипановый синий (Sigma-Aldrich, США) и камеру гемоцитометра (INCYTO, Республика Корея).
Формирование сфероидов на неадгезивной поверхности
Для формирования трансплантата хондроциты 1 или 2 пассажа переносили в лунки 96-луночного планшета с неадгезивным покрытием (Corning, США), где клетки формировали трехмерную структуру — сфероиды. Сфероиды инкубировали в среде Ham’s F-12 и αMEM (в соотношении 1:1) с добавлением 2 мМ L-глутамина и 10% аутологичной сыворотки крови пациента при температуре 37 °С и 5% СО2. Обновление среды проводили каждые 3–4 сут.
Оценка пролиферативной активности, определение времени удвоения популяции культивируемых хондроцитов
Для оценки пролиферативной активности культивируемых хондроцитов рассчитывали количество удвоений популяции (population doubling level, PDL) и время удвоения популяции (population doubling time, PDT). Для этого учитывали время культивирования, количество клеток при диссоциации монослойной культуры и последующем пассаже. Расчет показателя PDL проводили согласно формуле (1):
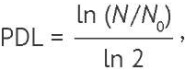 (1)
(1)
где N0 — исходное количество клеток, N — количество клеток через время Т.
Расчет показателя PDT проводили согласно формуле (2):
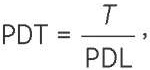 (2)
(2)
где Т — время культивирования.
Кроме того, для оценки пролиферативной активности хондроцитов использовали иммуноцитохимический метод, основанный на выявлении экспрессии маркера пролиферации Ki-67 [17]. С использованием микроскопа подсчитывали количество клеток, положительно окрашенных антителами к Ki-67, и общее количество клеток в нескольких полях зрения, далее вычисляли процентное содержание митотически активных клеток.
Кариологический анализ
Для проведения кариологического анализа препараты метафазных хромосом получали по стандартной методике. Для идентификации отдельных хромосом использовали дифференциальную G-окраску хромосом по методу Мительмана [18]. Анализ проводили с помощью микроскопа Axio Imager.Z2 (Carl Zeiss, Германия) и программного обеспечения Ikaros (MetaSystems, Германия). Для хромосомного анализа использовали иммерсионный объектив (×100). Подсчитывали не менее 50 метафаз на пассажах, при этом номер пассажа превышал необходимое число для производства БМКП. Кариотип анализировали в соответствии с критериями Международной цитогенетической номенклатуры1.
Иммуногистохимическое окрашивание
Для анализа экспрессии хондрогенных маркеров культивированные хондроциты фиксировали в 4% формальдегиде. Сфероиды заключали в среду Tissue-Tek® O.C.T. Compound (Sakura Finetek, Япония) и замораживали, далее с помощью криостата (CM1520, Leica, Германия) получали срезы толщиной 8 мкм, снимали на теплое предметное стекло, фиксировали в холодном ацетоне (минус 20 °С).
Зафиксированные препараты окрашивали первичными антителами в течение 12–15 ч при 4 °С. Использовали антитела к следующим белкам: Sox9 (1:200; Abcam, Великобритания), аггрекан (1:10; R&D Systems, США), коллаген типа II (1:100; Abcam, Великобритания), коллаген типа I (1:200; Abcam, Великобритания), Ki-67 (1:200; Abcam, Великобритания). После отмывки от первичных антител препараты инкубировали, применяя соответствующие вторичные антитела, конъюгированные с флуорохромами (Alexa Fluor 488, Alexa Fluor 546; 1:500; Life Technology, США) в течение 1 ч при комнатной температуре. После отмывки препараты покрывали средой Vectashield (Vector Laboratories, США), содержащей краситель 4’,6-диамидино-2-фенилиндол (DAPI) для окрашивания ядер. Окрашенные препараты анализировали с помощью микроскопа Axio Imager.Z2 с использованием подходящих флуоресцентных фильтров.
Клиническое исследование, статистическая обработка
БМКП Изитенс® применялся у пациентов в рамках клинического исследования HACS-KCD-III «Проспективное сравнительное открытое многоцентровое клиническое исследование эффективности и безопасности трансплантации препарата GNR-089 (Сфероиды из аутологичных хондроцитов человека, связанных матриксом) (АО «ГЕНЕРИУМ», Россия) в лечении пациентов с дефектами хряща коленного сустава 1–10 см²». Протокол исследования одобрен Минздравом России (разрешение на проведение клинического исследования БМКП № 1 от 12.03.2021), Советом по этике Минздрава России (выписка из протокола № 1 от 10.08.2020) и независимыми локальными этическими комитетами клинических центров. Исследование проводилось в 8 исследовательских центрах Российской Федерации в соответствии с Правилами надлежащей клинической практики2, действующими нормативными требованиями и с соблюдением этических принципов медицинских исследований с участием человека, заложенных Хельсинкской декларацией Всемирной медицинской ассоциации3.
В исследовании приняли участие 104 пациента в возрасте от 18 до 50 лет с изолированным единичным повреждением хряща коленного сустава III или IV степени по классификации повреждений хряща Международного общества восстановления хряща (International Cartilage Repair Society, ICRS) [19]. Пациенты были разделены на 2 группы в соответствии с размером дефекта хряща коленного сустава: группа I — 52 пациента с размером дефекта от ≥1 до <4 см², группа II — 52 пациента с размером дефекта от ≥4 до <10 см². Все пациенты предоставили информированное согласие на участие в исследовании до проведения любых процедур в рамках протокола. Дозировка трансплантируемых сфероидов составляла 10–70 сфероидов на 1 см² дефекта хрящевой ткани после хирургической обработки.
Промежуточная оценка была проведена через 12 мес. после трансплантации БМКП. Предусмотренные протоколом клинического исследования наблюдение и оценка функционального состояния будут продолжаться в течение 36 мес. после проведения трансплантации.
Оценка эффективности лечения повреждений суставного хряща проводилась при помощи батареи специализированных функциональных тестов и по Шкале оценки восстановления хрящевой ткани по результатам магнитно-резонансной томографии (Magnetic Resonance Observation of Cartilage Repair Tissue, MOCART) через 12 мес. после введения БМКП. Также 9 пациентам из группы II была проведена контрольная артроскопия. Основным критерием эффективности в исследовании было изменение общего балла по Шкале оценки исхода травмы и остеоартроза коленного сустава (Knee Injury and Osteoarthritis Outcome Score, KOOS).
Анализ изменения общего балла и баллов по пяти подшкалам Шкалы KOOS, а также других конечных точек в виде численных переменных в различных временных точках относительно исходного уровня проводился с использованием парного t-теста. Для оценки результатов магнитно-резонансной томографии использованы методы описательной статистики.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основные характеристики производственного процесса биомедицинского клеточного продукта
Была разработана технология производства БМКП в изоляторах клеточных культур. Общий вид изолятора клеточных культур, состоящего из трех сообщающихся модулей, представлен на рисунке 2.

Рис. 2. Изолятор клеточных культур, используемый для производства биомедицинского клеточного продукта Изитенс®.
Fig. 2. Cell culture isolator used for the production of the cell-based medicinal product Easytense®.
Поскольку серии БМКП не проходят стадию финальной стерилизации, в течение всего процесса должны соблюдаться высокие требования асептического производства. Все этапы производства БМКП проходили в асептических условиях в изоляторах клеточных культур. Использование данной технологии для производства серий БМКП позволило обеспечить постоянное соблюдение условий, соответствующих чистоте зон класса А (согласно рекомендациям GMP) во время культивирования, отбора образцов для контроля качества клеток и готового к имплантации продукта. Передача сырья и материалов внутрь изолятора возможна без нарушения асептических условий путем использования шлюза с сопутствующей биодеконтаминацией парами перекиси водорода. Благодаря изоляторной технологии исключен прямой контакт между персоналом и продуктом и снижен риск микробной и перекрестной контаминации БМКП.
Процесс производства БМКП был валидирован в ходе получения серий продукта для КИ. Все контролируемые параметры технологического процесса соответствовали критериям приемлемости. Процесс позволял получать серии БМКП, соответствующего требованиям спецификации на готовый продукт. Спецификация содержит сведения об аутологичном БМКП, его качественном и количественном составе, биологических и иных характеристиках [20].
Основные характеристики производственного процесса и клеточного продукта представлены в таблице 1.
Таблица 1. Основные характеристики производственного процесса
и биомедицинского клеточного продукта
Table 1. Main characteristics of the production process and the cell-based medicinal product
|
Характеристика Characteristics |
Описание Description |
|
|
Культура клеток Cell culture |
Аутологичные хондроциты человека Human autologous chondrocytes |
|
|
Количество пассажей Number of passages |
Не более двух Not more than two |
|
|
Питательная среда Culture medium |
Химически определенная среда (Ham’s F-12; αMEM) с аутологичной сывороткой крови человека Chemically defined medium (Ham’s F-12; αMEM) with autologous human serum |
|
|
Производственная среда Production environment |
Изолятор класса cGMP, класс чистоты А/ISO 5 cGMP grade isolator, cleanliness grade A/ISO 5 |
|
|
Параметры изолятора клеточных культур Cell culture isolator parameters |
Концентрация СО2 в инкубаторе Incubator CO2 levels |
4–6% |
|
Температура в инкубаторе Incubator temperature |
36–38 °С |
|
|
Скорость ламинарного потока Laminar flow velocity |
0,36–0,54 м/с 0.36–0.54 m/s |
|
|
Избыточное давление в камере Chamber overpressure |
Не менее 50 Па Not less than 50 Pa |
|
|
Нормы концентрации аэрозольных частиц в зоне чистоты класса А Maximum permitted airborne particle concentration for Grade A clean zones |
Частицы размером более 0,5 мкм — не более 3520/м³ Not more than 3,520 particles above 0.5 μm per m³ |
|
|
Частицы размером более 5,0 мкм — не более 20/м³ Not more than 20 particles above 5.0 μm per m³ |
||
|
Пределы микробной контаминации для класса чистоты А Microbial contamination limits for Grade A clean zones |
<1 КОЕ/чашку Петри за 4 ч методом седиментации <1 CFU/settle plate in 4 h (sedimentation method) |
|
|
<1 КОЕ/м³ воздуха методом аспирации <1 CFU/m³ (aspiration method) |
||
|
<1 КОЕ/пластину методом отпечатка <1 CFU/contact plate (imprint method) |
||
|
Продукт Product |
Суспензия сфероидов для внутрисуставного введения в 0,9% растворе натрия хлорида Spheroid suspension for intra-articular injection in 0.9% sodium chloride solution |
|
|
Дозировка БМКП CBMP dosage |
10–70 сфероидов на 1 см² дефекта суставного хряща 10–70 spheroids per 1 cm² of joint cartilage defect |
|
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. КОЕ — колониеобразующая единица, БМКП — биомедицинский клеточный продукт.
Note. CFU, colony-forming unit; CBMP, cell-based medicinal product.
Выделение и культивирование хондроцитов
После механического измельчения и ферментативного расщепления матрикса хрящевой ткани из биоптата хряща изолированные хондроциты высевали в культуральные флаконы в среде с добавлением аутологичной сыворотки и культивировали в стандартных условиях. Освобожденные от матрикса хондроциты приобретали способность быстро делиться в культуре (рис. 3А, Р0). Высокая пролиферативная активность хондроцитов была подтверждена иммуногистохимическим методом с использованием антител к маркеру пролиферации Ki-67 (рис. 3В). На первом пассаже количество клеток (%), находящихся в активной фазе клеточного цикла, составляло более 75%. Показано, что наибольшая скорость пролиферации наблюдалась в культуре хондроцитов на первичном (нулевом) пассаже — время удвоения популяции составляло в среднем 48±15 ч. После субкультивирования скорость деления клеток заметно снижалась и составила 73±13 и 81±16 ч на пассажах 1 и 2 соответственно.
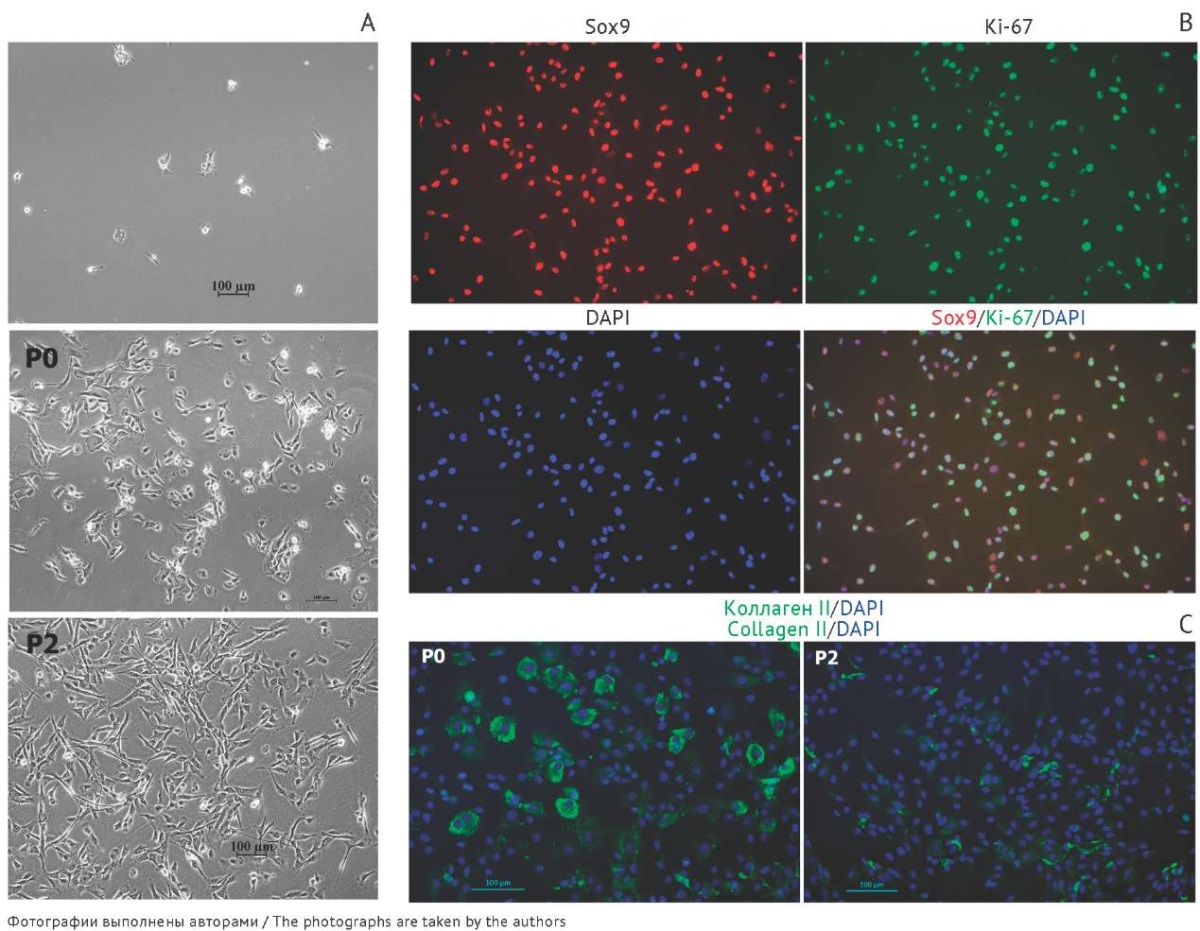
Рис. 3. Культивирование хондроцитов из биоптата хряща в монослойной культуре. А — прикрепление выделенных хондроцитов к поверхности культурального флакона (верхняя фотография), морфология клеток на первичном (нулевом) пассаже (фотография P0) и втором пассаже (фотография P2); фазово-контрастная микроскопия; В — выявление маркера хондроцитов Sox9 (красный цвет) и маркера пролиферирующих клеток Ki-67 (зеленый цвет); иммуноцитохимическое окрашивание на первом пассаже; ядра клеток докрашены красителем DAPI (синий цвет); С — снижение уровня экспрессии коллагена типа II при культивировании хондроцитов в монослое от нулевого (Р0) до второго пассажа (Р2), иммуноцитохимическое окрашивание.
Fig. 3. Cultivation of chondrocytes in monolayer culture. A: attachment of isolated chondrocytes to the culture flask surface (top), cell morphology during the initial (baseline) passage (P0) and the second passage (P2) visualised by phase-contrast microscopy. B: immunocytochemical detection of Sox9, a chondrocyte marker (red), and Ki-67, a cell proliferation marker (green), visualised by immunocytochemical staining at the first passage, with nuclei counterstained with DAPI, 4’,6-diamidino-2-phenylindole (blue). C: reduction of collagen II expression in monolayer culture of chondrocytes from the baseline passage (P0) through the second passage (P2) visualised by immunocytochemical staining.
Таким образом, культивирование хондроцитов, выделенных из биоптата хряща, позволяет в течение одного-двух пассажей получить необходимое количество клеток для трансплантации и восстановления поврежденной хрящевой ткани. Однако культивирование хондроцитов в виде монослойной культуры имело существенный недостаток — во время пассажей происходила дедифференцировка хондроцитов с утратой характерного фенотипа. Клетки приобретали вытянутую, веретенообразную форму, напоминающую фибробласты (рис. 3А, Р2). Анализ основных хондрогенных маркеров (аггрекан, коллаген типа II, Sox9) с помощью иммуноцитохимического окрашивания выявил изменения уровня их экспрессии при культивировании хондроцитов в монослое. Продукция характерного для гиалинового хряща коллагена типа II снижалась, в то время как продукция коллагена типа I повышалась (рис. 3С). Эти результаты согласуются с описанными в литературе данными [21][22]. Ранее было показано, что при трансплантации дедифференцированных хондроцитов происходило формирование волокнистого хряща с низкими биомеханическими свойствами [23–25], что ограничило применение клеток, культивируемых в виде монослоя, для восстановления поврежденного хряща и потребовало дополнительной разработки клеточного продукта на основе хондроцитов.
Получение сфероидов
Одним из способов редифференцировки хондроцитов является помещение их в условия трехмерной модели культивирования с формированием сфероидов, что способствует стимуляции экспрессии ключевых белковых маркеров хрящевой ткани [26–28]. Для производства БМКП хондроциты высевали в лунки с неадгезивным покрытием, которое препятствует прикреплению клеток ко дну лунок, повышая их адгезию друг к другу и, таким образом, способствуя образованию трехмерной клеточной структуры (сфероидов) (рис. 4А). В лунках в течение 2–3 нед. происходила агрегация хондроцитов и формирование сфероидов без какого-либо физического, химического или иного стимулирующего воздействия.
Переход к культивированию дедифференцированных хондроцитов в трехмерной системе индуцировал их редифференцировку, что сопровождалось восстановлением морфологических и функциональных свойств клеток. В течение 1 нед. культивирования сфероидов интенсивность окрашивания коллагена типа I оставалось более высокой в сравнении с коллагеном типа II, который выявлялся только в отдельных клетках. В течение следующих 2 нед. уровень коллагена типа II значительно повышался, при этом интенсивность окрашивания была равномерной по всему сфероиду — не только в клетках, но и в межклеточном пространстве, что свидетельствует о формировании характерного для хрящевой ткани внеклеточного матрикса. Одновременно с этим снижался уровень экспрессии коллагена типа I, при этом окрашивание наблюдалось, главным образом, в плоских клетках наружного слоя сфероидов, что имитировало образование слоя, подобного надхрящнице (рис. 4В). Через 2–3 нед. культивирования сфероидов в клетках наблюдалась устойчивая экспрессия характерных белков хрящевой ткани — коллагена типа II и аггрекана, при незначительном уровне коллагена типа I (рис. 4С).
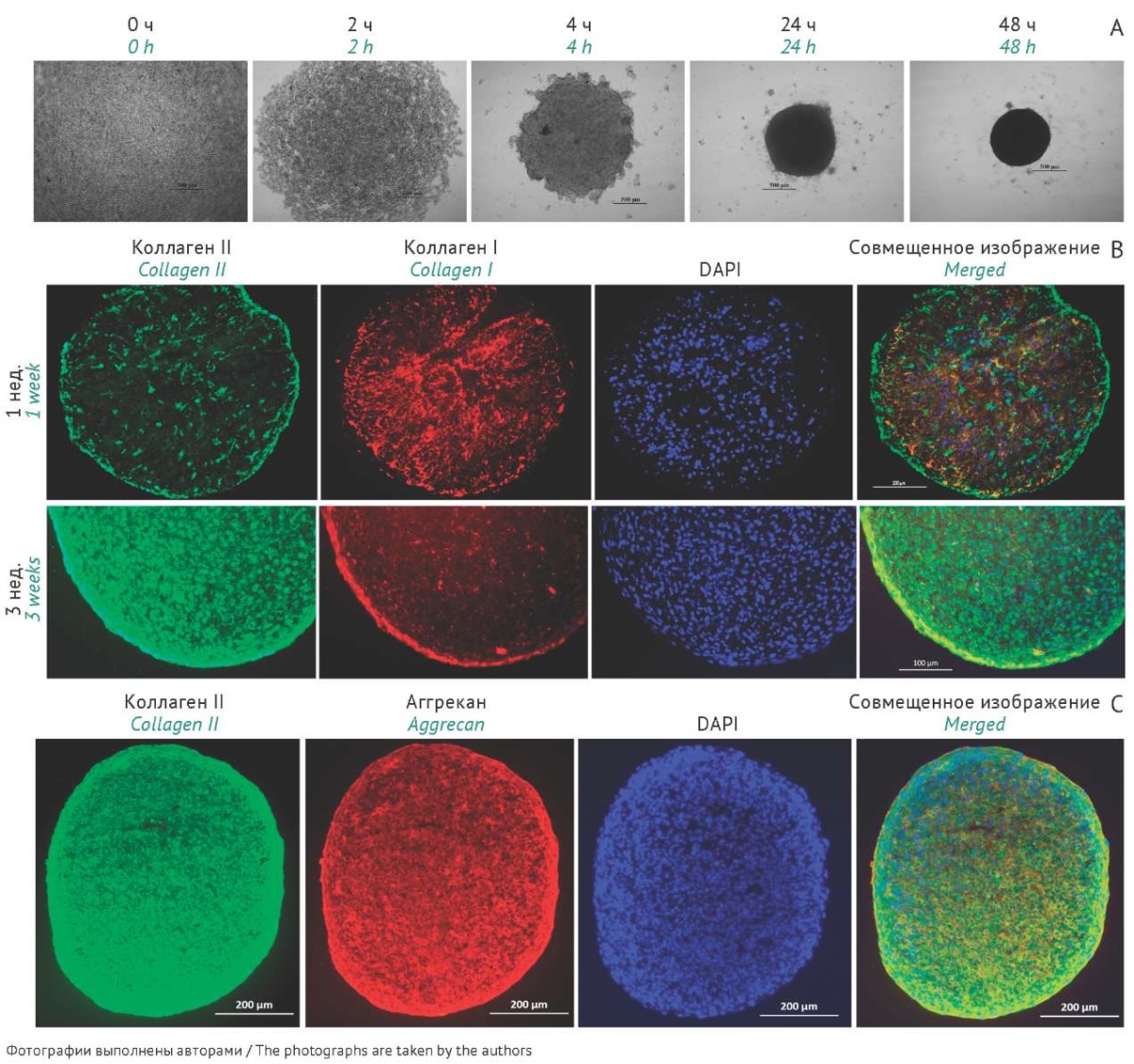
Рис. 4. Культивирование сфероидов из хондроцитов, выделенных из биоптата хряща. А — формирование сфероидов в лунках с неадгезивным покрытием через 0, 2, 4, 24 и 48 ч; фазово-контрастная микроскопия; В — переключение синтеза с коллагена типа I на коллаген типа II при культивировании сфероидов от 1 до 3 нед.: экспрессия маркера хрящевой ткани коллагена типа II (зеленый цвет) увеличивалась к 3 нед. культивирования, тогда как экспрессия коллагена типа I (красный цвет) снижалась; иммуноцитохимическое окрашивание, ядра клеток докрашены красителем DAPI (синий цвет); С — экспрессия маркеров хрящевой ткани — коллагена II (зеленый цвет) и аггрекана (красный); иммуноцитохимическое окрашивание, ядра клеток докрашены красителем DAPI (синий цвет).
Fig. 4. Cultivation of spheroids from chondrocytes isolated from a cartilage biopsy. A: formation of spheroids in culture plate wells with a non-adhesive coating in 0, 2, 4, 24, and 48 h, visualised by phase-contrast microscopy. B: switching from collagen I to collagen II synthesis during spheroid cultivation for 1 to 3 weeks with the expression of collagen II, a cartilage marker, increasing (green) and the expression of collagen I declining (red) by week 3, visualised by immunocytochemical staining, with nuclei counterstained with DAPI, 4’,6-diamidino-2-phenylindole (blue). C: expression of the cartilage-specific markers, collagen II (green) and aggrecan (red), visualised by immunocytochemical staining, with nuclei counterstained with DAPI (blue).
Полученные результаты подтверждают, что в сфероидах хондроциты находятся на более высоком уровне дифференцировки по сравнению с клетками в монослойной культуре, продуцируют характерные для матрикса хрящевой ткани белки, приобретая таким образом способность к быстрой адгезии сфероидов к хрящевой ткани и восстановлению поврежденного хряща.
Генетическая стабильность культивируемых хондроцитов
Генетическая стабильность культивируемых клеточных линий, используемых в производстве БМКП, является одним из обязательных условий обеспечения безопасности клеточной терапии [29]. В Европейском союзе в соответствии с Директивой Еврокомиссии 2009/120/ЕС4 кариологическая характеристика и генетическая стабильность используемой клеточной линии определены как одни из важнейших показателей при оценке качества и безопасности препарата для клеточной терапии.
Оценку генетической стабильности культивируемых хондроцитов проводили методом кариотипирования дифференциально окрашенных метафазных хромосом, позволяющим выявить численные и крупные структурные хромосомные аномалии. Анализ кариотипа включал подсчет числа хромосом в клетке, а также выявление структурных аномалий (одиночные и парные фрагменты; дицентрические, кольцевые, атипичные моноцентрические хромосомы). Клетки имели диплоидный набор хромосом, кариотип соответствовал нормальному кариотипу человека (46 ХХ или 46 XY) (рис. 5). При культивировании в течение не менее трех пассажей не было выявлено структурных и численных хромосомных аномалий, носящих клональный характер.
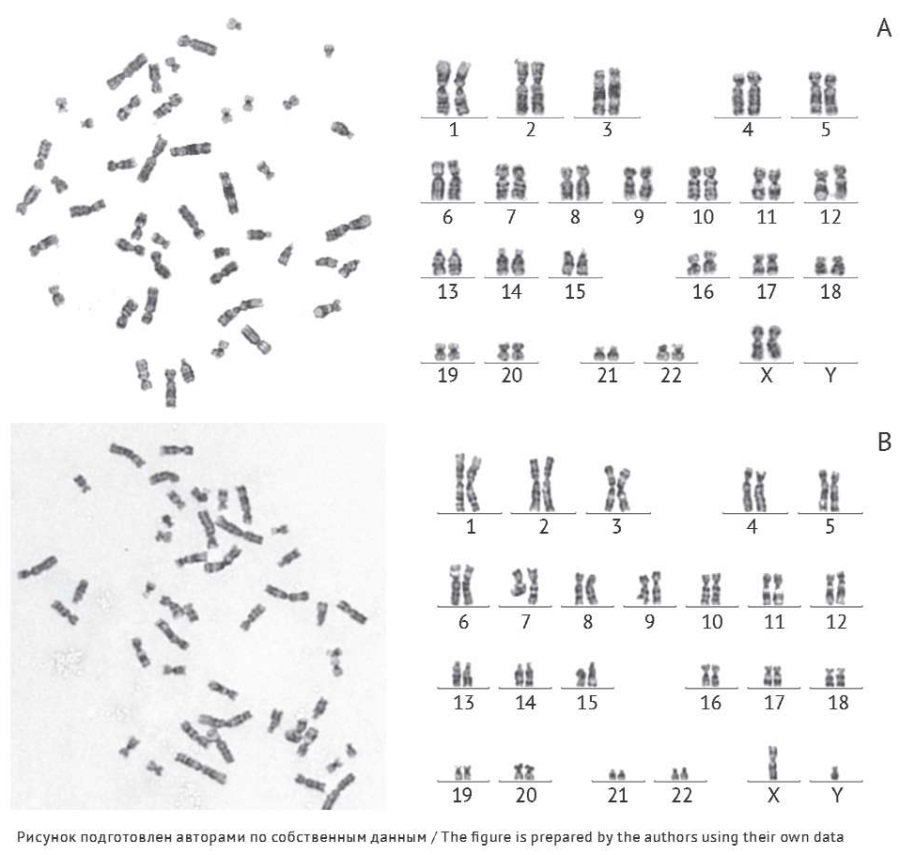
Рис. 5. Кариотип культивируемых хондроцитов человека, использованных при производстве биомедицинского клеточного продукта, на третьем пассаже (объектив ×100). А — 46 ХХ; В — 46 XY.
Fig. 5. Karyotype of cultured (third-passage) human chondrocytes used in the production of the cell-based medicinal product (×100 magnification). A, 46 XX; B, 46 XY.
В производстве БМКП использовались хондроциты, культивируемые in vitro не более двух пассажей. Анализ кариотипа хондроцитов на третьем пассаже (пассаж 3 превышает лимит культивирования, необходимый для производства препарата) подтвердил хромосомную стабильность культивируемых хондроцитов, что свидетельствует о генетической безопасности БМКП.
При подсчете количества удвоений популяции (показатель PDL) было установлено, что при культивировании хондроцитов в течение двух пассажей происходило от 7,5 до 10,7 удвоения популяции, в среднем 8,9±1,24. Таким образом, значение показателя PDL не более 10 можно считать максимальным для ограничения длительности культивирования хондроцитов с целью сохранения генетической стабильности.
Разработка стратегии контроля качества биомедицинского клеточного продукта
БМКП на основе сфероидов из аутологичных хондроцитов человека, связанных матриксом, имеет короткий срок годности (72 ч) и ограниченный объем серии, предназначенный для введения пациенту, для которого был получен продукт. В связи с этим для выполнения всех испытаний, необходимых для подтверждения качества продукта и соответствия требованиям приказа Минздрава России № 14н5, на различных этапах производственного цикла отбирают образцы для проведения контроля по соответствующим показателям.
Стерильность БМКП является критическим показателем качества. Данный показатель контролировали 4 раза на протяжении производственного процесса, начиная с контроля стерильности транспортной среды, в которой поставляется образец хрящевой ткани, и заканчивая ретроспективным контролем стерильности готового продукта. Для исключения возможности получения неверных результатов, вызванных человеческим фактором, и повышения чувствительности метода для контроля стерильности внедрен автоматизированный колориметрический метод (система BacT/ALERT® 3D DualT).
Контроль подлинности и специфической активности продукта проводили путем детекции экспрессии генов, характерных для хондроцитов человека, методом полимеразной цепной реакции с обратной транскрипцией с последующим электрофорезом в агарозном геле. Наличие экспрессии маркерных генов свидетельствует о том, что клетки в составе готового продукта обладают требуемыми характеристиками для восстановления поврежденной хрящевой ткани гиалинового типа. Определение жизнеспособности и количества клеток в составе сфероида проводили параллельно с процедурой упаковки готового продукта [20].
Стратегия контроля качества серии продукта обеспечивает готовность всех показателей качества к моменту отгрузки в медицинскую организацию за исключением завершающего ретроспективного контроля стерильности готового продукта. По причине технической невозможности получить все результаты контроля к моменту отгрузки, выпуск продукта происходит в два этапа в соответствии с порядком, описанном в приказе Минздрава России № 512н6. На первом этапе ответственные за производство и контроль качества проводят оценку записей, относящихся к процессу производства серии БМКП, и результатов мониторинга среды помещений, условий производства, отклонений от установленных процедур и контрольных результатов для первичного выпуска серии БМКП. После получения всех результатов уполномоченное лицо оценивает полностью сформированное досье на серию БМКП для заключительного подтверждения соответствия требованиям, установленным при государственной регистрации.
Клиническое применение биомедицинского клеточного продукта
В клиническое исследование были включены пациенты в возрасте от 18 до 49 лет, средний возраст составил 33,5±8,7 года. В соответствии с размером дефекта хряща коленного сустава пациенты были разделены на 2 группы: группа I — 52 пациента с размером дефекта от ≥1 до <4 см², группа II — 52 пациента с размером дефекта от ≥4 до <10 см². Статистически значимых отличий по показателям возраста, роста, массы тела и индекса массы тела между группами не выявлено (p>0,05). Группы были также сопоставимы по причинам формирования дефектов хряща коленного сустава (p>0,05) (табл. 2).
Таблица 2. Причины формирования дефектов хряща коленного сустава у пациентов
при проведении клинического исследования биомедицинского клеточного продукта
Table 2. Causes of knee cartilage defects in the patients
enrolled in the clinical trial of the cell-based medicinal product
|
Причина дефекта хряща Cartilage defect cause |
Группа I, размер дефекта от ≥1 до <4 см², N (% по группе) Group I, defect size from ≥1 to <4 cm², N (% of the group) |
Группа II, размер дефекта от ≥4 до <10 см², N (% по группе) Group II, defect size from ≥4 to <10 cm², N (% of the group) |
Всего, N (%) Total, N (%) |
|
Травматическое повреждение Traumatic damage |
12 (23,07%) |
15 (28,84%) |
27 (25,96%) |
|
Рассекающий остеохондрит Dissecting osteochondritis |
14 (26,92%) |
15 (28,84%) |
29 (27,89%) |
|
Остеоартроз Osteoarthritis |
25 (48,08%) |
22 (42,31%) |
47 (45,19%) |
|
Аваскулярный некроз Avascular necrosis |
1 (1,92%) |
0 |
1 (0,96%) |
|
Всего: Total: |
52 |
52 |
104 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Анализ динамики общего балла по Шкале KOOS через 12 мес. после введения БМКП на основе сфероидов показал статистически значимое улучшение относительно исходного уровня (p<0,0001). Среднее изменение общего балла KOOS составило 23,8±15,91, более выраженное у пациентов группы II (28,12±15,11) в сравнении с пациентами группы I (19,14±15,59).
При анализе оценок по подшкалам KOOS был получен такой же качественный результат, что и при оценке общего балла KOOS, а именно улучшение оценок по каждой подшкале через 12 мес. после трансплантации по сравнению с исходным уровнем (p<0,0001). Средние значения изменений по подшкалам KOOS варьировали от 16,1±14,41 до 35,1±28,76.
Полученные результаты анализа общей оценки МРТ по шкале MOCART также продемонстрировали улучшение состояния хрящевой ткани коленных суставов через 12 мес. после трансплантации в обеих группах пациентов и суммарно (p<0,0001).
Оценка состояния суставного хряща в ходе контрольной артроскопии, проведенной у 9 пациентов группы II, показала высокую степень восстановления: у 8 из 9 пациентов степень восстановления дефекта была сравнима с окружающим хрящом и только у 1 пациента наблюдалось восстановление на 75% от глубины дефекта; интеграция относительно пограничной зоны у 5 из 9 пациентов была полной, у остальных 4 пациентов наблюдалось формирование демаркационной линии менее 1 мм. Общая оценка восстановления хряща у всех пациентов была высокой и соответствовала II степени (почти нормальное состояние), что подтверждает факт успешной трансплантации БМКП на основе сфероидов.
Дополнительно проведен анализ пролиферативной активности культивируемых хондроцитов в зависимости от возраста, половой принадлежности, диагноза пациентов. Пролиферативная активность хондроцитов не зависела от возраста и половой принадлежности. В группах с разными диагнозами (травматическое повреждение хряща, остеоартроз и рассекающий остеохондрит) выявлены межгрупповые статистически значимые различия по показателю времени удвоения популяции (p<0,0001). Наибольшей пролиферативной активностью обладали хондроциты, выделенные из хрящевой ткани пациентов с травматическим повреждением хряща и рассекающим остеохондритом: время удвоения популяции в этих группах составило 62,9±13,95 и 67,4±15,46 ч соответственно. Наименее активно пролиферировали хондроциты, выделенные из хрящевой ткани пациентов с остеоартрозом: время удвоения популяции в этой группе — 81,3±25,30 ч. Однако анализ данных по изменению балла KOOS в этих группах не выявил межгрупповых статистически значимых различий через 12 мес. после трансплантации. Средние значения изменения общего балла KOOS варьировали от 22,2±19,67 до 22,9±16,35. Это свидетельствует об отсутствии корреляции между пролиферативной активностью культивируемых хондроцитов и эффективностью БМКП на основе этих хондроцитов.
Также не выявлено зависимости эффективности препарата от дозы, определяемой как количество трансплантированных сфероидов на квадратный сантиметр поврежденной поверхности суставного хряща. При трансплантации до 30 сфероидов на 1 см² дефекта хряща изменение общего балла по шкале KOOS составило 24,07±14,48, при трансплантации 30–40 сфероидов/см² — 21,83±16,66, а более 40 сфероидов/см² — 18,86±20,19.
ЗАКЛЮЧЕНИЕ
Технология производства отечественного препарата Изитенс® (АО ГЕНЕРИУМ», РУ № БМКП № 1) в изоляторах клеточных культур валидирована и обладает повторяемостью и надежностью, что гарантирует получение аутологичного биомедицинского клеточного продукта, соответствующего требованиям спецификации на готовый продукт.
С использованием кариологического метода показано, что при производстве биомедицинского клеточного продукта сохраняется генетическая стабильность клеточной линии хондроцитов.
При проведении клинических исследований препарата продемонстрировано улучшение состояния хрящевой ткани коленных суставов через 12 мес. после трансплантации. Показано, что ни возраст, ни половая принадлежность, ни площадь дефекта не являются ограничивающими факторами для лечения повреждений хрящевой ткани трансплантацией сфероидов из аутологичных хондроцитов. У пациентов с остеоартрозом было отмечено незначительное снижение характеристик пролиферативной активности хондроцитов по сравнению с пациентами с травматическим повреждением хряща и рассекающим остеохондритом. Производство продукта для пациентов с остеоартрозом может занять больше времени, однако подтверждено, что уровень пролиферативной активности клеток не влияет на результат лечения. Продемонстрирована высокая эффективность препарата для восстановления хрящевой ткани в установленном диапазоне дозировки трансплантируемых сфероидов.
На основании результатов КИ БМКП Изитенс® зарегистрирован биомедицинский клеточный продукт на территории Российской Федерации, введен в клиническую практику и может стать альтернативой эндопротезированию и дорогостоящим операциям за рубежом.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.С. Зоричева — концепция и дизайн исследования, выполнение экспериментальных работ, обработка и анализ данных, написание текста рукописи, формулировка выводов; Е.А. Звонова — дизайн исследования, анализ данных, написание и критическое обсуждение текста рукописи; Л.С. Агапова — выполнение экспериментальных работ, написание и критическое обсуждение текста рукописи, формулировка выводов; М.С. Лыкова — выполнение экспериментальных работ, критическое обсуждение и доработка текста рукописи; О.А. Маркова — планирование эксперимента, обработка данных, написание текста рукописи, формулировка выводов; В.С. Леонов — концепция работы, формулировка выводов, утверждение окончательной версии рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.S. Zoricheva conceptualised and designed the study, conducted experimental work, processed and analysed data, drafted the manuscript, and formulated the conclusions. E.A. Zvonova designed the study, analysed data, drafted and critically discussed the manuscript. L.S. Agapova conducted experimental work, drafted and critically discussed the manuscript, and formulated the conclusions. M.S. Lykova conducted experimental work, critically discussed and revised the manuscript. O.A. Markova designed the experiment, processed data, drafted the manuscript, and formulated the conclusions. V.S. Leonov conceptualised the study, formulated the conclusions, and approved the final version of the manuscript for publication.
Соответствие принципам этики. Протокол исследования одобрен Минздравом России (разрешение на проведение клинического исследования БМКП № 1 от 12.03.2021), Советом по этике Минздрава России (выписка из протокола № 1 от 10.08.2020) и независимыми локальными этическими комитетами клинических центров. Клиническое исследование проводилось в соответствии с этическими принципами медицинских исследований с участием человека, изложенными в Хельсинкской декларации.
Согласие пациентов. Получено информированное добровольное согласие участников исследования на обработку персональных данных и их использование с научной и образовательной целью, в том числе на публикацию персональной медицинской информации в обезличенной форме.
Благодарности. Авторы благодарны коллективу АО «ГЕНЕРИУМ» за помощь в организации экспериментальной работы и сборе данных.
Ethics approval. The study was approved by the Russian Ministry of Health (cell-based medicinal product clinical trial authorisation No. 1 of 12 March 2021), the Ethics Council of the Ministry of Health (meeting minutes No. 1 of 10 August 2020), and the independent local ethics committees of the clinical centres involved. The study was conducted in full compliance with the ethical principles for medical research involving human subjects described in the Declaration of Helsinki.
Informed consent. The patients gave informed consent for the processing of their protected personal and health information, as well as for its use and anonymised publication for scientific and educational purposes.
Acknowledgements. The authors are grateful to the team of GENERIUM JSC for their help in experiment organisation and data collection.
1. ISCN 2016: An international system for human cytogenomic nomenclature. Reprint of: Cytogenetic and genome research. 2016;149(1–2).
2. Integrated addendum to ICH E6(R1): Guideline for good clinical practice E6(R2). https://database.ich.org/sites/default/files/E6_R2_Addendum.pdf
3. WMA Declaration of Helsinki — ethical principles for medical research involving human subjects. https://www.wma.net/policies-post/wma-declaration-of-helsinki-ethical-principles-for-medical-research-involving-human-subjects/
4. Commission directive 2009/120/EC of 14 September 2009 amending Directive 2001/83/EC of the European Parliament and of the Council on the Community code relating to medicinal products for human use as regards advanced therapy medicinal products.
5. Приказ Министерства здравоохранения Российской Федерации от 19.01.2017 № 14н «Об утверждении формы спецификации на биомедицинский клеточный продукт».
6. Приказ Министерства здравоохранения Российской Федерации от 8.08.2018 № 512н «Об утверждении Правил надлежащей практики по работе с биомедицинскими клеточными продуктами».
Список литературы
1. Brittberg M, Recker D, Ilgenfritz J, Saris DBF, SUMMIT Extension Study Group. Matrix-applied characterized autologous cultured chondrocytes versus microfracture: five-year follow-up of a prospective randomized trial. Am J Sports Med. 2018.46(6):1343–51. https://doi.org/10.1177/0363546518756976
2. Hoburg A, Niemeyer P, Laute V, Zinser W, Becher C, Kolombe T, et al. Sustained superiority in KOOS subscores after matrix-associated chondrocyte implantation using spheroids compared to microfracture. Knee Surg Sports Traumatol Arthrosc. 2023;31(6):2482–93. https://doi.org/10.1007/s00167-022-07194-x
3. Ibarra C, Villalobos E, Madrazo-Ibarra A, Velasquillo C, Martinez-Lopez V, Izaguirre A, et al. Arthroscopic matrix -assisted autologous chondrocyte transplantation versus microfracture: a 6-year follow-up of a prospective randomized trial. Am J Sports Med. 2021;49(8):2165–76. https://doi.org/10.1177/03635465211010487
4. Mistry H, Connock M, Pink J, Shyangdan D, Clar C, Royle P, at al. Autologous chondrocyte implantation in the knee: systematic review and economic evaluation. Health Technol Assess. 2017;21(6):1–294. https://doi.org/10.3310/hta21060
5. Kikuchi T, Shimizu T. Thickness-wise growth technique for human articular chondrocytes to fabricate three-dimensional cartilage grafts. Regen Ther. 2020;14:119–27. https://doi.org/10.1016/j.reth.2019.12.001
6. Mendes LF, Katagiri H, Tam WL, Chai YC, Geris L, Roberts SJ, et al. Advancing osteochondral tissue engineering: bone morphogenetic protein, transforming growth factor, and fibroblast growth factor signaling drive ordered differentiation of periosteal cells resulting in stable cartilage and bone formation in vivo. Stem Cell Res Ther. 2018;9(1):42. https://doi.org/10.1186/s13287-018-0787-3
7. Song H, Du H, Li J, Wang M, Wang J, Ju X, Mu W. Effect of fibroblast growth factor 2 on degenerative endplate chondrocyte: from anabolism to catabolism. Exp Mol Pathol. 2021;118:104590. https://doi.org/10.1016/j.yexmp.2020.104590
8. Wang X, Xue Y, Ye W, Pang J, Liu Z, Cao Y, et al. The MEK-ERK1/2 signaling pathway regulates hyaline cartilage formation and the redifferentiation of dedifferentiated chondrocytes in vitro. Am J Transl Res. 2018;10(10):3068–85. PMID: 30416651
9. Gurusinghe S, Bandara N, Hilbert B, Trope G, Wang L, Strappe P. Lentiviral vector expression of Klf4 enhances chondrogenesis and reduces hypertrophy in equine chondrocytes. Gene. 2019;680:9–19. https://doi.org/10.1016/j.gene.2018.09.013
10. Varela-Eirín M, Varela-Vázquez A, Guitián-Caamaño A, Paíno CL, Mato V, Largo R, at al. Targeting of chondrocyte plasticity via connexin43 modulation attenuates cellular senescence and fosters a pro-regenerative environment in osteoarthritis. Cell Death Dis. 2018;9(12):1166. https://doi.org/10.1038/s41419-018-1225-2
11. Bachmann B, Spitz S, Schädl B, Teuschl A, Redl H, Nürnberger S, at al. Stiffness matters: fine-tuned hydrogel elasticity alters chondrogenic redifferentiation. Front Bioeng Biotechnol. 2020;8:373. https://doi.org/10.3389/fbioe.2020.00373
12. Hu X, Zhang W, Li X, Zhong D, Li Y, Li J, Jin R. Strategies to modulate the redifferentiation of chondrocytes. Front Bioeng Biotechnol. 2021;9:764193. https://doi.org/10.3389/fbioe.2021.764193
13. Eschen C, Kaps C, Widuchowski W, Fickert S, Zinser W, Niemeyer P, Roël G. Clinical outcome is significantly better with spheroid-based autologous chondrocyte implantation manufactured with more stringent cell culture criteria. Osteoarthr Cartil Open. 2020;2(1):100033. https://doi.org/10.1016/j.ocarto.2020.100033
14. Vonk LA, Roël G, Hernigou J, Kaps C, Hernigou P. Role of matrix-associated autologous chondrocyte implantation with spheroids in the treatment of large chondral defects in the knee: a systematic review. Int J Mol Sci. 2021;22(13):7149. https://doi.org/10.3390/ijms22137149
15. Guillén-García P, Guillén-Vicente I, Rodríguez-Iñigo E, Guillén-Vicente M, Fernández-Jaén TF, Navarro R, at al. Cartilage defect treatment using high-density autologous chondrocyte implantation (HD-ACI). Bioengineering (Basel). 2023;10(9):1083. https://doi.org/10.3390/bioengineering10091083
16. Шустер АМ, Ручко СВ, Щукин МВ, Александров ВН, Говоров ИВ, Григорьева ОВ и др. Опыт создания промышленной линии для производства клеточных продуктов по изоляторной технологии. БИОпрепараты. Профилактика, диагностика, лечение. 2014;(4):37–41.
17. Gerdes J, Lemke H, Baisch H, Wacker HH, Schwab U, Stein H. Cell cycle analysis of a cell proliferation-associated human nuclear antigen defined by the monoclonal antibody Ki-67. J Immunol. 1984;133(4):1710–5. https://doi.org/10.4049/jimmunol.133.4.1710
18. Ozkinay C, Mitelman F. A simple trypsin-Giemsa technique producing simultaneous G- and C-banding in human chromosomes. Hereditas. 1979;90(1):1–4. https://doi.org/10.1111/j.1601-5223.1979.tb01287.x
19. van den Borne MP, Raijmakers N, Vanlauwe J, Victor J, de Jong S, Bellemans J, at al. International Cartilage Repair Society. International Cartilage Repair Society (ICRS) and Oswestry macroscopic cartilage evaluation scores validated for use in Autologous Chondrocyte Implantation (ACI) and microfracture. Osteoarthritis Cartilage. 2007;15(12):1397–402. https://doi.org/10.1016/j.joca.2007.05.005
20. Мельникова ЕВ, Рачинская ОА, Меркулова ОВ, Семенова ИС, Кожевникова ЕО, Меркулов ВА. Методические аспекты разработки нормативной документации на биомедицинский клеточный продукт. БИОпрепараты. Профилактика, диагностика, лечение. 2021;21(2):122–35. https://doi.org/10.30895/2221-996X-2021-21-2-122-135
21. Darling EM, Athanasiou KA. Rapid phenotypic changes inpassaged articular chondrocyte subpopulations. J Orthop Res. 2005;23(2):425–32. https://doi.org/10.1016/j.ortres.2004.08.008
22. Marlovits S, Hombauer M, Truppe M, Vècsei V, Schlegel W. Changes in the ratio of type-I and type-II collagen expression during monolayer culture of human chondrocytes. J Bone Joint Surg Br. 2004;86(2):286–95. https://doi.org/10.1302/0301-620x.86b2.14918
23. Tew SR, Clegg PD. Analysis of post transcriptional regulation of SOX9 mRNA during in vitro chondrogenesis. Tissue Eng Part A. 2011;17(13–14):1801–7. https://doi.org/10.1089/ten.tea.2010.0579
24. Peterson L, Minas T, Brittberg M, Nilsson A, Sjögren-Jansson E, Lindahl A. Two- to 9-year outcome after autologous chondrocyte transplantation of the knee. Clin Orthop Relat Res. 2000;(374):212–34. https://doi.org/10.1097/00003086-200005000-00020
25. Roberts S, McCall IW, Darby AJ, Menage J, Evans H, Harrison P, et al. Autologous chondrocyte implantation for cartilage repair: monitoring its success by magnetic resonance imaging and histology. Arthritis Res Ther. 2003;5(1):60–73. https://doi.org/10.1186/ar613
26. Benya PD, Shaffer JD. Dedifferentiated chondrocytes reexpress the differentiated collagen phenotype when cultured in agarose gels. Cell. 1982;30(1):215–24. https://doi.org/10.1016/0092-8674(82)90027-7
27. Bonaventure J, Kadhom N, Cohen-Solal L, Ng KH, Bourguignon J, Lasselin C, Freisinger P. Reexpression of cartilage-specific genes by dedifferentiated human articular chondrocytes cultured in alginate beads. Exp Cell Res. 1994;212(1):97–104. https://doi.org/10.1006/excr.1994.1123
28. Martinez I, Elvenes J, Olsen R, Bertheussen K, Johansen O. Redifferentiation of in vitro expanded adult articular chondrocytes by combining the hanging-drop cultivation method with hypoxic environment. Cell Transplant. 2008;17(8):987–96. https://doi.org/10.3727/096368908786576499
29. Рачинская ОА, Меркулов ВА. Применение методов цитогенетического анализа при оценке качества клеточных линий в составе биомедицинских клеточных продуктов. БИОпрепараты. Профилактика, диагностика, лечение. 2018;18(1):25–32. https://doi.org/10.30895/2221-996X-2018-18-1-25-32
Об авторах
А. С. ЗоричеваРоссия
Зоричева Анастасия Сергеевна
ул. Заводская, стр. 273, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Е. А. Звонова
Россия
Звонова Елизавета Александровна, канд. биол. наук
ул. Тестовская, д. 10, Москва, 123112
Л. С. Агапова
Россия
Агапова Лариса Степановна, канд. биол. наук
ул. Заводская, стр. 273, пос. Вольгинский, Петушинский район, Владимирская область, 601125
М. С. Лыкова
Россия
Лыкова Мария Сергеевна, канд. биол. наук
ул. Заводская, стр. 273, пос. Вольгинский, Петушинский район, Владимирская область, 601125
О. А. Маркова
Россия
Маркова Оксана Анатольевна
ул. Тестовская, д. 10, Москва, 123112
В. С. Леонов
Россия
Леонов Вячеслав Сергеевич, канд. биол. наук
ул. Заводская, стр. 273, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Дополнительные файлы
Рецензия
Для цитирования:
Зоричева А.С., Звонова Е.А., Агапова Л.С., Лыкова М.С., Маркова О.А., Леонов В.С. Опыт производства и клинического применения биомедицинского клеточного продукта Изитенс® для восстановления повреждений хрящевой ткани коленного сустава человека. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(2):172-187. https://doi.org/10.30895/2221-996X-2024-24-2-172-187
For citation:
Zoricheva A.S., Zvonova E.A., Agapova L.S., Lykova M.S., Markova O.A., Leonov V.S. Experience in the production and clinical application of the cell-based medicinal product Easytense® for the repair of cartilage defects of the human knee. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(2):172-187. https://doi.org/10.30895/2221-996X-2024-24-2-172-187


































