Перейти к:
Промоторы для высокоэффективной экспрессии и секреции проинсулина в Saccharomyces cerevisiae
https://doi.org/10.30895/2221-996X-2025-25-3-258-270
Резюме
ВВЕДЕНИЕ. Нехватка систематических сравнительных данных об активности промоторов в Saccharomyces cerevisiae является фактором, ограничивающим повышение эффективности биосинтеза рекомбинантного проинсулина человека. Настоящая работа направлена на экспериментальное сравнение активности ряда конститутивных промоторов в стандартных технологических условиях для определения наиболее продуктивного регуляторного элемента, применимого в промышленных штаммах-продуцентах.
ЦЕЛЬ. Оценить влияние промоторов TEF1, ADH2, ALD4, TDH3 (GPD), TPI1 на экспрессию рекомбинантного проинсулина человека в Saccharomyces cerevisiae и ранжировать их по силе для выбора оптимального промотора, обеспечивающего максимальную продуктивность.
МАТЕРИАЛЫ И МЕТОДЫ. Для экспрессии предшественника инсулина (проинсулина) человека использовали диплоидный штамм S. cerevisiae YS3, полученный слиянием гаплоидных клеток. Векторная система на основе плазмиды pRS425 включала в себя синтетические промоторы (TPI1, TEF1, ADH2, ALD4, TDH3) и сигнальную последовательность. Конструкции вводили в клетки методом электропорации. Сравнительный анализ экспрессии белка проводили при культивировании S. cerevisiae YS3 в колбах и биореакторах с использованием среды YPD. Определение содержания проинсулина и этанола осуществляли с помощью спектрофотометрии, высокоэффективной жидкостной хроматографии (ВЭЖХ) и газовой хроматографии. Подтверждение экспрессии проводили методом ВЭЖХ, совмещенной с масс-спектрометрией. Статистическая обработка данных выполнялась при помощи дисперсионного и корреляционного анализов.
РЕЗУЛЬТАТЫ. Получены штаммы-продуценты S. cerevisiae YS3/pF1145 (TPI1), YS3/pF1157 (TEF1), YS3/pF1199 (ADH2), YS3/pF1200 (ALD4), YS3/pF1201 (TDH3), и проведено сравнение уровня экспрессии рекомбинантного белка. Штамм YS3/pF1201, в котором экспрессия проинсулина находилась под контролем промотора TDH3, обладал максимальной продуктивностью (15,51±0,57 мг/л). В процессе ферментации в лабораторных биореакторах продуктивность штамма YS3/pF1201 (TDH3) достигла 139,17 мг/л через 72 ч культивирования при значении биомассы 154,50 г/л.
ВЫВОДЫ. Промоторы для экспрессии проинсулина в клетках S. cerevisiae можно распределить по их силе в следующем порядке: TDH3≈ALD4>ADH2>TEF1>TPI1. В процессе ферментации при использовании промотора TDH3 достигнута продуктивность, превышающая в 6,1 раза продуктивность штамма-продуцента с классическим промотором TPI1, который используется для экспрессии проинсулина.
Ключевые слова
Для цитирования:
Буслаева Е.А., Хасаншина З.Р., Корнаков И.А., Коробкина М.П., Шмурак В.И., Драй Р.В. Промоторы для высокоэффективной экспрессии и секреции проинсулина в Saccharomyces cerevisiae. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(3):258-270. https://doi.org/10.30895/2221-996X-2025-25-3-258-270
For citation:
Buslaeva E.A., Khasanshina Z.R., Kornakov I.A., Korobkina M.P., Shmurak V.I., Drai R.V. Promoters for high-efficiency expression and proinsulin secretion in Saccharomyces cerevisiae. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(3):258-270. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-3-258-270
Cписок сокращений
- ADH2— ген алкогольдегидрогеназы II;
- Adr1— регулятор синтеза алкогольдегидрогеназы II;
- ALD2,ALD3, ALD4, ALD5, ALD6 — гены альдегиддегидрогеназ 2–6;
- ANOVA —дисперсионный анализ;
- DHAP —дигидроксиацетонфосфат;
- eEF1— фактор элонгации трансляции 1;
- GPEB —потенцирующий связывание с GRF1-сайтом элемент-связывающий белок;
- GRAS —общепризнанные как безопасные;
- GRF1— общий регуляторный фактор 1;
- Msn2,Msn4 — мультикопийные супрессоры мутации SNF1, белки 2 и 4;
- RAP1— белок-активатор репрессора 1;
- RPG— гены рибосомных белков;
- STRE— элементы реакции на стресс;
- TDH3(GPD) — ген глицеральдегид-3-фосфат-дегидрогеназы;
- TEF1— ген фактора элонгации трансляции 1;
- TPI1— ген триозофосфатизомеразы 1;
- TUF —трансляционный, находящийся перед геном, фактор;
- UAS —активирующая нуклеотидная последовательность перед геном;
- UASrpg —активирующая нуклеотидная последовательность перед генами рибосомных белков;
- YPD —питательная среда, содержащая дрожжевой экстракт, пептон и декстрозу;
- ВЭЖХ— высокоэффективная жидкостная хроматография;
- ВЭЖХ-МС — жидкостная хромато-масс-спектрометрия;
- СЭ— система экспрессии;
- УФ-излучение— ультрафиолетовое излучение.
ВВЕДЕНИЕ
Терапевтические белки вследствие специфичности, эффективности и безопасности приобретают все большее значение в профилактике и лечении заболеваний. С появлением технологии рекомбинантной ДНК для получения терапевтических белков используются различные системы экспрессии (СЭ) в бактериях, дрожжах, растениях и клетках млекопитающих [1–3]. В отличие от СЭ, в клетках млекопитающих дрожжи растут на недорогих питательных средах и легко поддаются генетическим манипуляциям. В отличие от прокариотической СЭ, дрожжевые клетки обладают эффективной системой секреции, что дает возможность получить правильно свернутый белок c большинством посттрансляционных модификаций, типичных для эукариотических клеток, и проводить менее затратную очистку целевого белка. Дрожжевые клетки не восприимчивы к фагам и эукариотическим вирусам, что является большим преимуществом для фармацевтической промышленности1 [4]. Наиболее часто используемыми дрожжевыми клетками являются Saccharomyces cerevisiae, Pichia pastoris, Yarrowia lipolytica и штаммы Kluyveromyces [4–6].
Вид S. cerevisiae является пионером среди дрожжей в получении рекомбинантных белков. Для редактирования полностью расшифрованного генома и метаболической инженерии штаммов S. cerevisiae доступно множество молекулярно-генетических инструментов [7], что делает S. cerevisiae перспективной системой экспрессии для получения различных рекомбинантных белков [8]. S. cerevisiae имеет статус GRAS, что ускоряет одобрение регуляторными органами продуктов, полученных из дрожжей, и снимает ряд нормативных барьеров в процессе разработки биофармацевтических продуктов.
Таким образом, создание универсального дрожжевого штамма-продуцента, соответствующего требованиям регуляторных органов и пригодного для производства различных рекомбинантных белков, остается актуальной задачей биотехнологии, так как единая платформа позволит сократить объем исследований и ускорит процесс выведения продукта на фармацевтический рынок.
Один из ключевых факторов, определяющих эффективность промышленного производства терапевтических белков — это высокая продуктивность штамма-продуцента [9]. Количество синтезируемого рекомбинантного белка тесно коррелирует с удельной скоростью роста клеток, зависит от правильного сворачивания полипептидной цепи, дальнейшего перемещения белка внутри клетки и последующей секреции [6][10]. В дрожжевых СЭ выбор источника углерода существенно влияет на продуктивность, при этом степень воздействия определяется характеристиками используемого промотора [11]. В большинстве случаев в СЭ, основанных на S. cerevisiae, применяются конститутивные промоторы, обеспечивающие стабильную экспрессию белка независимо от условий культивирования. Наиболее используемыми промоторами являются промоторы TPI1, TEF1, ADH2, ALD4 и TDH3 (GPD) [12–22].
Ген TPI кодирует гликолитический фермент триозофосфат-изомеразу. Промотор TPI1 содержит консервативную последовательность ACCCATCA, которая гомологична консенсусным сайтам связывания регуляторных белков GRF1, RAP1 и TUF, а также обнаруживает сходство с регуляторными элементами других генов гликолитического пути. Наличие такой последовательности может объяснить высокий уровень экспрессии данного гена [23]. Штаммы с удаленным TPI не способны метаболизировать глюкозу [24].
Ген TEF1 в S. cerevisiae отвечает за биосинтез eEF1 [25]. Комплекс eEF1 играет центральную роль в синтезе белка, доставляя аминоацил-тРНК к рибосоме в процессе элонгации [26]. Гены TEF принадлежат к большому семейству генов RPG, кодирующих компоненты аппарата трансляции, которые скоординированно регулируются. Большинство дрожжевых RPG содержат UASrpg [27].
Ген алкогольдегидрогеназы 2 (ADH2) — один из многих генов дрожжей, экспрессия которых регулируется в зависимости от присутствия глюкозы в среде. Промотор ADH2 очень удобен для использования при экспрессии гетерологичных генов, поскольку он обеспечивает сильный сигнал начала транскрипции, и транскрипция с промотора ADH2 значимо подавляется в присутствии глюкозы в среде [28].
Цитозольные изоформы альдегиддегидрогеназы дрожжей кодируются генами ALD2, ALD3 и ALD6, тогда как митохондриальные — генами ALD4 и ALD5 [29].
Элементы STRE и факторы транскрипции Msn2 и Msn4, по-видимому, опосредуют активацию генов в ответ на различные стрессы (тепловой шок, окислительный и осмотический стрессы), повреждение ДНК и голодание [30].
Продукт гена GPD (глицерин-3-фосфатдегидрогеназа) катализирует NADH-зависимое превращение DHAP в глицерин-3-фосфат. Активность промотора GPD, обусловленная двумя изоферментами Gpd1p и Gpd2p, важна для роста клеток в анаэробных условиях. Промотор гена GPD является самым сильным среди конститутивных промоторов S. cerevisiae [31–33].
Результаты сравнительных исследований влияния промоторов на экспрессию различных модельных белков (α-амилаза, сывороточный альбумин человека, зеленый флуоресцентный белок) описаны в работах [34–36]. На эффективность экспрессии влияет не только промотор, но и сам экспрессируемый белок [13][21][37–39]. На основании имеющихся данных не представляется возможным сделать однозначный вывод о превосходстве какого-либо типа промотора в отношении эффективности экспрессии гетерологичных белков в системе S. cerevisiae. Следовательно, актуально проведение сравнительного анализа по оценке влияния промоторов на экспрессию различных рекомбинантных белков. Стоит отметить, что подобное исследование не проводилось в отношении большинства терапевтических белков, экспрессируемых в дрожжевых системах экспрессии. В частности, изучено влияние нескольких промоторов на экспрессию проинсулина, но сравнительный анализ различных промоторов в рамках одного исследования не проводился [40]. Использование промоторной последовательности TPI1 для контроля экспрессии позволяет достичь продуктивности 80 мг/л [8][41][42] и 112 мг/л [43]. Использование промотора CIT1 привело к увеличению выхода проинсулина на 80% в сравнении с контролем (промотор TPI1) [44]. При использовании промотора TPI1 удалось достичь максимального выхода проинсулина (90 мг/л), в то время как в случае промотора TEF1 выход составлял 2,5 мг/л [36].
Результаты проведенных исследований не позволяют с уверенностью ранжировать промоторы по транскрипционной активности для экспрессии проинсулина, потому что уровень экспрессии зависит от транскрипционной и трансляционной регуляции. В связи с этим при конструировании дрожжевых штаммов-продуцентов значение имеет рациональный подбор генетических элементов СЭ для достижения максимальной продуктивности.
Нами было выбрано пять промоторов: TEF1, ADH2, ALD4, TDH3 (GPD), TPI1, которые чаще всего используются для экспрессии рекомбинантных белков в дрожжах. Выбор этих промоторов обусловлен доказанной эффективностью применения в биотехнологии, что позволяет провести обоснованное сравнение их эффективности в контексте экспрессии терапевтических белков и выявить наиболее подходящие промоторы для дальнейших исследований.
Цель работы — оценить влияние промоторов TEF1, ADH2, ALD4, TDH3 (GPD), TPI1 на экспрессию рекомбинантного проинсулина человека в Saccharomyces cerevisiae и ранжировать их по силе для выбора оптимального промотора, обеспечивающего максимальную продуктивность.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
В работе использовали диплоидный штамм Saccharomyces cerevisiae YS3, который был получен путем слияния гаплоидных клеток S. cerevisiae (MATalpha pep4::HIS3 prb1-delta1.6R his3-delta200 ura3-52 gal2 can1 tpi::URA3) и S. cerevisiae (MATa ura3-52 trp1 lys2-801 leu2-delta1 his3-delta200 pep4::HIS3 prb1-delta1.6R can1 GAL tpi::KanR).
В качестве вектора для создания экспрессионных конструкций использовали челночную плазмиду pRS425 (ATCC, США), содержащую маркер устойчивости к ампициллину, а также точки начала репликации (ориджин) pUC и 2-μm (рис. 1). Ген предшественника человеческого инсулина с сигнальным пептидом был синтезирован искусственно (ATUM, США) и клонирован в вектор с использованием рестрикционных сайтов SalI и SpeI. Последовательности промоторов и терминаторов транскрипции были получены синтетическим путем (ATUM, США). Последовательности промотора и терминатора гена TPI1 были клонированы рестрикционно-лигазным методом с использованием рестриктаз SacI и BamHI; последовательность промотора TEF1 — SacI/BglII; ADH2 — BspMI/BglII; ALD4 и TDH3 — SacI/BglII.
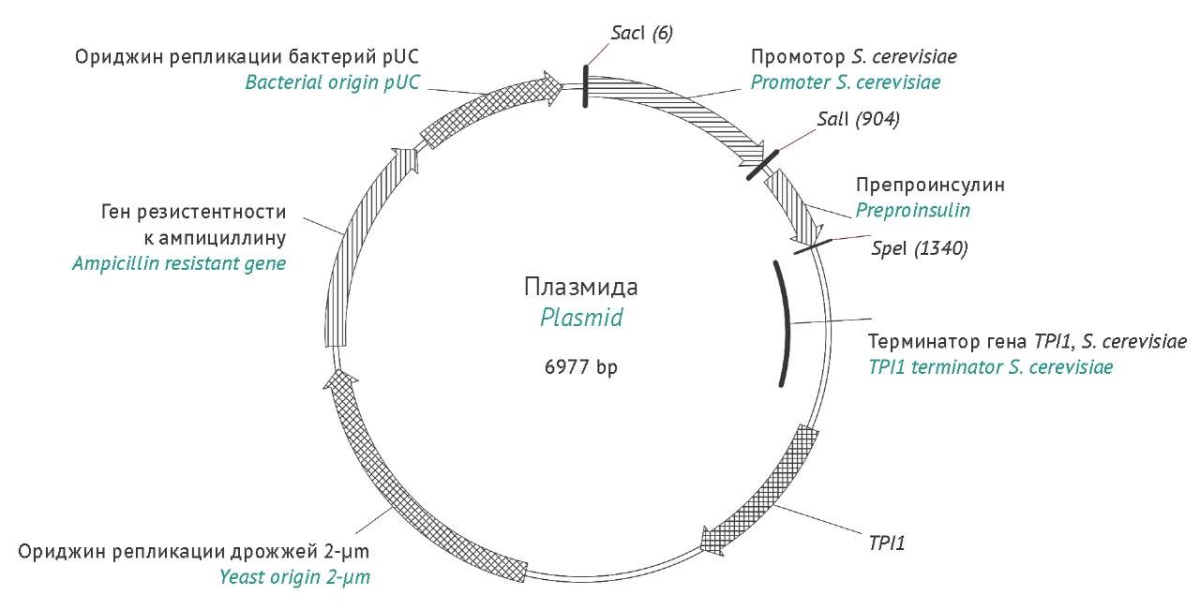
Рисунок подготовлен авторами по собственным данным с использованием программного обеспечения Vector NTI 10 (Thermo Fisher Scientific, США) / The figure is prepared by the authors using their own data on Vector NTI 10 software (Thermo Fisher Sientific, USA)
Рис. 1. Схема экспрессионной конструкции на основе вектора pRS425 с клонированными альтернативными промоторами и терминаторами транскрипции.
Fig. 1. Expression construct based on the pRS425 vector with cloned alternative promoters and transcription terminators.
Трансформацию штамма-хозяина YS3 плазмидой проводили с помощью электропорации [45]. В итоге были получены штаммы-продуценты S. cerevisiae YS3/pF1145, YS3/pF1157, YS3/pF1199, YS3/pF1200, YS3/pF1201, содержащие промоторы TPI1, TEF1, ADH2, ALD4, TDH3 соответственно. Из-за наличия ориджина 2-μm плазмиды реплицировались в клетках дрожжей без интеграции в геном. Для верификации сконструированных штаммов проводили амплификацию целевых участков методом ПЦР и последующее секвенирование (ЗАО «Евроген», Россия).
Методы
Культивирование штаммов-продуцентов S. cerevisiae в колбах. В экспериментах использовали стандартную жидкую питательную среду YPD1, содержащую 1% глюкозы [46], а для получения посевного материала — агаризованную среду YPD2, содержащую 2% глюкозы [46]. Инкубацию на агаризованной среде YPD2 проводили в термостате при 30 °C в течение 72 ч. Сформированные колонии смывали жидкой средой YPD1 и переносили в стерильные колбы объемом 100 мл, которые содержали 15 мл той же среды. Культуры инкубировали в среде YPD1 при 30 °C и перемешивании при 210 об/мин в течение 42 ч. В точках роста 18, 24 и 42 ч проводили отбор проб для измерения оптической плотности, содержания белка и этанола в культуральной жидкости.
Измерение оптической плотности проводили на спектрофотометре NanoPhotometer P300 (Implen, Германия). Начальная оптическая плотность клеток при инокуляции составила 0,2–0,5 при длине волны 600 нм.
Уровень глюкозы контролировали с помощью глюкометра Contour TS (Ascensia Diabetes Care, Швейцария) и при необходимости доводили концентрацию глюкозы до 1% с помощью 40%-го рабочего раствора глюкозы.
Подготовка посевного материала для ферментации в биореакторе. В качестве исходного материала для подготовки посевной культуры использовали предварительные клеточные банки штаммов YS3/pF1145 (TPI1) и YS3/pF1145 (TDH3). Клетки инокулировали в 300 мл жидкой среды соответствующего состава без добавления глюкозы [41] и инкубировали при 30±1 °C в шейкер-инкубаторе Ecotron (Infors HT, Швейцария) при 210 об/мин в течение 66–72 ч.
Культивирование в биореакторе. Основной этап культивирования штаммов-продуцентов проводили в течение 96 ч в лабораторных ферментерах Multifors (Infors HT, Швейцария). Состав питательной среды и параметры процесса были выбраны на основе ранее выполненной оптимизации с использованием методологии Design of Experiments для дрожжевых СЭ [41]. Во время ферментации периодически отбирали пробы культуральной жидкости для определения содержания клеточной биомассы, этанола и проинсулина.
Определение массы влажного осадка клеток проводили следующим образом: 2 мл клеточной суспензии переносили в заранее тарированные микропробирки и центрифугировали в течение 5 мин при 15000 об/мин на центрифуге Eppendorf 5424 (Eppendorf, Германия). Супернатант переносили в чистые пробирки для дальнейшего определения содержания этанола и проинсулина.
Определение молекулярной массы рекомбинантного проинсулина в культуральной жидкости проводили методом ВЭЖХ-МС, используя систему Acquity UPLC (Waters, США) с масс-спектрометрическим детектором. Разделение компонентов проводили на колонке SunFire™ C18 (5 мкм, 150×4,6 мм) (Waters, США) с регистрацией сигнала при длине волны 214 нм.
В качестве подвижных фаз использовали фазу А (89,9% вода, 10% ацетонитрил, 0,1% муравьиная кислота) и фазу B (99,9% ацетонитрил, 0,1% муравьиная кислота). Поток подвижной фазы поддерживали на уровне 0,9 мл/мин. Элюирование проводили в градиентном режиме: увеличение концентрации фазы B от 0 до 75% за 18 мин, затем от 75 до 100% за 1 мин с последующим возвращением к исходному составу за 1 мин.
Детектирование осуществляли в режиме положительной ионизации с анализом массы ионов в диапазоне 300–3000 m/z. Каждую серию анализов начинали и завершали введением холостой пробы, в качестве которой использовалась вода для хроматографии, в целях предотвращения перекрестной контаминации. В качестве контрольного образца использовали референсный стандарт инсулина (ООО «ГЕРОФАРМ», Россия).
Определение содержания проинсулина в культуральной жидкости определяли методом ВЭЖХ с использованием системы Acquity UPLC (Waters, США), оснащенной диодно-матричным детектором. Разделение компонентов проводили на колонке SunFire™ C18 (5 мкм, 150×4,6 мм) (Waters, США) с регистрацией сигнала при длине волны 214 нм. В качестве фазы A использовали 3% водный раствор натрия перхлората моногидрата, фазы B — 78% ацетонитрил. Хроматографирование проводили при скорости потока 0,9 мл/мин с использованием градиентной программы: увеличение концентрации фазы B от 20 до 40% за 20 мин, затем от 40 до 95% за 5 мин с последующим возвращением к исходному составу за 1 мин. Количественное определение проводили по калибровочному графику. Калибровка была произведена с использованием стандартного образца инсулина (ООО «ГЕРОФАРМ», Россия).
Анализ внеклеточного метаболита этанола в культуральной жидкости проводили методом газовой хроматографии с использованием хроматографа Agilent 7890A (Agilent Technologies, США), оборудованного пламенно-ионизационным детектором, системой парофазного ввода проб (Agilent 7694E), а также капиллярной колонкой HP FFAP (50 м×0,32 мм×0,5 мкм). Калибровка была произведена с использованием стандартного раствора изопропанола (ООО «Экросхим», Россия) с чистотой ≥99,5%.
Для анализа в парофазные флаконы объемом ~10 мл вносили 1,7 мл предварительно размороженной культуральной жидкости, после чего флаконы герметично закрывали металлическими крышками с силиконовыми прокладками. Пробы инкубировали в пробоотборнике при 85 °C в течение 15 мин, после чего осуществляли забор паровой фазы и ее введение в хроматограф.
Статистическую обработку данных осуществляли с использованием программы GraphPad Prism 9 (GraphPad Software Inc., США). Для выявления статистически значимых различий между штаммами по анализируемым показателям применяли дисперсионный анализ. Взаимосвязи между количественными параметрами оценивали с помощью парного корреляционного анализа по методу Пирсона отдельно для каждого исследуемого штамма. Статистически значимыми считались различия при p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение штаммов-продуцентов проинсулина
Были получены дрожжевые штаммы-продуценты S. cerevisiae YS3/pF1145, YS3/pF1199, YS3/pF1157, YS3/pF1200, YS3/pF1201, в которых экспрессия проинсулина находилась под контролем дрожжевых нативных конститутивных промоторов TPI1, TEF1, ADH2, ALD4, TDH3 соответственно.
Подтверждение подлинности продукта проводилось с использованием ВЭЖХ-МС. Экспериментальная масса проинсулина, обнаруженная в культуральной жидкости, имела то же значение, что и экспериментальная масса стандартного образца (рис. 2). Так как аминокислотная последовательность проинсулина не имеет сайтов гликозилирования, на хроматограммах отсутствовали различающиеся по массе гликоформы.
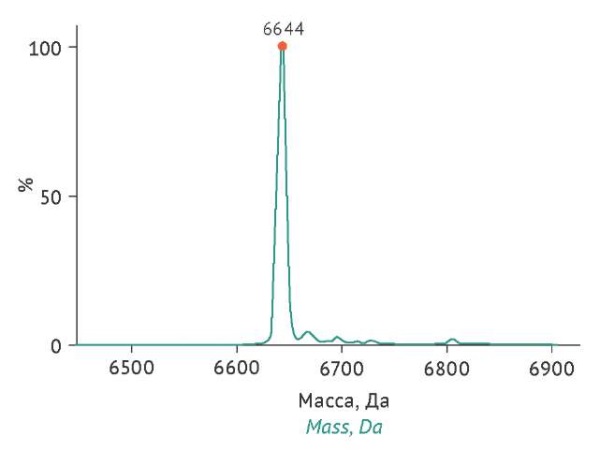
Рисунок подготовлен авторами по собственным данным c использованием программного обеспечения UniDec v.5.0.1 [47] / The figure is prepared by the authors using their own data on UniDec software v.5.0.1 [47]
Рис. 2. Пример типового ВЭЖХ-МС спектра образца культуральной жидкости штаммов-продуцентов проинсулина S. cerevisiae. По оси X обозначена масса проинсулина (Да), по оси Y — относительная интенсивность сигнала (% от максимального значения). Оригинальное изображение спектра экспортировано из программы UniDec v.5.0.1.
Fig. 2. Example of typical HPLC-MS of a sample spectrum of cultural medium from proinsulin S. cerevisiae producer strains. X-axis, proinsulin mass (Da); Y-axis, relative signal intensity (% of the maximal value). The original image was imported from UniDec software v.5.0.1.
Анализ показателей продуктивности и роста штаммов-продуцентов проинсулина
В рамках предварительной оценки полученных штаммов при культивировании в колбах исследовали параметры роста биомассы, накопления этанола и рекомбинантного белка. В качестве контроля использовался штамм YS3/pF1145, экспрессия проинсулина в котором находилась под контролем промотора TPI1. Последовательность данного промотора является «золотым стандартом» для экспрессии рекомбинантных белков в S. cerevisiae [36].
Оценка накопления биомассы штаммами-продуцентами. На рисунке 3 представлена динамика накопления биомассы различными штаммами-продуцентами при культивировании в течение 42 ч.
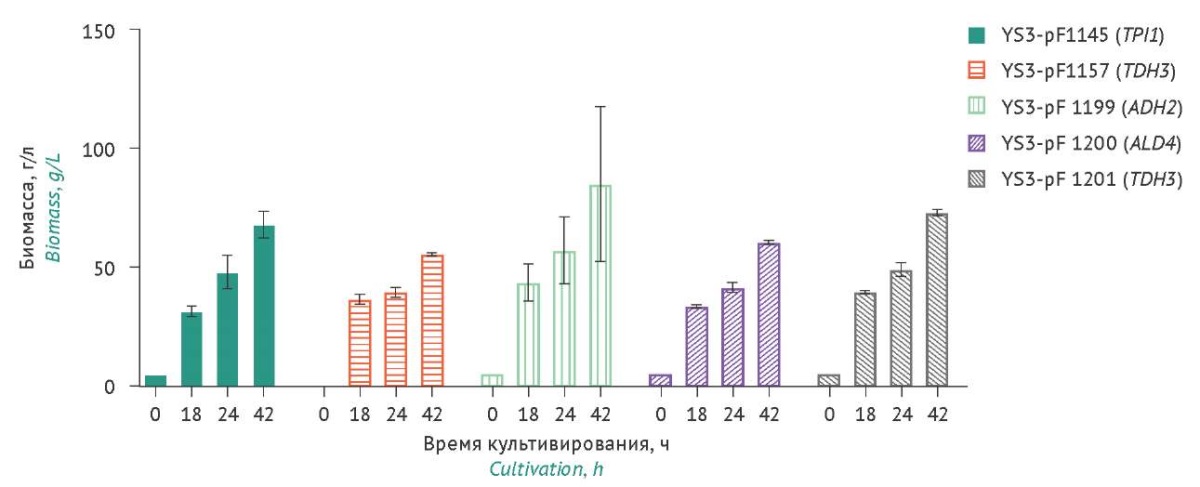
Рисунок подготовлен авторами по собственным данным c использованием программного обеспечения GraphPad Prism 9 (GraphPad Software Inc., США) / The figure is prepared by the authors using their own data on GraphPad Prism 9 software (GraphPad Software Inc., USA)
Рис. 3. Динамика роста биомассы различных штаммов-продуцентов S. cerevisiae при культивировании в течение 42 ч. Данные представлены в виде средних значений ± стандартное отклонение (n=3). Средние значения нормированы относительно значений в точке «18 ч» (штамм YS3/pF1145).
Fig. 3. Wet cell accumulation dynamics of different S. cerevisiae producer strains during 42-hour cultivation. The data are represented as the mean value ± standard deviation (n=3). The mean values are normalised to the 18-hour time point of strain YS3/pF1145.
Анализ результатов показал, что все исследуемые штаммы-продуценты демонстрировали схожую динамику роста на протяжении всего процесса культивирования в колбах. Штаммы различались по титру клеток через 42 ч культивирования при одинаковой плотности посева (5 г/л). Штаммы-продуценты YS3/pF1201 (TDH3) и YS3/pF1145 (TPI1) через 42 ч культивирования накапливали биомассу ≈35 г/л; YS3/pF1200 (ALD4) и YS3/pF1157 (TEF1) — ≈30 г/л; YS3/pF1199 (ADH2) — 42 г/л. Значения биомассы штамма-продуцента YS3/pF1199 (ADH2) значительно варьировались в двух точках (24 и 42 ч), что, возможно, связано с некоторой разницей плотности посева клеток.
Оценка накопления этанола штаммами-продуцентами. На рисунке 4 представлена сравнительная оценка накопления этанола различными штаммами-продуцентами в ходе культивирования. Все измеренные значения были нормированы по отношению к штамму YS3/pF1145 (TPI1) на соответствующем временном интервале.
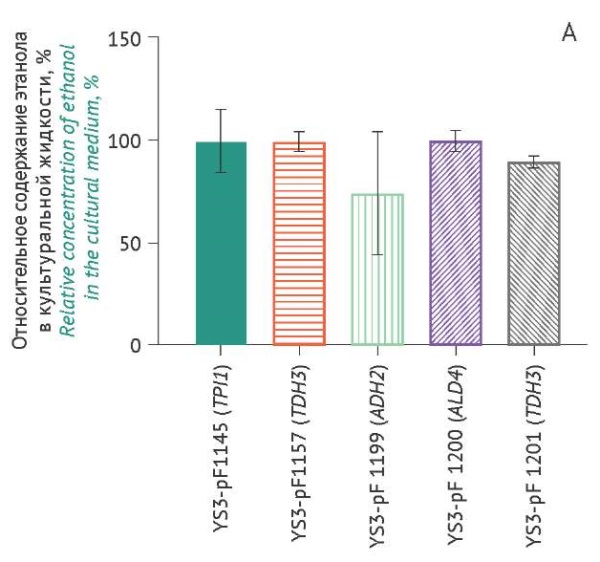
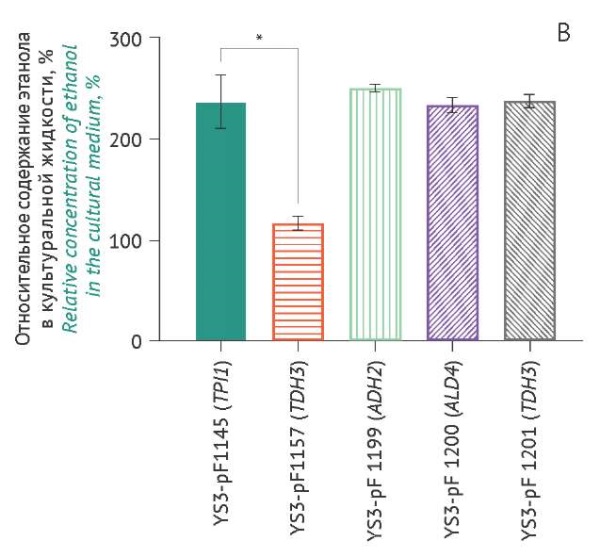
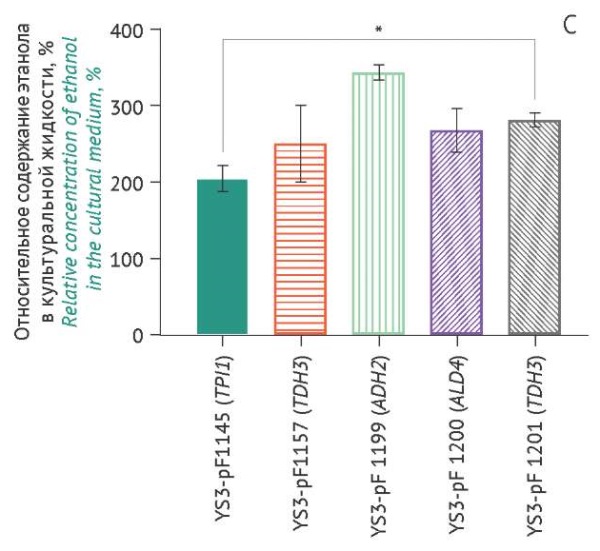
Рисунок подготовлен авторами по собственным данным c использованием программного обеспечения GraphPad Prism 9 (GraphPad Software Inc., США) / The figure is prepared by the authors using their own data on GraphPad Prism 9 software (GraphPad Software Inc., USA)
Рис. 4. Накопление в культуральной жидкости этанола, продуцируемого различными штаммами S. cerevisiae (ось Х), через 18 ч (А), 24 ч (B), 42 ч (C) культивирования. Данные представлены в виде средних значений ± стандартное отклонение (n=3). Средние значения нормированы относительно значений в точке «18 ч» (штамм YS3/pF1145). * p<0,05.
Fig. 4. Ethanol accumulation in the culture medium produced by various S. cerevisiae strains (X-axis) over 18 hours of cultivation (A), 24 hours (B), and 42 hours (C). The data are represented as the mean value ± standard deviation (n=3). The mean values are normalised to the 18-hour time point of strain YS3/pF1145. *, p<0.05.
Практически все штаммы-продуценты (рис. 4) увеличивали содержание этанола в культуральной жидкости. Самые низкие значения содержания этанола через 42 ч культивирования наблюдались для контрольного штамма-продуцента YS3/pF1145 (TPI1), тогда как максимальное накопление этанола было характерно для YS3/pF1199 (ADH2) через 42 ч культивирования и составляло 0,96% (табл. 1). Через 42 ч культивирования содержание этанола составило 0,7–0,8% в случаях остальных штаммов-продуцентов. t-тест показал, что статистически значимых различий между штаммами по накоплению этанола не наблюдалось. Для штамма-продуцента YS3/pF1157 (TEF1) накопление биомассы коррелировало с содержанием этанола в среде (p=0,032).
Таблица 1. Сравнение продуктивности и характеристик роста штаммов-продуцентов проинсулина S. cerevisiae
Table 1. Comparison of productivity and growth characteristics of proinsulin S. cerevisiae producer strains
|
Штамм Strain |
Промотор Promoter |
Накопление биомассы, г/л Biomass accumulation, g/L |
Содержание проинсулина, мг/л Proinsulin content, mg/L |
Содержание этанола, % Ethanol content, % |
|
YS3/pF1145 |
TPI1 |
34,00±2,83 |
9,85±0,25 |
0,58±0,05 |
|
YS3/pF1157 |
TEF1 |
27,75±0,35 |
12,98±0,08 |
0,70±0,14 |
|
YS3/pF1199 |
ADH2 |
42,50±16,26 |
14,32±6,11 |
0,96±0,03 |
|
YS3/pF1200 |
ALD4 |
30,25±0,35 |
16,59±0,02 |
0,75±0,08 |
|
YS3/pF1201 |
TDH3 |
36,50±0,71 |
15,51±0,57 |
0,79±0,03 |
Оценка накопления проинсулина штаммами-продуцентами. Уровни накопления проинсулина, продуцируемого различными штаммами-продуцентами (измеренные значения пересчитаны относительно YS3/pF1145 (TPI1) для каждой временной точки при культивировании), показаны на рисунке 5.
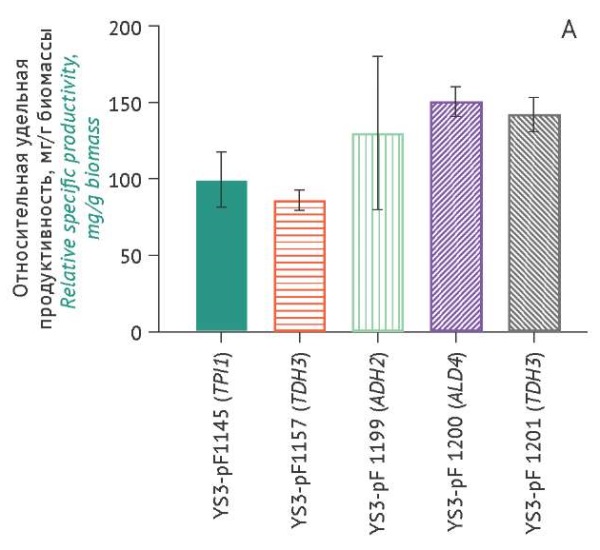
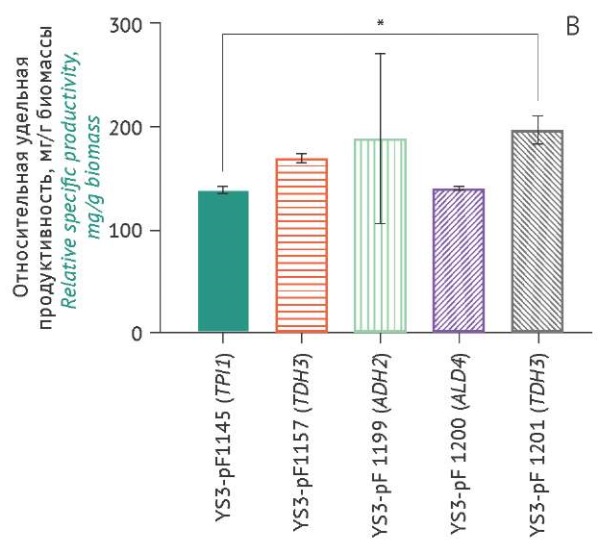
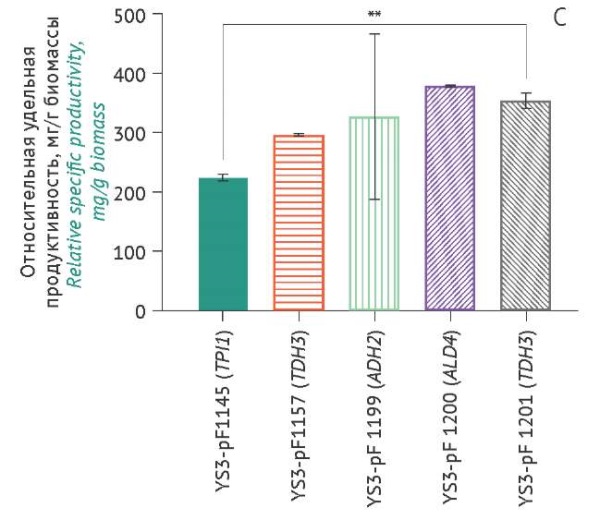
Рисунок подготовлен авторами по собственным данным c использованием программного обеспечения GraphPad Prism 9 (GraphPad Software Inc., США) / The figure is prepared by the authors using their own data on GraphPad Prism 9 software (GraphPad Software Inc., USA)
Рис. 5. Уровни накопления в культуральной жидкости проинсулина, продуцируемого различными штаммами S. cerevisiae (ось Х), через 18 ч (А), 24 ч (B), 42 ч (C) культивирования. Данные представлены в виде средних значений ± стандартное отклонение (n=3). Средние значения нормированы относительно значений в точке «18 ч» (штамм YS3/pF1145). * p<0,05; ** p<0,01.
Fig. 5. Proinsulin accumulation levels in the culture medium produced by different S. cerevisiae strains (X-axis) over 18 hours of cultivation (A), 24 hours (B), and 42 hours (C). The data are represented as the mean value ± standard deviation (n=3). The mean values are normalised to the 18-hour time point of strain YS3/pF1145. *, p<0.05; **, p<0.01.
Наименьшие значения удельной продуктивности в сравнении с остальными штаммами были характерны для контрольного штамма YS3/pF1145 (TPI1) через 42 ч культивирования. Максимальный выход проинсулина у штамма-продуцента YS3/pF1200 (ALD4) составил 16,59±0,02 мг/л (табл. 1) при 0,55±0,01 мг/г биомассы через 42 ч культивирования. Штамм YS3/pF1201 (TDH3) при объемной продуктивности 15,51±0,57 мг/л характеризовался низкой удельной продуктивностью (0,43±0,02 мг/г биомассы), тогда как штамм YS3/pF1157 (TEF1) при низкой объемной продуктивности 12,98±0,08 мг/л характеризовался высокой удельной продуктивностью (0,470±0,003 мг/г биомассы). Большая величина стандартного отклонения уровней накопления биомассы и целевого продукта (проинсулин) для штамма-продуцента YS3/pF1199 (ADH2), возможно, связана с некоторой разницей плотности посева клеток.
Для штаммов-продуцентов YS3/pF1199 (ADH2) и YS3/pF1201 (TDH3) отмечена зависимость между выходом рекомбинантного проинсулина и накоплением биомассы (p=0,020 и p=0,019 соответственно). Однако для всех штаммов-продуцентов не наблюдалось статистически значимой корреляции между выходом проинсулина и содержанием этанола или накоплением биомассы. Сравнение показателей продуктивности и характеристик роста исследуемых штаммов на момент завершения культивирования представлено в таблице 1.
Согласно полученным экспериментальным данным, промоторы по их силе для экспрессии проинсулина можно распределить в следующем ряду: TDH3≈ALD4>ADH2>TEF1>TPI1 (табл. 1). По данным литературы, промотор TDH3 считается одним из самых сильных, однако ранее это не было показано для проинсулина [31–33]. Экспрессия проинсулина под контролем промотора TEF1 была ниже по сравнению с TPI1, что объяснялось высокой скоростью распада мРНК [36]. Такое расхождение с данными литературы может быть обусловлено влиянием других структурных элементов экспрессионной конструкции и особенностями проведения эксперимента.
Таким образом, для дальнейшей работы был выбран штамм YS3/pF1201 (TDH3) по причине его высокой продуктивности и благоприятной динамики накопления биомассы. Штамм YS3/pF1200 (ALD4) характеризовался не меньшей продуктивностью, но низким уровнем накопления биомассы.
Исследование ферментации штаммов-продуцентов в лабораторном биореакторе
Для штамма YS3/pF1201 (TDH3) был получен предварительный банк клеток и проведена ферментация в лабораторном биореакторе. В качестве контроля была поставлена ферментация штамма YS3/pF1145 (TPI1) в аналогичных условиях. Результаты, полученные в процессе ферментации, представлены на рисунке 6.

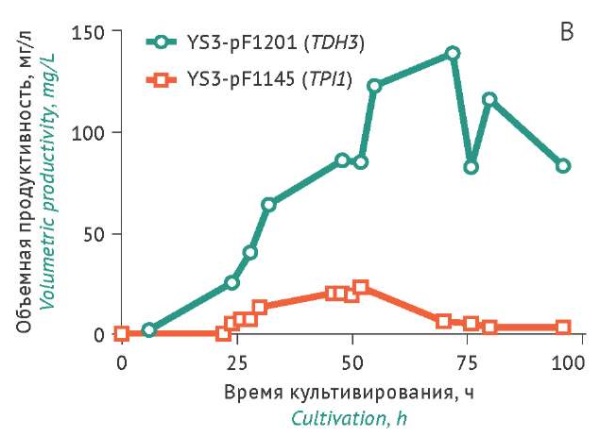
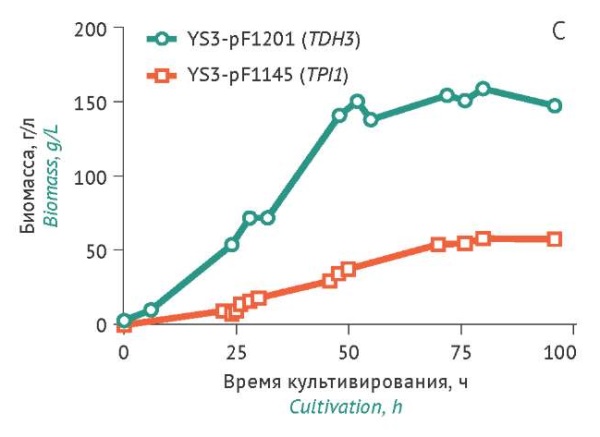
Рисунок подготовлен авторами по собственным данным c использованием программного обеспечения GraphPad Prism 9 (GraphPad Software Inc., США) / The figure is prepared by the authors using their own data on GraphPad Prism 9 software (GraphPad Software Inc., USA)
Рис. 6. Динамика показателей ферментации штаммов S. cerevisiae YS3/pF1201 и YS3/pF1145: A — значения оптической плотности; B — значения объемной продуктивности; C — значения биомассы.
Fig. 6. Fermentation dynamics, strains YS3/pF1201 and YS3/pF1145. A, optical density; B, volumetric productivity; C, wet cell weight.
Стационарная фаза роста штамма YS3/pF1201 (TDH3) наблюдалась через 50 ч культивирования, максимальное накопление проинсулина наблюдалось через 72 ч культивирования. В выбранных условиях ферментации максимальное значение продуктивности составляло 139,17 мг/л при значении биомассы 154,5 г/л. Стационарная фаза роста контрольного штамма YS3/pF1445 (TPI1) наблюдалось через 72 ч культивирования, при этом максимальное значение продуктивности (23 мг/л) было достигнуто через 50 ч культивирования, после чего данный показатель снижался.
Таким образом, для штамма YS3/pF1201 (TDH3) наблюдались более высокие значения продуктивности и накопления биомассы по сравнению с контрольным штаммом YS3/pF1145 (TPI1). Это может быть связано с тем, что экспрессия проинсулина штаммом YS3/pF1201 (TDH3) в меньшей степени репрессируется глюкозой.
ВЫВОДЫ
- Получены штаммы S. cerevisiae, в которых экспрессия проинсулина находится под контролем промоторов TPI, TEF1, ADH2, ALD4, TDH3.
- Промоторы по их силе для экспрессии проинсулина можно распределить в ряду TDH3≈ALD4>ADH2>TEF1>TPI1.
- Максимальные значения показателей накопления биомассы и выхода проинсулина были установлены для штамма S. cerevisiaeYS3/pF1201, в котором экспрессия проинсулина осуществлялась под контролем промотора TDH3. Спустя 42 ч после начала культивирования концентрация проинсулина в культуральной жидкости достигала 15,51±0,57 мг/л при удельной продуктивности 0,43±0,02 мг/г.
- В процессе ферментации в лабораторном биореакторе продуктивность штамма S. cerevisiaeYS3/pF1201 (TDH3) достигала 139,17 мг/л через 72 ч после начала культивирования при значении биомассы 154,5 г/л. Данный показатель в 6,1 раза превышал продуктивность штамма с классическим промотором TPI1, который используется для получения инсулинов.
- Ограничением проведенного исследования является то, что сравнительная оценка активности промоторов была выполнена лишь для пяти конститутивных последовательностей в стандартных лабораторных условиях и в рамках одной экспрессионной конструкции без модификации других регуляторных элементов. Для подтверждения промышленной применимости полученных результатов требуется исследовать влияние параметров культивирования на продуктивность штамма-продуцента и стабильность экспрессии, а также осуществить масштабирование процесса культивирования.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.А. Буслаева — идея, планирование и проведение экспериментов, анализ данных, написание текста рукописи; З.Р. Хасаншина — планирование и анализ данных эксперимента, написание текста рукописи; И.А. Корнаков — проведение экспериментов по культивированию; М.П. Коробкина — проведение высокоэффективной жидкостной хроматографии; В.И. Шмурак — проведение хромато-масс-спектрометрии; Р.В. Драй — определение основного направления исследования, утверждение окончательной версии статьи для публикации.
Благодарности. Исследование проводилось при спонсорской поддержке ООО «ГЕРОФАРМ». Авторы выражают признательность коллегам, которые оказывали помощь в выполнении исследования, сотрудникам лаборатории генной инженерии и ферментации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. E.A. Buslaeva suggested the study idea, planned and carried out experiments; analysed data; and drafted the manuscript. Z.R. Khasanshina conceptualised, planned experiments, analysed experimental data, and drafted the manuscript. I.A. Kornakov carried out cultivation experiments. M.P. Korobkina performed high-performance liquid chromatography. V.I. Shmurak performed liquid chromatography-mass spectrometry. R.V. Drai set the main research direction and approved the final version of the manuscript for publication.
Acknowledgements. The study was supported by GEROPHARM. The authors are grateful to their colleagues from the Laboratory for genetic engineering and fermentation who helped them with this study.
1. Viral safety evaluation of biotechnology products derived from cell lines of human or animal origin. International council for harmonization of technical requirements for pharmaceuticals for human use. ICH Q5A(R2). Geneva; 2022.
Список литературы
1. Navarrete C, Jacobsen IH, Martínez JL, Procentese A. Cell factories for industrial production processes: Current issues and emerging solutions. Processes. 2020;8(7):768. https://doi.org/10.3390/pr8070768
2. Slathia PS, Sagrika Sharma E, Khan IA, et al. Recombinant production of therapeutic proteins. In: Singh DB, Tripathi T, eds. Protein-based terapeutics. Springer, Singapore; 2023. P. 101–29. https://doi.org/10.1007/978-981-19-8249-1_4
3. Gomes AR, Byregowda SM, Veeregowda BM, Balamurugan V. An overview of heterologous expression host systems for the production of recombinant proteins. Adv Anim Vet Sci. 2016;4(7):346–56. https://doi.org/10.14737/journal.aavs/2016/4.7.346.356
4. Celik E, Calık P. Production of recombinant proteins by yeast cells. Biotechnol Adv. 2012;30(5):1108–18. https://doi.org/10.1016/j.biotechadv.2011.09.011
5. Huang M, Wang G, Qin J, et al. Engineering the protein secretory pathway of Saccharomyces cerevisiae enables improved protein production. Proc Natl Acad Sci USA. 2018;115(47):E11025–32. https://doi.org/10.1073/pnas.1809921115
6. Madhavan A, Arun KB, Sindhu R, et al. Customized yeast cell factories for biopharmaceuticals: from cell engineering to process scale up. Microb Cell Fact. 2021;20(1):124. https://doi.org/10.1186/s12934-021-01617-z
7. Zhao M, Ma J, Zhang L, Qi H. Engineering strategies for enhanced heterologous protein production by Saccharomyces cerevisiae. Microb Cell Fact. 2024;23:32. https://doi.org/10.1186/s12934-024-02299-z
8. Nielsen J. Production of biopharmaceutical proteins by yeast. Bioengineered. 2013;4(4):207–11. https://doi.org/10.4161/bioe.22856
9. Zepeda AB, Pessoa Jr A, Farías JG. Carbon metabolism influenced for promoters and temperature used in the heterologous protein production using Pichia pastoris yeast. Braz J Microbiol. 2018;49 Suppl 1:119–27. https://doi.org/10.1016/j.bjm.2018.03.010
10. Schenk J, Balazs K, Jungo C, et al. Influence of specific growth rate on specific productivity and glycosylation of a recombinant avidin produced by a Pichia pastoris Mut+ strain. Biotechnol Bioeng. 2008;99(2):368–77. https://doi.org/10.1002/bit.21565
11. Maury J, Kannan S, Jensen NB, et al. Glucose-dependent promoters for dynamic regulation of metabolic pathways. Front Bioeng Biotechnol. 2018;6:63. https://doi.org/10.3389/fbioe.2018.00063
12. Li S, Ma L, Fu W, et al. Programmable synthetic upstream activating sequence library for fine-tuning gene expression levels in Saccharomyces cerevisiae. ACS Synth Biol. 2022;11(3):1228–39. https://doi.org/10.1021/acssynbio.1c00511
13. Deng J, Wu Y, Zheng Z, et al. A synthetic promoter system for well-controlled protein expression with different carbon sources in Saccharomyces cerevisiae. Microb Cell Fact. 2021;20:202. https://doi.org/10.1186/s12934-021-01691-3
14. Liu R, Liu L, Li X, et al. Engineering yeast artificial core promoter with designated base motifs. Microb Cell Fact. 2020;19(1):38. https://doi.org/10.1186/s12934-020-01305-4
15. Tang H, Wu Y, Deng J, et al. Promoter architecture and promoter engineering in Saccharomyces cerevisiae. Metabolites. 2020;10(8):320. https://doi.org/10.3390/metabo10080320
16. He S, Zhang Z, Lu W. Natural promoters and promoter engineering strategies for metabolic regulation in Saccharomyces cerevisiae. J Ind Microbiol Biotechnol. 2023;50(1):kuac029 https://doi.org/10.1093/jimb/kuac029
17. Ottoz DS, Rudolf F. Constitutive and regulated promoters in yeast: how to design and make use of promoters in S. cerevisiae. In: Smolke C, Lee SY, Nielsen J, Stephanopoulos G, eds. Synthetic biology. Parts, devices and applications. Wiley-VCH Verlag GmbH & Co; 2018. P. 107–30. https://doi.org/10.1002/9783527688104.ch6
18. Myburgh MW, Schwerdtfeger KS, Cripwell RA, et al. Promoters and introns as key drivers for enhanced gene expression in Saccharomyces cerevisiae. In: Gadd GM, Sariaslani S, eds. Advances in applied microbiology. Academic Press; 2023. P. 1–29. https://doi.org/10.1016/bs.aambs.2023.07.002
19. Feng X, Marchisio MA. Saccharomyces cerevisiae promoter engineering before and during the synthetic biology era. Biology (Basel). 2021;10(6):504. https://doi.org/10.3390/biology10060504
20. Peng B, Williams TC, Henry M, et al. Controlling heterologous gene expression in yeast cell factories on different carbon substrates and across the diauxic shift: a comparison of yeast promoter activities. Microb Cell Fact. 2015;14:91. https://doi.org/10.1186/s12934-015-0278-5
21. Partow S, Siewers V, Bjørn S, et al. Characterization of different promoters for designing a new expression vector in Saccharomyces cerevisiae. Yeast. 2010;27(11):955–64. https://doi.org/10.1002/yea.1806
22. Sun J, Shao Z, Zhao H, et al. Cloning and characterization of a panel of constitutive promoters for applications in pathway engineering in Saccharomyces cerevisiae. Biotechnol Bioeng. 2012;109(8):2082–92. https://doi.org/10.1002/bit.24481
23. Scott EW, Allison HE, Baker HV. Characterization of TPI gene expression in isogeneic wild-type and gcr1-deletion mutant strains of Saccharomyces cerevisiae. Nucleic Acids Res. 1990;18(23):7099–107. https://doi.org/10.1093/nar/18.23.7099
24. Compagno C, Brambilla L, Capitanio D, et al. Alterations of the glucose metabolism in a triose phosphate isomerase-negative Saccharomyces cerevisiae mutant. Yeast. 2001;18(7):663–70. ttps://doi.org/10.1002/yea.715
25. Vignais ML, Huet J, Buhler JM, Sentenac A. Contacts between the factor TUF and RPG sequences. J Biol Chem. 1990;265(24):14669–74. https://doi.org/10.1016/S0021-9258(18)77354-7
26. Munshi R, Kandl K, Carr-Schmid A, et al. Overexpression of translation elongation factor 1A affects the organization and function of the actin cytoskeleton in yeast. Genetics. 2001;157(4):1425–36. https://doi.org/10.1093/genetics/157.4.1425
27. Bi X, Broach JR. UASrpg can function as a heterochromatin boundary element in yeast. Genes Dev. 1999;13(9):1089–101. https://doi.org/10.1101/gad.13.9.1089
28. Price VL, Taylor WE, Clevenger W, et al. Expression of heterologous proteins in Saccharomyces cerevisiae using the ADH2 promoter. Methods Enzymol. 1990;185:308–18. https://doi.org/10.1016/0076-6879(90)85027-l
29. Saint-Prix F, Bönquist L, Dequin S. Functional analysis of the ALD gene family of Saccharomyces cerevisiae during anaerobic growth on glucose: the NADP+-dependent Ald6p and Ald5p isoforms play a major role in acetate formation. Microbiology (Reading). 2004;150(Pt 7):2209–20. https://doi.org/10.1099/mic.0.26999-0
30. Navarro-Aviño JP, Prasad R, Miralles VJ, et al. A proposal for nomenclature of aldehyde dehydrogenases in Saccharomyces cerevisiae and characterization of the stress-inducible ALD2 and ALD3 genes. Yeast. 1999;15(10A):829–42. https://doi.org/10.1002/(sici)1097-0061(199907)15:10a<829::Aid-yea423>3.0.Co;2-9
31. Kjeldsen T, Balschmidt P, Diers I, et al. Expression of insulin in yeast: the importance of molecular adaptation for secretion and conversion. Biotechnol Genet Eng Rev. 2001;18:89–121. https://doi.org/10.1080/02648725.2001.10648010
32. Redden H, Alper HS. The development and characterization of synthetic minimal yeast promoters. Nat Commun. 2015;6:7810. https://doi.org/10.1038/ncomms8810
33. Yagi S, Yagi K, Fukuoka J, Suzuki M. The UAS of the yeast GAPDH promoter consists of multiple general functional elements including RAP1 and GRF2 binding sites. J Vet Med Sci. 1994;56(2):235–44. https://doi.org/10.1292/jvms.56.235
34. Hitzeman RA, Chen CY, Dowbenko DJ, et al. Use of heterologous and homologous signal sequences for secretion of heterologous proteins from yeast. Methods Enzymol. 1990;185:421–40. https://doi.org/10.1016/0076-6879(90)85037-o
35. Kaishima M, Ishii J, Matsuno T, et al. Expression of varied GFPs in Saccharomyces cerevisiae: codon optimization yields stronger than expected expression and fluorescence intensity. Sci Rep. 2016;6:35932. https://doi.org/10.1038/srep35932
36. Liu Z, Tyo KE, Martínez JL, et al. Different expression systems for production of recombinant proteins in Saccharomyces cerevisiae. Biotechnol Bioeng. 2012;109(5):1259–68. https://doi.org/10.1002/bit.24409
37. Myburgh MW, Rose SH, Viljoen-Bloom M. Evaluating and engineering Saccharomyces cerevisiae promoters for increased amylase expression and bioethanol production from raw starch. FEMS Yeast Res. 2020;20(6):foaa047. https://doi.org/10.1093/femsyr/foaa047
38. Reider Apel A, d’Espaux L, Wehrs M, et al. A Cas9-based toolkit to program gene expression in Saccharomyces cerevisiae. Nucleic Acids Res. 2017;45(1):496–508. https://doi.org/10.1093/nar/gkw1023
39. Zhang J, Cai Y, Du G, et al. Evaluation and application of constitutive promoters for cutinase production by Saccharomyces cerevisiae. J Microbiol. 2017;55:538–44. https://doi.org/10.1007/s12275-017-6514-4
40. Kjeldsen T, Andersen AS, Hubálek F, et al. Molecular engineering of insulin for recombinant expression in yeast. Trends Biotechnol. 2024;42(4):464–78. https://doi.org/10.1016/j.tibtech.2023.09.012
41. Хасаншина ЗР, Лунев ИС, Филипенко АА и др. Оптимизация условий культивирования штамма Saccharomyces cerevisiae — продуцента проинсулина. Биотехнология. 2022;38(3):35–48. https://doi.org/10.56304/S0234275822030036
42. Kjeldsen T. Yeast secretory expression of insulin precursors. Appl Microbiol Biotechnol. 2000;54(3):277–86. https://doi.org/10.1007/s002530000402
43. Kazemi Seresht A, Nørgaard P, Palmqvist EA, et al. Modulating heterologous protein production in yeast: the applicability of truncated auxotrophic markers. Appl Microbiol Biotechnol. 2013;97(9):3939–48. https://doi.org/10.1007/s00253-012-4263-1
44. Andersen AS, Diers I. Production of heterologous polypeptides in yeast. 2005. US patent US6861237B2. https://patents.google.com/patent/US6861237B2/en
45. Grey M, Brendel M. A ten-minute protocol for transforming Saccharomyces cerevisiae by electroporation. Curr Genet. 1992;22(4):335–6. https://doi.org/10.1007/bf00317931
46. Corbacho I, Teixidó F, Velázquez R, et al. Standard YPD, even supplemented with extra nutrients, does not always compensate growth defects of Saccharomyces cerevisiae auxotrophic strains. Antonie Van Leeuwenhoek. 2011;99(3):591–600. https://doi.org/10.1007/s10482-010-9530-5
47. Marty MT, Baldwin AJ, Marklund EG, et al. Bayesian deconvolution of mass and ion mobility spectra: from binary interactions to polydisperse ensembles. Anal Chem. 2015;87(8):4370–6. https://doi.org/10.1021/acs.analchem.5b00140
Об авторах
Е. А. БуслаеваРоссия
Буслаева Евгения Александровна
ул. Связи, д. 34, лит. А, пос. Стрельна, Санкт-Петербург, 198515
З. Р. Хасаншина
Россия
Хасаншина Зухра Рамилевна
ул. Связи, д. 34, лит. А, пос. Стрельна, Санкт-Петербург, 198515
И. А. Корнаков
Россия
Корнаков Игорь Александрович
ул. Связи, д. 34, лит. А, пос. Стрельна, Санкт-Петербург, 198515
М. П. Коробкина
Россия
Коробкина Мария Павловна
ул. Связи, д. 34, лит. А, пос. Стрельна, Санкт-Петербург, 198515
В. И. Шмурак
Россия
Шмурак Владимир Игоревич
ул. Связи, д. 34, лит. А, пос. Стрельна, Санкт-Петербург, 198515
Р. В. Драй
Россия
Драй Роман Васильевич, канд. мед. наук
ул. Связи, д. 34, лит. А, пос. Стрельна, Санкт-Петербург, 198515
Дополнительные файлы
Рецензия
Для цитирования:
Буслаева Е.А., Хасаншина З.Р., Корнаков И.А., Коробкина М.П., Шмурак В.И., Драй Р.В. Промоторы для высокоэффективной экспрессии и секреции проинсулина в Saccharomyces cerevisiae. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(3):258-270. https://doi.org/10.30895/2221-996X-2025-25-3-258-270
For citation:
Buslaeva E.A., Khasanshina Z.R., Kornakov I.A., Korobkina M.P., Shmurak V.I., Drai R.V. Promoters for high-efficiency expression and proinsulin secretion in Saccharomyces cerevisiae. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(3):258-270. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-3-258-270


































