ТЕМА НОМЕРА: ВЫСОКОТЕХНОЛОГИЧНЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
ВВЕДЕНИЕ. В настоящее время генная терапия на основе аденоассоциированных вирусов (adeno-associated viruses, AAV) сталкивается с рядом барьеров биомедицинского и технологического характера, анализ и преодоление которых необходимо для дальнейшего развития данного направления генной терапии.
ЦЕЛЬ. Провести анализ применения генной терапии ряда наследственных заболеваний с учетом ограничений, связанных с побочными эффектами или недостаточной эффективностью генной терапии, проблемой определения терапевтического окна и индивидуальной спецификой наследственного заболевания, а также рассмотреть подходы для снятия этих ограничений и повышения доступности генной терапии путем усовершенствования технологических подходов производства и снижения себестоимости генотерапевтических препаратов.
ОБСУЖДЕНИЕ. Рассмотрен опыт применения одобренных и находящихся на этапе клинических исследований генотерапевтических препаратов. Проведена оценка применимости генной терапии на примере ряда наследственных заболеваний и показано, что правильное определение терапевтического окна препаратов и своевременная диагностика наследственных заболеваний являются критически важными для эффективной и безопасной генной терапии. Рассмотрены современные стратегии снижения риска возникновения побочных эффектов и увеличения эффективности генной терапии на основе ААV, среди которых наиболее важны следующие: поиск новых серотипов ААV, модификация капсидов и генома ААV, подавление нецелевой экспрессии с помощью микроРНК, изменение содержания CpG, поиск новых промоторов для трансгена. Проведен анализ развития технологии производства генотерапевтических препаратов на основе ААV. Наиболее перспективным представляется переход на суспензионное культивирование, усовершенствование биореакторов, применение новых методов и материалов очистки вирусных частиц, совершенствование систем трансфекции и создание новых клеточных линий-продуцентов, что в конечном счете может привести к снижению затрат на производство препаратов и повышению доступности генной терапии.
ЗАКЛЮЧЕНИЕ. В настоящее время генная терапия используется только для небольшого количества наследственных заболеваний. Существенные ограничения применения генотерапевтических препаратов связаны с недостаточной эффективностью, риском возникновения побочных эффектов и высокой стоимостью лечения. Ведущиеся в настоящее время биомедицинские и технологические разработки позволят решить указанные проблемы и повысить доступность генной терапии.
ВВЕДЕНИЕ. Развитие злокачественных новообразований ассоциировано с изменениями в экспрессии малых некодирующих РНК (микроРНК), что подчеркивает необходимость исследований в области разработки микроРНК-направленных ингибиторов как перспективного подхода к лечению онкологических заболеваний.
ЦЕЛЬ. Сравнительная оценка и определение возможностей практического применения существующих в настоящее время стратегий подавления функциональной активности опухоль-ассоциированных микроРНК, основанных на использовании терапевтических нуклеиновых кислот.
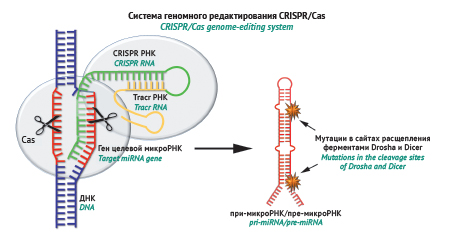
ОБСУЖДЕНИЕ. Проведен анализ известных ингибиторов микроРНК на основе олигонуклеотидов, характеризующихся различными механизмами действия. Ингибиторы микроРНК по механизму действия можно условно разделить на две группы. Первая группа соединений оказывает опосредованное ингибирующее влияние либо за счет блокирования функциональных связей между микроРНК и определенными мРНК-мишенями путем использования микроРНК-маскирующих олигонуклеотидов, либо за счет введения мутаций в гены микроРНК и нарушения процессов их биосинтеза с помощью системы CRISPR/Cas. Эти стратегии обладают сравнительно высоким биологическим потенциалом, однако в большинстве случаев используются в качестве поисковых инструментов для изучения функциональной роли микроРНК и определения их молекулярных взаимодействий в процессах канцерогенеза. Вторая группа олигонуклеотидных конструкций взаимодействует с микроРНК-мишенями напрямую, приводя к их стерическому блокированию или деградации. Такие микроРНК-связывающие олигонуклеотидные конструкции представлены множеством структурных вариантов, включая микроРНК-спонжи, РНК-зипперы, антисмысловые олигонуклеотиды и миРНКазы, демонстрирующие высокий терапевтический потенциал in vitro и in vivo.
ЗАКЛЮЧЕНИЕ. Представленный анализ биологических свойств, терапевтического потенциала и ключевых преимуществ разработанных микроРНК-направленных олигонуклеотидных конструкций позволяет обозначить области их потенциального практического применения при лечении злокачественных новообразований.
ВВЕДЕНИЕ. Малые интерферирующие РНК (миРНК) относятся к типу терапевтических нуклеиновых кислот, направленных на подавление экспрессии патогенетически значимых генов посредством механизма интерференции РНК. Однако потенциал препаратов на основе миРНК и их клиническое применение остаются ограниченными, что связано с проблемами биодоступности и иммуногенности миРНК, а также несовершенством систем доставки.
ЦЕЛЬ. Обобщить основные достижения в области создания лекарственных препаратов на основе миРНК, в том числе систем их доставки, рассмотреть итоги клинических исследований и обозначить перспективы разработки препаратов данной группы.
ОБСУЖДЕНИЕ. Рассмотрены молекулярные основы РНК-интерференции, особенности разработки миРНК и методы их эффективной доставки. Представлены сведения о системах доставки нуклеиновых кислот до клеток-мишеней. Наиболее перспективны невирусные системы доставки: липосомы, экзосомы, наночастицы, полимеры, клеточно-проникающие пептиды и системы с лигандом GalNAc. К основным преимуществам перечисленных систем доставки относятся простота получения комплексов с нуклеиновыми кислотами, возможность модификации и функционализации систем доставки, благоприятный профиль безопасности, способность прохождения биологических барьеров, тропизм к тканям-мишеням. Обобщены результаты клинических исследований за последние несколько лет миРНК-препаратов для лечения метаболических нарушений, инфекционных, онкологических и наследственных заболеваний, патологий органов зрения, почек, печени. Особое внимание уделено препаратам на основе миРНК, которые проходят клинические исследования (более 10 препаратов), а также одобренным для клинического применения (6 препаратов), в том числе первому зарегистрированному российскому препарату на основе миРНК — МИР 19.
ЗАКЛЮЧЕНИЕ. Препараты миРНК — перспективные средства персонализированной медицины, демонстрирующие возможности для терапии широкого спектра различных патологий. Дальнейшие исследования препаратов данной группы должны быть направлены на совершенствование технологии получения молекул миРНК — для увеличения биодоступности и периода полувыведения — и систем их доставки в целевые клетки — для снижения риска токсичности и повышения эффективности.
ВВЕДЕНИЕ. Существующие клеточные методы восстановления хрящевой ткани, такие как аутологичная трансплантация хондроцитов, недостаточно эффективны, а хирургическое вмешательство болезненно и травматично. Поэтому требуется разработка более эффективного продукта для клеточной терапии с малоинвазивной хирургической процедурой его имплантации пациенту.
ЦЕЛЬ. Разработка технологии производства аутологичного биомедицинского клеточного продукта (БМКП), содержащего трехмерные структуры (3D-сфероиды) на основе хондроцитов, выделенных из хрящевой ткани пациента, и оценка клинической эффективности его применения.
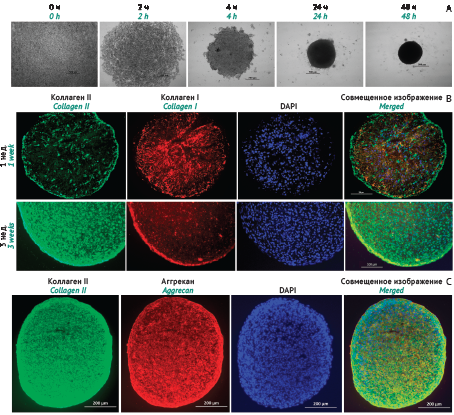
МАТЕРИАЛЫ И МЕТОДЫ. Аутологичные хондроциты, выделенные из биоптата хрящевой ткани пациента, культивировали в монослойной культуре для получения необходимого количества клеток. Дальнейшее культивирование хондроцитов проводили с использованием неадгезивного покрытия для формирования 3D-сфероидов. Все этапы производства БМКП проводили в асептических условиях в изоляторах клеточных культур. Для характеристики фенотипа хондроцитов на разных этапах культивирования использовали фазово-контрастную микроскопию и иммуногистохимическое окрашивание с применением специфических флуоресцентно меченных антител. Генетическую стабильность контролировали кариологическим методом. В рамках клинического исследования (КИ) проводили оценку эффективности БМКП Изитенс® при помощи специализированных функциональных тестов и по Шкале оценки восстановления хрящевой ткани по результатам магнитно-резонансной томографии (MOCART). Основным критерием эффективности было изменение общего балла по Шкале оценки исхода травмы и остеоартроза коленного сустава (KOOS).
РЕЗУЛЬТАТЫ. Разработана технология производства аутологичного БМКП Изитенс® из собственных клеток пациента без применения сыворотки животных, ростовых факторов, цитокинов и других добавок. С использованием кариологического метода подтверждено сохранение генетической стабильности хондроцитов на протяжении 3 пассажей культивирования в монослойной культуре. При 3D-культивировании в виде сфероидов хондроциты продуцируют характерные для матрикса хрящевой ткани белки (коллаген типа II, аггрекан), приобретая таким образом способность к восстановлению поврежденного хряща. В ходе КИ продемонстрировано статистически значимое улучшение состояния хрящевой ткани коленных суставов через 12 мес. после трансплантации 3D-сфероидов из аутологичных хондроцитов. Среднее изменение общего балла KOOS составило 23,8±15,9.
ВЫВОДЫ. Продемонстрирована высокая эффективность БМКП Изитенс® для восстановления хрящевой ткани. На основании результатов клинических исследований данный БМКП зарегистрирован на территории Российской Федерации, введен в клиническую практику и может стать альтернативой эндопротезированию и дорогостоящим операциям за рубежом.
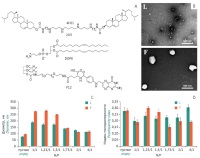
ВВЕДЕНИЕ. Использование катионных липосом является перспективным подходом для доставки терапевтических нуклеиновых кислот (НК) в клетки-мишени, так как позволяет защитить НК от деградации внеклеточными нуклеазами. Однако для обеспечения селективной доставки НК к месту терапевтического действия данный подход нуждается в совершенствовании, в том числе за счет модификации поверхности липосом адресными лигандами.
ЦЕЛЬ. Проведение сравнительного исследования кинетики накопления в клетках флуоресцентно-меченного олигонуклеотида (модельного препарата нуклеиновых кислот) с помощью адресных фолатсодержащих катионных липосом и обычных липосом.
МАТЕРИАЛЫ И МЕТОДЫ. Адресные фолатсодержащие катионные липосомы (F) и обычные липосомы (L) готовили с использованием следующих компонентов: поликатионный амфифил 2X3, цвиттер-ионный липид DOPE, фолатный липоконъюгат F12. Физикохимические характеристики липосом изучали с помощью методов динамического светорассеяния и трансмиссионной электронной микроскопии. Комплексы липосом с флуоресцентно-меченным олигонуклеотидом (FITC-ODN) формировали с использованием различных соотношений компонентов (N/P). Кинетика накопления комплексов на клетках рака шейки матки человека (линия КВ-3-1) и почки эмбриона человека (линия НЕК 293) была изучена с помощью методов проточной цитометрии, флуоресцентной и конфокальной микроскопии.
РЕЗУЛЬТАТЫ. Полученные липосомы L и F представляли собой сферические частицы диаметром от 75 до 100 нм. Сформированы комплексы катионных липосом (L и F) с FITC-ODN при оптимальном соотношении N/P, равном 2/1, при котором наблюдается образование однородных (индекс полидисперсности меньше 0,200) частиц с размером 112,4–125,1 нм. Фолатсодержащие липосомы на 25% эффективнее доставляли FITC-ODN в клетки КВ-3-1 через 90, 120 и 240 мин после начала трансфекции по сравнению с обычными липосомами, не содержащими адресного лиганда. Согласно данным флуоресцентной и конфокальной микроскопии после начала трансфекции клеток наблюдалась совместная колокализация флуоресцентных сигналов липосом и олигонуклеотида и далее происходило накопление олигонуклеотида в цитоплазме.
ВЫВОДЫ. Показана эффективная доставка флуоресцентно-меченного олигонуклеотида в цитоплазму опухолевых клеток с помощью катионных липосом. Использование адресных фолатсодержащих липосом позволяет увеличить количество трансфицированных клеток и эффективность доставки олигонуклеотида по сравнению с обычными липосомами, не содержащими адресного лиганда. Полученные результаты могут быть использованы для дальнейшей разработки препаратов направленного действия на основе терапевтических нуклеиновых кислот и липосом.
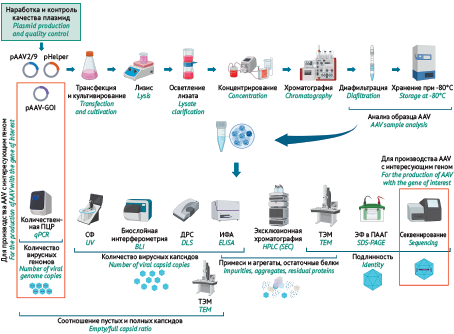
ВВЕДЕНИЕ. При фармацевтической разработке российских препаратов генной терапии на основе аденоассоциированных вирусов (AAV) необходимым этапом является создание стандартных образцов (СО), которые используются на протяжении всего цикла разработки препарата, а также установление стабильности СО при хранении. В качестве материала для СО AAV 9 серотипа (AAV9) может выступать препарат пустых капсидов AAV9.
ЦЕЛЬ. Разработка методик оценки физико-химических показателей качества для характеристики стандартного образца пустых капсидов AAV9 и исследование его стабильности при хранении.
МАТЕРИАЛЫ И МЕТОДЫ. Наработку СО пустых капсидов AAV9 проводили в суспензионных клетках HEK293 с использованием бессывороточной среды при оптимизированных параметрах трансфекции с последующим осветлением, концентрированием, хроматографической очисткой AAV9 на аффинном сорбенте (AAVX) и диафильтрацией. Для анализа образцов применяли электрофорез, трансмиссионную электронную микроскопию, иммуноферментный анализ (ИФА), эксклюзионную хроматографию, динамическое светорассеяние, спектрофотометрию и биослойную интерферометрию. Определение концентрации капсидов проводили методом ИФА. Для разработки методов оценки физического титра использовали СО AAV с известным титром. При исследовании стабильности СО хранили при –80 °C в течение 9 мес.
РЕЗУЛЬТАТЫ. Наработанный СО AAV9 обладал высокой степенью чистоты по результатам эксклюзионной хроматографии — содержание мономеров вирусных капсидов составляло не менее 98%. С использованием методов динамического светорассеяния, эксклюзионной хроматографии и электронной микроскопии показано отсутствие агрегатов в образце. Установлена стабильность полученного СО пустых капсидов AAV9 в течение 9 мес. Показано, что при определении физического титра СО пустых капсидов AAV9 оптимальными для рутинного анализа качества являются методы динамического рассеяния света и спектрофотометрии; метод биослойной интерферометрии рекомендуется для регулярного анализа. Определенные тремя указанными методами значения титра вирусных частиц варьировали от 1,48×10¹³ до 5,6×10¹³.
ВЫВОДЫ. Разработан стандартный образец пустых капсидов AAV9, который может быть пригоден для контроля качества препаратов генной терапии на основе AAV9.
ВВЕДЕНИЕ. Создание синтетических векторов на основе аденоассоциированных вирусов (ААВ) при разработке препаратов для генной терапии является трудоемким и дорогостоящим процессом. Для ускорения и снижения стоимости разработки генотерапевтических препаратов оптимальным представляется совершенствование методов оценки биораспределения и эффективности трансдукции in vivo ААВ векторов.
ЦЕЛЬ. Разработка методики биоинформатической оценки библиотек синтетических векторов на основе ААВ для анализа биораспределения и эффективности трансдукции ААВ in vivo.
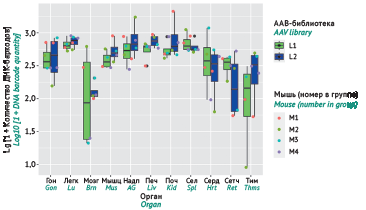
МАТЕРИАЛЫ И МЕТОДЫ. Конструировали синтетические ААВ векторы путем добавления специальной метки (баркода), специфичной для каждого исследуемого серотипа ААВ — 12-нуклеотидной последовательности, фланкированной с 5'-конца кодирующей последовательностью репортерного белка (зеленый флуоресцентный белок). Плазмиды с уникальными баркодами нарабатывали в компетентных клетках Escherichia coli XL10-Gold и использовали для сборки ААВ-библиотек: ААВ-библиотека L1 — с количеством вирусных геномов (вг) 10¹⁰; библиотека L2 с количеством вг — 10¹¹. Для продукции ААВ проводили трансфекцию клеток НЕК293Т. Векторы в виде двух ААВ-библиотек вводили внутривенно мышам линии С57В1/6N. Из органов и тканей животных выделяли ДНК и РНК для последующего анализа методом секвенирования нового поколения. Анализировали количество ДНК- и РНК-баркодов в органах мышей для оценки биораспределения и эффективности трансдукции ААВ. Баркоды идентифицировали с помощью выравнивания на ожидаемые последовательности, затем подсчитывали их количество и нормировали на количество в исходной библиотеке.
РЕЗУЛЬТАТЫ. Созданы 7 вирусных конструкций на основе ААВ различных серотипов, 6 из которых — синтетические (sААВ1, sААВ2, sААВ3, sААВ4, sААВ5, sААВ6), в составе двух ААВ-библиотек. При проведении секвенирования образцов из органов мышей обнаружено значимое количество ДНК-баркодов обеих ААВ-библиотек в образцах всех органов, за исключением мозга. Для библиотеки L1 детектированы РНК-баркоды на достаточном уровне в четырех органах: скелетная мускулатура, сердце, печень и надпочечники; для библиотеки L2 — дополнительно к перечисленным органам в гонадах и почках. При анализе эффективности трансдукции (по уровню РНК-баркодов с поправкой на ДНК-баркоды) показано, что наиболее перспективными вариантами для генной терапии заболеваний печени является sAAВ5, а для заболеваний надпочечников — sAAВ2 и sAAВ6.
ВЫВОДЫ. Разработанная методика биоинформатической оценки библиотек синтетических векторов на основе ААВ позволяет проводить анализ биораспределения и эффективности трансдукции ААВ векторов в организме. Предложенный подход является перспективным для подбора оптимальных ААВ векторов для конкретных органов и тканей при разработке генотерапевтических препаратов.
МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ
ВВЕДЕНИЕ. Особенности биологических лекарственных препаратов (БЛП), связанные с их природой или составом, вызывают определенные трудности при выявлении микробной контаминации, что влияет на оценку достоверности результатов контроля стерильности БЛП. К основным проблемам проведения испытаний БЛП относятся изменение внешнего вида и физического состояния питательной среды или образца, увеличенный риск контаминации и получения ложноположительного результата при испытании методом прямого посева, затруднения при проведении процедуры фильтрации и др. При разработке производителями БЛП нормативной документации на препарат, материалов регистрационного досье (раздел валидации аналитических методик) имеется необходимость в создании адекватных и воспроизводимых методик испытания по показателю «Стерильность» на основе фармакопейных методов для конкретных препаратов (вакцины живые и инактивированные, вирусные и бактериальные, одно- и многокомпонентные, бактериофаги и интерфероны, сыворотки и иммуноглобулины). Решением указанных проблем могут служить рекомендации по разработке методик на основе фармакопейных методов прямого посева и мембранной фильтрации.
ЦЕЛЬ. Предложить основные рекомендации по разработке методик испытания стерильности биологических лекарственных препаратов на основе фармакопейных методов.
ОБСУЖДЕНИЕ. Проведен ретроспективный анализ результатов экспертизы нормативной документации на БЛП, поступившей в испытательный центр ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России в 2021–2023 гг. Рассмотрены ключевые проблемные аспекты методик, изложенных в разделе «Стерильность» в нормативных документах, и представлены способы их решения. Предложены следующие рекомендации: при испытании препаратов крови методом прямого посева не рекомендуется использовать питательную среду Сабуро с низким значением pH; испытание препаратов, содержащих ртутные консерванты, проводить с использованием тиогликолевой среды при двух температурных режимах; при испытании различных групп БЛП исключить применение ватно-марлевых пробок, использовать питательные среды, разлитые в стеклянные флаконы, закрытые резиновыми пробками и завальцованные; испытание препаратов в большой первичной упаковке (от 10 мл и более) проводить методом мембранной фильтрации. При испытании БЛП методом мембранной фильтрации рекомендовано использовать растворитель и промывочную жидкость, подобранные в результате проведения валидационных испытаний, а также установить максимально возможный объем препарата, фильтруемый через один мембранный фильтр; при проведении испытания препаратов крови для уменьшения пенообразования проводить фильтрацию при более низкой скорости.
ЗАКЛЮЧЕНИЕ. Представленные рекомендации могут служить руководством при разработке методик испытания стерильности БЛП для соответствующего раздела нормативной документации и могут быть использованы предприятиями-изготовителями, контрольными лабораториями, а также в работе экспертных организаций для унификации подхода при контроле качества БЛП по показателю «Стерильность».
ISSN 2619-1156 (Online)