Перейти к:
Молекулярно-генетические методы контроля качества инактивированных вакцин на модели вируса Чикунгунья: подлинность штамма и полнота инактивации вируса
https://doi.org/10.30895/2221-996X-2024-24-3-279-293
Резюме
ВВЕДЕНИЕ. При разработке и производстве инактивированных вакцин важными критериями безопасности и качества препарата являются полнота инактивации вируса и подлинность вакцинного штамма. Для осуществления контроля качества инактивированных вакцин наиболее перспективным представляется использование молекулярно-биологических методов, отличающихся быстротой получения результата, а также высокими показателями чувствительности и специфичности.
ЦЕЛЬ. Разработка методов количественной полимеразной цепной реакции с детекцией в режиме реального времени (кПЦР-РВ) и интегрированной с культуральным методом кПЦР-РВ (ИКМ-кПЦР-РВ) для оценки полноты инактивации вируса Чикунгунья (ЧИКВ), а также метода обратной транскрипции — ПЦР с последующей оценкой полиморфиз ма длин рестрикционных фрагментов (ОТ-ПЦР-ПДРФ) для подтверждения подлинности штамма.
МАТЕРИАЛЫ И МЕТОДЫ. В исследовании использовали РНК штаммов ЧИКВ (по 3 штамма каждого из четырех генотипов (Asian, ECSA, ECSA-IOL, WAF), которые были предваритель но определены секвенированием), штамм ЧИКВ Nika21 (генотип ECSA), инактивированный β-пропиолактоном штамм Nika21, сорбированный на гидроокиси алюминия антиген Nika21. Применяли методы кПЦР-РВ, ИКМ-кПЦР-РВ, ОТ-ПЦР-ПДРФ, реакцию нейтрализации.
РЕЗУЛЬТАТЫ. Определен фрагмент гена белка nsP1 длиной 218 п.о. между позициями 789 и 1006, который содержит сайты узнавания эндонуклеаз рестрикции, наличие или отсутствие которых составляют различные комбинации и специфичны для каждого из 4 генотипов ЧИКВ. Подобраны праймеры, позволяющие амплифицировать выбран ный участок гена, отработаны условия проведения ОТ-ПЦР-РВ и ОТ-ПЦР-ПДРФ. Продемонстрирована возможность использования метода ИКМ-кПЦР-РВ для подтверждения полноты инактивации вируса. Показана возможность применения метода ОТ-ПЦР-ПДРФ для установления подлинности вакцинного штамма.
ВЫВОДЫ. Продемонстрированы преимущества применения метода ИКМ-кПЦР-РВ для оценки полноты инактивации антигена вакцинного штамма и метода ОТ-ПЦР-ПДРФ для подтверждения подлинности вакцинного штамма вируса. Данные методы являются более чувствительными и быстрыми относительно традиционных культуральных методов и могут быть использованы на всех этапах технологического процесса производства инактивированных вакцин.
Ключевые слова
Для цитирования:
Оксанич А.С., Самарцева Т.Г., Каа К.В., Отрашевская Е.В., Красько А.Г., Лапутина А.Г., Нетесова Н.А., Игнатьев Г.М. Молекулярно-генетические методы контроля качества инактивированных вакцин на модели вируса Чикунгунья: подлинность штамма и полнота инактивации вируса. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(3):279-293. https://doi.org/10.30895/2221-996X-2024-24-3-279-293
For citation:
Oksanich A.S., Samartseva T.G., Kaa K.V., Otrashevskaia E.V., Krasko A.G., Laputina A.G., Netesova N.A., Ignatyev G.M. Molecular genetic methods for quality control of inactivated vaccines using a Chikungunya virus model: vaccine strain identification and completeness of virus inactivation. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(3):279-293. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-3-279-293
ВВЕДЕНИЕ
При разработке и производстве инактивированных вакцин важными критериями безопасности и качества препарата являются полнота инактивации вируса и подлинность вакцинного штамма. В соответствии с требованиями Государственной фармакопеи Российской Федерации (ГФ РФ)1 (ОФС.1.7.1.0004.15) производителям инактивированных вакцин необходимо контролировать «специфическую безопасность», что подразумевает необходимость оценить «методами in vivo и/или in vitro полноту инактивации». С этой целью для различных вакцин применяют разные подходы: так, например, для вакцины лептоспирозной концентрированной инактивированной (ФС.3.3.1.0014.152) используют чувствительных лабораторных животных; для вакцины гриппозной инактивированной (ФС.3.3.1.0028.203) и вакцины оспенной инактивированной (ФС.3.3.1.0034.154) — куриные эмбрионы; для вакцины антирабической инактивированной (ФС.3.3.1.0025.155) — чувствительные культуры клеток. Методы in vivo, то есть с применением лабораторных животных, являются достаточно трудоемкими и затратными по времени. К недостаткам метода in vitro с использованием монослоя культуры чувствительных клеток можно отнести определенную степень субъективности из-за отсутствия практического стандарта для оценки данных, а также возможность получения сомнительных/неоднозначных результатов из-за неспецифических процессов деградации монослоя культуры клеток. В последнее десятилетие для контроля качества вакцин все чаще применяется метод количественной полимеразной цепной реакции (кПЦР) благодаря его специфичности, чувствительности и быстроты. Однако данный метод не позволяет различать инфекционные и неинфекционные вирусы, что делает невозможным его прямое использование для исследования полноты инактивации вируса. В работах B.L. Correia Moreira с соавт. [1][2] была предложена комбинация кПЦР в реальном времени с методом культивирования на чувствительных линиях клеток для контроля качества вакцин для профилактики бешенства, в том числе ветеринарных. Описанный подход также применялся в случае вакцин для профилактики гепатита А [3] и инфекции, вызванной SARS-CoV-2 [4]. Данная комбинация как единый метод уже используется для оценки эффективности химических и физических способов инактивации патогенных вирусов в окружающей среде, например для таких, как ротавирус, реовирус, энтеровирус, вирус Эбола и вирус полиомиелита [5–11]. Этот метод получил название «интегрированная с культуральным методом кПЦР в режиме реального времени» (ИКМ-кПЦР-РВ, integrated cell culture quantitative polymerase chain reaction, ICC–qPCR).
Для подтверждения подлинности производственного штамма вируса в препаратах инактивированных вакцин чаще всего используются чувствительные лабораторные животные. Так, в соответствии с требованиями ГФ РФ метод in vivo рекомендован для вакцины клещевого энцефалита (ФС.3.3.1.0031.15)6. Для вакцины оспенной инактивированной применяется метод in vitro — реакция нейтрализации с использованием вакцинного штамма и сыворотки иммунных животных (ФС.3.3.1.0034.15)7. Однако следует отметить, что эти методы могут подтвердить исключительно принадлежность производственного штамма вируса к определенному семейству и роду, а не к какому-то конкретному штамму [12][13]. Более того, эти методы являются достаточно трудоемкими. Молекулярно-биологические методы, в частности метод ПЦР с обратной транскрипцией с последующей оценкой полиморфизма длин рестрикционных фрагментов (ОТ-ПЦР-ПДРФ), могут стать существенным дополнением, а на определенном этапе полностью заменить биологический метод подтверждения подлинности производственного штамма вируса. Метод ОТ-ПЦР-ПДРФ разработан и рекомендуется для дифференциальной диагностики вакцинного штамма от «диких» для ряда препаратов, таких как вакцина для профилактики ветряной оспы [14], паротита [15], краснухи [12] и бешенства [16].
Указанные методы контроля полноты инактивации вируса и подлинности вакцинного штамма могут быть применены при разработке новых инактивированных вирусных вакцин, в частности для профилактики лихорадки, вызываемой вирусом Чикунгунья (ЧИКВ). В настоящее время инактивированные вакцины для профилактики ЧИКВ разрабатываются с использованием формалина или β-пропиолактона [17–20], и одна из них находится на II/III фазе клинических исследований8. Актуальность разработки подтверждает тот факт, что Управление по контролю за качеством продуктов питания и лекарственных средств США (Food and Drug Administration, FDA) и Европейское агентство по лекарственным средствам (European Medicines Agency, EMA) предоставили нескольким кандидатным вакцинам для профилактики заболевания, вызванного ЧИКВ, статус ускоренного и приоритетного рассмотрения (Fast Track, Priority Review)9.
Цель работы — разработка методов кПЦР-РВ и ИКМ-кПЦР-РВ для оценки полноты инактивации ЧИКВ, а также ОТ-ПЦР-ПДРФ для подтверждения подлинности штамма.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Вирусы. Для проведения исследования использовали РНК вирусов, относящихся к семействам Alphaviridae, Flaviviridaе, Bunyaviridae. Вирусы семейства Alphaviridae: ЧИКВ (по 3 штамма каждого из четырех генотипов, которые были предварительно определены секвенированием: Asian, ECSA, ECSA-IOL, WAF), вирус венесуэльского энцефаломиелита лошадей (ВЭЛ) (2 штамма), вирус Синдбис (2 штамма); вирусы семейства Flaviviridae — вирус желтой лихорадки (штамм 17D), вирусы денге (1 тип — штамм Hawaii, 2 тип — New Guinea C (NGC), 3 тип — H-87, 4 тип — H241), вирус японского энцефалита, вирус клещевого энцефалита (штамм Софьин) и вирус Западного Нила (каждого — по одному штамму); вирусы семейства Bunyaviridae — один штамм вируса Конго-Крымской геморрагической лихорадки. Вирусы были использованы для получения образцов РНК, которые применялись для подтверждения специфичности метода. Все указанные штаммы были получены из коллекций микроорганизмов следующих учреждений: ГУ «Республиканский научно-практический центр эпидемиологии и микробиологии» Республики Беларусь, ФГБНУ «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова» (Россия) и филиала ФГУП «Санкт-Петербургский научно-исследовательский институт вакцин и сывороток и предприятие по производству бактерийных препаратов» ФМБА России (Никарагуа).
Для изучения полноты инактивации использовали штамм Nika21 (генотип ECSA). Нуклеотидная последовательность штамма Nika21 представлена в GenBank (OQ32049510).
Все работы проводили с соблюдением действующих санитарных норм и правил.
РНК из образцов выделяли с использованием набора реагентов «АмплиСенс® Магно-Сорб» (ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора) согласно инструкции производителя. Экстракцию РНК осуществляли в 50 мкл элюирующего раствора и хранили при минус 70 °С до дальнейшего использования.
Образцы сывороток. Использовали образцы сывороток крови людей, полученные в ходе клинических испытаний в Никарагуа, как описано ранее [21], а также образцы сывороток лиц, привитых вакциной ВЭЛ, как описано ранее [22]. Предварительно скрининг образцов сывороток на наличие/отсутствие антител проводили методом иммуноферментного анализа (ИФА) с использованием доступных коммерческих наборов в соответствии с инструкциями производителей: наборы реагентов для определения антител (АТ) класса IgG к вирусу Чикунгунья и вирусу Синдбис — «БиоСкрин-Чикунгунья (IgG)» и «БиоСкрин-Синдбис (IgG)» (АО БТК «Биосервис», Россия); наборы реагентов для определения АТ класса IgG к вирусу денге и вирусу Зика — «Anti-Dengue Virus ELISA (IgG)» и «Anti-Zika Virus ELISA (IgG)» (Euroimmun AG, Германия); набор реагентов для определения АТ класса IgG к вирусу желтой лихорадки «Qualitative Human Yellow Fever Virus Antibody IgG (YFV-IgG) ELISA Kit» (MyBioSource Inc., США).
Для экспериментов были отобраны следующие образцы сывороток:
- 5 образцов сывороток от лиц, переболевших лихорадкой Чикунгунья, содержащих только антитела к ЧИКВ (группа «ЧИКВ»);
- 5 образцов сывороток от лиц, проживающих в странах Латинской Америки, содержащих только антитела к вирусу Синдбис (группа «Синдбис»);
- 5 образцов сывороток от лиц, привитых вакциной ВЭЛ, имеющих антитела только к вирусу ВЭЛ и не выезжавших в страны Латинской Америки или Юго-Восточной Азии (группа «ВЭЛ»);
- 5 образцов сывороток, не содержащих антитела к ЧИКВ, ВЭЛ и вирусу Синдбис, от лиц, не выезжавших в страны Латинской Америки или Юго-Восточной Азии. Данные образцы были использованы в качестве контрольных (группа «Контроль»).
Методы
Культивирование вируса. Вирус ЧИКВ (штамм Nika21, генотип ECSA) культивировали на клетках линии Vero с использованием дозы, соответствующей множественности заражения (multiplicity of infection, MOI), равной 0,00001, как описано ранее [23]. В качестве питательной среды применяли среду Игла МЕМ (ФГАНУ «Федеральный научный центр исследований и разработки иммунобиологических препаратов им. М.П. Чумакова РАН», Россия) с 2% эмбриональной телячьей сывороткой (ЭТС) (ООО «БиолоТ», Россия).
Титрование вируса проводили на клетках линии Vero, как описано ранее [23]. Результат титрования учитывали по выраженному цитопатическому действию и рассчитывали показатель тканевой цитопатической дозы, вызывающей гибель 50% клеток (ТЦД50), по методу Кербера в модификации Ашмарина и выражали его в lg ТЦД50/мл [23].
Инактивация вируса. Штамм ЧИКВ Nika21 был инактивирован β-пропиолактоном (при объемном соотношении β-пропиолактон: вируссодержащая культуральная жидкость, равном 1:1000). Инактивацию проводили в течение 48 ч при температуре 4 °С [24]. Через 48 ч обработанная β-пропиолактоном вируссодержащая культуральная жидкость в течение 2 ч выдерживалась при температуре 37 °С.
Сорбцию инактивированного ЧИКВ на гидроокись алюминия проводили, как описано ранее [24]. Десорбцию осуществляли как описано ранее [25].
Образцы для исследований. Для оценки метода ОТ-ПЦР-ПДРФ при подтверждении подлинности штамма вируса и метода ИКМ-кПЦР-РВ для анализа полноты инактивации штамма ЧИКВ Nika21 отбирали образцы вируссодержащей жидкости до и после инактивации, а также до и после сорбции на гидроокись алюминия (табл. 1).
Таблица 1. Описание образцов и методы их исследования
Table 1. Description of samples and testing methods
|
Номер образца Sample number |
Наименование образца Sample name |
Метод для подтверждения подлинности штамма ЧИКВ Nika21 Nika21 CHIKV strain identification method |
Метод для оценки полноты инактивации вируса Virus inactivation assessment method |
|
1 |
Вируссодержащая культуральная жидкость до инактивации β-пропиолактоном Virus-containing culture fluid before β-propiolactone inactivation |
ОТ-ПЦР-ПДРФ RT-PCR-RFLP |
ИКМ-кПЦР-РВ (в качестве положительного контроля) ICC-qPCR (positive control) |
|
2 |
Вируссодержащая культуральная жидкость после инактивации β-пропиолактоном Virus-containing culture fluid after β-propiolactone inactivation |
ОТ-ПЦР-ПДРФ RT-PCR-RFLP |
ИКМ-кПЦР-РВ ICC-qPCR |
|
3 |
Вируссодержащая культуральная жидкость после первого пассажа образца № 2 на клетках Vero Virus-containing culture fluid after Passage 1 of Sample 2 in Vero cells |
ОТ-ПЦР-ПДРФ RT-PCR-RFLP |
ИКМ-кПЦР-РВ ICC-qPCR |
|
4 |
Вируссодержащая культуральная жидкость после второго пассажа образца № 2 на клетках Vero Virus-containing culture fluid after Passage 2 of Sample 2 in Vero cells |
ОТ-ПЦР-ПДРФ RT-PCR-RFLP |
ИКМ-кПЦР-РВ ICC-qPCR |
|
5 |
Супернатант (надосадочная жидкость) после десорбции инактивированного ЧИКВ Supernatant after inactivated CHIKV desorption |
ОТ-ПЦР-ПДРФ RT-PCR-RFLP |
ИКМ-кПЦР-РВ ICC-qPCR |
|
6 |
Десорбированный инактивированный ЧИКВ Desorbed inactivated CHIKV |
ОТ-ПЦР-ПДРФ RT-PCR-RFLP |
ИКМ-кПЦР-РВ ICC-qPCR |
|
7 |
Суспензия клеток Vero Vero cell suspension |
– |
ИКМ-кПЦР-РВ (в качестве отрицательного контроля) ICC-qPCR (negative control) |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ЧИКВ — вирус Чикунгунья; ОТ-ПЦР-ПДРФ — метод полимеразной цепной реакции (ПЦР) с обратной транскрипцией с последующей оценкой полиморфизма длин рестрикционных фрагментов; ИКМ-кПЦР-РВ — интегрированная с культуральным методом количественная ПЦР в режиме реального времени.
Note. CHIKV, Chikungunya virus; RT-PCR-RFLP, reverse-transcription polymerase chain reaction assay coupled with restriction fragment length polymorphism analysis; ICC-qPCR, integrated cell culture real-time quantitative polymerase chain reaction.
Полимеразная цепная реакция с обратной транскрипцией
Обратная транскрипция (ОТ). Для получения кДНК проводили реакцию ОТ с использованием праймера pNS1CHVrev2-3 и набора реагентов для обратной транскрипции («Синтол», Россия) на матрице вирусной РНК. На первом этапе в отдельные пробирки, содержащие по 2 мкл обратного праймера pNS1CHVrev2-3 в концентрации 3 пмоль/мкл, добавляли по 3 мкл выделенной РНК, а затем прогревали смеси в течение 5 мин при 95 °С. Далее пробирки охлаждали до комнатной температуры и добавляли в каждую по 10 мкл смеси для ОТ, состоящей из 2,5-кратного буфера для ОТ («Синтол», Россия) и 25 ед. MMLV-ревертазы («Синтол», Россия). Смесь инкубировали при 42 °С в течение 30 мин. Для инактивации ревертазы после инкубации смесь прогревали в течение 5 мин при 95 °С.
Контрольная плазмида. При проведении ПЦР в качестве калибратора и положительного контроля использовали плазмидную ДНК, содержащую последовательность гена белка nsP1 ЧИКВ (D-1621, АО БТК «Биосервис», Россия).
Полимеразная цепная реакция. ПЦР на кДНК, полученной после ОТ, проводили в объеме 25 мкл с использованием оригинальных праймеров и зондов для выявления гена белка nsP1 ЧИКВ. Для подбора праймеров осуществляли множественное выравнивание нуклеотидных последовательностей 40 полноразмерных геномов ЧИКВ, представленных в GenBank11 и включающих все четыре генотипа, с помощью программы AlignX (Vector NTI 11.0, Invitrogen, США). Неструктурные белки ЧИКВ, как и других альфа-вирусов, кодируются в 5'-области генома вирусной РНК с положительной цепью и транслируются непосредственно после попадания РНК в цитоплазму. Из всех генов nsP1 отвечает за кэпирование геномной и субгеномной РНК ЧИКВ и удерживает репликативные комплексы на цитоплазматической поверхности мембраны клетки. Следовательно, можно предположить, что активность гена данного белка определяет скорость размножения и инфекционность ЧИКВ [26]. По результатам анализа к консервативным областям гена белка nsP1 вируса ЧИКВ были подобраны праймеры и зонд. Последовательности и характеристики подобранных олигонуклеотидов представлены в таблице 2 (опубликована на сайте журнала12).
ПЦР-смесь состояла из 10 мкл 2,5-кратной реакционной смеси («Синтол», Россия), по 3 пмоль каждого праймера, 2,5 пмоль флуоресцентномеченного зонда и 5 мкл кДНК или ДНК калибратора. Реакцию проводили с использованием амплификатора ДТпрайм 5М1 («ДНК-Технология», Россия) по следующей программе: 1 цикл — 95 °С — 90 с; 40 циклов — 95 °С — 15 с, 55 °С — 30 c; хранение — 10 °С. Расчетная длина фрагмента 218 п.о.
Анализ полиморфизма длин рестрикционных фрагментов (ПДРФ). Выбирая участок гена белка nsP1 ЧИКВ, руководствовались критерием наличия сайтов рестрикции внутри получаемого ПЦР-продукта. Также учитывали, что фрагменты, образующиеся при гидролизе ПЦР-продукта рестриктазой, должны иметь значительно отличающиеся друг от друга размеры. В выбранном фрагменте гена белка nsP1 имелись несколько сайтов рестрикции, характерных для каждого отдельного генотипа ЧИКВ (табл. 3, опубликована на сайте журнала13).
У штаммов ЧИКВ генотипов ECSA и ECSA-IOL имеется сайт рестрикции DraI, расщепление, по которому дает 2 фрагмента с размерами 133 и 85 п.о. Генотипы Asian и WAF такого сайта не имеют, что позволяет дифференцировать штаммы ECSA и ECSA-IOL от других генотипов ЧИКВ. У штаммов ЧИКВ генотипа WAF по сайту рестрикции HindIII образуются два фрагмента 45 и 173 п.о., а по сайту SmaI — 169 и 49 п.о. Для штаммов ЧИКВ генотипа Asian по сайту рестрикции HindIII образуются два фрагмента с размерами 125 и 93 п.о. Таким образом, штаммы ЧИКВ генотипа WAF можно дифференцировать путем проведения ПДРФ с использованием эндонуклеазы рестрикции SmaI и HindIII, а штаммы ЧИКВ генотипа Asian — с помощью эндонуклеазы рестрикции HindIII.
Для рестрикционного анализа использовали эндонуклеазу рестрикции DraI (ООО «СибЭнзайм», Россия). К 25 мкл смеси ПЦР после амплификации добавляли 5 мкл буфера для рестрикции ROSE (кат. № B021, ООО «СибЭнзайм», Россия) и 20 мкл воды, затем делили на две аликвоты по 25 мкл и к одной из них добавляли 20 ед. эндонуклеазы рестрикции. После инкубации пробы в течение 1 ч при 37 °С продукты гидролиза разделяли с помощью электрофореза в 2% агарозном геле с добавлением бромистого этидия и визуализировали в трансиллюминаторе в ультрафиолетовом свете.
Количественная ПЦР с обратной транскрипцией (ОТ-кПЦР). Содержание РНК ЧИКВ оценивали c использованием метода ПЦР в режиме реального времени по показателю порогового цикла флуоресценции (Ct). Расчет пороговых циклов проводили с использованием программного обеспечения к амплификатору ДТпрайм 5М1 («ДНК-Технология», Россия). Для определения количества копий геном-эквивалентов (ГЭ) был использован калибратор, представляющий собой контрольную плазмиду с известной концентрацией, в полилинкере которой была клонирована последовательность nsP1 ЧИКВ. Расчетная концентрация ГЭ плазмиды составила 10,48×10¹³ ГЭ/мл. Данную плазмиду использовали для получения калибровочных образцов путем 10-кратных разведений, начиная с концентрации 10¹⁰ ГЭ/мл до 10 ГЭ/мл.
Интегрированная с культуральным методом количественная ПЦР в режиме реального времени (ИКМ-кПЦР-РВ). Метод состоял из двух частей. Сначала в культуре клеток Vero проводили два последовательных пассажа ЧИКВ с минимальной MOI, подобранной ранее. Использовали культуральные флаконы с площадью поверхности 25 см² со сформировавшимся монослоем клеток Vero (в трех повторах). Для адсорбции вируса на клетках флаконы переносили в термостат с температурой 37 °С и 5% СО2 на 1 ч, затем во флаконы добавляли питательную среду Игла МЕМ с 2% ЭТС в объеме 4 мл. Далее флаконы продолжали инкубировать в термостате при 37 °С и 5% СО2. Наблюдение за клеточным монослоем проводили ежедневно с помощью микроскопа для оценки появления видимых морфологических изменений в структуре монослоя. На 5 сут все флаконы замораживали при минус 70 °С, после чего размораживали при комнатной температуре и собирали лизат для проведения второй части методики — кПЦР.
Реакцию нейтрализации (РН) проводили для определения вируснейтрализующих АТ по ранее описанной методике [24] с применением 96-луночных планшетов с использованием культуры клеток Vero и штаммов ЧИКВ, ВЭЛ и Синдбис. Для дальнейшей статистической обработки полученные результаты реакции выражали в виде значений логарифмов по основанию 2.
Статистический анализ данных проводили с использованием стандартного пакета программ Microsoft Office Excel 2016. Данные представляли в виде среднего значения (М) и стандартного отклонения среднего (SD). Достоверность различий сравниваемых величин оценивали с помощью непарного t-критерия Стьюдента с «двумя хвостами» распределения (t-test). Различия считали статистически достоверными при уровне значимости р<0,05. Корреляцию между показателями оценивали по Спирмену.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ полноты инактивации вируса Чикунгунья по показателю титра вируса в культуре клеток линии Vero и по значениям пороговых циклов в кПЦР
Специфичность кПЦР. Для определения специфичности метода проводили кПЦР с подобранными праймерами и зондом к гену белка nsP1 ЧИКВ и РНК штаммов вирусов семейств Flaviviridaе, Bunyaviridae и Alphaviridae, как описано в разделе «Материалы и методы». При использовании выбранных праймеров в кПЦР со штаммами вирусов семейств Flaviviridaе и Bunyaviridae амплификация не происходила, рост флуоресцентного сигнала не регистрировался, так же как и для образца клеток Vero. Для представителей семейства Alphaviridae — штаммов вирусов Синдбис и ВЭЛ — увеличения флуоресценции в ходе кПЦР также не регистрировалось. Напротив, при использовании РНК штаммов ЧИКВ, относящихся к разным генотипам, наблюдался рост флуоресцентного сигнала с регистрацией значений порогового цикла Ct≤36 в зависимости от титра вируса. При электрофоретическом анализе реакционной смеси после ОТ-ПЦР-РВ наблюдали наличие ампликонов, длина которых соответствовала расчетным для ЧИКВ — 218 п.о. Данные результаты подтверждают специфичность выбранных праймеров в отношении всех существующих генотипов ЧИКВ.
Чувствительность кПЦР. Раствор контрольной плазмиды c расчетной концентрацией 10,48×10¹³ ГЭ/мл использовали как стандарт, который разводили с 10-кратным шагом начиная с концентрации 10¹⁰ ГЭ/мл до 10 ГЭ/мл. Известные концентрации данного стандарта соответствовали определенным значениям порогового цикла Ct. Введение этого типа контроля позволило построить калибровочный график, представленный на рисунке 1 (опубликован на сайте журнала14).
Полученный калибровочный график позволяет определить концентрацию ГЭ/мл по значениям полученных пороговых циклов (Ct). Однако детекция (Ct более 36) наблюдается и при более низких концентрациях ДНК (менее 10⁴ ГЭ/мл), что свидетельствует о наличии ДНК в концентрации менее 50 молекул/25 мкл.
Оценка корреляционной зависимости между значением пороговых циклов РНК кПЦР и титром вируса Чикунгунья в культуре клеток Vero. Для анализа корреляции между значениями проводили исследование в динамике. На основании ранее опубликованных данных была выбрана доза ЧИКВ, которая вызывала полное разрушение монослоя клеток Vero в течение 72 ч — 0,00001 MOI на клетку [29]. В ходе исследования проводили заражение вирусом ЧИКВ монослоя клеток Vero и дальнейший отбор образов культуральной вируссодержащей жидкости через 2, 4, 8, 12, 24, 32, 36 и 48 ч, в которых определяли содержание ЧИКВ титрованием на линии клеток Vero и количества РНК ЧИКВ методом кПЦР.
Через 12 ч после заражения было отмечено появление признаков цитопатического действия ЧИКВ. Далее через 24 ч регистрировали нарушение клеточного монослоя до 25%, через 36 ч — до 50%, а через 48 ч монослой был разрушен более чем на 75%, в связи с чем дальнейшие наблюдения не проводились. Результаты определения титра ЧИКВ на линии клеток Vero и количества РНК ЧИКВ методом кПЦР представлены в таблице 4.
Таблица 4. Динамика изменения количества РНК вируса Чикунгунья (ЧИКВ), определяемого методом ОТ-кПЦР, и титра вируса, регистрируемого после заражения монослоя клеток линии Vero
Тable 4. Time course of changes in the amount of Chikungunya virus (CHIKV) RNA determined by RT-qPCR and the CHIKV titre determined in a monolayer of Vero cells after infection
|
Время, ч Time, h |
Результат ОТ-кПЦР ЧИКВ CHIKV RT-qPCR results |
Титр ЧИКВ, lg TЦД50/мл CHIKV titre, lоg10 TCID50/mL |
|
|
Пороговый цикл флуоресценции, Сt Fluorescence threshold cycle, Ct |
Количество РНК, lg [ГЭ/мл] Quantity of RNA, log10 [GE/mL] |
||
|
0* |
28,5±0,306 |
3,774±0,100 |
3,300±0,069 |
|
2 |
35,3±0,862 |
1,743±0,252 |
0,750±0,012 |
|
4 |
35,4±0,208 |
1,717±0,058 |
0,772±0,017 |
|
8 |
34,0±0,115 |
2,125±0,058 |
1,930±0,348 |
|
12 |
29,0±0,808# |
3,626±0,252 |
4,156±0,089# |
|
24 |
16,9±0,321# |
7,174±0,058# |
7,428±0,023# |
|
32 |
12,9±0,153# |
8,390±0,000# |
8,504±0,067# |
|
36 |
12,6±0,208# |
8,478±0,058# |
8,600±0,127# |
|
48 |
11,8±0,200# |
8,708±0,252# |
8,350±0,144# |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. * — данные на 0 ч представляют собой инфекционный титр ЧИКВ (3,300±0,069 lg ТЦД50/мл), который был использован для заражения монослоя клеток линии Vero; # — p≤0,05 относительно данных на 0 ч. ТЦД50 — тканевая цитопатическая доза, вызывающая гибель 50% клеток; ГЭ — геном-эквивалент. Данные в таблице представлены в виде М±SD.
Note. * The data at Hour 0 represent the infectious CHIKV titre (3.300±0.069 lоg10 TCID50/mL) used for infecting Vero cell monolayer cultures. # p≤0.05 (in comparison with the data at Hour 0). TCID50, tissue culture infective dose causing 50% cell death; GE, genome equivalent. Data are presented as M±SD.
Инфекционный титр ЧИКВ в культуральной жидкости (табл. 4) достоверно увеличивался после 12 ч и достиг максимума через 32 ч с сохранением на данном уровне до конца периода наблюдений. Отсутствие увеличения титра вируса после 32 ч может быть объяснено разрушением клеток Vero, то есть уменьшением субстрата для размножения ЧИКВ. Динамика показателя Ct имела сходную тенденцию — после 12 ч значения Сt уменьшились, что свидетельствовало об увеличении количества РНК ЧИКВ в исследуемых образцах.
Между значениями Ct, полученными методом кПЦР, и титром ЧИКВ в культуре клеток Vero установлена прямая сильная корреляция (r=0,987). Между значениями логарифма концентрации РНК, выраженной в ГЭ/мл, и титром ЧИКВ в культуре клеток Vero выявлена прямая сильная корреляционная зависимость (r=0,991). Таким образом, метод кПЦР позволяет получать достоверную информацию о количестве РНК ЧИКВ, которое положительно и сильно коррелирует с титром ЧИКВ в культуре клеток.
Сравнение результатов анализа полноты инактивации вируса Чикунгунья в культуре клеток Vero и кПЦР. Для оценки чувствительности обоих методов проводили заражение монослоя клеток Vero разными дозами вируса ЧИКВ. Множественность заражения составляла: MOI1 — 1:10⁶ клеток; MOI2 — 1:10⁷ клеток; MOI3 — 1:10⁸ клеток. При заражении в дозах MOI1 и MOI2 через 48 ч отмечено нарушение монослоя >75% и наблюдение было остановлено (конец срока наблюдения). Собранные в конце этого срока образцы вируссодержащей культуральной жидкости использовали для определения титра ЧИКВ в культуре клеток и количества РНК ЧИКВ методом кПЦР. В результате были получены данные, представленные в таблице 5. При отсутствии очевидной разницы при оценке цитопатического эффекта ad oculus титрование ЧИКВ в культуре клеток Vero выявило достоверную разницу между содержанием ЧИКВ при заражении клеточного монослоя в дозах MOI1 и MOI2 (р<0,05). При использовании дозы MOI3 в двух последовательных пассажах в течении 5 сут цитопатического эффекта в монослое клеток Vero не отмечали, и наблюдение было остановлено (конец срока наблюдения). При титровании образца ЧИКВ, полученного после первого пассажа при использовании дозы MOI3, в первом разведении в одной из лунок под микроскопом отметили изменение клеток без очевидного цитопатического эффекта. Данный результат оценили как сомнительный. При проведении второго пассажа нарушений монослоя не выявили, а при титровании образца на клетках Vero титр ЧИКВ не был определен и результат был расценен как отрицательный.
Таблица 5. Kоличество РНК вируса Чикунгунья (ЧИКВ), определяемое методом ОТ-кПЦР, и титр ЧИКВ, регистрируемый в клетках линии Vero в вируссодержащих образцах после заражения монослоя клеток Vero разными дозами ЧИКВ
Table 5. Chikungunya virus (CHIKV) RNA measurements by RT-qPCR and the CHIKV titre in virus-containing samples determined after infection of Vero cell monolayer cultures with different doses of CHIKV
|
Номер образца Sample number |
Характеристика образца (1 мл) Sample description (1 mL) |
||||
|
Доза заражения# Infectious dose# |
Титр ЧИКВ, lg ТЦД50/мл CHIKV titre, log10 ТCID50/mL |
Результат ОТ-кПЦР ЧИКВ CHIKV RT-qPCR results |
|||
|
Пороговый цикл флуоресценции, Сt Fluorescence threshold cycle, Ct |
Количество РНК, lg [ГЭ/мл] Quantity of RNA, log10 [GE/mL] |
||||
|
1 |
MOI1 |
8,725±0,125 |
11,46±0,200 |
8,8±0,100 |
|
|
2 |
MOI2 |
7,975±0,067* |
13,20±0,153** |
8,3±0* |
|
|
3 |
MOI3 |
1 пассаж Passage 1 |
≤1 |
33,06±0,251 |
2,4±0 |
|
4 |
2 пассаж Passage 2 |
Отсутствует Not present |
35,10±0,200*** |
1,8±0,306**** |
|
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. MOI — множественность заражения; ТЦД50 — тканевая цитопатическая доза, вызывающая гибель 50% клеток; ГЭ — геном-эквивалент. # — MOI1 — 1:10⁶ клеток; MOI2 — 1:10⁷ клеток; MOI3 — 1:10⁸ клеток. * — p<0,05 относительно образца MOI1; ** — p<0,003 относительно образца MOI1; *** — p<0,005 относительно образца MOI3 в 1 пассаже; **** — p<0,02 относительно образца MOI3 в 1 пассаже. Данные в таблице представлены в виде М±SD.
Note. MOI, multiplicity of infection; TCID50, tissue culture infective dose causing 50% cell death; GE, genome equivalent.
# MOI1 = 1:10⁶ cells, MOI2 = 1:10⁷ cells, and MOI3 = 1:10⁸ cells. * p<0.05 (in comparison with MOI1), ** p<0.003 (in comparison with MOI1), *** p<0.005 (in comparison with MOI3 at Passage 1), **** p<0.02 (in comparison with MOI3 at Passage 1). Data are presented as M±SD.
При сравнении соответствующих значений Ct в образцах, собранных после заражения клеточного монослоя дозами MOI1 и MOI2, разница также была достоверной, но более значимой (р<0,003), чем между соответствующими титрами ЧИКВ. Данный факт позволил предположить, что метод кПЦР является более чувствительным. Падение содержания РНК ЧИКВ во 2 пассаже относительно 1 пассажа при заражении монослоя дозой MOI3 можно объяснить разведением образца. При этом разница в показателях Ct была статистически достоверна. При сравнении количества геном-эквивалентов (ГЭ/мл) образцов, собранных после заражения дозам MOI2 и MOI1, разница была достоверна (p<0,05). Для образца, полученного при дозе MOI3, количество геном-эквивалентов в образцах 2 пассажа было достоверно ниже, чем в образце 1 пассажа (p<0,02). Таким образом, проведение двух пассажей вируссодержащей культуральной жидкости с последующим исследованием образцов методом кПЦР и их сравнением между собой позволило подтвердить отсутствие репликации ЧИКВ.
Далее в основном эксперименте исследовали полноту инактивации ЧИКВ в образцах, указанных в таблице 1. Наблюдение за монослоем продолжали в течение 5 сут. Результаты исследования данных образцов вируссодержащей культуральной жидкости представлены в таблице 6.
Таблица 6. Количество РНК вируса Чикунгунья (ЧИКВ), определяемого методом ОТ-кПЦР, и титр ЧИКВ, регистрируемый в клетках линии Vero в образцах вируссодержащей культуральной жидкости (1 мл), собранных на разных технологических этапах
Table 6. Chikungunya virus (CHIKV) RNA measurements by RT-qPCR and CHIKV titre determined in Vero cells using virus-containing culture fluid samples (1 mL) collected at different stages of vaccine production
|
Номер образца Sample number |
Описание образца Sample description |
Титр ЧИКВ, CHIKV titre, |
Результат ОТ-кПЦР ЧИКВ CHIKV RT-qPCR results |
|
|
Пороговый цикл флуоресценции, Сt Fluorescence threshold cycle, Ct |
Количество РНК, Quantity of RNA, |
|||
|
1 |
Вируссодержащая культуральная жидкость до инактивации β-пропиолактоном Virus-containing culture fluid before β-propiolactone inactivation |
7,628±0,067 |
14,80±0,200 |
7,829±0,021 |
|
2 |
Вируссодержащая культуральная жидкость после инактивации β-пропиолактоном Virus-containing culture fluid after β-propiolactone inactivation |
Без нарушения монослоя No cell monolayer disruption |
21,10±0,320* |
5,952±0,042* |
|
3 |
Вируссодержащая культуральная жидкость после 1 пассажа образца № 2 на клетках Vero Virus-containing culture fluid after Passage 1 of Sample 2 in Vero cells |
Без нарушения монослоя No cell monolayer disruption |
26,10±0,610** |
4,488±0,146** |
|
4 |
Вируссодержащая культуральная жидкость после 2 пассажа образца № 2 на клетках Vero Virus-containing culture fluid after Passage 2 of Sample 2 in Vero cells |
Без нарушения монослоя No cell monolayer disruption |
30,50±0,208** |
3,099±0,105** |
|
5 |
Суспензия клеток Vero Vero cell suspension |
Не приемлемо Not applicable |
≥40 |
Отсутствует Not present |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ТЦД50 — тканевая цитопатическая доза, вызывающая гибель 50% клеток; ГЭ — геном-эквивалент. * — p<0,0005 относительно образца № 1; ** — p<0,005 относительно предыдущего образца. Данные в таблице представлены в виде М±SD.
Note. TCID50, tissue culture infective dose causing 50% cell death; GE, genome equivalent. * p<0.0005 (in comparison with Sample 1), ** p<0.005 (in comparison with the previous sample). Data are presented as M±SD.
В образце вируссодержащей культуральной жидкости, полученном до инактивации β-пропиолактоном, выявлен цитопатический эффект, определен титр ЧИКВ, зарегистрированы показатель Ct и количество геном-эквивалентов (табл. 6). В образцах, полученных после применения β-пропиолактона, при заражении монослоя клеток Vero как при первом, так и при втором пассаже цитопатического эффекта не выявлено. При этом показатель Ct увеличился, а количество геном-эквивалентов уменьшилось. Объяснить данный факт можно следующим образом. Инактивированный препарат в любом случае имеет вирусную РНК, однако при последовательных пассажах происходит разведение образца, содержащего РНК ЧИКВ, и, соответственно, пороговые циклы регистрируются позже. Разница между показателем Ct до инактивации и после инактивации ЧИКВ статистически достоверна (p<0,0005). Количество геном-эквивалентов до инактивации и после инактивации также статистически достоверно уменьшается (p<0,0005).
В случае неполной инактивации β-пропиолактоном ЧИКВ происходило бы накопление вирусной РНК в течение 5 сут наблюдения за монослоем и, соответственно, флуоресценция появлялась бы раньше, при этом показатель Ct уменьшался, а количество геном-эквивалентов увеличивалось. Данных изменений в эксперименте не отмечали.
Таким образом, при контроле полноты инактивации в случае отрицательного или сомнительного результата in vitro проведение кПЦР дает дополнительную информацию для подтверждения отсутствия инфекционного вируса. Данный метод также исключает получение ложноположительных результатов, так как накопление РНК происходит только за счет инфекционного вируса. Применение метода ИКМ-кПЦР-РВ с проведением как минимум двух пассажей вируссодержащего образца в комбинации с кПЦР является убедительно информативным и специфичным, что особенно важно в случае неоднозначных результатов при использовании метода in vitro. Большинство исследователей отмечают, что длительность пассирования исследуемых образцов должна быть оптимальной, чтобы вирусные частицы, при их наличии, имели возможность достаточно размножиться, чтобы тем самым повысить чувствительность метода [10][27].
В качестве альтернативного традиционному культуральному методу данный метод предложен для детекции инфекционного аденовируса после дезинфекции ультрафиолетовым облучением [28]. Безусловно, метод требует тщательной валидации для получения данных по показателям Ct, которые бы однозначно подтверждали отсутствие размножения вируса (после инактивации) в образах после пассажей на чувствительной линии клеток.
Подтверждение подлинности штамма вируса Чикунгунья Nika21 с использованием реакции нейтрализации и ОТ-ПЦР-ПДРФ
Реакция нейтрализации. РН рекомендована для подтверждения подлинности вакцинных штаммов. Специфичность РН оценивали на примере штамма ЧИКВ Nika21 c использованием охарактеризованных образцов сывороток, в том числе специфических. Результаты проведения РН представлены в таблице 7. Максимальные показатели, ожидаемо, наблюдали в РН с образцами специфических сывороток. Минимальные показатели отмечены в реакции с образцами сыворотки группы «Контроль».
Таблица 7. Результаты реакции нейтрализации (РН) с использованием образцов сывороток и вирусов Чикунгунья (ЧИКВ), ВЭЛ и Синдбис
Table 7. Results of virus neutralisation (VN) assays using serum samples and Chikungunya (CHIKV), Venezuelan Equine Encephalitis (VEE), and Sindbis viruses
|
Вирус, использованный в РН Viruses used in VN assays |
Результаты РН, полученные при использовании образцов сывороток в группах# VN assay results for the following groups of serum samples# |
|||
|
Образцы сывороток группы «ЧИКВ» CHIKV group n=5 |
Образцы сывороток группы «ВЭЛ» VEE group n=5 |
Образцы сывороток группы «Синдбис» Sindbis group n=5 |
Образцы сывороток группы «Контроль»## Control group## n=5 |
|
|
ЧИКВ CHIKV |
6,40±0,18* |
4,60±0,18 |
4,00±0,38 |
1,80±0,18* |
|
ВЭЛ VEE |
3,80±0,38 |
5,20±0,38* |
3,60±0,18 |
1,40±0,38* |
|
Синдбис Sindbis |
3,20±0,18 |
2,80±0,18 |
4,60±0,18* |
1,80±0,18* |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. n — количество образцов сывороток в группе; # — образцы сывороток, содержащих только антитела к ЧИКВ (группа «ЧИКВ»), антитела к вирусу ВЭЛ (группа «ВЭЛ»), антитела к вирусу Синдбис (группа «Синдбис»); ## — образцы сывороток здоровых добровольцев, не содержащих антитела к ЧИКВ, ВЭЛ и вирусу Синдбис; * — p<0,05 относительно остальных групп сывороток. Данные в таблице представлены в виде значений log2 (M±m).
Note. n, number of serum samples per group. The samples marked with # contained antibodies only to CHIKV (CHIKV group), VEE (VEE group), or Sindbis (Sindbis group), and the samples marked with ## were obtained from healthy volunteers and contained no IgG against CHIKV, VEE, or Sindbis viruses. * p<0.05 (in comparison with other groups of sera). Data are presented as log2 (M±m).
Образцы специфических сывороток группы «ЧИКВ» оказывали вирус-нейтрализующее действие по отношению к каждому из использованных в эксперименте вирусов семейства Alphaviridae, хотя титр антител к ЧИКВ достоверно (p<0,001) превосходил этот показатель в отношении вирусов Синдбис и ВЭЛ. Аналогичная ситуация наблюдалась и для образцов сывороток других групп. Таким образом, выявлено наличие разной степени серологического перекреста между использованными в эксперименте вирусами Alphaviridae, то есть сыворотка, обладающая вируснейтрализующей активностью в отношении одного альфа-вируса, проявляла перекрестную реакцию нейтрализации с другим альфа-вирусом. Данный факт ограничивает возможность применения РН для подтверждения подлинности штамма ЧИКВ в нашем эксперименте. Результатом проведенного анализа может быть только факт подтверждения принадлежности исследуемого вируса к семейству альфа-вирусов.
Полученные результаты не противоречат ранее опубликованным данным о наличии серологического перекреста между представителями альфа-вирусов: Чикунгунья-Синдбис, ВЭЛ-Синдбис, Чикунгунья-ВЭЛ [21][29][30]. Данный феномен не позволяет при применении РН подтвердить конкретный вирусный штамм, но подтверждает принадлежность конкретного штамма вируса к семейству. Ранее этот феномен был продемонстрирован для парамикcовирусов и матонавирусов [12][13][15].
Подтверждение подлинности штамма вируса Чикунгунья Nika21 методом ОТ-ПЦР-ПДРФ. Из всех отобранных образцов (табл. 1) выделяли РНК, проводили ОТ-ПЦР и полученный продукт «обрабатывали» рестриктазой DraI. Полученные результаты представлены на рисунке 2.
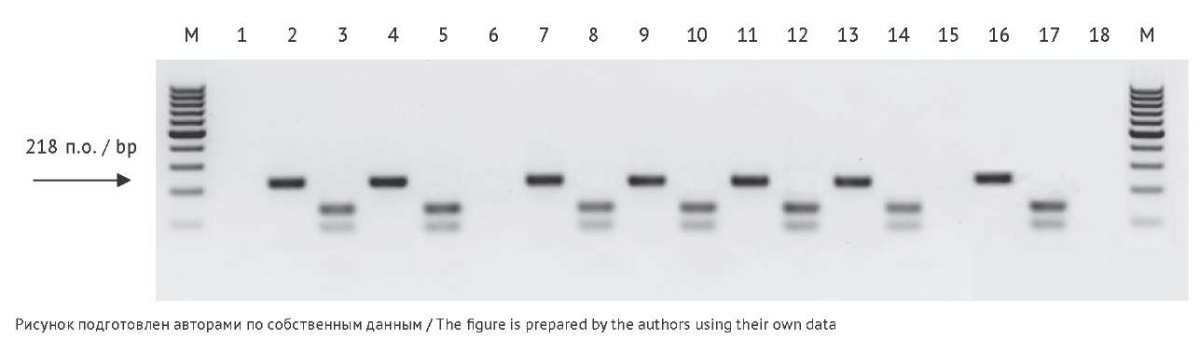
Рис. 2. Электрофоретический анализ гидролизованных рестриктазой DraI ПЦР-продуктов, полученных в результате амплификации нуклеиновых кислот, выделенных из образцов, содержащих и не содержащих РНК вируса Чикунгунья (ЧИКВ), штамм Nika21. Дорожки на электрофореграмме: М — ДНК-маркер 100 п.о.; 1, 6 — лизат клеток Vero; 2 — ампликон ЧИКВ до инактивации β-пропиолактоном; 3 — результат гидролиза DraI ампликона ЧИКВ до инактивации β-пропиолактоном; 4 — ампликон ЧИКВ после инактивации β-пропиолактоном; 5 — результат гидролиза DraI ампликона ЧИКВ после инактивации β-пропиолактоном; 7 — ампликон инактивированного ЧИКВ после 1 пассажа на клетках Vero; 8 — результат гидролиза DraI ампликона, инактивированного ЧИКВ после 1 пассажа на клетках Vero; 9 — ампликон инактивированного ЧИКВ после 2 пассажа на клетках Vero; 10 — результат гидролиза DraI ампликона, инактивированного ЧИКВ после 2 пассажа на клетках Vero; 11 — ампликон инактивированного ЧИКВ до сорбции; 12 — результат гидролиза DraI ампликона, инактивированного ЧИКВ до сорбции; 13 — ампликон, полученный при десорбции инактивированного ЧИКВ; 14 — результат гидролиза DraI ампликона, полученного при десорбции инактивированного ЧИКВ; 15 — отрицательный контроль выделения; 16 — К+ ПЦР (плазмида); 17 — К+ ПЦР (DraI); 18 — отрицательный контрольный образец.
Fig. 2. Electrophoretic analysis of DraI-cleaved PCR products obtained by amplification of nucleic acids isolated from samples containing or not containing RNA of the Chikungunya virus (CHIKV) Nika21 strain. Electropherogram lanes: M, DNA marker of 100 bp; 1 and 6, Vero cell lysate; 2, CHIKV amplicon before β-propiolactone inactivation; 3, DraI-cleaved CHIKV amplicon before β-propiolactone inactivation; 4, CHIKV amplicon after β-propiolactone inactivation; 5, DraI-cleaved CHIKV amplicon after β-propiolactone inactivation; 7, amplicon of inactivated CHIKV after Passage 1 in Vero cells; 8, DraI-cleaved amplicon of inactivated CHIKV after Passage 1 in Vero cells; 9, amplicon of inactivated CHIKV after Passage 2 in Vero cells; 10, DraI-cleaved amplicon of inactivated CHIKV after Passage 2 in Vero cells; 11, amplicon of inactivated CHIKV before adsorption; 12, DraI-cleaved amplicon of inactivated CHIKV before adsorption; 13, amplicon obtained by desorption of inactivated CHIKV; 14, DraI-cleaved amplicon obtained by desorption of inactivated CHIKV; 15, negative control for isolation; 16, positive control PCR (plasmid); 17, positive control PCR (DraI); 18, negative control sample.
Все полученные в реакции ОТ-ПЦР продукты (расчетной длиной 218 п.о.) подверглись гидролизу рестриктазой DraI с образованием ожидаемых фрагментов — 133 и 85 п.о. (рис. 2, табл. 3). В образцах клеток Vero (отрицательный контроль) ни один фрагмент не был амплифицирован. Таким образом, подлинность штамма Nika21 (генотип ECSA) подтверждена на всех этапах получения готового адсорбированного антигена.
Генотипирование является единственным способом отличить вакцинные штаммы от вирусов дикого типа. Это становится особенно критичным во время вспышки вакциноуправляемых инфекций, а также в случае расследования поствакцинальных осложнений. Генотипирование можно проводить с применением метода ОТ-ПЦР-ПДРФ, который является быстрым, эффективным и информативным. Метод ОТ-ПЦР-ПДРФ, разработанный для подтверждения подлинности вакцинного штамма, может быть эффективно использован с целью дискриминации вакцинного штамма от дикого, как, например, было предложено для вируса паротита [15]. Этот же метод был успешно применен для дискриминации вакцинного штамма ветеринарного препарата при расследовании эпидемии вируса птичьего ларинготрахеита [31].
Полученные результаты свидетельствуют о том, что молекулярно-генетические методы, в частности ОТ-ПЦР в реальном времени и с электрофоретической детекцией, и метод ПДРФ могут быть применены для контроля подлинности штамма на любых этапах производства инактивированных вакцин. Комбинированный метод ОТ-ПЦР-ПДРФ позволяет отнести исследуемый вирус к конкретному штамму и таким образом подтвердить его принадлежность именно к вакцинному штамму. Указанный метод также позволяет дополнительно оценить полноту сорбции антигена в вакцине.
ЗАКЛЮЧЕНИЕ
При контроле качества технологических этапов производства вакцин критично не только время проведения анализов, но и достоверность полученных результатов. В данном исследовании продемонстрированы возможности и преимущества применения интегрированной с культуральным методом количественной ПЦР с детекцией в режиме реального времени для оценки полноты инактивации антигена вакцинного штамма, а также метода обратной транскрипции — ПЦР с последующей оценкой полиморфизма длин рестрикционных фрагментов для подтверждения подлинности штамма вируса. Использованные методы показали себя как более чувствительные и быстрые относительно культуральных методов, также продемонстрирована возможность их применения на любых этапах технологического процесса производства инактивированных вакцин.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.С. Оксанич — дизайн, разработка и проведение молекулярно-биологических исследований, написание и критический анализ текста рукописи; Т.Г. Самарцева — проведение экспериментальных исследований, подготовка текста рукописи; К.В. Каа — участие в экспериментальных исследованиях; анализ результатов исследований; Е.В. Отрашевская — анализ и интерпретация результатов исследований; статистическая обработка данных; написание текста рукописи; А.Г. Красько — проведение экспериментальных исследований; анализ и обобщение результатов исследований; А.Г. Лапутина — участие в экспериментальных исследованиях; Н.А. Нетесова — обоснование концепции исследования, обобщение результатов исследования, критический пересмотр текста рукописи; Г.М. Игнатьев — обоснование концепции исследования, разработка дизайна исследования, проведение экспериментальных работ, написание и редактирование текста рукописи.
Дополнительная информация. На сайте журнала «БИОпрепараты. Профилактика, диагностика, лечение» размещены: таблица 2, 3, рисунок 1.
https://doi.org/10.30895/2221-996X-2024-24-3-279-293-table2
https://doi.org/10.30895/2221-996X-2024-24-3-279-293-table3
https://doi.org/10.30895/2221-996X-2024-24-3-279-293-fig1
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.S. Oksanich designed and conducted molecular biological experiments, drafted and critically analysed the manuscript. T.G. Samartseva conducted experiments and drafted the manuscript. K.V. Kaa conducted experiments and analysed the study results. E.V. Otrashevskaia analysed and interpreted the study results, conducted statistical analysis, and drafted the manuscript. A.G. Krasko conducted experiments, analysed and summarised the study results. A.G. Laputina conducted experiments. N.A. Netesova substantiated the study concept, summarised the study results, and critically revised the manuscript. G.M. Ignatyev substantiated the study concept, designed the study, conducted experiments, drafted and edited the manuscript.
Additional information. Table 2, Table 3, and Figure 1 are published on the website of Biological Products. Prevention, Diagnosis, Treatment.
https://doi.org/10.30895/2221-996X-2024-24-3-279-293-table2
https://doi.org/10.30895/2221-996X-2024-24-3-279-293-table3
https://doi.org/10.30895/2221-996X-2024-24-3-279-293-fig1
1. ОФС.1.7.1.0004.15 Вакцины и анатоксины. Государственная фармакопея Российской Федерации. XIV изд. Т. 2; 2018.
2. ФС.3.3.1.0014.15 Вакцина лептоспирозная концентрированная инактивированная жидкая, суспензия для подкожного введения. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
3. ФС.3.3.1.0028.20 Вакцина гриппозная инактивированная. Государственная фармакопея Российской Федерации. XIV изд. (введена приказом Министерства Здравоохранения Российской Федерации № 751 от 28.07.2200).
4. ФС.3.3.1.0034.15 Вакцина оспенная инактивированная. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
5. ФС.3.3.1.0025.15 Вакцина антирабическая культуральная концентрированная очищенная инактивированная. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
6. ФС.3.3.1.0031.15 Вакцина клещевого энцефалита культуральная очищенная концентрированная инактивированная жидкая сорбированная или сухая в комплекте с растворителем алюминия гидроксида. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
7. ФС.3.3.1.0034.15 Вакцина оспенная инактивированная. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
8. https://clinicaltrials.gov/study/NCT04566484
9. Code of Federal Regulations. Title 21. Section 601.91. Approval based on evidence of effectiveness from studies in animals. Washington DC: FDA; 2020.
10. https://www.ncbi.nlm.nih.gov/nuccore/OQ320495
11. https://www.ncbi.nlm.nih.gov/genbank/
12. https://doi.org/10.30895/2221-996X-2024-24-3-279-293-table2
13. https://doi.org/10.30895/2221-996X-2024-24-3-279-293-table3
14. https://doi.org/10.30895/2221-996X-2024-24-3-279-293-fig1
Список литературы
1. Correia Moreira BL, Aparecida Pereira L, Lappas Gimenez AP, Fernandes Inagaki JM, Raboni SM. Development and validation of a real-time RT-PCR assay for the quantification of rabies virus as quality control of inactivated rabies vaccines. J Virol Methods. 2019;270:46–51. https://doi.org/10.1016/j.jviromet.2019.04.025
2. Correia Moreira BL, Gimenez APL, Inagaki JMF, Raboni SM. Inactivated rabies vaccines: Standardization of an in vitro assay for residual viable virus detection. PLoS Negl Trop Dis. 2020;14(3):e0008142. https://doi.org/10.1371/journal.pntd.0008142
3. Zhou J, Ji G, Wen JN, Li J, Sheng W, Guo ZQ, et al. Effective inactivatian test of inactivated hepatitis A vaccine using integrated cell culture/strand-specific reverse transcriptase-poly-merase chain reaction. Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi. 2008;22(6):488–91 (In Chinese). PMID: 19544655
4. Sundaram AK, Ewing D, Liang Z, Jani V, Cheng Y, Sun P, et al. Immunogenicity of adjuvanted psoralen-inactivated SARS-CoV-2 vaccines and SARS-CoV-2 spike protein DNA vaccines in BALB/c mice. Pathogens. 2021;10(5):626. https://doi.org/10.3390/pathogens10050626
5. Li D, Gu AZ, Yang W, He M, Hu X-H, Shi H-C. An integrated cell culture and reverse transcription quantitative PCR assay for detection of infectious rotaviruses in environmental waters. J Microbiol Methods. 2010;82(1):59–63. https://doi.org/10.1016/j.mimet.2010.04.003
6. Gallagher EM, Margolin AB. Development of an integrated cell culture—real-time RT-PCR assay for detection of reovirus in biosolids. J Virol Methods. 2007;139(2):195–202. https://doi.org/10.1016/j.jviromet.2006.10.001
7. Reynolds KA. Integrated cell culture/PCR for detection of enteric viruses in environmental samples. Methods Mol Biol. 2004;268:69–78. https://doi.org/10.1385/1-59259-766-1:069
8. Huang Y, Xiao S, Song D, Yuan Z. Efficacy of disinfectants for inactivation of Ebola virus in suspension by integrated cell culture coupled with real-time RT-PCR. J Hosp Infect. 2022;125:67–74. https://doi.org/10.1016/j.jhin.2022.04.008
9. Kargar M, Sadeghipour S, Nategh R. Environmental surveillance of non-polio enteroviruses in Iran. Virol J. 2009;6:149. https://doi.org/10.1186/1743-422X-6-149
10. Guo X, Wang S, Zhao CL, Li JW, Zhong JY. An integrated cell absorption process and quantitative PCR assay for the detection of the infectious virus in water. Sci Total Environ. 2018;635:964–71. https://doi.org/10.1016/j.scitotenv.2018.04.223
11. Blackmer F, Reynolds KA, Gerba CP, Pepper IL. Use of integrated cell culture-PCR to evaluate the effectiveness of poliovirus inactivation by chlorine. Appl Environ Microbiol. 2000;66(5):2267–8. https://doi.org/10.1128/aem.66.5.2267-2268.2000
12. Игнатьев ГМ, Отрашевская ЕВ, Суханова ЛЛ, Сидоренко ЕС, Нетесова НА. Молекулярно-генетическое исследование штамма RA-27/3, используемого для производства вакцины против краснухи. Журнал микробиологии, эпидемиологии и иммунобиологии. 2019;(4):38–46. https://doi.org/10.36233/0372-9311-2019-4-38-46
13. Игнатьев ГМ, Отрашевская ЕВ, Суханова ЛЛ, Сидоренко ЕС, Нетесова НА. Молекулярно-генетическое исследование штамма Ленинград-16, используемого для производства вакцины кори. Журнал микробиологии, эпидемиологии и иммунобиологии. 2020;(2):182–9. https://doi.org/10.36233/0372-9311-2020-97-2-182-189
14. Loparev VN, Argaw T, Krause PR, Takayama M, Schmid DS. Improved identification and differentiation of varicellazoster virus (VZV) wild-type strains and an attenuated varicella vaccine strain using a VZV open reading frame 62-based PCR. J Clin Microbiol. 2000;38(9):3156–60. https://doi.org/10.1128/jcm.38.9.3156-3160.2000
15. Кулак МВ, Белавин ПА, Нетесова НА, Юнасова ТН, Голикова ЛН, Бектемиров ТА, Игнатьев ГМ. Дифференциация вакцинного штамма Л-3 от других штаммов вируса паротита методом ОТ-ПЦР. БИОпрепараты. Профилактика, диагностика, лечение. 2008;(4):7–10. EDN: SATPMF
16. Игнатьев ГМ, Оксанич АС, Антонова ЛП, Самарцева ТГ, Мосолова СВ, Мефед КМ и др. Молекулярно-генетическое исследование стабильности и подтверждение подлинности штамма Внуково-32, применяемого для производства вакцины антирабической культуральной концентрированной очищенной инактивированной сухой. БИОпрепараты. Профилактика, диагностика, лечение. 2020;20(2):107–15. https://doi.org/10.30895/2221-996X-2020-20-2-107-115
17. Отрашевская ЕВ, Трухин ВП, Меркулов ВА, Игнатьев ГМ. Прогресс в разработке вакцин для профилактики лихорадки Чикунгунья и перспективы появления на рынке. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(1):42–64. https://doi.org/10.30895/2221-996X-2023-23-1-42-64
18. Schrauf S, Tschismarov R, Tauber E, Ramsauer K. Current efforts in the development of vaccines for the prevention of Zika and Chikungunya virus infections. Front Immunol. 2020:11:592–612. https://doi.org/10.3389/fimmu.2020.00592
19. Tiwari M, Parida M, Santhosh SR, Khan M, Dash PK, Rao PV. Assessment of immunogenic potential of Vero adapted formalin inactivated vaccine derived from novel ECSA genotype of Chikungunya virus. Vaccine. 2009:27(18):2513–22. https://doi.org/10.1016/j.vaccine.2009.02.062
20. Kumar M, Sudeep AB, Arankalle VA. Evaluation of recombinant E2 protein-based and whole-virus inactivated candidate vaccines against Сhikungunya virus. Vaccine. 2012:30(43):6142–9. https://doi.org/10.1016/j.vaccine.2012.07.072
21. Отрашевская ЕВ, Казакова ЕВ, Жиренкина ЕН, Трухин ВП, Игнатьев ГМ. Ретроспективный серологический анализ распространения флавивирусных лихорадок и лихорадки Чикунгунья в Никарагуа — авидность специфических антител как инструмент дифференциальной диагностики. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(2):215–24. https://doi.org/10.36233/0372-9311-196
22. Лукин ЕП, Черникова НК. Продолжительность гуморального поствакцинального и постинфекционного иммунитета к вирусу венесуэльского лошадиного энцефаломиелита. Вопросы вирусологии. 1993;(2):71–4.
23. Каа КВ, Игнатьев ГМ, Синюгина АА, Ишмухаметов АА. Чувствительность клеточных линий к вирусу Чикунгунья и подбор метода наработки вирусного материала в промышленных объемах. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(1):11–20. https://doi.org/10.30895/2221-996X-2023-23-1-111-120
24. Игнатьев ГМ, Каа КВ, Антонова ЛП, Отрашевская ЕВ, Ишмухаметов АА. Иммуногенныe свойства препарата, содержащего инактивированный β-пропиолактоном антиген вируса Чикунгунья. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;(5):519–27. https://doi.org/10.36233/0372-9311-159
25. Оксанич АС, Красько АГ, Самарцева ТГ, Гасич ЕЛ, Игнатьев ГМ. Применение количественного иммуноферментного анализа для определения концентрации S-антигена в цельновирионных инактивированных адсорбированных коронавирусных вакцинах. БИОпрепараты. Профилактика, диагностика, лечение. 2022;22(4):403–15. https://doi.org/10.30895/2221-996X-2022-22-4-405-413
26. Frolov I, Frolova EI. Molecular virology of Chikungunya virus. Curr Top Microbiol Immunol. 2022;435:1–31. https://doi.org/10.1007/82_2018_146
27. Ryu H, Schrantz KA, Brinkman NE, Boczek LA. Applicability of integrated cell culture reverse transcriptase quantitative PCR (ICC-RTqPCR) for the simultaneous detection of the four human enteric enterovirus species in disinfection studies. J Virol Methods. 2018;258:35–40. https://doi.org/10.1016/j.jviromet.2018.05.008
28. Ryu H, Cashdollar JL, Fout G, Schrantz KA, Hayes S. Applicability of integrated cell culture quantitative PCR (ICC-qPCR) for the detection of infectious adenovirus type 2 in UV disinfection studies. J Environ Sci Health A Tox Hazard Subst Environ Eng. 2015;50(8):777–87. https://doi.org/10.1080/10934529.2015.1019795
29. Paessler S, Weaver SC. Vaccines for Venezuelan equine encephalitis. Vaccine. 2009;27 Suppl 4:D80–5. https://doi.org/10.1016/j.vaccine.2009.07.095
30. Ryder S, Perez M, Avila J, Briceno A. Deteccion de anticuerpos al virus de la encephalitis equine venezolana en equidos de los Distritos Mara y Paez de la Guajira Venezolana. 1984. I. Evaluacion prevacuna. Investigacion Clinica. 2013;28(4).
31. Kim HR, Kang MS, Kim MJ, Lee HS, Kwon YK. Restriction fragment length polymorphism analysis of multiple genome regions of Korean isolates of infectious laryngotracheitis virus collected from chickens. Poult Sci. 2013;(8):2053–8. https://doi.org/10.3382/ps.2013-03134
Об авторах
А. С. ОксаничРоссия
Оксанич Алексей Сергеевич, канд. биол. наук
Малый Казенный пер., д. 5а, 105064, Москва
Т. Г. Самарцева
Россия
Самарцева Татьяна Геннадьевна
Малый Казенный пер., д. 5а, 105064, Москва
К. В. Каа
Россия
Каа Константин Владимирович
Ул. Погодинская д. 10, стр. 1, Москва, 119121
Е. В. Отрашевская
Россия
Отрашевская Елена Викторовна
Малый Казенный пер., д. 5а, 105064, Москва
А. Г. Красько
Беларусь
Красько Анатолий Геннадиевич, канд. мед. наук
Ул. Филимонова, д. 23, г. Минск, 220114
А. Г. Лапутина
Россия
Лапутина Армине Германовна
Малый Казенный пер., д. 5а, 105064, Москва
Н. А. Нетесова
Россия
Нетесова Нина Александровна, д-р биол. наук
АБК, к. 12а, Кольцово, Новосибирская область, 630559
Г. М. Игнатьев
Россия
Игнатьев Георгий Михайлович, д-р мед. наук, проф.
Малый Казенный пер., д. 5а, 105064, Москва; ул. Свободы, д. 52, г. Красное Село, Санкт-Петербург, 198320
Дополнительные файлы

|
1. Таблица 2. Структура олигонуклеотидов для проведения полимеразной цепной реакции с обратной транскрипцией в режиме реального времени (ОТ-ПЦР-РВ) вируса Чикунгунья | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(735KB)
|
Метаданные ▾ | |

|
2. Таблица 3. Сайты рестрикции в амплифицируемом фрагменте гена белка nsP1 разных генотипов вируса Чикунгунья (ЧИКВ) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(736KB)
|
Метаданные ▾ | |

|
3. Рис. 1. Зависимость показателя порогового цикла флуоресценции (Ct) от концентрации стандарта (плазмидная ДНК, содержащая последовательность гена белка nsP1 вируса Чикунгунья). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(514KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Оксанич А.С., Самарцева Т.Г., Каа К.В., Отрашевская Е.В., Красько А.Г., Лапутина А.Г., Нетесова Н.А., Игнатьев Г.М. Молекулярно-генетические методы контроля качества инактивированных вакцин на модели вируса Чикунгунья: подлинность штамма и полнота инактивации вируса. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(3):279-293. https://doi.org/10.30895/2221-996X-2024-24-3-279-293
For citation:
Oksanich A.S., Samartseva T.G., Kaa K.V., Otrashevskaia E.V., Krasko A.G., Laputina A.G., Netesova N.A., Ignatyev G.M. Molecular genetic methods for quality control of inactivated vaccines using a Chikungunya virus model: vaccine strain identification and completeness of virus inactivation. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(3):279-293. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-3-279-293


































