Перейти к:
Требования к материалам раздела по стандартным образцам, представляемым в досье на биологические лекарственные средства
https://doi.org/10.30895/2221-996X-2024-24-1-7-20
Резюме
АКТУАЛЬНОСТЬ. Применение стандартного образца (СО), аттестованного в установленном порядке, является необходимым элементом стандартизации методики и обеспечивает возможность получения сопоставимых результатов при оценке показателей качества лекарственных средств в различных лабораториях, что важно при контроле качества биологических лекарственных средств (БЛС). При государственной регистрации лекарственного средства предусмотрено предоставление сведений о СО, однако конкретные требования к данному разделу досье отсутствуют, что обусловливает актуальность их разработки для дальнейшего включения в соответствующее руководство.
ЦЕЛЬ. Разработка требований к материалам раздела «Стандартные образцы» в досье на биологические лекарственные средства при их регистрации.
ОБСУЖДЕНИЕ. Проведен анализ международной (документы Всемирной организации здравоохранения (ВОЗ) и Евразийского экономического союза) и российской нормативной правовой базы для СО БЛС, документов Международной организации по стандартизации (ISO) и Росстандарта, а также опыта аттестации и применения СО для контроля качества БЛС в ФГБУ «НЦЭСМП» Минздрава России. Рассмотрены особенности аттестации СО для БЛС с учетом различий методик измерений и методик испытания. Сформулированы основные требования к формированию материалов раздела по СО в досье на БЛС. Методики, использующиеся для аттестации СО (методики испытания), должны быть описаны в соответствии с требованиями к написанию стандартной операционной процедуры; необходимые валидационные характеристики методики должны быть установлены в адекватных валидационных исследованиях. Сформулированы требования к аттестации первичных СО для подтверждения структуры рекомбинантных белков новых БЛС. Установление значений аттестованных характеристик и критических показателей качества должно проводиться для СО, технология производства которого описана и соответствует рекомендациям ВОЗ или требованиям надлежащей производственной практики (GMP). Основные этапы аттестации являются общими для всех видов СО. Исследования стабильности СО для установления срока годности должны проводиться методом естественного старения. Ускоренные испытания стабильности могут быть полезны для изучения механизма деградации и влияния кратковременных отклонений от регламентированных условий хранения. В соответствии с рекомендациями ВОЗ должны быть установлены изменения в отношении СО, которые требуют одобрения регуляторным органом.
ЗАКЛЮЧЕНИЕ. Систематизированы требования к формированию материалов раздела по стандартным образцам в досье на биологические лекарственные средства для подготовки соответствующего руководства. Разработка этих требований обеспечит единый подход заявителей, разработчиков лекарственных средств и экспертов уполномоченного органа к подготовке, аттестации, оформлению документов на стандартные образцы и ускорит их рассмотрение при регистрации.
Ключевые слова
Для цитирования:
Волкова Р.А., Фадейкина О.В., Устинникова О.Б., Саркисян К.А., Мовсесянц А.А., Меркулов В.А., Косенко В.В. Требования к материалам раздела по стандартным образцам, представляемым в досье на биологические лекарственные средства. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):7-20. https://doi.org/10.30895/2221-996X-2024-24-1-7-20
For citation:
Volkova R.A., Fadeikina O.V., Ustinnikova O.B., Sarkisyan K.A., Movsesyants A.A., Merkulov V.A., Kosenko V.V. Requirements for the information on reference standards submitted in the dossier for biologicals. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):7-20. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-7-20
Введение
В общих фармакопейных статьях (ОФС) «Стандартные образцы» согласно Государственной фармакопее Российской Федерации (ГФ РФ)1 и Фармакопее Евразийского экономического союза (ЕАЭС)2 приведены общие требования к стандартным образцам (СО) и их классификация по разным признакам, в том числе по природе вещества. В соответствии с ОФС.2.3.11.03 различают первичные и вторичные СО: «первичный стандартный образец — стандартный образец, обладающий необходимыми свойствами для предполагаемого использования, установленными без сравнения с существующими стандартными образцами», «вторичный стандартный образец — стандартный образец со значением свойства, установленным путем сравнения с первичным стандартным образцом».
При контроле качества биологических лекарственных средств (БЛС) стандартные образцы (далее — биологические СО) занимают ключевое место [1–4]. Рекомендации по разработке, изготовлению, утверждению, обращению биологических СО изложены в руководствах Всемирной организации здравоохранения (ВОЗ)4.
Применение СО, аттестованного в установленном порядке, является необходимым элементом стандартизации методики и обеспечивает возможность получения сопоставимых результатов при оценке качества лекарственных средств в различных лабораториях, что имеет важное значение при контроле качества БЛС [5–15].
Обязательное использование СО предусмотрено международными документами в области обращения лекарственных средств5, а также гармонизированными с ними документами ЕАЭС6 и ГФ РФ7. В указанных документах отражены общие положения в отношении СО для контроля БЛС.
Подходы к порядку оценки значения аттестуемой характеристики СО, в том числе в отношении использования статистических методов, изложены в документах Международной организации по стандартизации (International Organisation for Standardisation, ISO, ИСО) — ISO Guide 30, ISO Guide 31, ISO Guide 33, ISO Guide 34, ISO Guide 35. За последнее десятилетие документы ISO были доработаны: ISO Guide 30, ISO Guide 31, ISO Guide 33 обновлены в 2015 г.8, ISO Guide 35 существенно переработан в 2017 г.9 (добавлены аспекты аттестации СО в одной лаборатории с одной методикой и в нескольких лабораториях с разными методиками [16]), а ISO Guide 34 был переработан в международный стандарт ISO 17034:201610 с учетом требований системы менеджмента качества, в который, помимо общих требований к компетентности производителей СО, включены требования к содержанию паспортов и этикеток, к оценке однородности, стабильности и оценке рисков [17]. Отечественная нормативно-методологическая база Государственной системы обеспечения единства измерений в настоящее время в основном гармонизирована с документами ISO по СО (за исключением ISO Guide 35:2017) прежде всего в отношении ряда терминов (в том числе понятий неопределенности и прослеживаемости): приняты межгосударственные стандарты11 (ГОСТ ISO Guide 30-2019, ГОСТ ISO Guide 31-2019, ГОСТ ISO Guide 33-2019) и российские стандарты12 (ГОСТ Р ИСО 17034-2021). В Российской Федерации также приняты стандарты, отражающие специфику отечественной метрологической базы, но не имеющие международных аналогов13: ГОСТ 8.315-2019, ГОСТ Р 8.871-2014 и некоторые другие [18][19].
Необходимо отметить отличие российской нормативной правовой базы от международной: в России действует Государственная система обеспечения единства измерений, которая предусматривает использование государственных стандартных образцов утвержденного типа (ГСО) для передачи единиц измерения в единицах системы СИ и, соответственно, наличие поверочных схем для соответствующего измерительного оборудования.
Однако следует отметить, что переносить систему передачи единиц измерения в единицах системы СИ, для которой имеются первичные эталоны, на другие области не всегда корректно. В частности, это касается области обращения лекарственных средств, в которой все этапы жизненного цикла лекарственных препаратов (от разработки до коммерческого выпуска, применения и утилизации) регламентированы собственными нормативными документами, в том числе международными. Для контроля качества лекарственных средств используются валидированные фармакопейные методики или методики предприятия, которые, как правило, нельзя отнести к методикам измерения. Это, по существу, методики испытания или даже «методы научного познания» [20]. Однако для отдельных видов лекарственных средств, например для имеющих химическое происхождение, рассматривается возможность применения не только фармакопейных СО, но и ГСО [20–23]. По мнению авторов данной статьи, при использовании ГСО, в области применения которых указаны здравоохранение и фармацевтика без необходимой детализации и указания конкретных методик, может существовать ошибочное понимание в отношении возможности их использования без соответствующего обоснования.
При государственной регистрации лекарственного средства предусмотрено предоставление сведений о СО. Общие положения о СО изложены в международных и российских нормативных документах, но отсутствие конкретных требований к данному разделу досье БЛС обусловливает актуальность работы по их формулированию с учетом имеющейся нормативной правовой базы.
Цель работы — разработка требований к материалам раздела «Стандартные образцы» в досье на БЛС при их регистрации.
Особенности аттестации стандартных образцов для контроля качества биологических лекарственных средств
Процедура аттестации СО для контроля качества БЛС характеризуется следующими особенностями: для аттестации СО, как правило, применяют ту же методику, для которой предусмотрено применение данного СО, что определяет зависимость значения аттестуемой характеристики СО и его неопределенности от использующейся методики испытаний, которую не следует называть методикой измерения [4].
Термин «методика измерения» не может быть распространен на все методики, в том числе методики испытаний, каковыми являются большинство фармакопейных методик, использующихся для контроля качества БЛС [1][3][4]. В случае методик измерения СО являются средством передачи единицы измерения, выраженной в единицах системы СИ, при этом возможна оценка как систематической, так и случайной составляющих погрешности измерения. Для методик испытаний следует говорить не о погрешности, а о неопределенности методики. В этом случае средством передачи единицы измерения становится комплекс методики с используемым СО, а сам термин «единица измерения» оказывается условным, так как, в сущности, передается единица некой величины — например содержание какого-либо компонента, установленное определенным методом, или специфическая активность в принятых условных единицах, различающихся для разных методик и объектов испытания. Для методик испытаний раздельное определение систематической и случайной составляющих погрешности невозможно, также невозможно оценить вклад от неоднородности и нестабильности материала СО, а следовательно, невозможно и использование предусмотренного алгоритма расчета погрешности без вынужденных допущений [4]. Поэтому принципиально важным является не только подробное описание всех этапов методики испытания (приготовление растворов реактивов, подготовка пробы, проведение испытаний, оценка результатов и необходимых расчетов, представление результатов) в соответствии с требованиями к написанию стандартной операционной процедуры, но и проведение адекватных валидационных исследований для оценки правильности и прецизионности методики согласно документам ЕАЭС14, в том числе с учетом обновленного документа ICH Q2(R2)15 и нового документа ICH Q1416, посвященного разработке аналитических процедур.
Специфическая активность является одним из важнейших показателей качества БЛС и одной из основных характеристик СО для контроля качества БЛС, при определении которой часто используют методики с применением живых бактерий, вирусов, клеточных культур или животных. Большое количество влияющих факторов обусловливает вариабельность результатов аналитической методики, применяющейся для оценки качества БЛС, в силу чего неопределенность таких методик может быть более 20%. Поэтому для принятия корректных решений как при оценке результатов контроля качества, так и при аттестации и применении СО, а также при анализе рисков важна объективная оценка валидационных характеристик методик испытаний и, соответственно, их неопределенности, особенно методик определения показателей, связанных с эффективностью и безопасностью БЛС [1][4][24].
Работы по производству, аттестации, обращению и применению СО должны проводиться в соответствии с требованиями системы управления качеством17.
Аттестация стандартных образцов для подтверждения подлинности структуры рекомбинантных терапевтических белков
Отличительной особенностью биотехнологических лекарственных средств, представляющих собой рекомбинантные белки, является необходимость подтверждения их подлинности не только на уровне специфической биологической активности, но и на уровне структуры молекулы действующего вещества. Методики оценки подлинности БЛС требуют сравнения с СО и являются качественными по своей сути. Тем не менее для подтверждения подлинности структуры рекомбинантного белка каждой серии продукта требуется применение метода пептидного картирования с УФ-ВЭЖХ детектированием продуктов ферментативного гидролиза белка, а для гликозилированных продуктов — метода картирования гликанов (определения профиля гликанов) с флуоресцентным ВЭЖХ детектированием ферментативно отщепленных, меченых гликанов18 с установлением соотношения определяемых компонентов в сравнении с СО.
Для новых БЛС, как правило, отсутствуют международные или фармакопейные СО, в связи с чем актуальна разработка первичных СО, учитывающая посттрансляционные модификации белковой молекулы или профиль направленной модификации белка, например конъюгирования, которые индивидуальны для каждого продукта. При этом важна максимально полная характеристика СО для обеспечения объективности оценки подлинности и чистоты терапевтического белка [12].
Для испытаний используются различные высокотехнологичные физико-химические методы исследования: ядерный магнитный резонанс, анализ пептидных фрагментов после гидролиза с помощью ВЭЖХ, в том числе с масс-спектрометрическим детектированием, и другие19.
Процедура разработки первичных СО для оценки подлинности структуры молекулы рекомбинантного терапевтического белка должна включать:
- обоснование выбора материала, формы выпуска (объем розлива, концентрация белка, значение рН, наличие или отсутствие стабилизатора) и физического состояния — замороженный раствор/лиофилизат;
- обоснование набора показателей качества в спецификации, которая должна включать в себя не только показатели качества на активную фармацевтическую субстанцию, но и характеристику структуры действующего вещества, установленную при разработке БЛС [12].
Необходимо отметить, что на фоне расширения производства рекомбинантных белков и моноклональных антител в последнее десятилетие в Российской Федерации быстрыми темпами разрабатывается новая группа иммунобиологических препаратов — вакцин на основе модифицированных вирусных векторов. Определение подлинности препаратов данной группы помимо оценки специфической активности требует подтверждения подлинности в сравнении с СО, которым является модифицированный вирус и для которого должна быть установлена нуклеотидная последовательность. Ранее прямое подтверждение нуклеотидной последовательности требовалось для экспрессирующей конструкции, вектора и продуцента рекомбинантного белка при разработке препарата и создании банков вектора и штамма-продуцента. Оценку нуклеотидной последовательности можно отнести к качественному показателю. В работе В.В. Морозовой и соавт. [20] освещена проблема обеспечения метрологической прослеживаемости результатов исследований качественных свойств биологических субстанций, поскольку соответствующие эталоны и ГСО отсутствуют, а специалисты Государственной службы стандартных образцов считают необходимым обеспечить ими любые испытания. В статье упомянуты восемь ГСО биологических субстанций, для двух их них (СО фрагмента митохондриальной ДНК человека и инактивированного штамма «ГК2020/1» коронавируса SARS-CoV-2) авторы предложили методы установления показателя «последовательность нуклеотидов нуклеиновых кислот» в качестве дополнительных аттестованных характеристик. При этом, подчеркивая различия между процессом измерений и процессом исследований качественных свойств, авторы считают перспективным продолжение исследований в направлении разработки концепции оценки прослеживаемости для СО качественных свойств [20], несмотря на то что международное сообщество склоняется для данного вида методов к оценке вероятности правильного определения нуклеотидной последовательности.
На основе материалов, описанных авторами в данной работе и в более ранних публикациях [1][3][4][24], показано, что между методами измерения и любыми методами испытания (методами для контроля качества БЛС) существуют различия. По нашему мнению, актуальной является задача разработки теории, требований и практики применения в российской метрологии инструментов оценки правильности и прецизионности методик испытаний при проведении валидационных исследований, а не обеспечения прослеживаемости результатов исследований качественных свойств.
Установление значений аттестуемых характеристик и критических показателей качества
Установление значений аттестуемых характеристик и критических показателей качества должно проводиться для СО, технология производства которого описана и соответствует рекомендациям ВОЗ или требованиям надлежащей производственной практики (Good Manufacturing Practices, GMP). В руководстве ВОЗ20 даны общие требования к оборудованию, средствам измерений, используемым при производстве СО, однородности материала СО, качеству стекла ампул и флаконов, требованиям к консервантам и наполнителям, а также к параметрам процесса лиофилизации и запайки ампул. Технологический процесс получения СО при необходимости может отличаться от технологического процесса получения БЛС наличием дополнительных стадий очистки или требований при отборе материала. Операции по производству стандартного (референтного) материала необходимо выполнять в соответствии с требованиями GMP и системой качества, принятой на производстве.
Основными этапами аттестации всех видов СО для контроля БЛС согласно международным документам и документам ЕАЭС являются:
- выбор материала СО, формы выпуска, методов оценки качества и аттестации;
- установление значения аттестуемой характеристики и границ его неопределенности (если применимо);
- исследование стабильности и установление срока годности, определение оптимальных условий хранения и транспортирования;
- разработка и утверждение документации на СО (паспорт, инструкция по применению, макет упаковки) в соответствии с системой качества, принятой на предприятии.
Биологическая активность БЛС, как правило, выражается или в условных единицах — МЕ/мл при наличии международных СО, или (при их отсутствии) в других обоснованных единицах (БОЕ/мл, КОЕ/мл, LD50, ТЦД50 и др.), связанных с механизмом действия биологического препарата [5][10].
Для характеристики и аттестации любого СО необходимо использовать валидированные методики21. Эти же методики, как правило, применяются для оценки соответствующих показателей качества БЛС. Материалы по изучению или подтверждению валидационных характеристик методик должны включать все первичные данные и быть оформлены в соответствии с системой качества, принятой на предприятии, а также должны быть доступны для экспертизы при регистрации.
Аттестацию проводят с использованием соответствующих международных или фармакопейных СО при их наличии. При их отсутствии, что характерно для новых лекарственных средств, международными требованиями предусмотрена возможность применения разработанного заявителем собственного первичного референтного/стандартного образца/материала [6]. Для полного доказательства воспроизведения структуры целевого белка в спецификации первичного СО должна быть предусмотрена оценка высокотехнологичным методом дополнительной критичной характеристики, установленной при разработке препарата.
Неопределенностью аттестованного значения СО (в документах Росстандарта используется термин «погрешность») называют параметр, который связан с результатом измерения аттестованного значения СО и характеризует диапазон, в котором может находиться значение аттестованной характеристики СО. В соответствии с ISO Guide 35:2017 неопределенность (uc) следует рассчитывать как сумму всех составляющих неопределенности22 — неопределенности от неоднородности (uh), неопределенности от нестабильности материала (ustab), неопределенности от способа установления значения аттестуемой характеристики (uchar) согласно формуле (1):
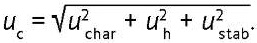 (1)
(1)
Параметр uchar оценивают как сумму систематической и случайной ошибок измерения. При этом составляющие неопределенности невозможно оценить для методов испытаний без использования допущений [4].
При нормальном распределении результатов неопределенность выражают в форме стандартного отклонения, которое называют стандартной неопределенностью (uc), и расширенной неопределенности (Up) — стандартной неопределенности, умноженной на коэффициент охвата 2, то есть 2uc, при уровне доверия ~95%23.
Для получения надежных оценок неопределенности СО необходимо использовать результаты аттестации, полученные не только разными операторами, но и с учетом в максимально возможной степени всех допустимых в методике вариантов проведения испытаний, например применяемого оборудования и реагентов [4][24]. Оценка неопределенности должна быть основана на максимально возможном массиве данных. Для биологического СО неопределенность оценивают по стандартному отклонению методики, которая используется для установления его аттестованного значения. При отсутствии сведений о неопределенности методики неопределенность значения аттестованной характеристики биологических СО (Up) оценивают по стандартному отклонению (Sсо) результатов испытаний в условиях воспроизводимости или промежуточной прецизионности по формуле (2):
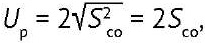 (2)
(2)
где Sсо — стандартное отклонение результатов измерений/испытаний в условиях воспроизводимости или промежуточной прецизионности [4].
Примеры аттестации биологических СО и расчета неопределенности представлены в научной литературе [5][7][8][10].
При применении СО рекомендуется учитывать требования руководства ВОЗ24 по Надлежащей практике для национальных фармацевтических контрольных лабораторий: обязательно наличие записей по работе с СО (идентификация СО, наименование производителя, номер партии/серии, дата утверждения, аттестованные значения, сроки годности, место хранения и другая необходимая информация, например результаты исследования стабильности). Информация об используемых СО должна содержаться в базе данных учреждения (предприятия).
Исследование стабильности стандартных образцов
Исследования стабильности для установления срока годности, условий хранения, транспортирования и применения биологических СО проводят в соответствии с документами ЕАЭС25 и ГФ РФ26. С этой целью разрабатывают программу исследования стабильности, в которой предусматривают продолжительность, периодичность (интервалы), температурные режимы хранения, количество образцов, вид испытаний, количество операторов.
Срок годности устанавливают по результатам изучения стабильности методом естественного старения (в реальном времени). Ускоренные испытания стабильности — это исследования, направленные на увеличение скорости химической деградации/деструкции или физического изменения БЛС путем использования неблагоприятных условий хранения, которые могут быть применены для оценки влияния кратковременных отступлений от заявленных условий хранения. Следует различать ускоренные испытания стабильности и метод ускоренного старения. При исследовании стабильности методом ускоренного старения возможна оценка предполагаемого срока годности, результаты которого следует подтверждать данными изучения стабильности в реальном времени [10].
Продолжительность времени исследования стабильности должна быть не менее предполагаемого срока годности СО.
В Программе исследования стабильности также должно быть предусмотрено изучение восстановленного/разведенного СО, если предполагается возможность непродолжительного хранения после вскрытия емкости. Исследование планируют таким образом, чтобы оно моделировало реальные условия применения, в том числе возможность замораживания и оттаивания СО.
Анализ в стрессовых условиях (например, при повышенной температуре) полезен для оценки влияния кратковременного отклонения от регламентированных условий хранения (например, во время транспортировки). С этой целью может быть применена следующая схема изучения стабильности в стрессовых условиях. До проведения исследования проводят контроль значения аттестованной характеристики и по всем показателям спецификации (например, описание, внешний вид, подлинность, для лиофилизатов — растворимость, потеря в массе при высушивании, вода (по Фишеру), средняя масса, отклонение от средней массы и др.).
В начале срока годности СО выдерживают при повышенной температуре (например, 25±2 и 37±2 °С) в течение 10 и 30 сут, затем исследуют в два этапа. Первую часть ампул анализируют непосредственно по истечении каждого периода температурного воздействия. Вторую часть образцов, подвергшихся воздействию повышенной температуры, продолжают хранить в регламентированных условиях до истечения срока годности. На исходе срока годности проводят контроль СО, подвергшихся температурному воздействию, в сравнении с контрольными экземплярами. Контрольными образцами в испытаниях служат образцы, хранящиеся в течение всего срока годности в регламентированных условиях (например, при температуре от 2 до 8 °С).
Контролируемый показатель — значение аттестованной характеристики. Дополнительные показатели: описание; внешний вид; для лиофилизатов — растворимость, потеря в массе при высушивании и/или вода (по Фишеру).
Показатели температуры и влажности помещений и, при необходимости, другие параметры должны быть зарегистрированы.
Результаты исследования стабильности оформляют в соответствии с системой качества, принятой на предприятии. По результатам исследования должны быть сформулированы требования к материалам первичной и вторичной упаковки, герметичности, защите от воздействия света, наличию остаточного количества воздуха и его компонентов в первичной упаковке после укупорки или запаивания, а также необходимые ограничения по температурному режиму хранения.
При использовании в качестве кандидата в СО одной из серий готового препарата требования к материалу первичной и вторичной упаковки, герметичности, защите от воздействия света, необходимые ограничения по температурному режиму хранения, а также срок годности аттестуемого СО могут соответствовать требованиям нормативной документации на соответствующее БЛС.
Внесение изменений в регистрационное досье в отношении использования стандартных образцов
В соответствии с руководствами ВОЗ определены категории при внесении изменений в отношении СО27: например, при замене первичного СО, замене СО с фармакопейного или международного на внутренний (не связанный с международным стандартом), изменении программы аттестации СО и его характеристики требуется рассмотрение и одобрение уполномоченным органом.
При внесении изменений в отношении используемых СО целесообразно составление Протокола сопоставимости (другое название — Протокол управления пострегистрационными изменениями), в котором устанавливают план будущей реализации изменений. Документ включает необходимые испытания и допустимые пределы, обоснованные материалами по валидации методики. Допустимые пределы нужны для оценки влияния конкретных изменений на качество, безопасность или эффективность БЛС и демонстрации сопоставимости препаратов до и после внесения изменений.
Для некоторых изменений стандартные испытания качества, проводимые при выпуске фармацевтических субстанций или лекарственных препаратов, могут оказаться недостаточными для оценки влияния изменения, поэтому могут потребоваться дополнительные испытания в процессе производства и оценки характеристик. Протоколы сопоставимости часто применяются для планового пополнения Рабочего банка клеток и запасов СО, используемых в испытаниях контроля качества (при истечении срока годности или снижении количества аликвот). Цель протокола сопоставимости — обеспечение прозрачности требований к сопроводительным данным для вносимых изменений и повышение предсказуемости последствий изменений.
Формирование материалов раздела «Стандартные образцы» в досье на биологические лекарственные средства
В досье для регистрации БЛС в отношении используемых СО представляют материалы в соответствии с Правилами регистрации и экспертизы лекарственных средств для медицинского применения ЕАЭС28 (требования к модулям 1–3). Для международных и фармакопейных СО зарубежных фармакопей, фармакопеи ЕАЭС и ГФ РФ должны быть представлены паспорта/сертификаты. Методики, в которых они применяются, должны быть валидированы с применением соответствующих СО. Отчетные материалы по их аттестации должны храниться у уполномоченных органов. Материалы по аттестации отечественных фармакопейных СО для контроля качества БЛС должны соответствовать рассмотренным в статье требованиям.
На предприятии, производящем БЛС, при использовании собственного стандартного образца предприятия (СОп) должны находиться материалы, которые могут быть запрошены в процессе экспертизы, а именно:
- паспорт/сертификат, который представляется при регистрации и должен содержать необходимые сведения: название документа; название и адрес организации, проводившей аттестацию; идентификационный номер; назначение; наименование аттестованной характеристики (аттестованное значение и его неопределенность); описание; прослеживаемость к СО, использованному при аттестации актуального стандартного образца (если применимо); порядок применения; условия транспортирования и хранения; требования безопасности; дата выпуска; срок годности; фамилия и подпись уполномоченного лица;
- схема производства СО, включая контрольные точки. Если производство отличается от технологии получения ЛС, например при необходимости проведения дополнительной очистки стандартных материалов, это должно быть указано в схеме производства;
- документы по порядку проведения и оформлению результатов аттестации, включая все первичные данные: материалы по установлению значения аттестованной характеристики и показателей качества СО; указание и описание аналитических методик, материалы по валидации данных методик; результаты изучения стабильности СО, обосновывающие срок его годности; порядок оформления результатов аттестации и документов на СО, в том числе правило присвоения идентификационного номера СО, порядок их утверждения; порядок внесения изменений в отношении СО; прослеживаемость серии СО к серии, использовавшейся при проведении доклинических и/или клинических исследований.
Результаты проверки наличия необходимых материалов для СОп целесообразно оформить в виде отдельного документа, например чек-листа, в соответствии со стандартной операционной процедурой (СОП) системы качества производителя БЛС, заявителя или регуляторного органа. Пример оформления чек-листа представлен в таблице 1.
Таблица 1. Пример оформления чек-листа по формированию материалов
раздела «Стандартные образцы» для досье на биологическое лекарственное средство
Table 1. Model checklist for preparing materials
for the Reference Standards section of the dossier for a biological product

Таблица составлена авторами / The table is prepared by the authors
Примечание. СОП — стандартная операционная процедура;
СОп — стандартный образец предприятия.
Note. SOP, standard operating procedure; RS, reference standard.
При оформлении чек-листа в связи с внесением изменений должны быть учтены соответствующие требования протокола сопоставимости результатов.
Таким образом, в досье для регистрации БЛС должны быть представлены паспорта (сертификаты) используемых СО. Методики, в которых они применяются, должны быть валидированы с применением соответствующих СО.
При использовании СОп в досье должны быть представлены не только паспорта (сертификаты) на СОп, но и схема производства СОп, если она отличается от схемы производства БЛС. На предприятии, производящем БЛС, должны находиться материалы, которые могут быть запрошены в процессе экспертизы, а именно документы по порядку проведения и оформления результатов аттестации СОп, включая все первичные данные.
Заключение
Проведенный анализ и систематизация международной и российской нормативной правовой документации для стандартных образцов, а также опыт аттестации и применения биологических стандартных образцов в ФГБУ «НЦЭСМП» Минздрава России позволили разработать требования к формированию раздела по стандартным образцам в досье на биологические лекарственные средства для дальнейшего включения в соответствующее руководство.
Разработка требований к материалам раздела «Стандартные образцы» обеспечит единый подход заявителей, разработчиков и экспертов уполномоченного органа к подготовке, аттестации, оформлению документов на стандартные образцы.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Р.А. Волкова — концепция исследования, написание и редактирование текста рукописи; О.В. Фадейкина — обобщение материалов исследования, обсуждение текста рукописи, подготовка и редактирование текста рукописи; О.Б. Устинникова — обсуждение и подготовка текста рукописи; К.А. Саркисян — обсуждение и редактирование текста рукописи; А.А. Мовсесянц — критическое обсуждение и редактирование текста рукописи; В.А. Меркулов — критическое обсуждение текста рукописи; В.В. Косенко — критическое обсуждение и утверждение окончательной версии статьи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. R.A. Volkova conceptualised the study, drafted and edited the manuscript. O.V. Fadeikina summarised the study materials; prepared, discussed and edited the manuscript. O.B. Ustinnikova discussed and drafted the manuscript. K.A. Sarkisyan discussed and edited the manuscript. A.A. Movsesyants critically discussed and edited the manuscript. V.A. Merkulov critically discussed the manuscript. V.V. Kosenko critically discussed the manuscript and approved the final version for publication.
1. ОФС.1.1.0007 Стандартные образцы. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
2. ОФС.2.3.11.0 Стандартные образцы. Фармакопея Евразийского экономического союза. Т. 1. Ч. 2. М.; 2023.
3. Там же.
4. Recommendations for the preparation, characterization, and establishment of international and other biological reference standards. Annex 2. TRS No. 932. WHO; 2006.
WHO manual for the establishment of national and other secondary standards for vaccines. WHO/IVB/11/03. WHO; 2011.
5. Guidelines on stability evaluation of vaccines. Annex 3. TRS No. 962. WHO; 2011.
Guidelines on the quality, safety and efficacy of biotherapeutic protein products prepared by recombinant DNA technology. Annex 4. TRS No. 987. WHO; 2014.
Guidelines on procedures and data requirements for changes to approved vaccines. Annex 4. TRS No. 993. WHO; 2015.
WHO good manufacturing practices for biological products. Annex 2. TRS No. 999. WHO; 2016.
Guidelines on procedures and data requirements for changes to approved biotherapeutic products. Annex 3. TRS No. 1011. WHO; 2017.
ICH Q5C Guideline for industry. Quality of biotechnological products: Stability testing of biotechnological/biological products.
ICH Q5E Comparability of biotechnological/biological products subject to changes in their manufacturing process; 2005.
ICH Q6B Specifications: test procedures and acceptance criteria for biotechnological/biological products.
6. Решение Совета ЕЭК от 03.11.2016 № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза».
Решение Совета ЕЭК от 03.11.2016 № 78 «Об утверждении Правил регистрации и экспертизы лекарственных средств для медицинского применения».
Решение Совета ЕЭК от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
ОФС.2.3.11.0 Стандартные образцы. Фармакопея Евразийского экономического союза. Т. 1. Ч. 2. М.; 2023.
7. ОФС.1.1.0007 Стандартные образцы. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
8. ISO Guide 30:2015. Reference materials — Selected terms and definitions.
ISO Guide 31:2015. Reference materials — Contents of certificates, labels and accompanying documentation.
ISO Guide 33:2015. Reference materials — Good practice in using reference materials.
9. ISO Guide 35:2017. Reference materials — Guidance for characterization and assessment of homogeneity and stability.
10. ISO 17034:2016 General requirements for the competence of reference material producers.
11. ГОСТ ISO Guide 30-2019. Межгосударственный стандарт. Стандартные образцы. Некоторые термины и определения.
ГОСТ ISO Guide 31-2019. Содержание сертификатов, этикеток и сопроводительной документации.
ГОСТ ISO Guide 33-2019. Надлежащая практика применения стандартных образцов.
12. ГОСТ Р ИСО 17034-2021. Общие требования к компетентности производителей стандартных образцов.
13. ГОСТ 8.315-2019. Государственная система обеспечения единства измерений. Стандартные образцы состава и свойств веществ и материалов. Основные положения.
ГОСТ Р 8.871-2014. Стандартные образцы предприятий и отраслей. Общие требования.
14. ОФС.2.3.14.0. Валидация аналитических методик. Фармакопея Евразийского экономического союза. Т. 1. Ч. 2. М.; 2023.
Руководство по валидации аналитических методик проведения испытаний лекарственных средств. ЕАЭС; 2018.
15. ICH Q2 (R2) Validation of analytical procedures; 2023.
16. ICH Q14 Guideline on аnalytical procedures development; 2023.
17. ГОСТ Р ИСО 17034–2021. Общие требования к компетентности производителей стандартных образцов.
ГОСТ ISO/IEC 17025-2019. Межгосударственный стандарт. Общие требования к компетентности испытательных и калибровочных лабораторий.
18. 1055 Biotechnology-derived articles — peptide mapping. United States Pharmacopeia. USP–NF 2023. Rockville, MD; 2023.
01/2011(11.0):20259. Glycan analysis of glycoproteins. European Pharmacopoeia. 11 ed. Strasbourg; 2023.
19. Guidance on the description of composition of pegylated (conjugated) proteins in the SPC (EMEA/CMP/BWP/3068/03). EMEA; 2003.
20. Recommendations for the preparation, characterization, and establishment of international and other biological reference standards. Annex 2. TRS No. 932. WHO; 2006.
21. ОФС.2.3.14.0. Валидация аналитических методик. Фармакопея Евразийского экономического союза. Т. 1. Ч. 2. М.; 2023.
ICH Q2 (R2) Validation of analytical procedures; 2023.
ICH Q14 Guideline on аnalytical procedures development; 2023.
Руководство ЕВРАХИМ/СИТАК. Количественное описание неопределенности в аналитических измерениях. 3 изд. QUAM:2012.P1-RU.
22. ISO Guide 35:2017. Reference materials — Guidance for characterization and assessment of homogeneity and stability.
23. Там же.
24. Good practices for national pharmaceutical control laboratories. Annex 3. TRS No. 902. WHO; 2002.
25. Глава 8. Исследование стабильности биотехнологических (биологических) препаратов при внесении изменений в производственный процесс: доклинические и клинические исследования. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
26. ОФС.1.1.0020.18 Стабильность биологических лекарственных средств. Государственная фармакопея Российской Федерации. XIV изд. Т. 1. М.; 2018.
27. Guidelines on procedures and data requirements for changes to approved vaccines. Annex 4. TRS No. 993. WHO; 2014.
Guidelines on procedures and data requirements for changes to approved biotherapeutic products. Annex 3. TRS No. 1011. WHO; 2017.
28. Решение Совета ЕЭК от 03.11.2016 № 78 «Об утверждении Правил регистрации и экспертизы лекарственных средств для медицинского применения».
Список литературы
1. Волкова РА, Фадейкина ОВ, Устинникова ОБ, Саканян ЕИ, Меркулов ВА, Мовсесянц АА и др. Современные проблемы стандартных образцов лекарственных средств в Российской Федерации. Фармация. 2020;69(2):5–11. https://doi.org/10.29296/25419218-2020-02-01
2. Гегечкори ВИ, Шатилина АА, Шульга НА, Петухова ЯД, Смирнов ВВ, Раменская ГВ. Биологические стандартные образцы: актуальные вопросы разработки и порядка аттестации. Эталоны. Стандартные образцы. 2023;19(3):21–9. https://doi.org/10.20915/2077-1177-2023-19-3-21-29
3. Фадейкина ОВ, Волкова РА. Разработка порядка аттестации стандартных образцов биологических лекарственных средств. Химико-фармацевтический журнал. 2017;51(8):44–50. https://doi.org/10.30906/0023-1134-2017-51-8-44-50
4. Волкова РА, Фадейкина ОВ. Проблемы оценки неопределенности методик испытаний и стандартных образцов иммунобиологических лекарственных средств. Биопрепараты. Профилактика, диагностика, лечение. 2017;17(1):27–31. EDN: VWOGAY
5. Карпова ЕВ, Сангаджиева АД, Мамонтова ТВ, Фадейкина ОВ, Волкова РА, Саркисян КА, Мовсесянц АА. Аттестация отраслевого стандартного образца специфической активности вакцины полиомиелитной пероральной, двухвалентной, живой аттенуированной 1, 3 типов — Бивак полио. Биопрепараты. Профилактика, диагностика, лечение. 2017;17(2):122–7. EDN: ZGVOZD
6. Устинникова ОБ, Голощапова ЕО, Рунова ОБ, Коротков МГ, Волкова РА. Разработка порядка аттестации стандартного образца метиониновой формы интерферона альфа-2b для подтверждения подлинности методом пептидного картирования. Медицинская иммунология. 2018;20(4):543–50. https://doi.org/10.15789/1563-0625-2018-4-543-550
7. Шведова ЕВ, Клепикова АГ, Фадейкина ОВ, Шведов ДВ, Борисевич ИВ, Солдатов АА. Разработка фармакопейного стандартного образца для количественного определения активности иммуноглобулина человека антирезус Rho(D). Иммунология. 2023;44(3):358–67. https://doi.org/10.33029/1816-2134-2023-44-3-358-367
8. Нечаев АВ, Кудашева ЭЮ, Постнова ЕЛ, Волкова РА, Фадейкина ОВ, Борисевич ИВ, Мовсесянц АА. Особенности разработки, аттестации и применения фармакопейного стандартного образца содержания иммуноглобулинов класса А в препаратах иммуноглобулинов человека для парентерального применения. Биопрепараты. Профилактика, диагностика, лечение. 2023;23(3–1):443–51. https://doi.org/10.30895/2221-996X-2023-23-3-1-443-451
9. Бинятова АС, Юнасова ТН, Ильясова ТН, Саркисян КА, Фадейкина ОВ, Мовсесянц АА. Анализ качества комбинированной отечественной вакцины для профилактики кори, краснухи и паротита. Вопросы вирусологии. 2022;67(5):414–22 https://doi.org/10.36233/0507-4088-131
10. Юнасова ТН, Фадейкина ОВ, Сидоренко ЕС, Суханова ЛЛ, Шитикова ОЮ, Саркисян КА и др. Разработка и изучение отраслевого стандартного образца активности вакцины против краснухи. Биопрепараты. Профилактика, диагностика, лечение. 2015;(3):49–53. EDN: UJUWZX
11. Бинятова АС, Юнасова ТН, Волкова РА, Бутырский АЮ, Ильясова ТН, Саркисян КА, Мовсесянц АА. Опыт применения фармакопейного стандартного образца активности коревой вакцины. Вопросы вирусологии. 2023;68(4):327–33. https://doi.org/10.36233/0507-4088-185
12. Устинникова ОБ, Волкова РА, Мовсесянц АА, Меркулов ВА, Бондарев ВП. Рекомендации по аттестации стандартных образцов для подтверждения подлинности структуры рекомбинантных терапевтических белков. Биопрепараты. Профилактика, диагностика, лечение. 2022;22(2):218–25. https://doi.org/10.30895/2221-996X-2022-22-2-218-225
13. Бинятова АС, Юнасова ТН, Саркисян КА, Давыдов ДС, Ильясова ТН, Мовсесянц АА. Мониторинг качества отечественных вакцин для профилактики кори. Эпидемиология и вакцинопрофилактика. 2021;20(2):58–67. https://doi.org/10.31631/2073-3046-2021-20-2-58-67
14. Калинина ЕН, Вильданова НС, Кормщикова ЕС, Йовдий АВ, Смольникова МВ. Определение критериев качества кандидата в стандартный образец содержания антител антирезус Rh0(d). Сибирский научный медицинский журнал. 2023;43(6):90–100. https://doi.org/10.18699/SSMJ20230611
15. Кормщикова ЕС, Росина ЕВ, Воробьев КА, Парамонов ИВ, Кудашева Э.Ю. Получение стабильной формы стандартного образца содержания антител IgG человека к вирусу клещевого энцефалита. Биотехнология. 2021;37(3):42–52. https://doi.org/10.21519/0234-2758-2021-37-3-42-52
16. Trapmann S, Botha A, Linsinger TPJ, MacCurtain S, Emons H. The new International Standard ISO 17034: general requirements for the competence of reference material producers. Accred Qual Assur. 2017;22:381–7. https://doi.org/10.1007/s00769-017-1285-5
17. Linsinger TPJ, Botha A. Principles for the characterisation and the value assignment of the candidate reference material in the new ISO Guide 35:2017. Accred Qual Assur. 2019;24:157–61. https://doi.org/10.1007/s00769-018-1364-2
18. Мигаль ПВ, Собина ЕП, Аронов ПМ, Кремлева ОН, Студенок ВВ, Фирсанов ВА, Медведевских СВ. Об оценке стабильности стандартных образцов. Эталоны. Стандартные образцы. 2023;19(3):65–75. https://doi.org/10.20915/2077-1177-2023-19-3-65-75
19. Собина ЕП, Аронов ПМ, Мигаль ПВ, Кремлева ОН, Студенок ВВ, Фирсанов ВА, Медведевских СВ. Алгоритмы оценивания однородности стандартных образцов состава и свойств дисперсных и монолитных материалов. Эталоны. Стандартные образцы. 2023;19(3):77–91.https://doi.org/10.20915/2077-1177-2023-19-3-77-91
20. Морозова ВВ, Кулябина ЕВ, Морозов ВЮ, Кулябина ТВ. Стандартные образцы качественных свойств биологических субстанций. Эталоны. Стандартные образцы. 2023;19(3):45–54. https://doi.org/10.20915/2077-1177-2023-19-3-45-54
21. Кулябина ЕВ, Щекотихин АЕ, Тевяшова АН, Кулябина ТВ, Морозова ВВ. Стандартные образцы состава фармацевтических субстанций противомикробных препаратов. Эталоны. Стандартные образцы. 2023;19(4):17–26. https://doi.org/10.20915/2077-1177-2023-19-4-17-26
22. Гегечкори ВИ, Шульга НА, Князев АМ, Чадова НН, Шестаков ВН. Создание стандартных образцов утвержденного типа для примесей активных фармацевтических субстанций. В кн.: Стандартные образцы в измерениях и технологиях. Тезисы докладов V Международной научной конференции. Екатеринбург, 2022. С. 45–6. EDN: JDIKGA
23. Гегечкори ВИ, Шатилина АА, Щепочкина ОЮ, Раменская ГВ. Разработка методики количественного определения протеолитической активности стандартного образца панкреатина. Вопросы биологической, медицинской и фармацевтической химии. 2023;26(12):25–31. EDN: QRJRSL
24. Волкова РА. Методики контроля или методики испытаний – к вопросу о метрологическом обеспечении аналитических методик. Справочник заведующего КДЛ. 2013;(4):4–9. EDN: QBPDNB
Об авторах
Р. А. ВолковаРоссия
Волкова Рауза Асхатовна, д-р биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. В. Фадейкина
Россия
Фадейкина Ольга Васильевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. Б. Устинникова
Россия
Устинникова Ольга Борисовна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
К. А. Саркисян
Россия
Саркисян Каринэ Арташесовна, канд. мед наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
А. А. Мовсесянц
Россия
Мовсесянц Арташес Авакович, д-р мед. наук, профессор
Петровский б-р, д. 8, стр. 2, Москва, 127051
В. А. Меркулов
Россия
Меркулов Вадим Анатольевич, д-р мед. наук, профессор
Петровский б-р, д. 8, стр. 2, Москва, 127051
В. В. Косенко
Россия
Косенко Валентина Владимировна, канд. фарм. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Волкова Р.А., Фадейкина О.В., Устинникова О.Б., Саркисян К.А., Мовсесянц А.А., Меркулов В.А., Косенко В.В. Требования к материалам раздела по стандартным образцам, представляемым в досье на биологические лекарственные средства. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):7-20. https://doi.org/10.30895/2221-996X-2024-24-1-7-20
For citation:
Volkova R.A., Fadeikina O.V., Ustinnikova O.B., Sarkisyan K.A., Movsesyants A.A., Merkulov V.A., Kosenko V.V. Requirements for the information on reference standards submitted in the dossier for biologicals. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):7-20. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-7-20
JATS XML



































