Перейти к:
Разработка клеточных линий-продуцентов рекомбинантных терапевтических белков на примере деносумаба
https://doi.org/10.30895/2221-996X-2025-553
Резюме
ВВЕДЕНИЕ. При создании биотехнологических лекарственных препаратов ключевое значение имеет разработка высокопродуктивных клеточных линий-продуцентов рекомбинантных белков. Отработка протоколов селекции и подходов для эффективного скрининга линий-продуцентов целевых белков — необходимый этап разработки технологии производства рекомбинантных белков с высоким выходом целевого продукта.
ЦЕЛЬ. Получение высокопродуктивных клеточных линий-продуцентов рекомбинантного белка деносумаба на основе суспензионной клеточной линии СНО.
МАТЕРИАЛЫ И МЕТОДЫ. Использовалась суспензионная клеточная линия СНО-К1. Для культивирования применялись среды и подпитки без использования сыворотки или других компонентов животного происхождения. Клетки линии СНО трансфицировали плазмидами, содержащими гены легкой и тяжелой цепей деносумаба, с использованием метода электропорации с помощью системы MaxCyte STX. Селекцию трансфицированных клеток проводили с добавлением антибиотиков (гигромицин, генетицин). Моноклональные клеточные линии получали с использованием системы ClonePix FL. Проводили периодическое культивирование с добавлением подпитки и определение концентрации деносумаба методом иммуноферментного анализа (ИФА) в культуральной жидкости для выявления лидерных моноклональных клеточных линий.
РЕЗУЛЬТАТЫ. Оптимальная концентрация антибиотиков для селекции клеточных линий-продуцентов на основе клеток СНО составила 600 мг/л гигромицина и 600 мг/л генетицина. После проведения трансфекции из 1920 минипулов селекцию прошел 1041 (около 54%). Отбор минипулов-продуцентов деносумаба проводили путем скрининга проб культуральной жидкости с использованием ИФА из 96-, 24- и 6-луночных планшетов. Отобранные 23 лидерных минипула были адаптированы к условиям шейкерного культивирования. С учетом показателей ростовых и продукционных характеристик минипулов определен лидерный минипул (mp-19) с продуктивностью 1,92 г/л (на 7 сут периодического культивирования). На основе mp-19 получены моноклональные клеточные линии-продуценты деносумаба с продуктивностью до 6,5 г/л на 9 сут культивирования с подпиткой.
ВЫВОДЫ. Получены высокопродуктивные моноклональные клеточные линии-продуценты деносумаба. Предложенный подход к созданию клеток-продуцентов может быть применен для получения различных рекомбинантных белков, включая моноклональные антитела, ферменты, факторы свертывания крови.
Ключевые слова
Для цитирования:
Тимонова С.С., Кирик И.А., Филатова М.А., Анфилатова А.И., Шубина С.С., Полупанова А.А., Габдрахманова А.Ф., Иванов Е.С., Бадэ В.Н., Пискунов А.А., Хамитов Р.А. Разработка клеточных линий-продуцентов рекомбинантных терапевтических белков на примере деносумаба. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(3):245-257. https://doi.org/10.30895/2221-996X-2025-553
For citation:
Timonova S.S., Kirik I.A., Filatova M.A., Anfilatova A.I., Shubina S.S., Polupanova A.A., Gabdrakhmanova A.F., Ivanov E.S., Bade V.N., Piskunov A.A., Khamitov R.A. Development of cell lines producing recombinant therapeutic proteins, with denosumab as a case study. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(3):245-257. (In Russ.) https://doi.org/10.30895/2221-996X-2025-553
ВВЕДЕНИЕ
Разработка высокопродуктивных клеточных линий-продуцентов рекомбинантных белков представляет собой ключевой этап создания биотехнологических лекарственных препаратов [1]. Для достижения высокой экспрессии рекомбинантных белков применяют различные подходы.
Для стабильной интеграции чужеродной ДНК в геном клетки-хозяина необходимо подобрать оптимальный экспрессионный вектор и включить дополнительные генетические элементы, такие как системы селекции, механизмы амплификации генов, участки, обеспечивающие транскрипционную активность, а также гены, регулирующие пролиферацию (например, bcl-2, xiap, aven, mcl-1) [2][3].
Выбор клеточной линии является важным звеном в разработке биотехнологического препарата. Большинство продуктов производятся с использованием эукариотических клеточных линий: клетки яичника китайского хомячка (CHO), клетки мышиной миеломы (NS0 и Sp2/0-Ag14), клетки эмбриональной почки человека (HEK 293), клетки почки сирийского хомячка (BHK). Выбор клеток эукариотического происхождения обусловлен их способностью синтезировать белки, которые по своей структуре и биохимическим свойствам близки белкам, встречающимся в организме человека [4].
Для крупномасштабного коммерческого производства требуются клеточные линии, способные достигать высоких концентраций жизнеспособных клеток (viable cell density, VCD), что обеспечивает высокую производительность процесса. Важную роль играет оптимизация ростовых сред и подпиток для конкретных клеток-продуцентов, позволяющая значительно повысить выход продукта [5–7]. Применение ростовых сред и добавок определенного химического состава (без использования белков животного происхождения) дает возможность регулировать целевой профиль продукта, включая состав гликанов, биологическую активность и др. Оптимизация условий культивирования клеток-продуцентов по различным параметрам (продолжительность, температурный режим, подача газов, контроль рН и др.) имеет ключевое значение [8][9]. Коэкспрессия дополнительных белков/ферментов может способствовать улучшению выхода целевого продукта [10][11].
Авторами данной статьи рассматривается реализация подхода, направленного на создание высокопроизводительных клеточных линий-продуцентов рекомбинантных терапевтических белков на примере деносумаба, разрабатываемого в АО «ГЕНЕРИУМ».
Деносумаб представляет собой человеческое моноклональное антитело класса IgG2, специфичное к цитокину RANKL — фактору дифференцировки и активации остеокластов. Ингибирование RANKL подавляет процессы созревания и выживаемости остеокластов, тем самым снижая интенсивность резорбции кости [12]. В настоящее время доступны коммерческие препараты на основе деносумаба, одобренные для лечения постменопаузного остеопороза [13][14] и лечения опухолевых заболеваний (миелома, метастазы в кости, нерезектабельная гигантоклеточная опухоль кости, доброкачественные опухоли кости) [15][16]. Проводятся доклинические и клинические исследования с применением биоаналогов оригинального препарата деносумаба1. Получение российского биоаналога деносумаба повысит доступность препарата для пациентов в Российской Федерации, что будет в целом способствовать реализации государственной политики в сфере развития фармацевтической промышленности.
Цель работы — получение высокопродуктивных клеточных линий-продуцентов рекомбинантного белка деносумаба на основе суспензионной клеточной линии СНО.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Линия клеток СНО-К1 (Н-188) получена из коллекции клеточных культур НИЦ «Курчатовский институт», ГосНИИгенетика, Россия (далее — линия CHO) и адаптирована к суспензионному культивированию без использования сыворотки и любых других компонентов животного происхождения. В работе использовали следующие реактивы: среда для культивирования BalanCD CHO Growh A (BCD) (Fujifilm, Irvine Scientific, США); подпитка BalanCD CHO Feed 4 (Fujifilm, Irvine Scientific, США); полутвердая среда для клонирования ClonaCell Flex (Stemcell, Канада); буфер для электропорации (MaxCyte, CША); фосфатно-солевой буфер, PBS («ЭкоСервис», Россия); Твин 20 (Panreac AppliChem, Испания); контрольный (референтный) препарат деносумаба (Пролиа, Амджен Европа Б.В., Нидерланды); альбумин (Sigma-Aldrich, Япония); козьи поликлональные антитела против IgG человека (Sigma, Япония); козьи поликлональные антитела против IgG человека, конъюгированные с пероксидазой хрена (Sigma, Япония); 3,3',5,5'-тетраметилбензидин (Transgen Biotech, Китай); диметилсульфоксид (Sterile Filtered, Cell Culture Tested, CDH, Индия).
Методы
Получение экспрессионных векторов. Синтетические кодон-оптимизированные последовательности генов легкой и тяжелой цепей деносумаба клонировали в экспрессионный вектор с селективным маркером. Полученные плазмиды с генами легкой цепи (pGNR-FAB) и тяжелой цепи (pGNR-FC) в дальнейшем использовали для проведения трансфекции. Экспрессия генов находилась под контролем гибридного CMVe/EF1alpha-промотора. Схема вектора аналогична ранее описанной авторами [11].
Суспензионное культивирование клеток CHO. Посевная концентрация жизнеспособных клеток СНО составляла 0,5×10⁶ клеток/мл. Клетки культивировали в среде BalanCD CHO Growth A при 37 °С и 5% CO2 c поддержанием постоянной влажности не менее 75% и скоростью перемешивания 100 об/мин с помощью шейкера-инкубатора (Infors HT, Multitron, США).
Определение ростовых и продукционных характеристик культуры клеток-продуцентов. Показатель VCD определяли с использованием 0,1% раствора трипанового синего на автоматическом счетчике клеток Countess II FL (Life Technologies, США). Показатели кумулятивной клеточной плотности (cumulative cell density, ССD) и продуктивности вычисляли по формулам, представленным в работах авторов [17][18].
Трансфекция клеток СНО методом электропорации. Трансфекцию проводили с помощью оборудования для электропорации и кюветы ОС-100 (MaxCyte, CША) с использованием протокола СНО. Клетки осаждали центрифугированием, после чего осадок ресуспендировали в буфере для электропорации. Далее суспензию клеток смешивали с плазмидной ДНК легкой и тяжелой цепей (pGNR-FAB и pGNR-FC) в эквимолярном соотношении. В случае отрицательного контроля проводили электропорацию в тех же условиях без добавления плазмидной ДНК.
Получение минипулов. Трансфицированные клетки СНО высевали в плоскодонные 96-луночные планшеты (Greiner Bio-One, Австрия) по 50 мкл в ростовой среде BCD c селективными антибиотиками и культивировали при 37 °С, 5% СO2 и 70% влажности. Затем проводили анализ культуральной жидкости (КЖ) из лунок с минипулами, прошедшими селекцию, методом иммуноферментного анализа (ИФА). Минипулы с наиболее высокой продуктивностью переносили в 24- и 6-луночные планшеты (Greiner Bio-One, Австрия), а затем — в колбы Эрленмейера (Corning, США) с последующей адаптацией к росту в суспензии при постоянном перемешивании.
Получение клонов в полутвердой среде. Клетки лидерного минипула-продуцента высевали в 6-луночные планшеты (Greiner Bio-One, Австрия) в полутвердой среде ClonaCell Flex и инкубировали в стационарных условиях при 37 °С, 5% СO2 в CO2-инкубаторе (Sanyo, Япония) до момента появления колоний. Отбор клонов проводили с помощью роботизированной системы ClonePix FL (Molecular Devices, США).
Периодическое культивирование. Культивирование продуцентов проводили в среде BCD в минибиореакторах TubeSpin Bioreactor (TPP Techno Plastic Products AG, Швейцария) с посевной концентрацией клеток 0,5×10⁶ клеток/мл. В качестве подпитки использовали BalanCD CHO Feed 4. Условия культивирования: содержание СО2 — 5%, влажность — не менее 70%, температурный режим — 37 °С, скорость перемешивания — 100 об/мин. Отбор проб КЖ и подсчет показателей VCD и оценку жизнеспособности проводили каждый день начиная с 3–4 сут культивирования.
Иммуноферментный анализ. Сорбцию проводили в планшетах MaxiSorb (Nunc, Дания) с использованием козьих поликлональных антител против IgG человека в концентрации 4 мкг/мл (карбонатно-бикарбонатный буфер, рН 9,4) при 37 °С в течение 1 ч. Далее лунки промывали PBS с добавлением Твин 20 (PBS-T) и проводили блокировку раствором бычьего сывороточного альбумина в PBS-T (PBS-Ta, Sigma-Aldrich, Япония). Исследуемые образцы, содержащие деносумаб, и контрольный образец (деносумаб, Пролиа) инкубировали 1 ч при 37 °С на орбитальном термостатируемом шейкере ELMI ST-3L (Elmi, Латвия) при скорости 300 об/мин. После промывания лунок PBS-T добавляли детектирующие козьи поликлональные антитела против IgG человека, конъюгированные c пероксидазой хрена, в концентрации 1 мкг/мл в PBS-Ta и инкубировали 1 ч при 37 °С на шейкере ELMI ST-3L при 300 об/мин. Далее лунки промывали PBS-Т и добавляли раствор тетраметилбензидина (50 мкл). Для остановки реакции использовали раствор серной кислоты. Оптическую плотность измеряли при длине волны 450 нм (OD450) с помощью спектрофотометра Benchmark Plus (Bio-Rad, Германия).
Криоконсервация клеточных культур. Для крио-консервации культур клеток (в логарифмической фазе роста) использовали ростовую среду без антибиотика, содержащую 10% диметилсульфоксида. Концентрация клеток в ампуле составляла 5–10 млн клеток/мл. После медленного охлаждения ампул с клетками в морозильнике при температуре минус 80 °C в контейнерах для замораживания (Mr. Frosty, Thermo Scientific) ампулы помещали в пары жидкого азота.
РЕЗУЛЬТАТЫ
На рисунке 1 представлена схема получения промышленного клона-продуцента терапевтического рекомбинантного белка (на примере деносумаба) на основе клеточной линии СНО, в которой выделяют следующие этапы:
- трансфекция клеток СНО;
- получение минипулов-продуцентов (селекция продуцентов, скрининг для выявления наиболее продуктивных линий, отбор лидерных минипулов);
- получение клонов-продуцентов (процесс клонирования, скрининг полученных клонов, отбор лидерных клонов-продуцентов);
- изучение стабильности роста клонов и уровня экспрессии рекомбинантных белков у лидерных клонов-продуцентов;
- оптимизация процесса культивирования стабильного лидерного клона-продуцента;
- передача клона-продуцента на производство и дальнейшее масштабирование процесса.
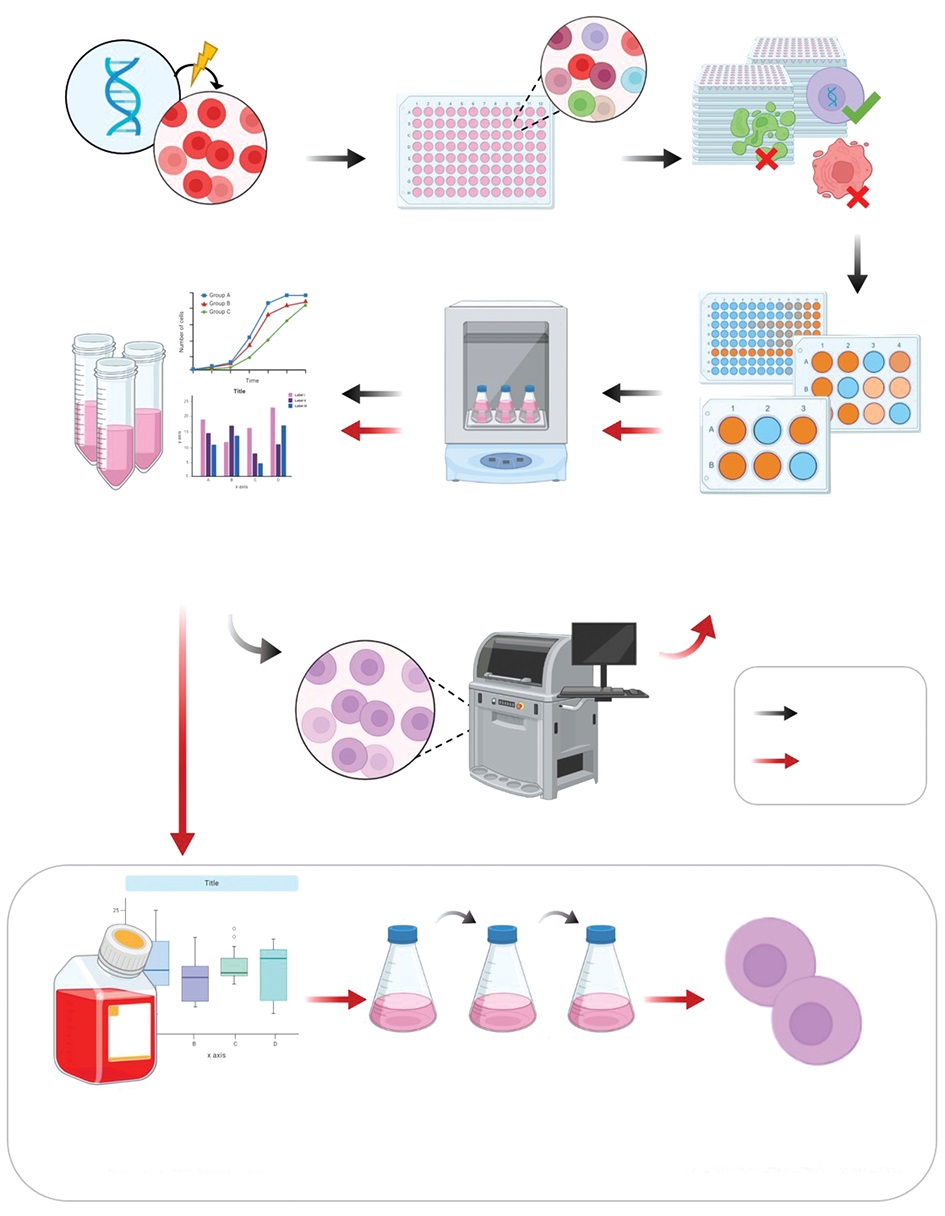
Рисунок подготовлен авторами c использованием шаблонов biorender.com / This figure is prepared by the authors using the templates from biorender.com
Рис. 1. Схема получения клеточных линий-продуцентов рекомбинантного белка (на примере деносумаба) на основе клеточной линии СНО.
Fig. 1. Schematic representation of obtaining CHO-based cell lines producing recombinant proteins (based on the example of denosumab).
Подбор концентрации селективного агента для клеточных линий-продуцентов
Процесс подбора концентрации антибиотиков генетицина и гигромицина для селекции клеток СНО представлен на рисунке S1 (опубликован на сайте журнала2). Показано, что оптимальными концентрациями антибиотиков для проведения селекции клеток-продуцентов деносумаба являются 600 мг/л гигромицина и 600 мг/л генетицина. При этих концентрациях жизнеспособность клеток снижалась до нулевых значений на 7 сут культивирования.
Получение минипулов-продуцентов рекомбинантного белка деносумаба на основе клеток линии СНО
Трансфекция клеток линии CHO. После проведения трансфекции клеток СНО определяли показатель VCD и жизнеспособность трансфицированных клеток (табл. 1) через 24 и 48 ч для контроля выживаемости клеток. Через 48 ч после трансфекции клетки восстановили свою жизнеспособность, достигнув уровня около 90%.
Таблица 1. Жизнеспособность и концентрация жизнеспособных клеток СНО после трансфекции
Table 1. Viability and viable cell density of CHO cells after transfection
|
Плазмиды Plasmids |
Время после трансфекции, ч Time after transfection, h |
|||
|
24 |
48 |
|||
|
VCD, ×10⁶ клеток/мл VCD, ×10⁶ cells/mL |
Жизнеспособность, % Viability, % |
VCD, ×10⁶ клеток/мл VCD, ×10⁶ cells/mL |
Жизнеспособность, % Viability, % |
|
|
pGNR-FC + pGNR-FAB |
1,1 |
68 |
1,83 |
89 |
|
Контроль Control |
1,2 |
95 |
1,55 |
92 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. VCD — концентрация жизнеспособных клеток.
Note. VCD, viable cell density.
Получение минипулов-продуцентов. Трансфицированный пул клеток рассевали на минипулы в среде с селективным агентом в 96-луночные планшеты (всего 20 планшетов). Инкубирование проводили в стационарных условиях в СО2-инкубаторе до достижения 70–90% конфлюэнтного монослоя в ростовой среде BCD с селективными антибиотиками (600 мг/л гигромицина и 600 мг/л генетицина), оптимальная концентрация которых была подобрана заранее (рис. S1). Из 1920 минипулов селекцию прошел 1041 минипул, что составило примерно 54% от общей выборки.
Скрининг и отбор лидерных минипулов-продуцентов. На 10 сут инкубирования проводили скрининг проб КЖ минипулов-продуцентов из 96-луночных планшетов с использованием метода ИФА (рис. 2А). Максимальная продуктивность минипулов достигла 200 мг/л. Далее 240 минипулов с максимальной продуктивностью (лидерные минипулы) переносили в 24-луночные планшеты. Скрининг проб КЖ минипулов из 24-луночных планшетов (рис. 2В) показал, что максимальная продуктивность составила 90 мг/л. Затем 88 лидерных минипулов переносили в 6-луночные планшеты и культивировали в стационарных условиях. Анализ продуктивности минипулов из 6-луночных планшетов (рис. 2С) позволил выявить 23 лидерных минипула, которые были переведены в условия культивирования с перемешиванием в мини-биореакторах для адаптации роста и восстановления жизнеспособности клеток.
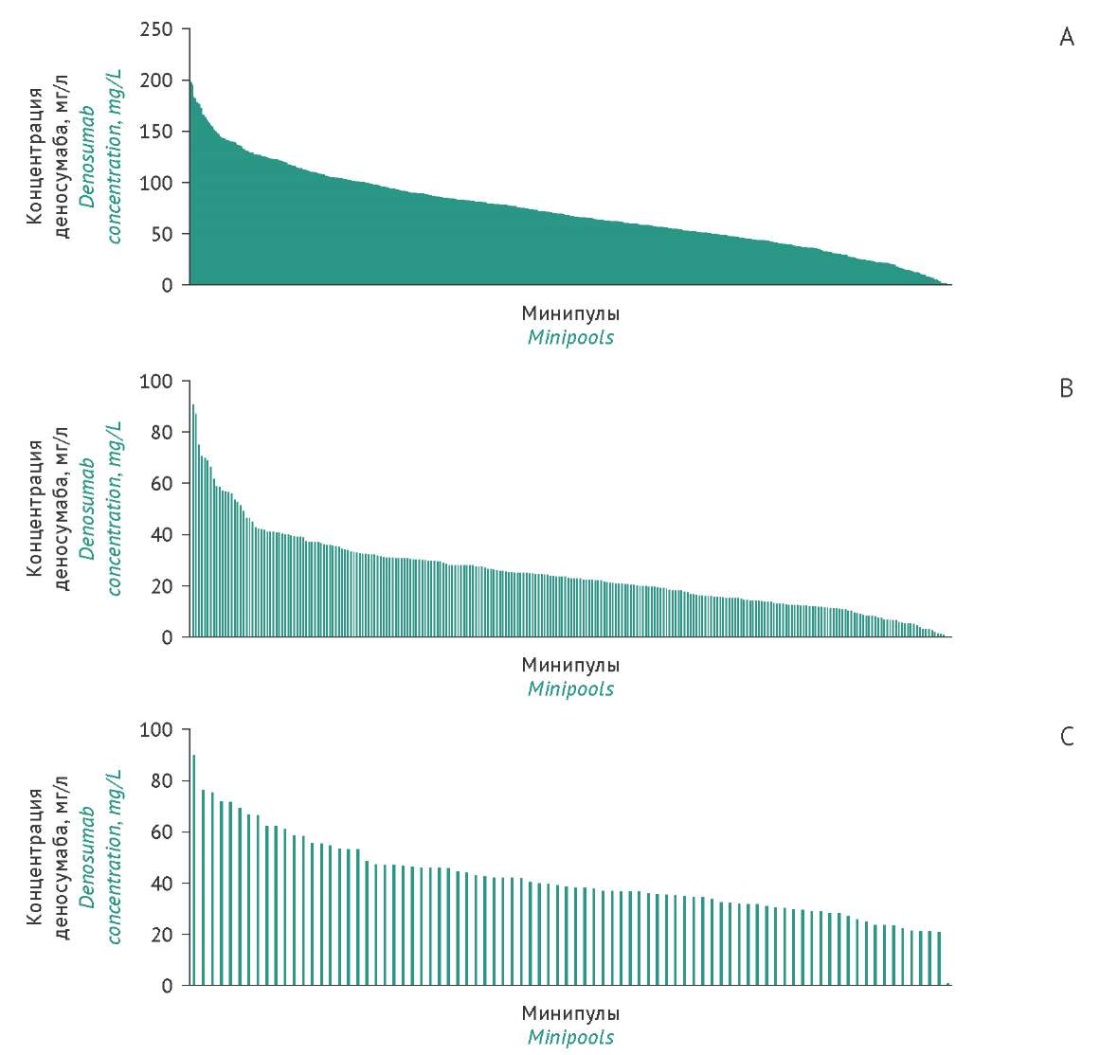
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Распределение минипулов-продуцентов по концентрации целевого белка (деносумаб) в культуральной жидкости при культивировании в планшетах: А — 96-луночные планшеты (1041 минипул); В — 24-луночные планшеты (240 минипулов); С — 6-луночные планшеты (88 минипулов).
Fig. 2. Distribution of producer minipools according to the content of the target protein (denosumab) in culture fluid during plate culture: A, 96-well plates (1041 minipools); B, 24-well plates (240 minipools); C, 6-well plates (88 minipools).
Таким образом, из 1041 минипула, прошедшего селекцию, после нескольких этапов скрининга было отобрано 23 минипула с лучшими показателями продуктивности деносумаба. Данные минипулы переносили в условия шейкерного культивирования для проведения адаптации и последующей криоконсервации культур клеток.
Исследование ростовых и продукционных характеристик минипулов. Для определения наиболее перспективных кандидатов проводили периодическое культивирование минипулов-продуцентов деносумаба в течение 7 сут (рис. 3). Для всех минипулов отмечали высокую жизнеспособность, превышающую 90% (рис. 3А). Максимальное значение показателя VCD (более 30×10⁶ клеток/мл) наблюдали на 7 сут для следующих минипулов: mp-14 (36,3×10⁶ клеток/мл), mp-16 (34,5×10⁶ клеток/мл), mp-20 (33,8×10⁶ клеток/мл) (рис. 3В). Показатель волюметрической продуктивности (VCD) варьировал от 0,6 до 1,9 г/л среди всей выборки продуцентов (рис. 3С). Выявлены минипулы-продуценты с наибольшим выходом целевого белка (более 1,7 г/л) на 7 сут: mp-19 (1,92 г/л), mp-14 (1,82 г/л), mp-4 (1,75 г/л).
Таким образом, определены минипулы, для которых продемонстрирован высокий показатель клеточной плотности одновременно с максимальным выходом целевого продукта деносумаба: mp-14, mp-4, mp-19 (рис. 3D). После сравнительного исследования физико-химических свойств полученного белка и контрольного препарата, включая изучение профиля гликозилирования (результаты не приведены), для дальнейшего клонирования был выбран минипул-продуцент mp-19.
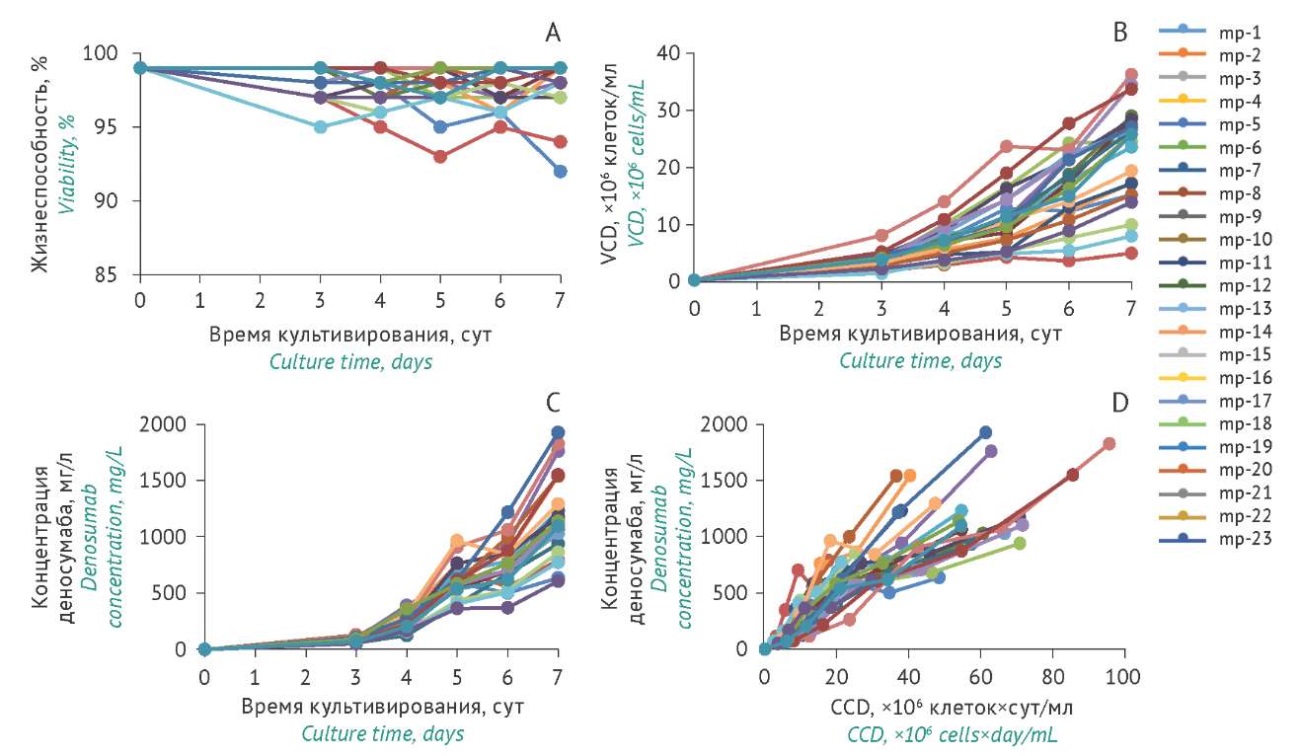
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 3. Характеристика минипулов-продуцентов деносумаба во время культивирования в течение 7 сут: А — жизнеспособность клеток; В — концентрация жизнеспособных клеток (VCD); С — продуктивность клеток; D — зависимость кумулятивной клеточной плотности (CCD) от продуктивности. mp — минипулы-продуценты деносумаба.
Fig. 3. Characteristics of denosumab-producing minipools during 7 days of culture: A, cell viability; B, viable cell density (VCD); C, cell productivity; D, cumulative cell density (CCD) vs cell productivity; mp, minipools of denosumab-producing cell lines.
Получение моноклональных клонов-продуцентов рекомбинантного белка деносумаб
Клоны-продуценты рекомбинантного белка деносумаба получали методом клонирования в полутвердую среду с последующим отбором клонов с помощью роботизированной системы ClonePix FL (в 12- и 96-лучных планшетах, всего 1056 колоний). Для определения лидерных клонов проводили серию скринингов КЖ клонов-продуцентов деносумаба методом ИФА. В ходе скрининга отбирали клоны с максимальной продуктивностью (результаты не приведены), в соответствии с принципом, представленным на рисунке 1. Выбранные лидерные клоны-продуценты (24 клона) переносили в условия шейкерного культивирования для проведения адаптации и последующей криоконсервации культур клеток.
Оптимизация культивирования клонов-продуцентов деносумаба
Культивирование клонов-продуцентов деносумаба в непрерывном режиме с подпиткой проводили в течение 9 сут, исследуя ростовые и продукционные характеристики культур (рис. S2, опубликован на сайте журнала3). Жизнеспособность клонов к 9 сут оставалась более 80% (рис. S2А). Максимальное значение показателя VCD (более 45×10⁶ клеток/мл) фиксировали на 6–8 сут культивирования для следующих клонов-продуцентов: clone-12 (48,5×10⁶ клеток/мл) и clone-23 (47,7×10⁶ клеток/мл) (рис. S2B). Продуктивность клонов варьировала от 0,9 до 6,5 г/л (рис. S2C). Выделены лидерные клоны с продуктивностью деносумаба более 6 г/л: clone-8 (6,58 г/л), clone-13 (6,52 г/л), clone-19 (6,04 г/л). Определены клоны, для которых продемонстрированы одновременно высокие значения плотности жизнеспособных клеток и выхода продукта: clone-13, clone-8, clone-11, clone-6 (рис. S2D). Максимальная специфическая продуктивность (выше 35 пг/клетка/сут) показана для следующих клонов: clone-16 (38,5 пг/клетка/сут), clone-5 (36,2 пг/клетка/сут), clone-19 (35,9 пг/клетка/сут) (табл. 2).
Таблица 2. Специфическая продуктивность клонов-продуцентов деносумаба
Table 2. Specific productivity of clones producing denosumab
|
Клон Clone |
Специфическая продуктивность, пг/клетка/сут Specific productivity, pg/cell/day |
||||
|
Время культивирования, сут Culture time, days |
|||||
|
5 |
6 |
7 |
8 |
9 |
|
|
clone-1 |
11,6 |
14,4 |
5,4 |
23,0 |
16,9 |
|
clone-2 |
14,7 |
28,4 |
13,1 |
29,5 |
26,4 |
|
clone-3 |
2,8 |
8,8 |
9,8 |
10,2 |
17,6 |
|
clone-4 |
8,7 |
22,1 |
20,2 |
22,5 |
15,8 |
|
clone-5 |
11,3 |
27,5 |
14,6 |
26,1 |
36,2 |
|
clone-6 |
9,7 |
14,5 |
18,2 |
21,1 |
24,9 |
|
clone-7 |
10,6 |
18,3 |
14,6 |
17,7 |
22,6 |
|
clone-8 |
14,3 |
18,9 |
8,1 |
24,0 |
32,2 |
|
clone-9 |
8,5 |
16,1 |
9,1 |
22,6 |
19,7 |
|
clone-10 |
14,3 |
20,5 |
36,9 |
22,1 |
13,1 |
|
clone-11 |
9,1 |
16,8 |
6,6 |
13,5 |
28,4 |
|
clone-12 |
6,0 |
15,1 |
15,6 |
14,4 |
11,1 |
|
clone-13 |
12,6 |
23,0 |
14,0 |
20,7 |
32,5 |
|
clone-14 |
4,9 |
15,2 |
24,8 |
16,3 |
25,0 |
|
clone-15 |
10,7 |
19,2 |
20,4 |
21,9 |
31,9 |
|
clone-16 |
8,4 |
18,6 |
19,6 |
22,0 |
38,5 |
|
clone-17 |
0,0 |
5,2 |
13,7 |
13,7 |
11,2 |
|
clone-18 |
8,0 |
14,1 |
14,9 |
17,6 |
27,2 |
|
clone-19 |
8,9 |
18,4 |
16,5 |
21,5 |
35,9 |
|
clone-20 |
0,1 |
6,8 |
20,1 |
10,3 |
5,0 |
|
clone-21 |
5,6 |
13,4 |
16,1 |
12,0 |
20,3 |
|
clone-22 |
0,0 |
9,1 |
28,9 |
11,2 |
18,6 |
|
clone-23 |
3,2 |
9,2 |
17,5 |
9,5 |
19,2 |
|
clone-24 |
2,0 |
5,5 |
28,1 |
15,1 |
20,6 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Clone — моноклональные клеточные линии-продуценты деносумаба.
Note. Clone, monoclonal cell lines producing denosumab.
Таким образом, в результате проведенного исследования была получена панель клонов-продуцентов рекомбинантного терапевтического белка деносумаба. Лидерные клоны (6–8 клонов), характеризующиеся оптимальными параметрами, были отобраны для последующих экспериментов, направленных на оценку стабильности ростовых и продукционных свойств.
ОБСУЖДЕНИЕ
Критическим аспектом разработки рекомбинантных терапевтических белков является выбор клеточной линии-продуцента. Для производства рекомбинантных белков в биофармацевтическом производстве наиболее часто используют линию клеток яичника китайского хомячка CHO [19]. Имеющийся опыт создания препаратов на основе этой клеточной линии может существенно сократить сроки и затраты при разработке лекарственных средств [20]. Клетки СНО пригодны для крупномасштабных промышленных процессов культивирования в суспензионных условиях благодаря способности достигать высоких показателей VCD и обеспечивать максимальный выход белка [21–23]. Важным преимуществом является профиль гликозилирования продуцируемых белков, близкий человеческому, что повышает вероятность сохранения биологической активности рекомбинантных белков в организме человека и обеспечивает эффективность терапии [24]. Культура клеток СНО характеризуется низкой восприимчивостью к вирусам человека, обусловленной отсутствием экспрессии многих человеческих вирусных генов, что делает эту клеточную линию предпочтительной с точки зрения биобезопасности при коммерческом производстве препаратов [25–27]. Способность клеток линии СНО адаптироваться к изменениям pH, уровню кислорода, давлению или температуре [28] позволяет варьировать критические параметры качества конечного продукта. Клетки СНО способны к росту в бессывороточных средах, что снижает риск контаминации вирусами и прионами, обеспечивая биобезопасность терапевтических белков. Применение таких сред также способствует воспроизводимости профиля качества белка, повышению продуктивности клеточной линии и оптимизации стадий выделения и очистки белка (за счет снижения белковых примесей) [29].
К недостаткам линии СНО относится присутствие в гликозилированных рекомбинантных белках гликанов (галактоза-альфа-1,3-галактоза, N-гликолилнейраминовая кислота) [30][31], что может повышать иммуногенность и изменять фармакокинетику терапевтического белка [32].
Основные этапы процесса разработки стабильных моноклональных клеточных линий-продуцентов рекомбинантных белков (cell line development) могут варьировать в зависимости от используемых модифицированных клеточных линий, экспрессионных векторов, методов и оборудования.
Экспрессионный вектор должен содержать все необходимые регуляторные элементы для обеспечения эффективной экспрессии целевого гена, встроенного в геном родительской клеточной линии. Вектор подбирается под определенный тип клеток и целевой белок. От должного конструирования генно-инженерной конструкции и содержания регуляторных элементов зависит продукция целевого белка. В настоящее время изучены и апробированы различные регуляторные генетические элементы, которые способствуют увеличению выхода целевого белка [33].
Тип селективного маркера является ключевым фактором при получении продуцентов. Для селекции продуцентов традиционно применяют векторы, содержащие гены устойчивости к антибиотикам, такие как ген пуромицин-N-ацетилтрансферазы, позволяющий трансфицированным клеткам расти в присутствии антибиотика. Для эффективного проведения селекции и отбора высокопродуктивных клеточных линий на предварительном этапе работ подбирается оптимальная концентрация селективного антибиотика. Выбор системы селекции определяется конкретной клеточной линией; например, существуют линии, система селекции которых основана на механизмах ауксотрофии, такие как CHO-DG44 [34], СНО-GS и др. В последнее время активно внедряют методы получения новых клеточных линий и улучшения клеточного метаболизма существующих линий с помощью CRISPR/Cas9 [35].
Для трансфекции эукариотических клеточных линий применяются различные реагенты (липофектамин, полиэтиленимин), а также электропораторы и др. Наиболее распространенным методом для стабильной трансфекции эукариотических клеток является электропорация [36]. Параметры электропорации (напряжение, длительность импульса, частота и др.) подбираются индивидуально для каждой клеточной линии, обеспечивая максимальную эффективность трансфекции и стабильную интеграцию генно-инженерной конструкции в геном клеток хозяина.
Использование моноклональной клеточной линии для производства рекомбинантных терапевтических белков является обязательным регуляторным требованием для регистрации лекарственных препаратов. Моноклональность культуры играет ключевую роль в обеспечении качества биотехнологического продукта, полученного с помощью технологии рекомбинантной ДНК, и стабильности производственного процесса [37]. При разработке моноклональных клеточных линий используют различные подходы, в том числе метод предельного разведения, а также специализированное оборудование, предназначенное для обеспечения получения клеточной линии из одной клетки-предшественницы с высокой вероятностью (дозаторы единичных клеток, сортеры, роботизированные системы для получения клонов, системы фотодокументирования планшетов и др.). В данной работе для получения клонов-продуцентов деносумаба была использована роботизированная система Clone Pix, осуществляющая отбор колоний клеток из полутвердой среды в автоматическом режиме при асептических условиях [38].
Для получения высокопродуктивного продуцента необходима большая выборка клеточных линий. В данной работе из 1920 минипулов селекцию прошел 1041 минипул (около 54%). Среди них при культивировании в периодическом режиме в течение 7 сут было выявлено 4 минипула с продуктивностью более 1,5 г/л (0,2%). Затем лидерный минипул с продуктивностью около 2 г/л был клонирован, в результате чего получено 1056 моноклонов. При культивировании среди них было выявлено 3 моноклона с продуктивностью более 6 г/л (0,3%). Таким образом, на основе имеющейся выборки минипулов и клонов удалось выявить моноклоны, обеспечивающие титр целевого белка на 9 сут более 6 г/л. Этот подход позволяет прогнозировать необходимое количество исследуемых клеточных линий для достижения требуемого уровня выхода целевого белка. В настоящее время активно применяется математическое моделирование при отборе наиболее предпочтительных клонов по разным показателям [39].
Подход к разработке моноклональных клеточных линий-продуцентов может значительно различаться в зависимости от выбора родительской клеточной линии, экспрессионных векторов, используемых материалов, методов анализа и оборудования на разных этапах разработки. Достижение высоких титров целевого рекомбинантного белка стало возможным благодаря комплексу работ, направленных на усовершенствование векторов экспрессии; выбора клеток-хозяев, методов скрининга, продуцентов, высокотехнологичного оборудования; оптимизацию сред и подпиток определенного химического состава, а также благодаря применению инновационных решений в этой области.
Рост спроса на биотерапевтические препараты стимулирует необходимость сокращения времени и затрат на разработку клеточных линий. Это способствует совершенствованию методов, реактивов и оборудования для получения клонов-продуцентов.
Авторы данной работы представили собственный подход и описали основные этапы процесса разработки стабильных моноклональных клеточных линий-продуцентов рекомбинантных белков на основе суспензионной клеточной линии СНО на примере получения продуцентов деносумаба.
ВЫВОДЫ
- Отработана схема получения высокопродуктивных клеточных линий-продуцентов рекомбинантных белков на основе суспензионной клеточной линии СНО.
- Получены высокопродуктивные моноклональные клеточные линии-продуценты рекомбинантного терапевтического белка деносумаб с выходом целевого белка более 6 г/л.
- Предложенный подход к созданию клеточных линий-продуцентов может быть использован для получения широкого спектра коммерчески значимых рекомбинантных белков, включая моноклональные антитела, ферменты, факторы свертывания крови и другие белки.
1. https://dhpp.hpfb-dgpsa.ca/review-documents/resource/RDS1710769045419
https://dhpp.hpfb-dgpsa.ca/review-documents/resource/RDS1710165579186
https://adisinsight.springer.com/drugs/800049295
2. https://doi.org/10.30895/2221-996X-2025-553-fig-s1
3. https://doi.org/10.30895/2221-996X-2025-553-fig-s2
Список литературы
1. Zhu MM, Mollet M, Hubert RS, Kyung YS, Zhang GG. Industrial production of therapeutic proteins: Cell lines, cell culture, and purification. Handbook of Industrial Chemistry and Biotechnology. 2017;(3):1639–69. https://doi.org/10.1007/978-3-319-52287-6_29
2. Yang Y, Li Z, Li Q, Ma K, Lin Y, Feng H, Wang T. Increase recombinant antibody yields through optimizing vector design and production process in CHO cells. Appl Microbiol Biotechnol. 2022;106(13–16):4963–75. https://doi.org/10.1007/s00253-022-12051-5
3. Fischer S, Handrick R, Otte K. The art of CHO cell engineering: A comprehensive retrospect and future perspectives. Biotechnol Adv. 2015;33(8):1878–96. https://doi.org/10.1016/j.biotechadv.2015.10.015
4. Zhu J. Mammalian cell protein expression for biopharmaceutical production. Biotechnol Adv. 2012;30(5):1158–70. https://doi.org/10.1016/j.biotechadv.2011.08.022
5. Thombre S, Gadgil M. Increase in efficiency of media utilization for recombinant protein production in Chinese hamster ovary culture through dilution. Biotechnol Appl Biochem. 2011;58(1):25–31. https://doi.org/10.1002/bab.9
6. Pal D, Patel G, Dobariya P, Nile SH, Pande AH, Banerjee UC. Optimization of medium composition to increase the expression of recombinant human interferon-β using the Plackett–Burman and central composite design in E. coli SE1. 3 Biotech. 2021;11(5):226. https://doi.org/10.1007/s13205-021-02772-1
7. Li W, Fan Z, Lin Y, Wang T-Y. Serum-free medium for recombinant protein expression in Chinese hamster ovary cells front. Front Bioeng Biotechnol. 2021;9:646363. https://doi.org/10.3389/fbioe.2021.646363
8. Almo SC, Love JD. Better and faster: Improvements and optimization for mammalian recombinant protein production. Curr Opin Struct Biol. 2014;26:39–43. https://doi.org/10.1016/j.sbi.2014.03.006
9. Schellenberg J, Nagraik T, Wohlenberg OJ, Ruhl S, Bahnemann J, Scheper T, Solle D. Stress-induced increase of monoclonal antibody production in CHO cells. Eng Life Sci. 2022;22(5):427–36. https://doi.org/10.1002/elsc.202100062
10. Zhu X, Zhang K, Luo H, Wu J. Overexpression of the class A penicillin-binding protein PonA in Bacillus improves recombinant protein production. Bioresour Technol. 2023;383:129219. https://doi.org/10.1016/j.biortech.2023.129219
11. Тимонова СС, Смолова КА, Зарипова ДТ, Пантюшенко МС, Королева МА, Анисимов РЛ и др. Увеличение продуктивности клеточной линии-продуцента арилсульфатазы B за счет коэкспрессии формилглицин-генерирующего фермента. БИОпрепараты. Профилактика, диагностика, лечение. 2022;22(1):80–93. https://doi.org/10.30895/2221-996X-2022-22-1-80-93
12. Lu J, Hu D, Zhang Y, Ma C, Shen L, Shuai B. Current comprehensive understanding of denosumab (the RANKL neutralizing antibody) in the treatment of bone metastasis of malignant tumors, including pharmacological mechanism and clinical trials. Front Oncol. 2023;13:1133828. https://doi.org/10.3389/fonc.2023.1133828
13. Di Lorenzo L. Denosumab in elderly osteoporotic patients. A narrative review. Clin Ter. 2023;174(6):545–9. https://doi.org/10.7417/CT.2023.5023
14. Abduelkarem AR, Guella A, Hamrouni AM, Hassanein MM, Nasr A, Rana O. Denosumab use in chronic kidney disease associated osteoporosis: A narrative review. Risk Manag Healthc Policy. 2023;16:1809–13. https://doi.org/10.2147/RMHP.S426869
15. Tan X, Zhang Y, Wei D, Yang Y, Xiang F. Denosumab for giant cell tumors of bone from 2010 to 2022: A bibliometric analysis. Clin Exp Med. 2023;23(7):3053–75. https://doi.org/10.1007/s10238-023-01079-0
16. Imre A, Zoltán S, Miklós S. Current indications for denosumab in benign bone tumours. EFORT Open Rev. 2023;8(12):895–905. https://doi.org/10.1530/EOR-23-0138
17. Тимонова СС, Пантюшенко МС, Тихонов РВ, Пискунов АА, Бадэ ВН. Оптимизация процесса культивирования клона-продуцента рекомбинантного лизосомального фермента идуронат-2-сульфатазы. Биотехнология. 2021;37(2):34–47. https://doi.org/10.21519/0234-2758-2021-37-2-34-47
18. Тимонова СС, Павелко ВИ, Кирик ИА, Бадэ ВН, Малыгина ТО, Хамитов РА, Пискунов АА. Принцип оперативного выбора лидерных клонов-продуцентов моноклональных антител при создании стабильных клеточных линий на основе СНО. Биотехнология. 2019;35(4):65–72. https://doi.org/10.21519/0234-2758-2019-35-4-65-72
19. Tihanyi B, Nyitray L. Recent advances in CHO cell line development for recombinant protein production. Drug Discov Today Technol. 2020;38:25–34. https://doi.org/10.1016/j.ddtec.2021.02.003
20. Lewis NE, Liu X, Li Y, Nagarajan H, Yerganian G, O’Brien E. Genomic landscapes of Chinese hamster ovary cell lines as revealed by the Cricetulus griseus draft genome. Nat Biotechnol. 2013;31(8):759–65. https://doi.org/10.1038/nbt.2624
21. Huang YM, Hu W, Rustandi E, Chang K, Yusuf-Makagiansar H, Ryll T. Maximizing productivity of CHO cell-based fed-batch culture using chemically defined media conditions and typical manufacturing equipment. Biotechnol Prog. 2010;26(5):1400–10. https://doi.org/10.1002/btpr.436
22. Lai T, Yang Y, Ng SK. Advances in Mammalian cell line development technologies for recombinant protein production. Pharmaceuticals (Basel). 2013;6(5):579–603. https://doi.org/10.3390/ph6050579
23. Kim JY, Kim YG, Lee GM. CHO cells in biotechnology for production of recombinant proteins: Current state and further potential. Appl Microbiol Biotechnol. 2012;93(3):917–30. https://doi.org/10.1007/s00253-011-3758-5
24. El Maï N, Donadio-Andréi S, Iss C, Calabro V, Ronin C. Engineering a human-like glycosylation to produce therapeutic glycoproteins based on 6-linked sialylation in CHO cells. Methods Mol Biol. 2013;988:19–29. https://doi.org/10.1007/978-1-62703-327-5_2
25. Boeger H, Bushnell DA, Davis R, Griesenbeck J, Lorch Y, Strattan JS, et al. Structural basis of eukaryotic gene transcription. FEBS Lett. 2005;579(4):899–903. https://doi.org/10.1016/j.febslet.2004.11.027
26. Bandaranayake A.D, Almo SC. Recent advances in mammalian protein production. FEBS Lett. 2014;588(2):253–260. https://doi.org/10.1016/j.febslet.2013.11.035
27. Xu X, Nagarajan H, Lewis NE, Pan S, Cai Z, Liu X, et al. The genomic sequence of the Chinese hamster ovary (CHO)-K1 cell line. Nat Biotechnol. 2011;29(8):735–41. https://doi.org/10.1038/nbt.1932
28. Li F, Vijayasankaran N, Shen AY, Kiss R, Amanullah A. Cell culture processes for monoclonal antibody production. MAbs. 2010;2(5):466–79. https://doi.org/10.4161/mabs.2.5.12720
29. Dumont J, Euwart D, Mei B, Estes S, Kshirsagar R. Human cell lines for biopharmaceutical manufacturing: History, status, and future perspectives. Crit Rev Biotechnol. 2016;36(6):1110–22. https://doi.org/10.3109/07388551.2015.1084266
30. Liu L. Antibody glycosylation and its impact on the pharmacokinetics and pharmacodynamics of monoclonal antibodies and Fc-fusion proteins. J Pharm Sci. 2015;104(6):1866–84. https://doi.org/10.1002/jps.24444
31. Sommer JM, Buyue Y, Bardan S, Peters RT, Jiang H, Kamphaus GD, et al. Comparative field study: impact of laboratory assay variability on the assessment of recombinant factor IX Fc fusion protein (rFIXFc) activity. Thromb Haemost. 2014;112(5):932–40. https://doi.org/10.1160/TH13-11-0971
32. Butler M, Spearman M. The choice of mammalian cell host and possibilities for glycosylation engineering. Curr Opin Biotechnol. 2014;30:107–12. https://doi.org/10.1016/j.copbio.2014.06.010
33. Maksimenko O, Gasanov NB, Georgiev P. Regulatory elements in vectors for efficient generation of cell lines producing target proteins. Acta Naturae. 2015;7(3):15–26. https://doi.org/10.32607/20758251-2015-7-3-15-26
34. Csató-Kovács E, Salamon P, Fikó-Lászlo S, Kovács K, Koka A, András-Korodi M, et al. Development of a mammalian cell line for stable production of anti-PD-1. Antibodies (Basel). 2024;13(4):82. https://doi.org/10.3390/antib13040082
35. Grav LM, Rojek JB, la Cour Karottki KJ, Lee JS, Kildegaard HF. Application of CRISPR/Cas9 genome editing to improve recombinant protein production in CHO cells. Methods Mol Biol. 2025;2853:49–69. https://doi.org/10.1007/978-1-0716-4104-0_5
36. Chong ZX, Yeap SK, Ho WY. Transfection types, methods and strategies: A technical review. PeerJ. 2021;9:e11165. https://doi.org/10.7717/peerj.11165
37. Welch JT, Arden NS. Considering “clonality”: A regulatory perspective on the importance of the clonal derivation of mammalian cell banks in biopharmaceutical development. Biologicals. 2019;62:16–21. https://doi.org/10.1016/j.biologicals.2019.09.006
38. Тимонова СС, Павелко ВИ, Кирик ИА, Бадэ ВН, Пискунов АА, Хамитов РА. Метод Монте-Карло для вычисления вероятности моноклональности клеточных линий. Биотехнология. 2024;40(1):100–8. https://doi.org/10.56304/S0234275824010113
39. Goldrick S, Alosert H, Lovelady C, Bond NJ, Senussi T, Hatton D, et al. Next-generation cell line selection methodology leveraging data lakes, natural language generation and advanced data analytics. Front Bioeng Biotechnol. 2023;11:1160223. https://doi.org/10.3389/fbioe.2023.1160223
Об авторах
С. С. ТимоноваРоссия
Тимонова Софья Сергеевна, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
И. А. Кирик
Россия
Кирик Инесса Анатольевна, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
М. А. Филатова
Россия
Филатова Мария Александровна, канд. вет. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
А. И. Анфилатова
Россия
Анфилатова Анастасия Ивановна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
С. С. Шубина
Россия
Шубина Софья Сергеевна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
А. А. Полупанова
Россия
Полупанова Анна Андреевна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
А. Ф. Габдрахманова
Россия
Габдрахманова Алина Фаритовна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Е. С. Иванов
Россия
Иванов Евгений Сергеевич
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
В. Н. Бадэ
Россия
Бадэ Вероника Николаевна, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
А. А. Пискунов
Россия
Пискунов Александр Александрович, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Р. А. Хамитов
Россия
Хамитов Равиль Авгатович, д-р мед. наук, проф.
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Дополнительные файлы

|
1. Рис. S1. Подбор концентрации селективного антибиотика для клеточной линии СНО: А и С — концентрация жизнеспособных клеток (VCD); В и D — жизнеспособность клеток. В легенде указано: контроль — среда без антибиотиков; hygro — среда с антибиотиком гигромицином (цифрами указана концентрация, мг/л); G418 — среда с антибиотиком генетицином (цифрами указана концентрация, мг/л). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(1MB)
|
Метаданные ▾ | |

|
2. Рис. S2. Характеристика клонов-продуцентов деносумаба при их культивировании с подпиткой в течение 9 сут: А — жизнеспособность клеток; В — концентрация жизнеспособных клеток (VCD); С — продуктивность клеток; D — зависимость кумулятивной клеточной плотности (CCD) от продуктивности. Clone — моноклональные клеточные линии-продуценты деносумаба. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(736KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Тимонова С.С., Кирик И.А., Филатова М.А., Анфилатова А.И., Шубина С.С., Полупанова А.А., Габдрахманова А.Ф., Иванов Е.С., Бадэ В.Н., Пискунов А.А., Хамитов Р.А. Разработка клеточных линий-продуцентов рекомбинантных терапевтических белков на примере деносумаба. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(3):245-257. https://doi.org/10.30895/2221-996X-2025-553
For citation:
Timonova S.S., Kirik I.A., Filatova M.A., Anfilatova A.I., Shubina S.S., Polupanova A.A., Gabdrakhmanova A.F., Ivanov E.S., Bade V.N., Piskunov A.A., Khamitov R.A. Development of cell lines producing recombinant therapeutic proteins, with denosumab as a case study. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(3):245-257. (In Russ.) https://doi.org/10.30895/2221-996X-2025-553

































