Перейти к:
Программа контроля качества препаратов на основе индуцированных плюрипотентных стволовых клеток
https://doi.org/10.30895/2221-996X-2025-25-2-127-140
Резюме
ВВЕДЕНИЕ. В настоящее время в регуляторной системе отсутствуют гармонизированные единые требования к контролю качества лекарственных препаратов (ЛП) на основе соматических клеток человека (соматотерапевтических ЛП) и тканеинженерных ЛП, в состав которых включены дифференцированные клетки, полученные из индуцированных плюрипотентных стволовых клеток (ИПСК). В связи с этим актуальным представляется формирование подходов в рамках регуляторной системы Евразийского экономического союза (ЕАЭС) к разработке программы контроля качества и установлению критических показателей качества ЛП, полученных из ИПСК.
ЦЕЛЬ. Систематизация опыта ведущих мировых регуляторных органов и нормативных требований Евразийского экономического союза для разработки и обоснования программы контроля качества лекарственных препаратов, полученных из индуцированных плюрипотентных стволовых клеток.
ОБСУЖДЕНИЕ. Основными направлениями терапевтического применения ЛП, полученных из ИПСК, являются лечение нейродегенеративных, сердечно-сосудистых, онкологических заболеваний, сахарного диабета, реакции «трансплантат против хозяина» и офтальмологической патологии. За последнее десятилетие рекомендации и требования к качеству ИПСК клинического уровня были представлены Китайским обществом исследований стволовых клеток, регуляторным органом Японии, Глобальным альянсом по терапии ИПСК (GAiT), Европейским банком ИПСК (EBiSC). В рамках ЕАЭС требования к качеству генетически модифицированных клеток введены в действие в 2025 г. (глава 32 Решения Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств ЕАЭС»). Перечень критических показателей качества ИПСК клинического уровня, предложенный GAiT, в целом соответствует регуляторным нормам ЕАЭС и может быть использован при составлении программы контроля качества ЛП на основе ИПСК для применения на территории Российской Федерации и ЕАЭС. Программа контроля качества готового соматотерапевтического или тканеинженерного ЛП, полученного из ИПСК, должна основываться на принципе прослеживаемости характеристик качества начиная с исходного материала. Процедура получения ИПСК является полноценным технологическим процессом, который должен соответствовать правилам надлежащей производственной практики (GMP) для генетически модифицированных клеток. Контроль качества ИПСК должен включать определение специфических показателей, включая следующие: остаточное содержание ДНК-векторов, использованных для перепрограммирования (оценка чистоты); экспрессия маркеров недифференцированного состояния клеток (подтверждение подлинности); тест на плюрипотентность (оценка активности).
ЗАКЛЮЧЕНИЕ. Программа контроля качества готовых ЛП, полученных из ИПСК, должна соответствовать типу дифференцированных клеток и учитывать показания к их клиническому применению. Критическими аспектами качества при характеризации ИПСК являются доказательство отсутствия примесных недифференцированных клеток и клеток с новыми иммуногенными эпитопами, подтверждение подлинности и генетической стабильности. Рассмотренные подходы к оценке качества ИПСК могут быть использованы для обоснования стратегии контроля качества ЛП на основе ИПСК, а также для формирования спецификаций при государственной регистрации по правилам ЕАЭС.
Ключевые слова
Для цитирования:
Мельникова Е.В., Рачинская О.А., Семенова И.С., Меркулов В.А. Программа контроля качества препаратов на основе индуцированных плюрипотентных стволовых клеток. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):127-140. https://doi.org/10.30895/2221-996X-2025-25-2-127-140
For citation:
Melnikova E.V., Rachinskaya O.A., Semenova I.S., Merkulov V.A. Quality control programmes for induced pluripotent stem cell-derived medicinal products. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):127-140. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-2-127-140
ВВЕДЕНИЕ
Применение клеточной терапии как инновационного подхода к лечению тяжелых жизнеугрожающих, социально значимых заболеваний, для которых отсутствуют эффективные доступные лекарственные препараты (ЛП), ограничивается невозможностью выделить определенные типы клеток или их несоответствием требованиям качества вследствие прежде всего наличия мутаций в геноме, что не позволяет их использовать для производства препарата. Вариантом решения проблем является применение в качестве исходного материала индуцированных плюрипотентных столовых клеток (ИПСК). Исследования последних лет направлены на получение ИПСК для клинического применения (ИПСК «клинического уровня», clinical grade iPSCs) и создания банков клеток для дальнейшего производства препаратов клеточной терапии [1–7]. Направлениями клинического использования ИПСК и полученных на их основе определенных типов дифференцированных клеток являются нейродегенеративные [8–11], сердечно-сосудистые [9][12], онкологические заболевания [9][13], диабет [14][15], реакция «трансплантат против хозяина» [16] и заболевания глаз [9][17].
В настоящее время в мировой регуляторной системе отсутствуют гармонизированные единые требования к контролю качества ЛП на основе соматических клеток человека (соматотерапевтических ЛП) и тканеинженерных ЛП, в состав которых включены дифференцированные клетки, полученные из ИПСК. Это объясняется сравнительно недавним открытием механизма клеточного перепрограммирования, недостаточностью сведений о безопасности направленных изменений эпигенетического профиля клеток, экономически затратным процессом получения и аттестации аутологичных ИПСК, ограниченностью данных по характеризации ИПСК при их хранении в банке клеток (банкирование), а также отсутствием разрешенных к медицинскому применению ЛП на основе ИПСК и подходов к экспертизе представленных материалов для государственной регистрации. В Российской Федерации отмечается отсутствие значительного опыта работы с ИПСК клинического уровня, включая их характеризацию и хранение в Коллекциях клеточных культур, а также подходов к их экспертной оценке.
Цель работы — систематизация опыта ведущих мировых регуляторных органов и нормативных требований Евразийского экономического союза (ЕАЭС) для разработки и обоснования программы контроля качества лекарственных препаратов, полученных из индуцированных плюрипотентных стволовых клеток.
Поиск информации об актуальных клинических исследованиях ЛП на основе ИПСК проводили с помощью реестра клинических исследований (КИ) ClinicalTrials.gov (ключевое слово: «induced pluripotent stem cell»; статус КИ: все, за исключением «unknown» и «withdrawn»). Поиск научных публикаций проводили с использованием базы данных PubMed по ключевым словам: «induced pluripotent stem cell», «clinical-grade human induced pluripotent stem cell lines», «pluripotent stem cell-specific quality control».
ОСНОВНАЯ ЧАСТЬ
Международные подходы к контролю качества индуцированных плюрипотентных стволовых клеток
В настоящее время КИ препаратов, полученных из ИПСК, проводятся преимущественно в США, Китае и Японии (табл. S1, опубликована на сайте журнала1).
Необходимо отметить, что в Китае все препараты на основе стволовых клеток, включая полученные из ИПСК, используются в рамках медицинских технологий без государственной регистрации. КИ в Китае, информация о которых размещена на сайте ClinicalTrial.gov, являются исследованиями, инициированными исследователями (investigators initiated trials, IIT), которые проводятся не для целей государственной регистрации [18].
Китай
В 2021 г. экспертами Китайского общества исследований стволовых клеток (Chinese Society for Stem Cell Research) был разработан документ — Requirements for Human-Induced Pluripotent Stem Cells («Требования к индуцированным плюрипотентным стволовым клеткам человека для клинического использования»), который регламентирует технические требования, методы испытаний и инструкции по использованию, маркировке, упаковке, хранению и транспортировке ИПСК при их производстве и контроле качества (табл. 1) [19].
Таблица 1. Контроль качества индуцированных плюрипотентных стволовых клеток (ИПСК)
Table 1. Quality control of induced pluripotent stem cells (iPSCs)
Характеристика Attribute | Методы анализа Test methods | Нормы Requirements |
Подлинность — морфологический анализ Identity: morphological analysis | Микроскопия Microscopy | Клетки, культивированные в 2D-условиях, должны образовывать компактные колонии с четкими границами и характеризоваться схожей морфологией и наличием плотных межклеточных контактов Cells grown in 2D conditions should form compact colonies with clear edges, be similar in morphology, and have a dense intercellular communication network |
Подлинность — кариотип Identity: karyotype | Дифференциальное G-окрашивание Differential G-banding | Нормальный кариотип 46,XX или 46,XY The normal karyotype is 46,XX or 46,XY |
Жизнеспособность Viability | Подсчет клеток в гемоцитометре при окраске трипановым синим Haemocytometer counting with trypan blue staining | Жизнеспособность клеток ≥90% до криоконсервации и ≥60% после криоконсервации при подсчете в двух повторах с последующим расчетом среднего значения. Разница между результатами подсчетов не должна превышать 10% от среднего арифметического Cell viability should be ≥90% before cryopreservation and ≥60% after cryopreservation, with cell counting in two runs, followed by the calculation of the mean value. The difference between the calculation results should not exceed 10% of their arithmetic mean |
Подлинность — маркеры клеточной популяции Identity: cell surface markers | Проточная цитометрия Flow cytometry | Уровень экспрессии, по крайней мере, двух поверхностных клеточных маркеров (SSEA3, SSEA4, TRA-1-60, TRA-1-81) в популяции клеток должен составлять ≥70%, уровень экспрессии внутриклеточных маркеров Oct4 и Nanog должен составлять ≥70% The expression of at least two of the surface cell markers SSEA3, SSEA4, TRA-1-60 and TRA-1-81 in the cell population should be ≥70%, and the expression of the intracellular markers Oct4 and Nanog should be ≥70% |
Чистота — остаточное содержание ДНК транскрипционных факторов Purity: residual amounts of transcription factor DNA | Количественный ПЦР-анализ Quantitative PCR analysis | Расчет концентрации целевых генов производится в соответствии с построенной стандартной кривой при использовании эталонных стандартов ДНК целевых генов The concentration of target genes is calculated according to the standard curve plotted using reference standards for the DNA of target genes |
Тест на плюрипотентность Pluripotency test | Формирование тератомы in vivo на иммунодефицитных мышах In vivo teratoma formation in immunodeficient mice | ИПСК должны быть способны образовывать in vivo тератомы с производными всех трех зародышевых листков после введения клеток (подкожно, внутримышечно, в пространство семенных канальцев под оболочкой яичек или под почечной капсулой) с последующим гистологическим исследованием при окрашивании препарата гематоксилином и эозином (через 6–10 нед. после образования тератом) iPSCs should be able to form in vivo teratomas with derivatives of all three germ layers after administration of iPSCs (subcutaneous, intramuscular, into the space of the seminal tubules under the testicular membrane, or under the renal capsule), followed by histological examination with haematoxylin and eosin staining (6–10 weeks after teratoma formation) |
Стерильность Микоплазма Занесенные агенты Sterility Mycoplasma Adventitious agents | Фармакопейные методы Compendial methods | Проверка донорского материала на наличие вируса иммунодефицита человека, вирусов гепатита B и гепатита С, T-лимфотропного вируса человека, вируса Эпштейна — Барр, цитомегаловируса и возбудителя сифилиса осуществляется на стадии скрининга доноров. Клетки должны быть стерильными, не содержать бактерий, грибов, микоплазм, вирусов The donor material should be checked for the presence of human immunodeficiency virus, hepatitis B and hepatitis C viruses, human T-lymphotropic virus, Epstein-Barr virus, cytomegalovirus and Treponema pallidum agent at the screening stage of donors. Cells should be sterile and free of bacteria, fungi, mycoplasmas, and viruses |
Аутентификация (внутрипроизводственный контроль) Authentication (in-process control) | Метод коротких тандемных повторов Short tandem repeat analysis | Соответствие STR-профилей ИПСК и материала донора STR profiles of iPSCs and donor material should correspond to each other |
Таблица составлена авторами по данным [19] / The table is prepared by the authors using data from [19]
Примечание. ПЦР — полимеразная цепная реакция; STR — метод коротких тандемных повторов.
Note. PCR, polymerase chain reaction; STR, short tandem repeat.
Учитывая сложность процесса получения ИПСК, использование аллогенных клеток в качестве исходного материала становится экономически целесообразным решением при создании банков клеток клинического уровня. В данном случае ключевое значение приобретает задача обеспечения иммунологической совместимости. Для снижения иммуногенности применяются следующие подходы:
- получение ИПСК от доноров с гомозиготными гаплотипами главного комплекса гистосовместимости (HLA);
- модификация ИПСК для подавления экспрессии HLA, что позволяет решить проблему тканевого несоответствия между HLA донора и пациента [2][20].
Модифицированные клеточные линии ИПСК можно отнести к универсальному источнику получения препаратов для клеточной терапии, обеспечивающему значительное сокращение сроков ожидания лечения, устранение потребности в подборе подходящего донора и необходимость предшествующей иммуносупрессивной терапии. Такой подход оказывается существенно более экономичным вариантом терапии по сравнению с использованием аутологичных ИПСК [4].
Возникновение иммуногенности дифференцированных клеток, полученных из ИПСК, может быть связано с появлением новых иммуногенных эпитопов на этапе получения ИПСК вследствие спонтанных мутаций, происходящих в митохондриальной ДНК в процессе клеточного перепрограммирования. По этой причине рекомендуется проводить генетический анализ на различных этапах производства ЛП на основе ИПСК [9][21].
Анализ чистоты (оценка примесей) включает определение остаточного содержания ДНК транскрипционных факторов, которые могут способствовать возникновению опухолей. Этот риск характерен именно для ИПСК. Установлено, что все четыре ключевых фактора перепрограммирования Яманаки (Ост3/4, Sox2, Klf4, с-Myc) обладают потенциалом вызывать образование опухолей. c-Myc является одним из наиболее часто мутирующих генов при онкологических заболеваниях, и мутация в нем может выступать как драйверная мутация, предоставляя преимущество в пролиферации и селекции клонов опухолевых клеток [22].
В работе J. Wu с соавт. [23] представлена программа контроля качества и критерии приемлемости на стадиях производства ИПСК для всех промежуточных продуктов, используемых при получении островков поджелудочной железы с целью лечения пациентов с сахарным диабетом 2 типа. Программа включает контроль качества следующих типов клеток: стволовых клеток энтодермы, прогениторных клеток поджелудочной железы (ПЖ), эндокринных прогениторных клеток и собственно островковых клеток (активное вещество) (рис. S1, опубликован на сайте журнала2).
ИПСК получали из мононуклеарных клеток периферической крови при использовании набора факторов (Ост4, Sox2, Klf4, с-Myc). Затем были отобраны и охарактеризованы два клона на 10 пассаже, из которых были получены стволовые клетки энтодермы, для которых на 20 пассаже с использованием метода полногеномного секвенирования было подтверждено отсутствие известных онкогенных мутаций. Генетическую стабильность определяли с использованием кариотипирования. Безопасность, связанную с отсутствием примеси ИПСК, оценивали на животных моделях по образованию тератом. Продукты, полученные на промежуточных этапах производства, — прогениторные клетки ПЖ и эндокринные прогениторные клетки оценивали согласно сокращенному контролю качества, определяя подлинность и отсутствие микроорганизмов (тесты на стерильность, микоплазмы, занесенные агенты, бактериальные эндотоксины). Активное вещество (островковые клетки) комплексно характеризовалось по следующим показателям: подлинность (определение основных типов целевых и нецелевых клеток); активность — по секреции инсулина (С-пептида) после стимулирования глюкозой; на отсутствие микроорганизмов.
Япония
В Японии проводятся исследования (стадия IIT) препаратов, полученных из ИПСК, для лечения различных заболеваний: пигментный ретинит (jRCTa050200027), амавроз Лебера (jRCTa050210178, jRCTa050200122, jRCTa050190084), онкологические (jRCTa030220741) и сердечно-сосудистые заболевания (jRCTa032200189), повреждения хряща коленного сустава (jRCTa050190104) и спинного мозга (jRCTa031190228) [24]. В 2013 г. в Японии было выпущено руководство по оценке качества и проведению необходимых доклинических исследований для последующего клинического применения клеток пигментного эпителия сетчатки, полученных из ИПСК. Согласно руководству определены показания для применения препарата: возрастная макулярная дегенерация сетчатки, дегенеративная миопия, болезнь Штаргардта, травматические повреждения, пигментный ретинит3.
В данном руководстве представлены требования к качеству клеток, касающиеся, прежде всего, эффективности и специфической безопасности (оценка примесей), а также описаны показатели, методы и маркеры (рис. 1).
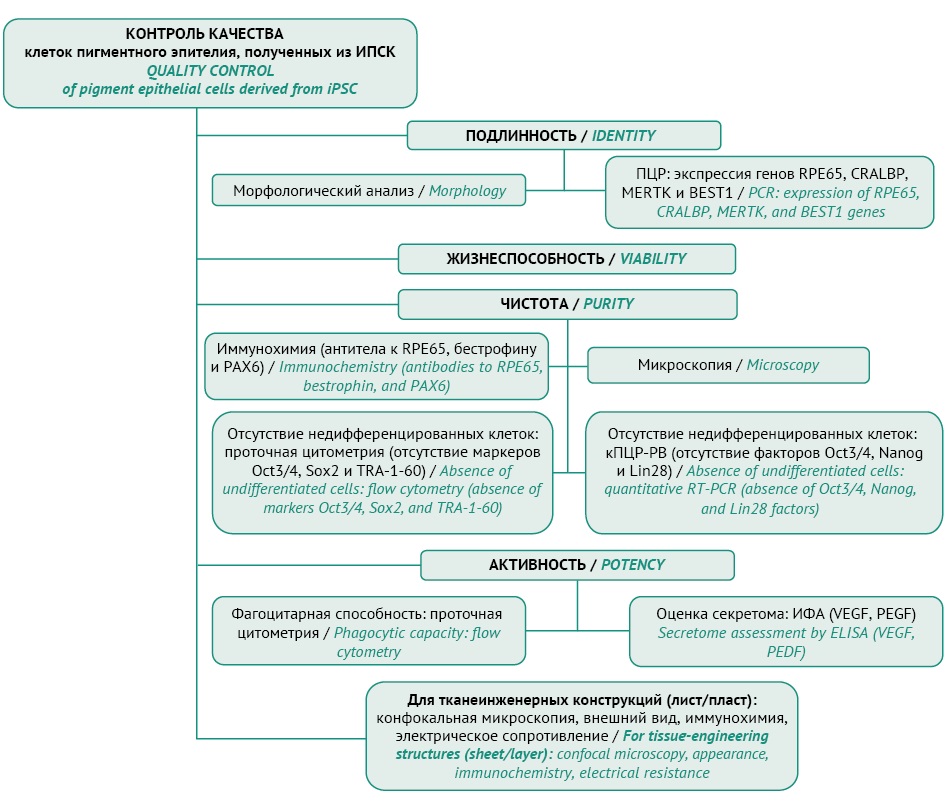
Рисунок подготовлен авторами по материалам Pharmaceutical and Food Safety Bureau, Ministry of Health, Labour and Welfare, Japan5 / The figure is prepared by the authors using materials of the Pharmaceutical and Food Safety Bureau, Ministry of Health, Labour and Welfare, Japan5
Рис. 1. Необходимый перечень показателей качества для клеток пигментного эпителия, полученных из индуцированных плюрипотентных стволовых клеток (ИПСК) согласно требованиям регуляторных органов Японии.
Fig. 1. Quality attributes for pigment epithelial cells derived from induced pluripotent stem cells (iPSCs), as listed in the requirements of the Japanese regulatory authorities.
Примечание. кПЦР-РВ — количественная полимеразная цепная реакция в реальном времени; ИФА — иммуноферментный анализ; VEGF — фактор роста эндотелия сосудов; PEDF — фактор пигментного эпителия.
Note. RT-PCR, real-time polymerase chain reaction; ELISA, enzyme-linked immunosorbent assay; VEGF, vascular endothelial growth factor; PEDF, pigment epithelium-derived factor.
Критические показатели качества для индуцированных плюрипотентных стволовых клеток клинического уровня
В 2018 г. Глобальным альянсом по терапии ИПСК (Global Alliance for iPSC Therapies, GAiT [20]) был определен минимальный набор критериев для контроля качества и критические показатели качества ИПСК клинического уровня, предназначенных для использования в качестве исходного материала для получения препаратов клеточной терапии, подлежащих банкированию [1]. Данные рекомендации основаны на тщательном анализе значимости этих показателей с точки зрения информации о потенциальном риске, связанном с клиническим применением ИПСК, а также направлены на формирование полного понимания возможных последствий, которые могут возникнуть при тестировании (табл. S2, опубликована на сайте журнала4, [25–29]).
Для оценки показателей качества ИПСК таблица S2 дополнена указаниями на действующие фармакопейные статьи Государственной фармакопеи Российской Федерации и фармакопеи ЕАЭС, а также на другие источники, регламентирующие оценку в случае нефармакопейных методов анализа.
Дополнительно на промежуточных этапах получения ИПСК для их характеризации возможно применение расширенного спектра методов для описания и тестирования, включая следующие:
- подробное описание условий культивирования, определение пролиферативной активности ИПСК;
- методы подтверждения генетической стабильности, учитывающие повышенный риск образования мутаций вследствие процессов перепрограммирования клеток, например: исследование однонуклеотидного полиморфизма (single nucleotide polymorphism, SNP-анализ), позволяющего обнаруживать субхромосомные изменения и нейтральную потерю гетерозиготности, что может свидетельствовать о клеточной трансформации; применение полногеномного/полноэкзомного секвенирования для определения локусов возможной полной/частичной интеграции векторов перепрограммирования, ассоциированных с риском образования опухолей, и других генетических маркеров в соответствии с международной базой данных соматических мутаций в опухолях COSMIC, содержащей сведения об известных онкогенах и супрессорных генах опухолей6, классифицируемых согласно рекомендациям Американского колледжа медицинской генетики и геномики (American College of Medical Genetics and Genomics, ACMG) [30];
- иммуноцитохимическое определение маркеров, специфичных для плюрипотентных стволовых клеток человека;
- анализ экспрессии генов с использованием молекулярных матриц, мРНК-матриц или РНК-seq, что позволяет прогнозировать функциональную плюрипотентность.
Впоследствии стратегия контроля качества, предложенная GAiT для характеризации ИПСК клинического уровня с целью дальнейшего включения в коллекции и банки, была адаптирована Европейским банком индуцированных плюрипотентных стволовых клеток (European bank for induced pluripotent stem cells, EBiSC) [7], а также конкретными медицинскими центрами, специализирующимися на производстве препаратов генной и клеточной терапии в соответствии с требованиями правил надлежащей производственной практики (good manufacturing practice, GMP) [4][5][31].
С целью стандартизации процесса EBiSC предложены рекомендации для характеризации ИПСК при создании банков клеток клинического уровня [7]. Согласно данным рекомендациям необходимо проведение оценки безопасности на первичных клетках, на ранних пассажах клеточной линии после перепрограммирования и на клеточной линии ИПСК для включения в банк клеток с помощью следующих методов: аутентификация клеточной линии (STR-профиль, short tandem repeat profile), анализ генетической стабильности (G-бэндинг, SNP или сравнительная геномная гибридизация), анализ на стерильность и отсутствие микоплазмы. Такой подход к контролю качества донорского материала и промежуточных этапов производства ИПСК позволяет накопить надежный массив исторических данных, необходимых для обоснования объема текущего контроля качества (например, проверка вирусной безопасности полученных клеточных линий проводится лишь при отсутствии результатов тестирования донора) и оценки любых изменений процесса производства. В случае прямого перепрограммирования клеток рекомендуется проверять собранные первичные образцы и/или полученные популяции клеток на стерильность и наличие вирусных агентов, а также подтверждать идентичность клеточной линии (принадлежность конкретному человеку).
Наличие результатов генетического тестирования первичных клеток (например, кариотип, SNP-профиль), позволяет в последующем выявить врожденные генетические аномалии и любые отклонения, возникшие непосредственно в ходе перепрограммирования.
Подтверждение подлинности, активности и чистоты ИПСК рекомендуется выполнять на предназначенных для включения в банк клетках и перед получением дифференцированных клеток для готового ЛП. При этом необходимо проводить количественное определение жизнеспособных клеток, оценку экспрессии маркеров недифференцированных ИПСК, тест на плюрипотентность и др. Морфологический анализ рекомендуется выполнять для всех объектов при получении ИПСК, в том числе для первичных клеток и в ходе рутинного культивирования, в связи с высокой степенью вероятности изменения морфологии клеток, что может произойти в случае микробной контаминации или вследствие появления генетических мутаций.
Для рутинного мониторинга при культивировании рекомендованы следующие условия и периодичность:
- определение STR-профиля: каждые 6–8 нед. или 10–12 пассажей на линиях клеток в культуре;
- оценка генетической стабильности: каждые 6 нед. или 10 пассажей, а также после проведения селекции или при появлении изменений в морфологии и скорости роста клеток в культуре;
- визуальная оценка стерильности: ежедневно;
- тестирование на присутствие микоплазм: каждые 3–4 нед. или 5–6 пассажей, а также при появлении изменений в морфологии и скорости роста клеток в культуре;
- оценка морфологии: ежедневно;
- определение экспрессии специфических маркеров и тест на плюрипотентность: при появлении изменений в морфологии и скорости роста клеток в культуре.
Согласно данным J.J. Novoa с соавт. [4][5], предложенная стратегия контроля качества [1] позволяет охарактеризовать ИПСК по необходимым показателям безопасности и эффективности для их последующего хранения в банках клеток. Авторы провели валидацию методик контроля качества, специфичных для ИПСК, для определения:
- остаточного содержания ДНК-векторов, использованных для перепрограммирования (оценка чистоты);
- маркеров недифференцированного состояния клеток (подтверждение подлинности);
- плюрипотентности (оценка активности).
Одним из основных этапов внутрипроизводственного контроля ИПСК является оценка безопасности, включающая проверку туморогенного потенциала [4][5]. Это исследование предусматривает анализ уровня остаточного содержания ДНК-векторов, использованных для перепрограммирования, и установление оптимального минимального числа пассажей клеточной линии, позволяющего оценить стабильность генома клеток для последующего включения ИПСК в банк и клинического использования. В работе J.J. Novoa с соавт. [4][5] показано, что скрининг на присутствие остаточных ДНК-векторов в эписомальной форме наиболее целесообразно осуществлять между восьмым и десятым пассажами. Это позволит одновременно исключить клеточные линии, содержащие векторы в эписомальной форме, оптимизировать число пассажей для снижения потенциального риска неблагоприятного воздействия на целостность генома и минимизировать объем выбраковываемых клеточных линий ИПСК.
Для анализа ДНК-векторов было установлено минимальное количество клеток в образце — 20000 клеток (120 нг геномной ДНК). Поскольку используемые ДНК-векторы содержат регуляторный элемент EBNA-1 вируса Эпштейна — Барр, необходимо проводить дополнительное тестирование донора на наличие инфекции данным вирусом и антител к нему. Положительный результат такого теста требует дополнительного исследования материала донора на выявление маркера BNRF1 вируса Эпштейна — Барр. Этот подход позволит дифференцировать эндогенную вирусную инфекцию Эпштейна — Барр от введенного во время перепрограммирования ИПСК элемента EBNA-1. Кроме того, рекомендуется проводить полногеномное секвенирование клеточных линий ИПСК, предназначенных для хранения в банке клеток, что позволит выявить возможную интеграцию фрагментов плазмидных последовательностей, лишенных последовательности EBNA-1 [5].
Оценка потенциала дифференцировки ИПСК в направлении трех зародышевых листков осуществляется посредством теста на функциональную плюрипотентность, который выполняется с применением покровных стекол и конфокальной микроскопии, обеспечивая морфологический анализ и оценку экспрессии маркеров, специфичных для линии. Согласно результатам исследования J.J. Novoa с соавт. [4], полученные ими клеточные линии ИПСК продемонстрировали способность к дифференцировке во всех направлениях: панкреатические островки (энтодерма); почечные органоиды и кардиомиоциты (мезодерма); кератиноциты, ГАМКергические интернейроны и органоиды внутреннего уха (эктодерма). Оценка экспрессии маркеров недифференцированного состояния клеток проводилась с использованием трех типов маркеров: двух внеклеточных (SSEA4 и TRA-1-60) и одного внутриклеточного (Oct3/4) [5].
Требования к контролю качества индуцированных плюрипотентных стволовых клеток в соответствии с нормативной документацией ЕАЭС
Исходное сырье и материалы
Нормативно-правовое обеспечение контроля качества ЛП, полученных из ИПСК, осуществляется на протяжении всего жизненного цикла продукции начиная с этапа разработки в строгом соответствии с требованиями документации ЕАЭС7. Уточненные требования к разработке, контролю качества, проведению доклинических и клинических исследований ЛП на основе соматических и генетически модифицированных (ГМ) клеток были утверждены в 2025 г. главами 31 и 32 к Решению Совета Евразийской экономической комиссии (ЕЭК) № 898 (далее — Решение Совета ЕЭК № 89). Эти положения полностью гармонизированы с европейскими требованиями9. Согласно этим требованиям ГМ клетки разрабатываются с целью терапевтического применения (ГТЛП) или в производственных целях при разработке продукта клеточной терапии или тканевой инженерии (например, для создания ИПСК, которые впоследствии дифференцируются в соматотерапевтические ЛП или тканеинженерные ЛП). При этом в отношении ЛП, созданных на основе ИПСК, принципы GMP и научно обоснованные рекомендации применяются последовательно начиная с этапа заготовки клеток, включая создание ИПСК и последующие этапы отбора. Программа контроля качества таких препаратов должна включать все этапы производственного процесса: контроль сырья для получения ИПСК, контроль самих ИПСК, промежуточных продуктов производства, активной фармацевтической субстанции (АФС) и готового препарата.
Получение ИПСК предполагает использование следующих исходных компонентов: факторы, обеспечивающие модификацию (перепрограммирование) клеток; средства доставки факторов (плазмидные, вирусные векторы и др.); первичные клетки человека.
Контроль качества процесса получения ИПСК включает следующие ключевые аспекты:
- верификация состава комбинации факторов для модификации (включая коммерчески доступные наборы). Перед использованием факторы должны пройти стерилизацию и проверку на отсутствие вирусной контаминации, в том числе репликационно-компетентных вирусов в случае использования вирусных векторов в качестве средств доставки факторов;
- характеризация первичных клеток и ГМ клеток (ИПСК) по следующим показателям: жизнеспособность клеток, концентрация, чистота (остаточное содержание ДНК транскрипционных факторов, другие примеси), стерильность, активность (тест на плюрипотентность). Подтверждение подлинности (идентификация) должно выполняться с использованием соответствующих генотипических и/или фенотипических маркеров. Эти показатели соответствуют критическим критериям качества для ИПСК клинического уровня как исходного материала для получения препаратов клеточной терапии, предложенным GAiT [1];
- создание главного банка ГМ клеток (ИПСК) должно быть осуществлено до начала I фазы КИ (согласно главе 1 Решения Совета ЕЭК № 89);
- проведение оценки безопасности исходных материалов (донорский материал, ИПСК) относительно возможного присутствия посторонних агентов и подтверждение генетической стабильности;
- проведение оценки характеристик клеток (ИПСК, ЛП на основе ИПСК) до и после генетической модификации, а также после процедуры криоконсервации (заморозка и хранение).
Характеризация банков клеток
Общие требования к характеризации банков клеток описаны в главе 1 Решения Совета ЕЭК № 89 и представлены на рисунке 2. Эти требования могут применяться для характеризации банков ИПСК, принимая во внимание необходимость оценки генетической стабильности, полногеномного и полноэкзомного секвенирования для выявления мутаций. Необходимо подтверждение состояния плюрипотентности клеток для обоснования дальнейшего использования конкретных типов дифференцированных клеток. Важнейший аспект — подтверждение генетической стабильности ИПСК, так как это является основой для определения предельного возраста клеток in vitro, используемых в производстве. Это исследование может проводиться при оценке морфологических характеристик, параметров роста, биохимических, иммунологических, генотипических, фенотипических маркеров.

Рисунок подготовлен авторами по данным Решения Совета ЕЭК № 89 / The figure is prepared by the authors using Decision No. 89 of the Council of the Eurasian Economic Commission
Рис. 2. Общие аспекты характеризации банков клеток.
Fig. 2. General aspects of cell bank characterisation.
Так как банк ГМ клеток (ИПСК) формируется после их получения из соматических клеток путем генетической модификации, необходимо установить полный перечень показателей, определяемых для готового препарата на основе этих клеток, включая оценку наличия примесей, характерных для конкретного процесса производства. Особое внимание необходимо уделить определению остаточного содержания ДНК факторов перепрограммирования и средств их доставки (плазмидный, вирусный вектор или др.).
Сведения регистрационного досье
В соответствии с положениями главы 14 Решения Совета ЕЭК № 89 (требования для получения разрешения на проведение КИ) и Решения Совета ЕЭК № 78 (требования для формирования модуля 3 регистрационного досье) необходимо представить описание процесса производства биологического ЛП (включая ЛП на основе ИПСК), которое должно включать описание критических стадий, пределы и диапазоны показателей качества, критические параметры, влияющие на важнейшие характеристики (подлинность, чистота, биологическая активность, количественное содержание, стабильность), результаты валидации процесса производства (для I–II фаз КИ полные сведения могут отсутствовать)10.
Необходимо представить результаты исследований сопоставимости ЛП, например при изменениях в клеточном исходном материале (источник клеток, метод выделения требуемой(ых) субпопуляции(й) клеток, введение стадии замораживания клеточного материала и др.) или в производственном процессе АФС или ЛП.
Документация на готовый ЛП на основе ИПСК должна содержать подробное обоснование всех показателей качества, предусмотренных спецификацией для АФС и готового продукта, а также критериев приемлемости (допустимых значений) по следующим параметрам: чистота продукта, содержание примесей (предельное содержание с точки зрения клинической безопасности), биологическая активность и другие критические параметры качества, влияющие на функциональные свойства препарата.
Важным аспектом является релевантность аналитических методик контроля качества, подтверждающих их пригодность. При подаче документов на разрешение проведения I фазы КИ требуется предоставить информацию в виде таблицы, содержащей установленные пределы приемлемости и параметры валидации. Для II–III фаз КИ необходимо представить резюме результатов валидации. При государственной регистрации необходим полный пакет данных о валидации методик контроля качества11.
Результаты исследования стабильности ЛП на основе ИПСК, а также информация о предполагаемых сроках годности и условиях хранения должны быть представлены отдельно для АФС, ЛП и промежуточных продуктов, которые подвергаются длительному хранению в ходе производственного процесса. Критическими показателями качества, которые требуют обязательного определения в рамках исследований стабильности ЛП, являются подлинность, биологическая активность и количественное содержание. Для получения разрешения на проведение КИ необходимо представить данные по стабильности, как минимум, одной серии, произведенной согласно технологическому процессу производства, который будет использоваться для производства препаратов для КИ. Допустимо представление данных по стабильности серий, изготовленных в период разработки или с использованием предыдущей версии технологического процесса, при условии соответствия качества указанных серий уровню качества препарата, планируемого к применению в КИ.
Программа контроля качества и состава спецификации ЛП на основе ИПСК в соответствии с п. 17.3 Решения Совета ЕЭК № 78 по специальным требованиям к модулю 3 регистрационного досье на соматотерапевтические ЛП и ЛП на основе ГМ клеток должна включать следующие аспекты:
- модуль 3 регистрационного досье должен содержать резюме о получении, заготовке и испытании тканей и клеток человека (включая исходные материалы, используемые для получения ИПСК);
- должна быть представлена стратегия пулирования в случае объединения аллогенных клеток после стадии дифференцировки из ИПСК (поскольку пулирование ИПСК до настоящего времени не применялось ввиду повышенного риска генетической нестабильности) и информация о мерах по обеспечению прослеживаемости;
- необходимо учитывать вариабельность исходных материалов для прогнозирования направления терапевтического применения и оценки активности, а также источник происхождения первичных клеток, поскольку установлено, что ИПСК сохраняют «эпигенетическую память» [32][33]. Так, показано, что ИПСК, полученные из фетальных нейральных стволовых клеток, формировали большее количество нейральных предшественников и дифференцированных нейрональных клеток по сравнению с ИПСК, полученными из фибробластов [34]; ИПСК, полученные из кератиноцитов, чаще формировали нейроэктодермальные структуры по сравнению с ИПСК, полученными из фибробластов [35];
- необходимо представить данные о валидации процесса производства и методах контроля качества, описании и квалификации банков клеток ИПСК;
- контроль качества готового соматотерапевтического ЛП на основе ИПСК должен включать следующие показатели: подлинность, чистота (стерильность, присутствие микоплазмы, бактериальных эндотоксинов, посторонних агентов и клеточных контаминантов), жизнеспособность, активность, кариологический профиль, туморогенность, пригодность для предполагаемого медицинского применения, подтверждение генетической стабильности, содержание производственных и родственных примесей. Особенное внимание уделяется наличию остаточных количеств недифференцированных ИПСК, клеток с новыми иммуногенными эпитопами и других промежуточных продуктов, появляющихся на этапах перепрограммирования, культивирования и других технологических фазах. Следует отметить, что при характеристике подлинности и активности клеток, полученных из ИПСК, основная проблема заключается в недостаточном уровне их созревания;
- необходимо привести обоснования использования результатов внутрипроизводственного контроля для выпуска серии ЛП;
- необходимо представить описание влияния биологически активных молекул (факторы роста, цитокины) на остальные компоненты АФС;
- для препаратов с трехмерными структурами необходима оценка состояния дифференцировки, структурной и функциональной организации клеток в результате комбинирования с матриксами, скаффолдами, медицинскими изделиями, а также образующегося внеклеточного матрикса;
- при описании разработки ЛП необходимо представить анализ целостности популяции клеток после технологических манипуляций в готовом ЛП.
Таким образом, программа контроля качества готового соматотерапевтического или тканеинженерного ЛП, полученного из ИПСК, должна основываться на принципе прослеживаемости характеристик качества начиная с исходного материала.
ЗАКЛЮЧЕНИЕ
Рассмотренные подходы мировых регуляторных органов, международных организаций, в том числе Европейского банка ИПСК (EBiSC) и отдельных медицинских центров, специализирующихся на производстве препаратов генной и клеточной терапии, основаны на принципе строгой прослеживаемости качества лекарственных препаратов на основе ИПСК начиная с исходного материала ввиду особенностей их производства. Процедура получения ИПСК рассматривается как полноценный технологический процесс, соответствующий правилам надлежащей производственной практики (GMP) для генетически модифицированных клеток.
Контроль качества ИПСК предусматривает определение специфических показателей, включая следующие: остаточное содержание ДНК-векторов, использованных для перепрограммирования (оценка чистоты); экспрессия маркеров недифференцированного состояния клеток (подтверждение подлинности); тест на плюрипотентность (оценка активности). Однако в настоящее время в нормативных документах в недостаточной степени описано регулирование процедур квалификации и валидации этих методик, включая критерии приемлемости, для их использования в условиях производства, соответствующего требованиям GMP.
Перечень критических показателей качества ИПСК клинического назначения, предложенный Глобальным альянсом по терапии ИПСК (GAiT), в целом соответствует регуляторным нормам стран ЕАЭС и с учетом представленных авторами в обзоре нормативных, методических документов и научных рекомендаций может служить основой при составлении программ контроля качества лекарственных препаратов на основе ИПСК для последующего использования на территории Российской Федерации и ЕАЭС.
Программа контроля качества готовых соматотерапевтических или тканеинженерных препартов ЛП, полученных из ИПСК, должна соответствовать типу дифференцированных клеток и учитывать показания к клиническому применению. Критическими аспектами качества при характеризации ИПСК являются доказательство отсутствия примесных недифференцированных клеток и клеток с новыми иммуногенными эпитопами, а также подтверждение подлинности и генетической стабильности.
Дополнительная информация. На сайте журнала «БИОпрепараты. Профилактика, диагностика, лечение» размещены таблицы S1 и S2, рисунок S1.
https://doi.org/10.30895/2221-996X-2025-25-2-127-140-table-s1
https://doi.org/10.30895/2221-996X-2025-25-2-127-140-table-s2
https://doi.org/10.30895/2221-996X-2025-25-2-127-140-fig-s1
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.В. Мельникова — концепция работы, написание текста рукописи, формулировка выводов; О.А. Рачинская, И.С. Семенова — работа с источниками литературы; В.А. Меркулов — участие в формулировке выводов, утверждение окончательной версии статьи для публикации.
Additional information. Tables S1 and S2 and Figure S1 are published on the website of Biological Products. Prevention, Diagnosis, Treatment.
https://doi.org/10.30895/2221-996X-2025-25-2-127-140-table-s1
https://doi.org/10.30895/2221-996X-2025-25-2-127-140-table-s2
https://doi.org/10.30895/2221-996X-2025-25-2-127-140-fig-s1
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. E.V. Melnikova conceptualised the study, drafted the manuscript, and formulated the conclusions. O.A. Rachinskaya and I.S. Semenova worked with literature sources. V.A. Merkulov participated in formulating the conclusions and approved the final version of the manuscript for publication.
1. https://doi.org/10.30895/2221-996X-2025-25-2-127-140-table-s1
2. https://doi.org/10.30895/2221-996X-2025-25-2-127-140-fig-s1
3. Guidance on Evaluation of Autologous Induced Pluripotent Stem Cells-derived Retinal Pigment Epithelial Cells. Pharmaceutical and Food Safety Bureau. Ministry of Health, Labour and Welfare. Japan; 2013.
4. https://doi.org/10.30895/2221-996X-2025-25-2-127-140-table-s2
5. Guidance on Evaluation of Autologous Induced Pluripotent Stem Cells-derived Retinal Pigment Epithelial Cells. Pharmaceutical and Food Safety Bureau. Ministry of Health, Labour and Welfare. Japan; 2013.
6. COSMIC. Catalogue of somatic mutations in cancer. https://cancer.sanger.ac.uk/cosmic
7. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О правилах регистрации и экспертизы лекарственных средств для медицинского применения».
8. Решение Совета Евразийской экономической комиссии от 22.01.2025 № 13 «О внесении изменений в Правила проведения исследований биологических лекарственных средств Евразийского экономического союза».
9. Guideline on human cell-based medicinal products (EMEA/CHMP/410869/2006). EMEA; 2008.
Guideline on quality, non-clinical and clinical aspects of medicinal products containing genetically modified cells. (EMA/CAT/GTWP/671639/2008). EMEA; 2020.
10. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О правилах регистрации и экспертизы лекарственных средств для медицинского применения».
11. Решение Совета ЕЭК от 03.11.2016 № 89 «Об утверждении правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
Список литературы
1. Sullivan S, Stacey GN, Akazawa Ch, Aoyama N, Baptista R, Bedford P, et al. Quality control guidelines for clinical-grade human induced pluripotent stem cell lines. Regen Med. 2018; 13(7):859–66. https://doi.org/10.2217/rme-2018-0095
2. Yoshida S, Kato TM, Sato Y, Umekage M, Ichisaka T, Tsukahara M, et al. A clinical-grade HLA haplobank of human induced pluripotent stem cells matching approximately 40% of the Japanese population. Med. 2023;4(1):51–66.e10. https://doi.org/10.1016/j.medj.2022.10.003
3. Tian P, Elefanty A, Stanley EG, Durnall JC, Thompson LH, Elwood NJ. Creation of GMP-compliant iPSCs from banked umbilical cord blood. Front Cell Dev Biol. 2022;10:835321. https://doi.org/10.3389/fcell.2022.835321
4. Novoa JJ, Westra IM, Steeneveld E, Neves NF, Arendzen ChH, Rajaei B, et al. Good Manufacturing Practice-compliant human induced pluripotent stem cells: From bench to putative clinical products. Cytotherapy. 2024;26(6):556–66. https://doi.org/10.1016/j.jcyt.2024.02.021
5. Novoa J, Westra I, Steeneveld E, Neves NF, Daleman L, Asensio AB, et al. Validating human induced pluripotent stem cell-specific quality control tests for the release of an intermediate drug product in a Good Manufacturing Practice quality system. Cytotherapy. 2024;26(9):1105–17. https://doi.org/10.1016/j.jcyt.2024.04.004
6. O’Shea O, Steeg R, Chapman C, Mackintosh P, Stacey GN. Development and implementation of large-scale quality control for the European Bank for Induced Pluripotent Stem Cells. Stem Cell Res. 2020;45:101773. https://doi.org/10.1016/j.scr.2020.101773
7. Steeg R, Mueller SC, Mah N, Holst B, Cabrera-Socorro A, Stacey GN, et al. EBiSC best practice: How to ensure optimal generation, qualification, and distribution of iPSC lines. Stem Cell Reports. 2021;16(8):1853–67. https://doi.org/10.1016/j.stemcr.2021.07.009
8. Shi J-X, Zhang K-Z. Advancements in autologous stem cell transplantation for Parkinson’s disease. Curr Stem Cell Res Ther. 2024;19(10):1321–7. https://doi.org/10.2174/1574888x19666230907112413
9. Cerneckis J, Cai H, Shi Y. Induced pluripotent stem cells (iPSCs): Molecular mechanisms of induction and applications. Signal Transduct Target Ther. 2024;9(1):112. https://doi.org/10.1038/s41392-024-01809-0
10. Schweitzer JS, Song B, Herrington TM, Park T-Y, Lee N, Ko S, et al. Personalized iPSC-derived dopamine progenitor cells for Parkinson’s disease. N Engl J Med. 2020;382(20):1926–32. https://doi.org/10.1056/nejmoa1915872
11. Choompoo N, Bartley OJM, Precious SV, Vinh N-N, Schnell Ch, Garcia A, et al. Induced pluripotent stem cells derived from the developing striatum as a potential donor source for cell replacement therapy for Huntington disease. Cytotherapy. 2021;23(2):111–8. https://doi.org/10.1016/j.jcyt.2020.06.001
12. Huang K, Hu S, Cheng K. A new era of cardiac cell therapy: Opportunities and challenges. Adv Healthc Mater. 2019; 8(2):e1801011. https://doi.org/10.1002/adhm.201801011
13. Finck AV, Blanchard T, Roselle CP, Golinelli G, June CH. Engineered cellular immunotherapies in cancer and beyond. Nat Med. 2022;28:678–89. https://doi.org/10.1038/s41591-022-01765-8
14. Cuesta-Gomez N, Verhoeff K, Jasra IT, Pawlick R, Dadheech N, Shapiro AMJ, et al. Characterization of stem-cell-derived islets during differentiation and after implantation. Cell Rep. 2022;40(8):111238. https://doi.org/10.1016/j.celrep.2022.111238
15. Ramzy A, Thompson DM, Ward-Hartstonge KA, Ivison S, Cook L, Garcia RV, et al. Implanted pluripotent stem-cell-derived pancreatic endoderm cells secrete glucose-responsive C-peptide in patients with type 1 diabetes. Cell Stem Cell. 2021;28(12):2047–61. https://doi.org/10.1016/j.stem.2021.10.003
16. Kelly K, Bloor AJC, Griffin JE, Radia R, Yeung DT, Rasko JEJ, et al. Two-year safety outcomes of iPS cell-derived mesenchymal stromal cells in acute steroid-resistant graft-versus-host disease. Nat Med. 2024;30(6):1556–8. https://doi.org/10.1038/s41591-024-02990-z
17. Kim JY, Nam Y, Rim YA, Ju JH. Review of the current trends in clinical trials involving induced pluripotent stem cells. Stem Cell Rev Rep. 2022;18(1):142–54. https://doi.org/10.1007/s12015-021-10262-3
18. Мельникова ЕВ, Меркулов ВА, Меркулова ОВ. Регуляторные механизмы внедрения генной и клеточной терапии в медицинскую практику в странах Восточной Азии. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(1):29–41. https://doi.org/10.30895/1991-2919-2024-14-1-29-41
19. Zhang Y, Wei J, Cao J, Zhang K, Peng Y, Deng H, et al. Requirements for human-induced pluripotent stem cells. Cell Prolif. 2022;55(4):e13182. https://doi.org/10.1111/cpr.13182
20. Sullivanan S, Ginty P, McMahon S, May M, Solomon SL, Kurtz A, et al. The Global Alliance for iPSC Therapies (GAiT). Stem Cell Res. 2020;49:102036. https://doi.org/10.1016/j.scr.2020.102036
21. Wei W, Gaffney DJ, Chinnery PF. Cell reprogramming shapes the mitochondrial DNA landscape. Nat Commun. 2021; 12(1):5241. https://doi.org/10.1038/s41467-021-25482-x
22. Yamanaka S. Pluripotent stem cell-based cell therapy — promise and challenges. Cell Stem Cell. 2020;27(4):523–31. https://doi.org/10.1016/j.stem.2020.09.014
23. Wu J, Li T, Guo M, Ji J, Meng X, Fu T, et al. Treating a type 2 diabetic patient with impaired pancreatic islet function by personalized endoderm stem cell-derived islet tissue. Cell Discov. 2024;10(1):45. https://doi.org/10.1038/s41421-024-00662-3
24. Maruyama Y. Regulatory update of regenerative medicine in Japan. 7th India-Japan Medical Products Regulatory Symposium. New Delhi, India; 2024.
25. Хорольский МД, Семенова ИС, Мельникова ЕВ, Олефир ЮВ. Применение метода коротких тандемных повторов для аутентификации клеточных линий. БИОпрепараты. Профилактика, диагностика, лечение. 2019;19(4):251–60. https://doi.org/10.30895/2221-996X-2019-19-4-251-260
26. Мельникова ЕВ, Рачинская ОА, Трусов ГА, Хорольский МД, Семенова ИС, Терешкина НВ и др. Обоснование методических подходов к экспертной оценке подлинности биомедицинских клеточных продуктов. БИОпрепараты. Профилактика, диагностика, лечение. 2019;19(1):28–38. https://doi.org/10.30895/2221-996X-2019-19-1-28-38
27. Покровский НС, Водякова МА, Меркулов ВА, Мельникова ЕВ. Особенности и ключевые параметры валидации методик фенотипирования клеточных линий. Иммунология. 2024;45(3):343–54. https://doi.org/10.33029/1816-2134-2024-45-3-343-354
28. Покровский НС, Водякова МА, Меркулов ВА, Мельникова ЕВ. Рекомендации по созданию алгоритма валидации методик фенотипирования клеточных линий. Иммунология. 2024;45(4):505–17. https://doi.org/10.33029/1816-2134-2024-45-4-505-517
29. Чапленко АА, Меркулова ОВ, Семенова ИС, Сайфутдинова АР, Мельникова ЕВ, Меркулов ВА. Детекция микоплазм в эукариотических клеточных линиях методом real-time ПЦР с использованием различных способов концентрирования образца. Цитология. 2020;62(1):56–63. https://doi.org/10.31857/S0041377120010034
30. Richards S, Aziz N, Bale Sh, Bick D, Das S, Gastier-Foster J, et al. Standards and guidelines for the interpretation of sequence variants: A joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17(5):405–24. https://doi.org/10.1038/gim.2015.30
31. Beckenkamp LR, da Silva CG, Hohendorff MLI, Ogliari KS. Manufacturing parameters for the creation of clinical-grade human-induced pluripotent stem cell lines from umbilical cord mesenchymal stromal cells. Stem Cells Transl Med. 2024;13(5):454–61. https://doi.org/10.1093/stcltm/szae010
32. Poetsch MS, Strano A, Guan K. Human induced pluripotent stem cells: From cell origin, genomic stability, and epigenetic memory to translational medicine. Stem Cells. 2022; 40(6):546–55. https://doi.org/10.1093/stmcls/sxac020
33. Scesa G, Adami R, Bottai D. iPSC preparation and epigenetic memory: Does the tissue origin matter? Cells. 2021;10(6):1470. https://doi.org/10.3390/cells10061470
34. Hargus G, Ehrlich M, Hallmann AL, Kuhlmann T. Human stem cell models of neurodegeneration: A novel approach to study mechanisms of disease development. Acta Neuropathol. 2014; 127(2):151–73. https://doi.org/10.1007/s00401-013-1222-6
35. Chlebanowska P, Sulkowski M, Skrzypek K, Tejchman A, Muszyńska A, Noroozi R, et al. Origin of the induced pluripotent stem cells affects their differentiation into dopaminergic neurons. Int J Mol Sci. 2020;21(16):5705. https://doi.org/10.3390/ijms21165705
Об авторах
Е. В. МельниковаРоссия
Мельникова Екатерина Валерьевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. А. Рачинская
Россия
Рачинская Ольга Анатольевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
И. С. Семенова
Россия
Семенова Ирина Семеновна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
В. А. Меркулов
Россия
Меркулов Вадим Анатольевич, д-р мед. наук, проф.
Петровский б-р, д. 8, стр. 2, Москва, 127051;
Трубецкая ул., д. 8, стр. 2, Москва, 119991
Дополнительные файлы

|
1. Таблица S1. Примеры клинических исследований препаратов, полученных из индуцированных плюрипотентных стволовых клеток (ИПСК) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(393KB)
|
Метаданные ▾ | |

|
2. Таблица S2. Критические показатели качества для индуцированных плюрипотентных стволовых клеток (ИПСК) для клинического применения | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(763KB)
|
Метаданные ▾ | |

|
3. Рис. S1. Программа контроля качества при получении островковых клеток поджелудочной железы из индуцированных плюрипотентных стволовых клеток. МКПК — мононуклеарные клетки периферической крови; AFP — альфа-фетопротеин. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(414KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Мельникова Е.В., Рачинская О.А., Семенова И.С., Меркулов В.А. Программа контроля качества препаратов на основе индуцированных плюрипотентных стволовых клеток. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):127-140. https://doi.org/10.30895/2221-996X-2025-25-2-127-140
For citation:
Melnikova E.V., Rachinskaya O.A., Semenova I.S., Merkulov V.A. Quality control programmes for induced pluripotent stem cell-derived medicinal products. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):127-140. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-2-127-140


































