Перейти к:
Аттестация фармакопейного стандартного образца для оценки специфической активности рекомбинантного интерферона α-2b
https://doi.org/10.30895/2221-996X-2024-24-1-21-31
Резюме
АКТУАЛЬНОСТЬ. Методика определения специфической активности рекомбинантных интерферонов предусматривает использование стандартного образца в качестве меры сравнения. Доступность международного стандартного образца (МСО), обычно используемого для оценки качества препаратов указанного типа, в настоящее время ограничена, в связи с чем при оценке качества интерферонов целесообразно применять фармакопейные стандартные образцы (ФСО), которые предварительно аттестуют с использованием МСО при их наличии.
ЦЕЛЬ. Аттестация фармакопейного стандартного образца для оценки специфической активности рекомбинантного интерферона α-2b.
МАТЕРИАЛЫ И МЕТОДЫ. Определение специфической активности проводили в реакции подавления интерфероном цитопатического действия вируса на культуре клеток в сравнении с активностью МСО интерферона α-2b (WHO International Standard Interferon alpha 2b (Human, rDNA derived). В исследовании использовали клетки линий A549 и MDBK в комбинации с вирусами везикулярного стоматита (VSV) и энцефаломиокардита (EMC). Исследование проводили в соответствии с требованиями Государственной фармакопеи Российской Федерации (ОФС.1.7.2.0002.15). Учет результатов осуществляли инструментальным и визуальным методами. При расчетах использовали методы математической статистики; учет влияния факторов промежуточной прецизионности проводили с помощью t-критерия Стьюдента.
РЕЗУЛЬТАТЫ. В соответствии с разработанной программой и методикой аттестации проведена аттестация ФСО человеческого рекомбинантного интерферона α-2b (ФСО чрИФН-α-2b), предназначенного для оценки качества соответствующего препарата по показателям «Специфическая активность» (определение противовирусной активности на культуре клеток), «Подлинность» (реакция нейтрализации). Входной контроль кандидата в ФСО по показателям спецификации подтвердил его соответствие требованиям нормативной документации. По результатам испытаний установлено значение специфической активности ФСО: 4,47×10⁸ МЕ/мл, расширенная неопределенность: 8,12×10⁷ МЕ/мл (коэффициент охвата 2, уровень доверия ~95%). Срок годности ФСО чрИФН-α-2b установлен по сроку годности соответствующего препарата при хранении при температуре не выше минус 40 °С. Допускается хранение размороженного ФСО при температуре 2–8 °С в течение 1 мес.
ВЫВОДЫ. Аттестован ФСО для оценки специфической активности рекомбинантного интерферона α-2b. По результатам аттестации ФСО включен в Реестр фармакопейных стандартных образцов Государственной фармакопеи Российской Федерации с реестровым номером ФСО.3.2.00455 и наименованием «Интерферон альфа-2b человеческий рекомбинантный (специфическая активность)». Внедрение аттестованного ФСО чрИФН-α-2b позволит проводить оценку качества всех отечественных препаратов интерферона указанного типа по показателям «Специфическая активность», «Подлинность» на надлежащем научно-методическом уровне и обеспечит независимость отечественных производителей и органов контроля качества препаратов от импорта МСО.
Ключевые слова
Для цитирования:
Гайдерова Л.А., Лебедева Ю.Н., Лобанова Т.Н., Липатова Э.К., Волкова Р.А., Фадейкина О.В. Аттестация фармакопейного стандартного образца для оценки специфической активности рекомбинантного интерферона α-2b. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):21-31. https://doi.org/10.30895/2221-996X-2024-24-1-21-31
For citation:
Gaiderova L.A., Lebedeva Yu.N., Lobanova T.N., Lipatova E.K., Volkova R.A., Fadeikina O.V. Certification of a pharmacopoeial reference standard for potency testing of recombinant interferon α-2b. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):21-31. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-21-31
Введение
Стандартные образцы (СО) выполняют важную роль в системе производства и обеспечения качества биотехнологических лекарственных препаратов (БтЛП). Они служат мерой сравнения при оценке показателей качества при контроле готовой и промежуточной продукции, а также при стандартизации методов контроля в научно-исследовательских и контролирующих организациях, что позволяет оценивать сопоставимость результатов в различных лабораториях, выпускать качественную продукцию и обеспечивать безопасность и эффективность биологических препаратов при их клиническом применении [1–4].
При производстве и контроле качества БтЛП применяют международные стандартные образцы (МСО) Всемирной организации здравоохранения1 [5]. Однако МСО имеют высокую стоимость, а кроме того, их производят в ограниченном количестве, что снижает доступность МСО, особенно в условиях санкций в отношении Российской Федерации. В связи с этим для оценки качества при производстве и испытании БтЛП для подтверждения их соответствия требованиям нормативной документации (НД) целесообразно применять вторичные СО, аттестацию которых проводят с использованием МСО, например фармакопейные стандартные образцы (ФСО) [5–7]. В свою очередь, ФСО также могут быть использованы для аттестации cтандартного образца предприятия (СОп).
Аттестация СО — исследование, имеющее целью определение значений метрологических характеристик в соответствии с программой и методикой аттестации, с последующим включением полученных результатов в паспорт СО [6]. В соответствии с требованиями международных2 и российских3 стандартов первоочередной этап определения значений аттестуемых характеристик СО — разработка программы и методики аттестации. Аттестуемая характеристика СО БтЛП, как правило, — это показатель специфической активности, титр или концентрация микроорганизмов, содержание активного действующего компонента. Необходимые характеристики СО — однородность, стабильность и срок годности [6].
Ранее авторами данной статьи была проведена разработка отраслевого СО для оценки специфической активности препаратов лейкоцитарного интерферона альфа (ИФН-α) [7]. В настоящее время препараты указанной группы сняты с производства и все больше используются рекомбинантные БтЛП, активным компонентом которых являются цитокины и, в частности, ИФН [8]. В Российской Федерации зарегистрировано 23 отечественных препарата на основе человеческого рекомбинантного интерферона-альфа-2b (чрИФН-α-2b)4, которые используются для лечения различных заболеваний вирусной этиологии.
Специфическая активность (противовирусная активность) — один из важнейших показателей качества препаратов на основе рекомбинантных интерферонов, который отражает их механизм действия и эффективность. Методика определения этого показателя предусматривает использование культур клеток, чувствительных к ИФН, вируса-индикатора и СО в качестве меры сравнения. Важное условие адекватного определения специфической активности — стандартность всех вышеперечисленных компонентов, в том числе использование различными производителями препаратов ИФН стандартного образца, обеспечивающего единство измерений [8].
В связи с введением международных санкций особую актуальность приобретает разработка и аттестация ФСО для оценки активности чрИФН-α-2b, что позволит обеспечить независимость отечественных производителей и органов контроля качества препаратов от импорта МСО и снижение затрат на производство.
Цель работы — аттестация фармакопейного стандартного образца для оценки специфической активности рекомбинантного интерферона α-2b.
Для достижения цели были поставлены следующие задачи:
- разработка программы и методики аттестации;
- подтверждение соответствия кандидата в ФСО требованиям НД (входной контроль);
- определение значения аттестованной характеристики ФСО и неопределенности аттестованного значения;
- определение срока годности ФСО;
- разработка сопроводительной документации (проект паспорта, макет этикетки первичной и вторичной упаковки, инструкция по применению ФСО).
Материалы и методы
Материалы
Стандартный образец. МСО чрИФН-α-2b (WHO International Standard: Interferon alpha 2b (Human rDNA derived), NIBSC code: 95/6565).
Материал кандидата в фармакопейный стандартный образец. Интерферон альфа-2b человеческий рекомбинантный, безметиониновый — субстанция-раствор концентрированный, замороженный (ФС-001808-280422) производства ООО «Фирн М» (Россия). Дата выпуска — 20.06.2022. Срок годности до 06.2024.
Культуры клеток:
- клеточная линия карциномы легких человека A549 (ATCC, США, кат. № CCL-185) получена из коллекции ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России; клетки поддерживали в рабочей коллекции ФГБУ «НЦЭСМП» Минздрава России;
- перевиваемая клеточная линия почки быка MDBK (NBL-1) получена из коллекции ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России; клетки поддерживали в рабочей коллекции ФГБУ «НЦЭСМП» Минздрава России. Для аттестации ФСО рекомендовано использовать 3–30-й пассаж клеток.
Индикаторные вирусы:
- вирус энцефаломиокардита (ЕМС) получен из коллекции ATCC (ATCC, США, кат. № VR 129B); вирус поддерживали на культуре клеток Vero (коллекция ФГБУ «НЦЭСМП» Минздрава России);
- вирус везикулярного стоматита (VSV), штамм «Индиана» (№ 29) получен из Государственной коллекции вирусов ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» (Институт вирусологии им. Д.И. Ивановского) Минздрава России; вирус поддерживали на культуре клеток MDBK (коллекция ФГБУ «НЦЭСМП» Минздрава России).
Реактивы и материалы. В работе использовали следующие основные реактивы: эмбриональная телячья сыворотка (HyClone, США), раствор трипанового синего 0,4% (Macklin, Китай), краситель нафтол сине-черный (Sigma-Aldrich, США), уксусная кислота ледяная (Sigma-Aldrich, США), формальдегид 37% (Sigma-Aldrich, США), натрия ацетат тригидрат (Fisher Chemical, Великобритания), натрия гидроксид (Fisher Chemical, Великобритания), а также реактивы производства ООО НПП «ПанЭко» (Россия): питательная среда DMEM, жидкая без глутамина, с глюкозой (4,5 г/л); L-глутамин; гентамицин, 10 мг/мл; раствор Версена; трипсин-ЭДТА. В работе использовали материалы производства Corning (США): планшеты культуральные 96-, 24-, 12- и 6-луночные стерильные; стерильные пробирки пластиковые конические вместимостью 15 и 50 мл; стерильные пипетки объемом 1, 2, 10, 25 и 50 мл; чашки Петри культуральные стерильные 100 мм.
Оборудование
Холодильник POZIS ХФ-400-2 (ПАО «СЭЗ им. Серго Орджоникидзе», Россия); морозильник MDF-U 3386S (Panasonic, Япония); СО2-инкубатор МСО-15АС (Sanyo Electric, Япония); шкаф ламинарный БАВп-01-1,2 (ЗАО «Ламинарные системы», Россия); микроскоп инвертированный EVOS® XL (Thermo Fisher Scientific, США); термошейкер ST-3L (Elmi, Латвия); центрифуга 5804 R (Eppendorf, Германия); дозатор Biohit Midi Plus (Sartorius, Финляндия); камера Горяева (ООО «МиниМед», Россия).
Методы
При аттестации кандидата в ФСО чрИФН-α-2b по показателю «Специфическая активность» исследовали его противовирусную активность биологическим методом в реакции подавления интерфероном цитопатического действия вируса на культуре клеток в соответствии с ОФС.1.7.2.0002.156. Испытания проводили два аналитика в разные дни с использованием различных комбинаций клеток (MDBK, А549) и вирусов (VSV, EMC), чувствительных к ИФН (табл. 1).
Проведение анализа. Каждый образец чрИФН-α-2b анализировали в 4 повторностях (независимые разведения образца вносились в отдельный планшет). Предварительно образцы кандидата в ФСО и МСО разводили до концентрации 100 МЕ/мл.
Далее использовали 3 варианта проведения испытаний, отличающихся применением различных комбинаций вида клеток и вирусов, порядком внесения испытуемых образцов (кандидата в ФСО и МСО) до и после образования монослоя, способом учета результатов:
- клетки A549, вирус EMC, инструментальный учет— готовили серию двукратных разведений чрИФН-α-2b в планшете для предварительных разведений, вносили их в 96-луночный планшет с предварительно сформированным монослоем клеток;
- клетки MDBK, вирус VSV, визуальный учет— разведение чрИФН-α-2b проводили непосредственно в планшетах с уже сформировавшимся монослоем клеток;
- клетки MDBK, вирус VSV, инструментальный учет — образцыразведенного чрИФН-α-2b вносили в планшеты одновременно с суспензией клеток, при этом клеточный монослой формировался в присутствии интерферона.
В каждом варианте оставляли в планшете два ряда с питательной средой для контроля клеток и вируса.
Планшеты инкубировали при 37 °С в течение 24 ч в атмосфере, содержащей (5,0±0,5)% СО2. После инкубирования культур клеток и удаления культуральной среды добавляли в лунки по 100 мкл раствора индикаторного вируса в рабочей дозе 100 ТЦД50/0,1 мл (ТЦД50 — тканевая цитопатическая доза вируса, вызывающая гибель 50% клеток). В лунки, предназначенные для контроля клеток и вируса, вносили по 100 мкл поддерживающей среды.
На контрольном планшете предусматривали 16 лунок для подтверждения дозы вируса, в которые вносили по 100 мкл разведений вируса, соответствующих 100, 10, 1 и 0,1 ТЦД50/0,1 мл. Затем планшет инкубировали при 37 °С в течение 24–48 ч в атмосфере, содержащей (5,0±0,5)% СО2.
Учет и оценка результатов. Результаты испытания подлежали учету, если выполнялись следующие три условия:
- в лунках с контролем клеток, в лунках, содержащих максимальное количество интерферона, и в лунках с индикаторным вирусом в дозе 0,1 ТЦД50/0,1 мл не наблюдается поражения клеточного монослоя вирусом;
- в лунках с клетками без интерфероновой защиты, подвергшимися действию вируса в заражающей дозе 100 ТЦД50, и в лунках, содержащих минимальное количество интерферона, наблюдается полное поражение клеточного монослоя вирусом;
- доза внесенного вируса составляет 100 ТЦД50в 0,1 мл.
Визуальный учет активности интерферона. В планшетах с испытуемыми образцами с помощью инвертированного микроскопа подсчитывали число лунок в каждом разведении для тех растворов кандидата в ФСО и МСО, в которых наблюдалась защита клеточного монослоя от цитопатического действия вируса.
Для каждого планшета рассчитывали титр МСО (ТМСО) и кандидата в ФСО (ТкФСО), используя метод Спирмена–Кербера7:
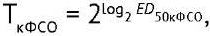 (1)
(1)
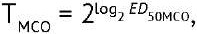 (2)
(2)
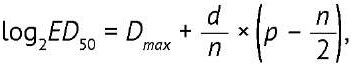 (3)
(3)
где ТкФСО — титр кандидата в ФСО; ТМСО — титр МСО; ED50 — 50%-ная эффективная доза противовирусной активности; Dmax — двоичный логарифм фактора разведения, ниже которого наблюдается защита клеток от цитопатического действия вируса (отсутствие признаков деградации монослоя) в 100% лунок; d — двоичный логарифм шага разведений (=1); n — число лунок, приходящееся на каждое разведение; p — число лунок для разведения, соответствующего Dmax, и последующих разведений, в которых наблюдается защита клеток от цитопатического действия вируса (отсутствие признаков деградации монослоя).
Для каждого рабочего планшета рассчитывали специфическую активность кандидата в ФСО (АкФСО) по формуле:
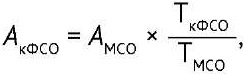 (4)
(4)
где АкФСО — специфическая активность кандидата в ФСО; АМСО — номинальная специфическая активность МСО; ТкФСО — титр кандидата в ФСО; ТМСО — титр МСО.
Специфическую активность образца рассчитывали как среднее арифметическое по всем повторностям.
Инструментальный учет активности интерферона. При выполнении перечисленных ранее трех условий, допускающих учет результатов, по окончании инкубирования проводили окрашивание клеток (краситель нафтол сине-черный), результаты которого регистрировали путем измерения оптической плотности растворов в лунках с использованием планшетного спектрофотометра.
Специфическую активность испытуемых образцов рассчитывали с помощью модели параллельных линий. Принцип ее основан на том, что обычно в интервале применяемых доз количественный ответ связан линейно с логарифмом дозы. По результатам измерения строили графики «доза — ответ», представляющие собой зависимость значений оптической плотности, соответствующих испытуемым образцам кандидата в ФСО и МСО, от логарифма их разведения. Специфическую активность определяли на основе сравнения линий дозозависимости МСО и кандидата в ФСО. Обработку результатов испытаний и расчет величины специфической активности проводили с помощью программного обеспечения PLA 3.0 (Stegmann Systems, Германия). Значение показателя «Специфическая активность» рассчитывали как среднее арифметическое по всем повторностям.
Статистическая обработка результатов. С использованием программы Microsoft Office Exсel рассчитывали показатели описательной статистики: среднеарифметическое значение (Хср), стандартное отклонение (S), относительное стандартное отклонение (RSD).
Значение аттестованной характеристики ФСО чрИФН-α-2b представляли в виде:
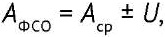 (5)
(5)
где АФСО — специфическая активность ФСО чрИФН-α-2b; Аср — среднее арифметическое (Хср) значение показателя «Специфическая активность»; U — расширенная неопределенность, рассчитанная как ±2S (два стандартных отклонения результатов испытаний, полученных в условиях промежуточной прецизионности).
Статистическую значимость (или незначимость) различий двух групп данных для оценки возможности объединения экспериментальных данных, полученных при учете влияния факторов промежуточной прецизионности (клетки MDBK, вирус VSV; клетки A549, вирус EMC; инструментальный/визуальный метод учета; аналитик) проводили с помощью t-критерия Стьюдента при уровне значимости α=0,5 и соответствующего числа степеней свободы, рассчитываемого по формуле df = n1 + n2 – 2 [9].
Результаты и обсуждение
В соответствии с разработанной программой и методикой аттестации провели оценку качества (входной контроль) кандидата в ФСО чрИФН-α-2b, а затем испытания его образцов по показателю «Специфическая активность» для установления значения аттестованной характеристики.
Входной контроль кандидата в ФСО на соответствие требованиям НД8 проведен согласно спецификации. Показатель «Специфическая активность» определяли с использованием МСО.
Результаты испытаний подтвердили соответствие материала кандидата в ФСО требованиям НД по проверенным показателям качества: описание (визуальный метод), подлинность (методы — реакция нейтрализации противовирусной активности анти-альфа-интерфероновыми антителами, изоэлектрическое фокусирование, пептидное картирование, обращенно-фазовая ВЭЖХ, электрофорез в полиакриламидном геле в восстанавливающих условиях), прозрачность (визуальный метод), цветность (визуальный метод), рН (потенциометрический метод), белок (метод Лоури), стерильность (метод прямого посева), специфическая активность (определение противовирусной активности на культуре клеток), удельная активность (расчетный метод), белковые примеси (электрофорез в полиакриламидном геле в восстанавливающих и невосстанавливающих условиях), родственные примеси (обращенно-фазовая ВЭЖХ).
Испытания кандидата в фармакопейный стандартный образец для оценки показателя «Специфическая активность» и установление значения аттестованной характеристики
Аттестуемой характеристикой является специфическая активность, так как исследуемый кандидат в ФСО чрИФН-α-2b предназначен для оценки специфической (противовирусной) активности препаратов интерферона и выражения ее в международных единицах (МЕ).
Испытания проводили в различных условиях с использованием наиболее часто встречающихся в НД производителей сочетаний клетки/вирус (табл. 1). В испытаниях участвовало 2 аналитика, получено 30 независимых результатов. В таблицах 2 и 3 представлены результаты испытаний и статистической обработки полученных данных.
Таблица 1. Варианты проведения испытаний кандидата
в фармакопейный стандартный образец
для оценки специфической активности человеческого рекомбинантного интерферона α-2b
Table 1. Testing arrangement for the candidate pharmacopoeial reference standard
for potency testing of human recombinant interferon α-2b
Вариант испытаний Test variant | Материал (клетки, вирус) Material (cells, viruses) | Метод учета Recording method | Скл, Ccells, | Время инкубирования клеточной суспензии, ч Incubation time for cell suspensions, h | Доза вносимого вируса, Viral inoculum dose, | Индикатор-краситель Indicating dye | Число испытаний Number of tests |
1 | MDBK, VSV | Инструментальный Instrumental | 200 | 1–1,5 | 100 | Нафтол сине-черный Naphthol blue black | 12 |
2 | A549, EMC | Инструментальный Instrumental | 250 | 24 | 100 | Нафтол сине-черный Naphthol blue black | 8 |
3 | MDBK, VSV | Визуальный Visual | 250 | 24 | 100 | Без окрашивания No staining | 10 |
Таблица составлена авторами по собственным данным /The table is prepared by the authors using their own data
Примечание. Варианты испытаний человеческого рекомбинантного интерферона α-2b, чрИФН-α-2b (каждый вариант испытывали по 2 аналитика): 1 — предварительно подготовленная в отдельном планшете серия двукратных разведений чрИФН-α-2b вносится в другой планшет с уже сформированным монослоем клеток; 2 — разведение чрИФН-α-2b непосредственно в планшетах с уже сформировавшимся монослоем клеток; 3 — внесение разведенного чрИФН-α-2b в планшеты одновременно с суспензией клеток, клеточный монослой формируется в присутствии интерферона. Клетки: MDBK — перевиваемая клеточная линия почки быка, A549 — клеточная линия карциномы легких человека; вирусы: VSV — вирус везикулярного стоматита, штамм «Индиана» (№ 29), EMC — вирус энцефаломиокардита (№ VR-129B); Скл — концентрация клеточной суспензии, вносимой в 96-луночный планшет, тыс. клеток на 1 мл (тыс. кл./мл); ТЦД50 — тканевая цитопатическая доза вируса, вызывающая гибель 50% клеток.
Note. Testing arrangement for human recombinant interferon α-2b (rhIFN α-2b), with each test conducted by 2 analysts: 1, serial two-fold dilution of rhIFN α-2b prepared on one plate and inoculated onto another plate with a pre-formed cell monolayer; 2, rhIFN α-2b diluted directly on the plate with a formed cell monolayer; 3, diluted rhIFN α-2b plated simultaneously with the cell suspension forming a monolayer in the presence of rhIFN α-2b. Cells: MDBK, Madin–Darby bovine kidney; A549, adenocarcinomic human alveolar basal epithelial cells. Viruses: VSV, vesicular stomatitis virus, Indiana serotype (National Virus Collection, 29); EMC, encephalomyocarditis virus (ATCC, VR-129B). С, concentration of the cell suspension for inoculation onto 96-cell plates (thousand cells per 1 mL); TCID50, tissue culture infectious dose requires to kill 50% of inoculated cells.
Таблица 2. Результаты определения специфической активности
кандидата в фармакопейный стандартный образец
человеческого рекомбинантного интерферона α-2b
Table 2. Results of potency testing of the candidate pharmacopoeial reference standard
for human recombinant interferon α-2b
№ п/п Item No. | Фактор промежуточной прецизионности (клетки, вирус, метод учета, аналитик) Intermediate precision factor (cell line, virus, result recording method, analyst) | Число образцов, n Number of samples, n | Аср, МЕ/мл Average potency, IU/mL | S, МЕ/мл S, IU/mL | RSD, % |
1 | MDBK, VSV Инструментальный учет Аналитик 1 MDBK, VSV Instrumental method Analyst 1 | n1=6 | 4,659×10⁸ | 3,637×10⁷ | 7,8 |
2 | MDBK, VSV Инструментальный учет Аналитик 2 MDBK, VSV Instrumental method Analyst 2 | n2=6 | 4,559×10⁸ | 2,279×10⁷ | 5,0 |
3 | A549, EMC Инструментальный учет Аналитик 1 A549, EMC Instrumental method Analyst 1 | n1=3 | 4,644×10⁸ | 4,2×10⁷ | 9,1 |
4 | A549, EMC Инструментальный учет Аналитик 2 A549, EMC Instrumental method Analyst 2 | n2=5 | 4,068×10⁸ | 3,659×10⁷ | 9,0 |
5 | MDBK, VSV Визуальный учет Аналитик 1 MDBK, VSV Visual method Analyst 1 | n1=5 | 4,332×10⁸ | 3,485×10⁷ | 8,04 |
6 | MDBK, VSV Визуальный учет Аналитик 2 MDBK, VSV Visual method Analyst 2 | n2=5 | 4,574×10⁸ | 5,400×10⁷ | 11,8 |
Таблица составлена авторами по собственным данным /The table is prepared by the authors using their own data
Примечание. n1 — число образцов, исследуемых аналитиком 1; n2 — число образцов, исследуемых аналитиком 2; Аср — среднее арифметическое значение показателя «Специфическая активность»; S — стандартное отклонение значений показателя; RSD — относительное стандартное отклонение; клетки: MDBK — перевиваемая клеточная линия почки быка, A549 — клеточная линия карциномы легких человека; вирусы: VSV — вирус везикулярного стоматита, штамм «Индиана» (№ 29), EMC — вирус энцефаломиокардита (№ VR 129B).
Note. n1, number of samples tested by analyst 1; n2, number of samples tested by analyst 2; S, standard deviation; RSD, relative standard deviation. Cells: MDBK, Madin–Darby bovine kidney; A549, human lung adenocarcinoma cells. Viruses: VSV, vesicular stomatitis virus, Indiana serotype (National Virus Collection, 29); EMC, encephalomyocarditis virus (ATCC, VR-129B).
Таблица 3. Результаты статистического анализа результатов испытаний
с t-критерием Стьюдента
Table 3. Statistical analysis of test results using Student’s t-test
Метод учета результатов, клетки, вирус, аналитик Result recording method, cell line, virus, analyst | Наименование фактора промежуточной прецизионности Intermediate precision factor | Число испытаний Number of tests | Число степеней свободы, df Number of degrees of freedom, df | Значение t-критерия Стьюдента, рассчитанное по экспериментальным данным, tэксп Student’s t-test value for experimental data, texp | Критическое значение t-критерия Стьюдента, Critical value of Student’s t-test, | Достигнутый уровень значимости, p Achieved level of significance, p-value | Вывод о статистической значимости/ Conclusion on statistical significance/ |
Сравнение результатов, полученных разными аналитиками Comparison of results obtained by different analysts | |||||||
Инструментальный учет, MDBK, VSV Instrumental method, MDBK, VSV | Аналитик 1 Аnalyst 1 | nаналитик1=6 nanalyst1=6 | 10 | 0,5718 | tтабл (df = 10;0,05)=2,2281 tcrit (df = 10;0,05)=2.2281 | 0,5801 | Не значимо Insignificant |
Аналитик 2 Аnalyst 2 | nаналитик2=6 nanalyst2=6 | ||||||
Инструментальный учет, A549, EMC Instrumental method, A549, EMC | Аналитик 1 Аnalyst 1 | nаналитик1=3 nanalyst1=3 | 6 | 1,9612 | tтабл (df = 6;0,05)=2,447 tcrit (df = 6;0,05)=2.447 | 0,0868 | Не значимо Insignificant |
Аналитик 2 Аnalyst 2 | nаналитик2=5 nanalyst2=5 | ||||||
Визуальный учет, MDBK, VSV Visual method, MDBK, VSV | Аналитик 1 Аnalyst 1 | nаналитик1=5 nanalyst1=5 | 8 | 0,8440 | tтабл (df = 8;0,05)=2,306 tcrit (df = 8;0,05)=2.306 | 0,4232 | Не значимо Insignificant |
Аналитик 2 Аnalyst 2 | nаналитик2=5 nanalyst2=5 | ||||||
Сравнение результатов, полученных инструментальным методом с использованием культуры клеток MDBK/вирус VSV и культуры клеток A549/вирус EMC Comparison of results recorded instrumentally using MDBK/VSV and A549/EMC combinations | |||||||
Инструментальный учет, Аналитик 1, 2 Instrumental method, Аnalyst 1, 2 | MDBK, VSV MDBK, VSV | nаналитик1,2=12 nanalyst1,2=12 | 18 | 1,7567 | tтабл (df = 18;0,05)=2,101 tcrit (df = 18;0,05)=2.101 | 0,0702 | Не значимо Insignificant |
A549, EMC A549, EMC | nаналитик1,2=8 nanalyst1,2=8 | ||||||
Сравнение результатов, полученных инструментальным и визуальным методом Comparison of results recorded by instrumental and visual methods | |||||||
Аналитик 1, 2, MDBK, VSV A549, EMC Аnalyst 1, 2 MDBK, VSV A549, EMC | Инструментальный учет Instrumental method | Nинстр=20 Ninstrumental=20 | 28 | 1,1589 | tтабл (df = 28;0,05)=2,048 tcrit (df = 28;0,05)=2.048 | 0,8695 | Не значимо Insignificant |
Визуальный учет Visual method | Nвизуальный=10 Nvisual=10 | ||||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Клетки: MDBK — перевиваемая клеточная линия почки быка, A549 — клеточная линия карциномы легких человека; вирусы: VSV — вирус везикулярного стоматита, штамм «Индиана» (№ 29), EMC — вирус энцефаломиокардита (№ VR 129B).
Note. Cells: MDBK, Madin–Darby bovine kidney; A549, human lung adenocarcinoma cells. Viruses: VSV, vesicular stomatitis virus, Indiana serotype (National Virus Collection, 29); EMC, encephalomyocarditis virus (ATCC, VR-129B).
Проведенный статистический анализ результатов определения специфической активности кандидата в ФСО, полученных в условиях промежуточной прецизионности (табл. 3), показал, что во всех случаях значения t-критерия Стьюдента, рассчитанные по экспериментальным данным (tэксп), меньше критического табличного значения tтабл (df;0,05) при уровне значимости 0,05 и соответствующего для каждой сравниваемой групп числа степеней свободы. Это означает, что результаты, полученные разными аналитиками, разными методами с использованием разных культур клеток и вирусов не имеют статистически значимых различий, что позволило объединить все экспериментальные данные и использовать их для расчета значения аттестованной характеристики.
Среднее значение специфической активности (АФСО) исследуемых образцов, стандартное отклонение (S) и относительное стандартное отклонение (RSD) рассчитаны на основе результатов, приведенных в столбце Аср таблицы 2.
Таким образом, значение аттестованной характеристики ФСО чрИФН-α-2b (АФСО), установленное относительно МСО, составило 4,470×10⁸ МЕ/мл, стандартное отклонение (S) — 4,059×10⁷ МЕ/мл, RSD — 9,08%; расширенная неопределенность аттестованного значения для коэффициента охвата k=2 и уровня доверия ~95% (U=2S) — 8,118×10⁷ МЕ/мл.
Полученные авторами результаты исследования на двух системах клетки/вирус (A549/EMC и MDBK/VSV) полностью подтверждаются данными исследований зарубежных авторов на значительно большем количестве сочетаний клетки/вирус [4], что позволяет использовать аттестованный нами ФСО на любых клетках, чувствительных чрИФН-α-2b.
Оценка стабильности и установление срока годности фармакопейного стандартного образца
Для оценки стабильности размороженного ФСО чрИФН-α-2b провели испытания 10 образцов по показателю «Специфическая активность» после их хранения при температуре 2–8 °С в течение 1 мес. Рассчитанные по экспериментальным данным среднее значение активности Аср=4,614×10⁸ МЕ/мл и значения статистических показателей, характеризующих ее неопределенность (S=6,686×10⁷ МЕ/мл, RSD=14,49%), входят в интервал значений аттестованной характеристики (от 3,67 до 6,27 МЕ/мл) и подтверждают стабильность размороженного СО.
Срок годности ФСО чрИФН-α-2b установлен по сроку годности соответствующего препарата при хранении при температуре не выше минус 40 °С.
Выводы
- Аттестован фармакопейный стандартный образец для оценки специфической активности человеческого рекомбинантного интерферона α-2b. Значение аттестованной характеристики фармакопейного стандартного образца активности человеческого рекомбинантного интерферона α-2b, установленное относительно международного стандартного образца, составило 4,47×10⁸МЕ/мл, расширенная неопределенность: 8,12×10⁷ МЕ/мл (коэффициент охвата 2; уровень доверия ~95%).
- Подтверждена стабильность размороженного фармакопейного стандартного образца по показателю «Специфическая активность» после хранения в течение 1 мес. при температуре 2–8 °С.
- Установлен срок годности аттестованного фармакопейного стандартного образца активности человеческого рекомбинантного интерферона α-2b при хранении при температуре не выше минус 40°С.
- Разработана и утверждена в установленном порядке сопроводительная документация (паспорт, макет этикетки первичной и вторичной упаковки, инструкция по применению ФСО).
- Стандартный образец включен в Реестр фармакопейных стандартных образцов Государственной фармакопеи Российской Федерации с реестровым номером ФСО.3.2.004559и наименованием «Интерферон альфа-2b человеческий рекомбинантный (специфическая активность)».
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Л.А. Гайдерова — обсуждение результатов, редактирование текста рукописи и утверждение окончательной версии рукописи для публикации; Ю.Н. Лебедева — разработка дизайна и проведение экспериментальных исследований, систематизация, статистическая обработка, оформление и интерпретация результатов; Т.Н. Лобанова — анализ результатов, написание, редактирование и переработка текста рукописи; Э.К. Липатова — проведение экспериментальных исследований, оформление и систематизация результатов; Р.А. Волкова — разработка дизайна исследования, обсуждение программы аттестации и анализ результатов; О.В. Фадейкина — обсуждение и статистический анализ результатов; разработка сопроводительных документов (паспортов, этикеток).
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. L.A. Gaiderova discussed the results, edited the manuscript, and approved the final version for publication. Yu.N. Lebedeva designed the study; conducted experiments; carried out statistical processing of the results; registered, systematised, and interpreted the results. T.N. Lobanova analysed the results, drafted and edited the manuscript. E.K. Lipatova conducted experiments, formatted and systematised the results. R.A. Volkova designed the study, discussed the certification programme, and analysed the results. O.V. Fadeikina carried out statistical analysis of the results, designed the accompanying documentation for the reference standard (certificates, labels).
1. Recommendations for the preparation, characterization and establishment of international and other biological reference standards. Annex 2. WHO Technical Report Series, No. 932. WHO; 2006.
2. ISO Guide 35:2017. Reference materials. Guidance for characterization and assessment of homogeneity and stability. Geneva: ISO; 2017.
3. ГОСТ 8.315-2019. Государственная система обеспечения единства измерений. Стандартные образцы состава и свойств веществ и материалов. Основные положения.
ГОСТ Р ИСО 17034-2021. Общие требования к компетентности производителей стандартных образцов.
4. Государственный реестр лекарственных средств. https://grls.rosminzdrav.ru
5. https://nibsc.org/documents/ifu/95-656.pdf
6. ОФС.1.7.2.0002.15 Биологические методы испытания препаратов интерферона с использованием культур клеток. Государственная фармакопея Российской Федерации XIV изд. Т.2; 2018.
7. Там же.
8. НД № ФС-001808-280422, Интерферон альфа-2b человеческий рекомбинантный, безметиониновый — субстанция-раствор концентрированный, производства ООО «Фирн М».
9. https://www.regmed.ru/produkt-n-service/fso/fso-registry/fso-of-biological-origin/
Список литературы
1. Волкова РА, Фадейкина ОВ, Устинникова ОБ, Саканян ЕИ, Меркулов ВА, Мовсесянц АА и др. Современные проблемы стандартных образцов лекарственных средств в Российской Федерации. Фармация. 2020;69(2):5–11. https://doi.org/10.29296/25419218-2020-02-01
2. Гегечкори ВИ, Шатилина АА, Шульга НА, Петухова ЯД, Смирнов ВВ, Раменская ГВ. Биологические стандартные образцы: актуальные вопросы разработки и порядка аттестации. Эталоны. Стандартные образцы. 2023;19(3):21–9. https://doi.org/10.20915/2077-1177-2023-19-3-21-29
3. Олефир ЮВ, Волкова РА, Фадейкина ОВ, Саканян ЕИ, Меркулов ВА, Мовсесянц АА, Бондарев ВП. Проблемы стандартных образцов биологических лекарственных средств. В кн.: Сборник тезисов докладов III международной научной конференции «Стандартные образцы в измерениях и технологиях». Екатеринбург; 2018. С. 148–50. EDN: YSMLQL
4. Meager A, Gaines Das R, Zoon K, Mire-Sluis A. Establishment of new and replacement World Health Organization International Biological Standards for human interferon alpha and omega. J Immunol Methods. 2001;257(1–2):17–33. https://doi.org/10.1016/s0022-1759(01)00460-4
5. Петров АЮ, Сысуев ЕБ, Новикова НА. Некоторые особенности применения стандартных образцов в фармации. Роль технического регулирования и стандартизации в эпоху цифровой экономики. Сборник статей II Международной научно-практической конференции молодых ученых. Екатеринбург: Ажур; 2020. С. 21–32. EDN: JGBEAC
6. Фадейкина ОВ, Волкова РА. Разработка порядка аттестации стандартных образцов биологических лекарственных средств. Химико-фармацевтический журнал. 2017;51(8):44–50. https://doi.org/10.30906/0023-1134-2017-51-8-44-50 https://doi.org/10.1007/s11094-017-1680-6
7. Гайдерова ЛА, Никитина ТН, Фадейкина ОВ, Байкова МЛ, Устинникова ОБ, Климов ВИ, Шведов ДВ. Аттестация отраслевого стандартного образца активности лейкоцитарного интерферона альфа типа. БИОпрепараты. Профилактика, диагностика, лечение. 2014;(2):31–6. EDN: SJRCDF
8. Алпатова НА, Гайдерова ЛА, Яковлев АК, Мотузова ЕВ, Лысикова СЛ, Солдатов АА, Авдеева ЖИ. Особенности определения специфической активности биотехнологических лекарственных средств. БИОпрепараты. Профилактика, диагностика, лечение. 2017;17(1):13–26. EDN: YHSSGL
9. Glantz SA. Primer of biostatistics. 7th ed. New York: McGraw-Hill; 2012
Об авторах
Л. А. ГайдероваРоссия
Гайдерова Лидия Александровна, канд. мед. наук
Петровский б-р, д. 8, стр. 2, 127051
Ю. Н. Лебедева
Россия
Лебедева Юлия Николаевна
Петровский б-р, д. 8, стр. 2, 127051
Т. Н. Лобанова
Россия
Лобанова Татьяна Николаевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, 127051
Э. К. Липатова
Россия
Липатова Эльвира Константиновна
Петровский б-р, д. 8, стр. 2, 127051
Р. А. Волкова
Россия
Волкова Рауза Асхатовна, доктор биол. наук
Петровский б-р, д. 8, стр. 2, 127051
О. В. Фадейкина
Россия
Фадейкина Ольга Васильевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Гайдерова Л.А., Лебедева Ю.Н., Лобанова Т.Н., Липатова Э.К., Волкова Р.А., Фадейкина О.В. Аттестация фармакопейного стандартного образца для оценки специфической активности рекомбинантного интерферона α-2b. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):21-31. https://doi.org/10.30895/2221-996X-2024-24-1-21-31
For citation:
Gaiderova L.A., Lebedeva Yu.N., Lobanova T.N., Lipatova E.K., Volkova R.A., Fadeikina O.V. Certification of a pharmacopoeial reference standard for potency testing of recombinant interferon α-2b. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):21-31. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-21-31


































