ТЕМА НОМЕРА: ИННОВАЦИОННЫЕ ИММУНОБИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ
ВВЕДЕНИЕ. Прогрессивный рост заболеваемости и младенческой смертности от коклюша обусловлен недостаточной эффективностью существующих вакцин как в России, так и в мире. Ранее разработанная в ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России живая рекомбинантная коклюшная вакцина интраназального применения ГамЖВК в клинических исследованиях с участием взрослых добровольцев продемонстрировала формирование длительного противобактерийного иммунитета. Для продолжения клинических исследований данной вакцины с участием добровольцев детского возраста, в том числе младенцев, необходимо проведение доклинических исследований ГамЖВК на экспериментальной модели новорожденных детенышей обезьян.
ЦЕЛЬ. Изучение безопасности и иммуногенности вакцины ГамЖВК при интраназальной иммунизации детенышей обезьян Papio hamadryas и ее противобактерийной защитной активности от экспериментальной коклюшной инфекции.
МАТЕРИАЛЫ И МЕТОДЫ. В работе использовали 20 обезьян вида павианов гамадрилов: 7 детенышей возрастом 1–1,5 мес., 7 матерей и 6 обезьян контрольной группы. Определяли динамику изменения количества специфических антител класса IgG к коклюшному токсину и филаментозному гемагглютигину (КТ+ФГА) в сыворотках крови животных методом ИФА и антител к антигенам Bordetella pertussis в реакции агглютинации (РА). ДНК B. pertussis в аспиратах регистрировали методом ПЦР в реальном времени.
РЕЗУЛЬТАТЫ. Интраназальное введение вакцины ГамЖВК детенышам обезьян сопровождается продукцией специфических антител класса IgG (КТ+ФГА), увеличением титра общих противококлюшных антител в РА и не вызывает местных и общих реакций организма, а также изменений в общем и биохимическом анализах крови. Защитная активность исследуемой вакцины против экспериментальной коклюшной инфекции выражается отсутствием клинико-лабораторных признаков коклюша у иммунизированных животных по сравнению с группой контроля.
ВЫВОДЫ. Показана безопасность и иммуногенность живой коклюшной вакцины интраназального применения ГамЖВК у новорожденных детенышей обезьян павианов гамадрилов. ГамЖВК представляется перспективной для ранней вакцинации младенцев, ревакцинации детей и взрослых, формирования коллективного семейного иммунитета против коклюша.
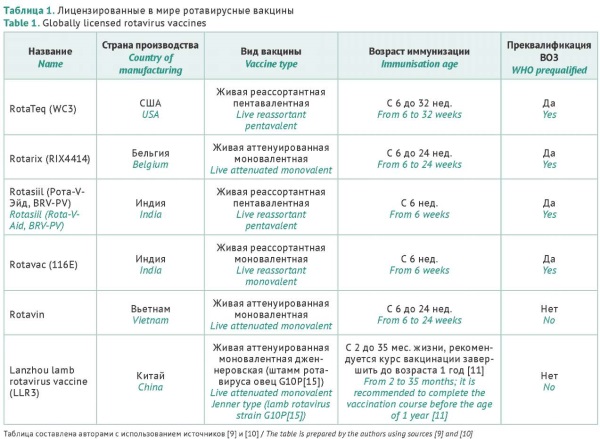
ВВЕДЕНИЕ. Вакцинация признана единственным действенным методом борьбы с ротавирусной инфекцией, которая остается одной из главных причин смертности детей раннего возраста преимущественно в развивающихся странах. В настоящее время в мире существуют доступные ротавирусные вакцины для оральной иммунизации младенцев и продолжаются разработки инновационных типов ротавирусных вакцин, в том числе и российскими учеными. В то же время отсутствуют нормативные правовые акты и рекомендации, позволяющие составить разработчикам оптимальную программу доклинических (ДКИ) и клинических исследований (КИ) ротавирусных вакцин.
ЦЕЛЬ. Изучение и обобщение мирового опыта планирования и проведения доклинических и клинических исследований вакцин против ротавирусной инфекции, который может быть рекомендован отечественным разработчикам.
ОБСУЖДЕНИЕ. Проанализированы доступные данные (в том числе за последние 5 лет) о существующих в мире ротавирусных вакцинах, результаты КИ которых подтвердили их эффективность в предотвращении развития тяжелых ротавирусных гастроэнтеритов и снижении числа госпитализаций по причине острых кишечных инфекций. Эффективность ротавирусных вакцин варьирует в разных регионах мира и может снижаться в развивающихся странах в силу ряда причин. Профиль безопасности оральных ротавирусных вакцин в целом считается благоприятным, однако по-прежнему существуют опасения развития инвагинаций тонкого кишечника у младенцев на фоне вакцинации. Для решения подобных проблем ведется разработка новых типов ротавирусных вакцин, преимущественно инактивированных (субъединичных или рекомбинантных), в том числе и в России. Для планирования и проведения ДКИ могут быть рекомендованы общие подходы с оценкой острой и хронической токсичности, иммуногенности, вируснейтрализующей активности поствакцинальных антител и фармакологической безопасности. При проведении КИ следует предусмотреть оценку профилактической эффективности в целевой группе детей раннего возраста по предотвращению развития ротавирусных гастроэнтеритов различной степени тяжести, числа госпитализаций и общей заболеваемости острыми кишечными инфекциями любой этиологии. Важно подтвердить безопасность и отсутствие взаимного влияния на иммуногенность при одновременном введении ротавирусной вакцины с другими вакцинами национального календаря профилактических прививок.
ЗАКЛЮЧЕНИЕ. Для проведения ДКИ ротавирусных вакцин могут применяться стандартные и общепринятые подходы, однако планирование и проведение КИ имеет свои особенности, связанные как со спецификой ротавирусной инфекции, так и с особенностями национального календаря профилактических прививок для детей раннего возраста.
ВВЕДЕНИЕ. Создание вакцин на основе вирусоподобных частиц (virus-like particles, VLP), состоящих из рекомбинантных белков ротавируса типа А человека, имитирующих структуру нативного вируса, но не обладающих инфекционной активностью, является перспективным направлением для вакцинопрофилактики. Для оценки специфической активности таких вакцин оптимальным представляется применение метода иммуноферментного анализа (ИФА) для определения титра специфических IgG-антител к белкам ротавируса А в образцах сыворотки крови иммунизированных животных.
ЦЕЛЬ. Разработка и валидация методики оценки специфической активности ротавирусной вакцины на основе VLP с использованием метода ИФА для определения уровня антител к белкам VP2/6 ротавируса А в образцах сыворотки крови иммунизированных морских свинок.
МАТЕРИАЛЫ И МЕТОДЫ. Оценку специфической активности ротавирусной вакцины на основе VLP проводили in vivo с использованием трех видов экспериментальных животных: мышей линии BALB/c, морских свинок породы агути и новорожденных карликовых свиней. Вакцину в дозе 30 мкг вводили животным трехкратно внутримышечно. Оценивали уровни специфических иммуноглобулинов класса G (IgG) к белкам VP2/6 ротавируса А и вируснейтрализующих антител (ВНА) в образцах сыворотки крови животных методом непрямого ИФА и в реакции нейтрализации соответственно. Определяли среднее геометрическое значение титров (СГТ) антител. Валидацию методики оценки специфической активности проводили на двух сериях вакцины с использованием стандартных методов статистического анализа.
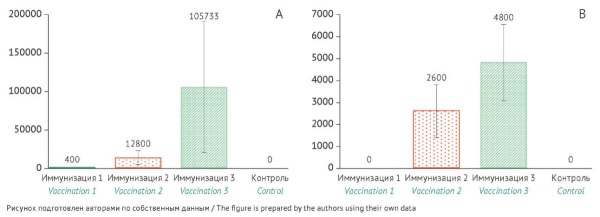
РЕЗУЛЬТАТЫ. Проведено сравнение уровней специфических IgG-антител к белкам VP2/6 и ВНА к ротавирусу типа A через 14 сут после первой, второй и третьей иммунизаций. Значительное увеличение титра антител и статистически значимые различия (p<0,05) между группами наблюдались уже после второй иммунизации. Двукратная иммунизация вакциной приводила к образованию IgG-антител и ВНА у новорожденных карликовых свиней (СГТ антител — 200,0 и 108,9 соответственно) и морских свинок (СГТ антител — 12800 и 2600 соответственно). У иммунизированных мышей наблюдался значительный рост уровня специфических IgG-антител (СГТ — 572440). В качестве релевантной модели для валидации методики ИФА для определения специфической активности были выбраны морские свинки при использовании двукратной схемы иммунизации. По результатам валидационных испытаний двух серий вакцины установлено, что метод ИФА удовлетворял критериям приемлемости по характеристикам: специфичность, повторяемость (коэффициент вариации не более 15% — для 1 и 2 серий вакцины 12,4 и 7,7%) и промежуточная прецизионность (коэффициент вариации не более 15% — для 1 и 2 серий вакцины 6,9 и 10,2%).
ВЫВОДЫ. Разработана и валидирована методика оценки специфической активности ротавирусной вакцины на основе VLP с использованием ИФА. Метод ИФА может быть использован для контроля показателя качества «Специфическая активность» ротавирусной вакцины на основе VLP.
ВВЕДЕНИЕ. Для профилактики ротавирусной инфекции применяются живые аттенуированные вакцины. Однако, учитывая мировую и российскую практику вакцинации, а также особенности физиологии детского организма, актуальным представляется создание инактивированных ротавирусных вакцин. Необходимым условием при разработке таких вакцин является наличие стабильно реплицирующихся штаммов вируса и подбор оптимального режима инактивации для проявления необходимого уровня антигенной активности и иммуногенности.
ЦЕЛЬ. Оценка и сравнительная характеристика специфического противоротавирусного иммунного ответа на введение неинактивированных (нативных) штаммов и композиции инактивированных штаммов ротавируса вида А на модели мышей.
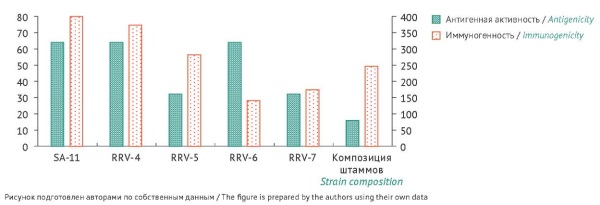
МАТЕРИАЛЫ И МЕТОДЫ. В работе использовали штаммы ротавируса человека вида А (RRV-4, RRV-5, RRV-6, RRV-7), стандартизированный штамм SA-11 № 2364 ГКВ, клеточные культуры линий Vero и СПЭВ. Инфекционную активность штаммов, выращенных на перевиваемых клетках линии Vero, определяли методом титрования вируса. Учет зараженных клеточных культур вели до наступления цитопатического действия и рассчитывали показатель ТЦД50 (50% тканевая цитопатическая доза) по методу Кербера в модификации Ашмарина и выражали его в lg ТЦД50/мл. Для инактивации штаммов вируса использовали формальдегид. Для оценки иммуногенной активности проводили иммунизацию нелинейных белых мышей с использованием нативных штаммов и композиции инактивированных штаммов (RRV-4, RRV-5, RRV-6, RRV-7). После иммунизации у животных отбирали кровь и в образцах сыворотки определяли титр антител к ротавирусу вида А с помощью метода гетерогенного непрямого иммуноферментного анализа.
РЕЗУЛЬТАТЫ. Штаммы ротавируса, адаптированные к росту на клеточной культуре линии Vero, проявляли инфекционную активность с уровнем титров от 8,9 до 7,9 lg ТЦД50/мл.
Показано, что инактивация штаммов наступала при температуре 37 °С и концентрации формальдегида от 0,05 до 0,025% в зависимости от длительности обработки. При оценке антигенной активности выявлено, что титр антигена в композиции инактивированных штаммов (1:16) был ниже, чем в случае нативных штаммов (1:32–1:64). Показано, что нативные штаммы и композиция инактивированных штаммов при иммунизации мышей обладали сравнимой специфической иммуногенной активностью.
ВЫВОДЫ. Получены штаммы-кандидаты ротавируса вида A, стабильно реплицирующиеся на перевиваемых клетках линии Vero. Подобраны оптимальные условия инактивации штаммов и разработана композиция инактивированных штаммов, обладающая специфической антигенной активностью и иммуногенностью. Представленные данные позволяют рассматривать полученную композицию инактивированных штаммов ротавируса вида A как основу для дальнейшей разработки инактивированной ротавирусной вакцины.
ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ
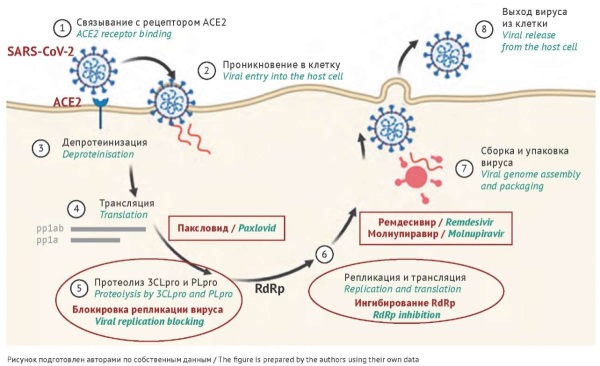
ВВЕДЕНИЕ. Геном SARS-CoV-2 характеризуется высокой частотой мутаций, в связи с чем особое беспокойство вызывает проблема резистентности вируса к современным противови-
русным препаратам — ингибиторам основной протеазы (3CLpro) и РНК-зависимой РНК-полимеразы (RdRp).
ЦЕЛЬ. Проанализировать сведения о частоте встречаемости, спектре и причинах формирования мутаций лекарственной устойчивости вируса SARS-CoV-2 к ингибиторам основной протеазы и РНК-зависимой РНК-полимеразы, применяемым в клинической практике или находящимся в стадии разработки, на основе клинических, вирусологических и генотипических данных.
ОБСУЖДЕНИЕ. Анализ частоты встречаемости мутаций лекарственной устойчивости в геноме вируса SARS-CoV-2 к противовирусным препаратам (ингибиторы RdRp — ремдесивир и молнупиравир; ингибиторы протеазы 3CLpro — паксловид) за 2021–2024 гг. показал, что некоторые мутации существовали до начала использования препаратов. Уровень распространенности мутаций лекарственной резистентности в мире не превышает 0,5%. Однако согласно результатам клинических и экспериментальных исследований продемонстрирована возможность снижения восприимчивости к препаратам более чем в 200 раз, в том числе и с формированием мультирезистентных вариантов вируса SARS-CoV-2, что особенно актуально для пациентов с иммуносупрессией. У таких пациентов SARS-CoV-2 может сохраняться в течение многих месяцев, и противовирусный препарат может потерять свою эффективность по мере отбора или появления спонтанных мутаций, создавая риск распространения лекарственно-устойчивых штаммов и/или неблагоприятного исхода для пациентов.
ЗАКЛЮЧЕНИЕ. В связи с увеличением охвата лечением пациентов с COVID-19 существует риск роста резистентных вариантов вируса. Представленные данные свидетельствуют о необходимости проведения геномного эпидемиологического надзора с анализом потенциальных мишеней действия лекарственных препаратов с учетом данных клинического наблюдения пациентов, что в будущем может определять тактику терапии и необходимость разработки новых противовирусных препаратов (ингибиторов RdRp и протеаз), адаптированных к лекарственно-устойчивым вариантам SARS-CoV-2.
КЛЕТОЧНАЯ ТЕРАПИЯ
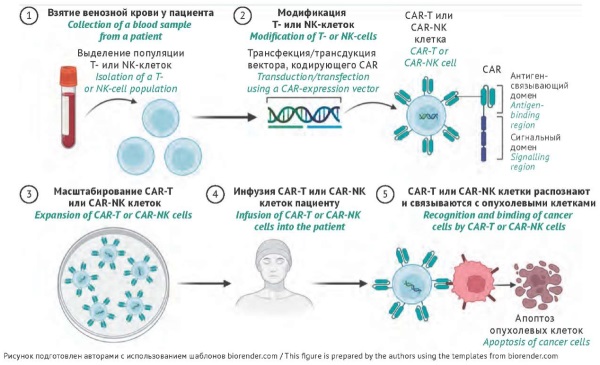
ВВЕДЕНИЕ. Препараты клеточной терапии и тканевой инженерии ориентированы на пациентов с тяжелыми заболеваниями (генетические, нейродегенеративные, онкологические заболевания, травмы опорно-двигательного аппарата, ожоги и др.), при которых существует немного альтернативных вариантов лечения. Анализ данных о клинической эффективности препаратов этой группы важен для понимания перспектив развития данной области как одного из направлений персонализированной медицины.
ЦЕЛЬ. Обзор основных направлений клеточной терапии, анализ данных об одобренных лекарственных препаратах клеточной терапии и тканевой инженерии, оценка проблем и перспектив их использования.
ОБСУЖДЕНИЕ. Проведен анализ данных о составе препаратов клеточной терапии и тканевой инженерии, показаниях к применению, результатах клинических исследований. Клеточные продукты изготавливают на основе аутологичных или аллогенных мезенхимальных и лимбальных стволовых клеток, эпителиальных клеток, хондроцитов, нативных или генетически модифицированных гемопоэтических стволовых клеток, генетически модифицированных лимфоцитов (CAR-T, CAR-NK) и др. Препараты на основе клеточных технологий получили одобрение во многих странах: США (около 30), странах Европейского союза (около 20), Японии (18), Южной Корее (15) и др. В Российской Федерации зарегистрировано два препарата на основе клеток — один на основе CAR-T-лимфоцитов (генотерапевтический препарат), другой на основе хондроцитов (биомедицинский клеточный продукт) — при этом последний является российской разработкой. Основными преимуществами препаратов клеточной терапии по сравнению со стандартными методами лечения являются их более высокая эффективность и меньшее количество вызываемых побочных эффектов. К проблемным аспектам клеточной терапии можно отнести риск формирования иммунных реакций, а также вероятность мутагенеза при использовании лентивирусных векторов или технологии CRISPR/Cas9; ограниченная эффективность CAR-T и CAR-NK клеток под иммуносупрессивным влиянием опухолевого микроокружения.
ЗАКЛЮЧЕНИЕ. Подходы к лечению с использованием препаратов клеточной терапии и тканевой инженерии позволяют эффективно восполнить дефекты различных тканей организма, избежать высокоинвазивных хирургических вмешательств и значительно сократить сроки регенерации по сравнению со стандартными методами терапии. Создание аналогичных доступных российских препаратов является перспективной задачей для системы здравоохранения Российской Федерации.
КОНТРОЛЬ КАЧЕСТВА
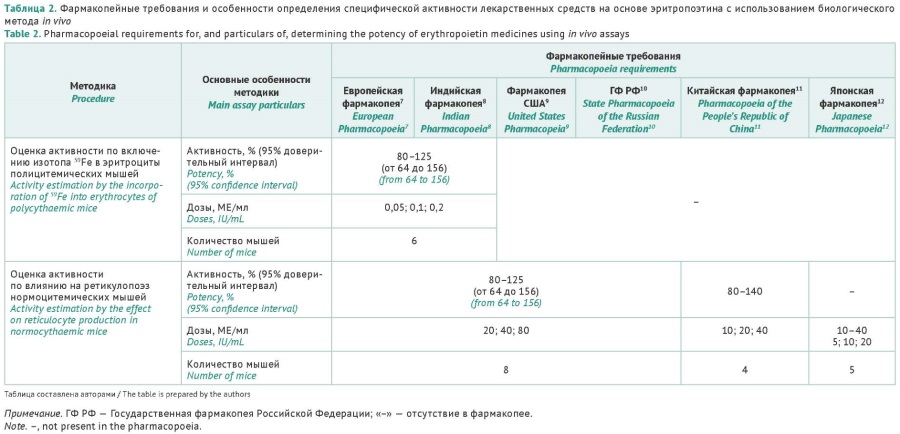
ВВЕДЕНИЕ. Учитывая распространенность применения в клинической практике лекарственных препаратов рекомбинантного эритропоэтина человека (рчЭПО) разных производителей, при оценке их качества по показателю «Специфическая активность» важно гарантировать то, что пациенты получают сопоставимые дозы препаратов. Для гармонизации подходов в определении специфической активности необходимо применение фармакопейных биологических методов анализа и соответствующих стандартных образцов (СО) — международных (МСО) и фармакопейных (ФСО).
ЦЕЛЬ. Обобщение сведений о фармакопейных требованиях к оценке специфической активности препаратов рчЭПО, об актуальных СО и биологических методиках (in vivo и in vitro) для оценки специфической активности рчЭПО, а также анализ соответствия требованиям нормативной документации на лекарственные средства рчЭПО, зарегистрированные в Российской Федерации.
ОБСУЖДЕНИЕ. Представлена информация об особенностях структуры молекул эритропоэтинов. Профиль гликозилирования, который обусловливает различия в периодах полувыведения и скорости биодеградации препаратов рчЭПО, главным образом влияет на специфическую биологическую активность данных препаратов. Приведены фармакопейные требования к биологическим методам оценки специфической активности in vivo. Обобщены сведения о СО, применяемых для определения активности. Отражены проблемы, связанные с разработкой биологических методик оценки специфической активности in vitro, и изучены возможности их включения в фармакопеи. Проведенный анализ методов определения специфической активности лекарственных средств на основе рчЭПО российского производства позволил заключить, что используемые методы не в полном объеме соответствуют установленным требованиям Государственной фармакопеи Российской Федерации.
ЗАКЛЮЧЕНИЕ. Выявлена необходимость разработки и аттестации национального фармакопейного СО для оценки специфической активности рчЭПО с целью обеспечения потребностей производителей российских препаратов в условиях импортозамещения. Для внедрения адекватных методов анализа при оценке качества рчЭПО в соответствии с принципом 3R необходима гармонизация подходов и создание единого документа, регулирующего проведение испытаний специфической активности препаратов рчЭПО.
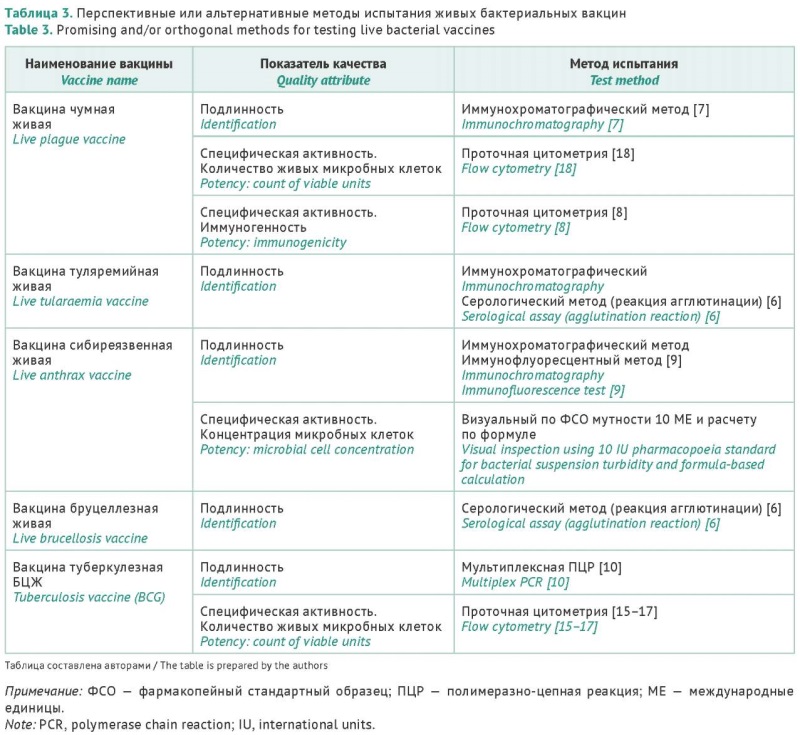
ВВЕДЕНИЕ. Живые бактериальные вакцины (ЖБВ) разработаны для профилактики туберкулеза и особо опасных инфекций: чумы, туляремии, сибирской язвы и бруцеллеза. Высокая эффективность ЖБВ связана с имитацией естественной инфекции и обеспечивает надежную и длительную защиту организма. Несмотря на значительные отличия состава и назначения живых вакцин, а также видовой принадлежности производственных штаммов, подходы к экспертизе качества этой группы лекарственных препаратов объединены рядом общих принципов. В то же время существуют значительные различия в методических подходах к оценке ряда показателей качества, некоторая часть из которых нуждается в улучшении и оптимизации.
ЦЕЛЬ. Анализ современных регуляторных требований к качеству живых бактериальных вакцин разного состава и назначения, выявление показателей качества и методов их оценки, нуждающихся в усовершенствовании, и определение перспектив разработок в данном направлении.
ОБСУЖДЕНИЕ. Нормативная документация на все ЖБВ включает общие показатели качества. Одним из основных показателей качества вакцинного препарата является его подлинность. В связи с разработкой новых отечественных диагностических тест-систем апробированы возможности их использования для подтверждения подлинности бактериальных вакцин. Для контроля качества вакцины туляремийной успешно применили иммунохроматографический и серологический методы, для бруцеллезной — серологический, для чумной и сибиреязвенной рекомендован иммунохроматографический метод. Для вакцины БЦЖ был апробирован метод мультиплексной ПЦР с использованием реактивов от отечественных производителей. Перспективным методом совершенствования экспертизы качества вакцин туберкулезной и чумной по показателю «Определение количества живых микробных клеток» и вакцины чумной по показателю «Иммуногенность» является метод проточной цитометрии.
ЗАКЛЮЧЕНИЕ. Представленный анализ регуляторных требований свидетельствует о существовании проблемных вопросов, связанных с нормируемыми показателями качества ЖБВ и методами их оценки. Результаты анализа литературы и собственных исследований позволяют определить перспективные направления в методологии экспертизы качества ЖБВ, в частности использование для оценки показателя «Подлинность» коммерческих тест-систем отечественного производства.
ВВЕДЕНИЕ. Важными задачами ведения коллекций микроорганизмов являются обеспечение стабильности свойств и поддержание жизнеспособности микробиологических культур во время хранения и при транспортировке. При использовании коллекционных штаммов микроорганизмов в качестве контрольных образцов в ряде случаев необходимы точные данные о количестве живых микробных клеток в каждом образце, в связи с чем актуальна разработка и применение методики прогнозирования гарантийных сроков хранения тест-штаммов.
ЦЕЛЬ. Оценить изменение жизнеспособности тест-штаммов для прогнозирования гарантийных сроков их хранения в различной первичной упаковке на примере штамма Salmonella enterica subsp. enterica serovar Abony NCTC 6017 методом ускоренного хранения.
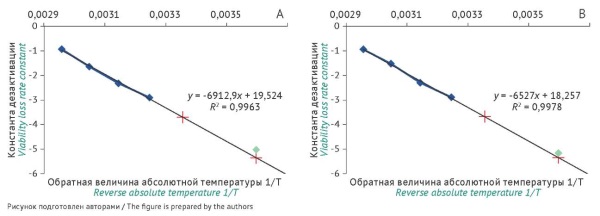
МАТЕРИАЛЫ И МЕТОДЫ. В работе использовали лиофилизированные образцы культуры штамма Salmonella enterica subsp. enterica serovar Abony NCTC 6017, депонированного в Государственной коллекции патогенных микроорганизмов ФГБУ «НЦЭСМП» Минздрава России. В качестве первичной упаковки применены ампулы боросиликатные вакуумного наполнения и флаконы для лиофилизации стандарта 2R. Проведена оценка образцов по ряду показателей качества (потеря в массе при высушивании, количество жизнеспособных клеток, выживаемость клеток, морфология колоний, биохимическая идентификация) и смоделировано ускоренное хранение при повышенных температурах (35–65 °С).
РЕЗУЛЬТАТЫ. Существенных различий качества лиофилизированных образцов в зависимости от типа первичной упаковки не выявлено. Экспериментально определены константы дезактивации жизнеспособности микробиологических культур при хранении образцов при повышенных температурах. Рассчитаны константы дезактивации для температур транспортировки и хранения в различной первичной упаковке. Прогнозируемое время снижения жизнеспособности клеток до 10% составляет 19 лет при хранении во флаконах и 25 лет — в ампулах. Прогнозируемое время снижения жизнеспособности клеток до 50% составляет 5,8 и 7,6 года — для флаконов и ампул соответственно.
ВЫВОДЫ. Анализ результатов исследования подтвердил возможность использования различных типов первичной упаковки (ампулы и флаконы) для лиофильного высушивания и хранения тест-штаммов микроорганизмов. Полученные данные могут быть использованы для дальнейших исследований и разработки рекомендаций по хранению лиофилизированных штаммов в различных типах упаковки.
ISSN 2619-1156 (Online)