Перейти к:
Аттестация фармакопейного стандартного образца для оценки специфической активности адсорбированного столбнячного анатоксина на морских свинках
https://doi.org/10.30895/2221-996X-2025-25-2-182-192
Резюме
ВВЕДЕНИЕ. В настоящее время национальный фармакопейный стандартный образец (ФСО.3.2.00247) для оценки активности адсорбированного столбнячного анатоксина (СА) аттестован только на мышах, в то время как международный стандартный образец (МСО) ВОЗ аттестован на двух видах животных — мышах и морских свинках. В связи с формированием регуляторной системы Евразийского экономического союза (ЕАЭС) и гармонизацией Фармакопеи ЕАЭС с Европейской фармакопеей актуально дополнить аттестованную характеристику ФСО.3.2.00247 значением специфической активности, установленной методом летального заражения на морских свинках.
ЦЕЛЬ. Определение величины специфической активности фармакопейного стандартного образца адсорбированного столбнячного анатоксина методом летального заражения на морских свинках.
МАТЕРИАЛЫ И МЕТОДЫ. В работе использовали четвертый МСО ВОЗ адсорбированного СА (4th WHO International Standard for tetanus toxoid adsorbed), ФСО для оценки активности адсорбированного СА (ФСО.3.2.00247, серия 011-210619). Определение специфической активности ФСО адсорбированного СА проводили методом летального заражения относительно МСО на морских свинках в соответствии с требованиями Европейской фармакопеи (монография 2.7.8). В работе использованы 352 аутбредные морские свинки весом 250–350 г. Животных по 8–10 особей равномерно распределяли по опытным группам для проведения иммунизации: 4 группы для МСО и ФСО соответственно. Через 28–30 сут проводили инъекции столбнячного токсина — 50 LD50. Результат оценивали в течение 5 сут, регистрируя клинические признаки столбнячной интоксикации согласно международной шкале. Для контроля активности столбнячного токсина группе неиммунизированных животных из той же партии вводили соответственно 2; 1; 0,5; 0,25 LD50 токсина. Величину специфической активности ФСО и LD50 токсина рассчитывали по формуле Кербера.
РЕЗУЛЬТАТЫ. Разработана программа аттестации ФСО.3.2.00247 (серия 011-210619). Проведена аттестация ФСО методом летального заражения на морских свинках. По результатам четырех испытаний установлено значение специфической активности ФСО.3.2.00247, которое составило 220 МЕ/ампула. Полученные экспериментальные данные являются основанием для внесения изменений в паспорт ФСО.3.2.00247 (серия 011-210619) путем дополнения его значением активности, определенным на морских свинках (220 МЕ/ампула). Представленные результаты свидетельствуют о возможности использования ФСО не только в методе летального заражения, но и в альтернативных методах контроля, в том числе в иммуноферментном анализе.
ВЫВОДЫ. Аттестованная характеристика фармакопейного стандартного образца адсорбированного столбнячного анатоксина может быть дополнена значением специфической активности, установленной методом летального заражения на морских свинках — 220 МЕ/ампула.
Ключевые слова
Для цитирования:
Комаровская Е.И., Фадейкина О.В., Лыско К.А., Волкова Р.А., Корнилова О.Г. Аттестация фармакопейного стандартного образца для оценки специфической активности адсорбированного столбнячного анатоксина на морских свинках. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):182-192. https://doi.org/10.30895/2221-996X-2025-25-2-182-192
For citation:
Komarovskaya E.I., Fadeikina O.V., Lysko K.A., Volkova R.A., Kornilova O.G. Certification of a pharmacopoeial reference standard for potency testing of adsorbed tetanus toxoid in guinea pigs. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):182-192. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-2-182-192
ВВЕДЕНИЕ
Адсорбированный столбнячный анатоксин (СА) является одним из основных компонентов вакцин для профилактики столбняка для всех возрастных групп населения. СА входит также в состав комбинированных вакцин для профилактики дифтерии, столбняка и коклюша (АКДС-вакцины). АКДС-вакцина включена в национальные календари профилактических прививок1 [1][2]. Всемирной организацией здравоохранения (ВОЗ) установлены требования для оценки качества АКДС-вакцин2.
Для вакцин против столбняка, используемых для первичной иммунизации младенцев, ВОЗ определены требования к специфической (иммуногенной) активности в международных единицах (МЕ). Показатель специфической активности в прививочной дозе (0,5 мл) для адсорбированного СА должен составлять не менее 40 МЕ в тесте на морских свинках и не менее 60 МЕ в тесте на мышах3. Специфическую активность определяют путем сравнения с международными стандартными образцами (МСО) или национальными стандартными образцами (СО), откалиброванными относительно МСО4.
Активность действующего четвертого МСО адсорбированного СА (4th WHO International Standard for tetanus toxoid adsorbed) была определена методом летального заражения на морских свинках и мышах5. Этот метод признан «золотым стандартом» для оценки активности адсорбированного СА. Национальные СО и любые вторичные СО должны быть откалиброваны относительно действующего МСО с применением метода летального заражения на морских свинках или мышах6. В Российской Федерации фармакопейный стандартный образец (ФСО) ФСО.3.2.00247 для оценки активности адсорбированного СА аттестован относительно МСО методом летального заражения на мышах.
Морские свинки более чувствительны к воздействию столбнячного токсина, чем мыши [3][4]. Исследования по оценке специфической активности первых двух международных стандартов адсорбированного СА продемонстрировали различия в чувствительности между линиями мышей (BALB/c, NIH, CFW): значения специфической активности существенно варьировали. Показатели, полученные на морских свинках, характеризовались отсутствием значимых отклонений7. В связи с этим многие производители вакцин (например, Пентаксим, Адасель) оценивают специфическую активность адсорбированного СА методами с использованием морских свинок. Методы, применяемые производителями, являются арбитражными, несмотря на наличие в нормативной документации альтернативного метода летального заражения на мышах в соответствии с требованиями Государственной фармакопеи Российской Федерации8 (ГФ РФ).
Согласно Европейской фармакопее величину специфической активности адсорбированного СА устанавливают при помощи следующих методов: метод летального заражения на морских свинках (метод А) или на мышах (метод В); серологический метод (метод С)9. Последний метод применяют для определения уровня защитных противостолбнячных антител в сыворотке крови лабораторных животных: морские свинки (метод иммуноферментного анализа, ИФА) или мыши (метод ингибирования токсина, Toxin Binding Inhibition, ToBI).
Во всех указанных методах для оценки специфической активности адсорбированного СА применяют параллельную иммунизацию морских свинок или мышей исследуемой вакциной и СО, калиброванным в МЕ. После иммунизации животных подвергают разрешающему подкожному заражению столбнячным токсином (метод летального заражения) или проводят забор крови (серологический метод). В последнем случае в сыворотке крови определяют титр антитоксических антител методом in vitro (метод С).
В настоящее время в Европейском союзе серологические методы являются предпочтительными с точки зрения реализации Директивы 2010/63/EU «О защите животных, используемых в научных целях» и принципов 3Rs («replacement/refinement/reduction», «замена/улучшение/сокращение»)10. Основные цели реализации принципов 3Rs состоят в замене экспериментов на животных и сокращении количества животных, уменьшении их боли и страданий, а также в усовершенствовании методов, при выполнении которых невозможно отказаться от животных [5][6].
В Российской Федерации осуществляется работа по формированию единых подходов к оценке качества комбинированных вакцин на территории государств — членов Евразийского экономического союза (ЕАЭС). Основной задачей является интеграция и гармонизация нормативных требований Фармакопеи ЕАЭС с положениями Европейской фармакопеи11 [7][8]. В связи с процессом гармонизации методов контроля качества вакцин высокую значимость приобретает совершенствование применяемых в России методов испытаний, что потребует дополнение характеристик ФСО. Установление дополнительной величины специфической активности СА на морских свинках обеспечит возможность использования ФСО в методах контроля, предусмотренных Фармакопеей ЕАЭС (аналогично Европейской фармакопее), включая метод летального заражения и определение титров антител в сыворотке крови вакцинированных животных. Это особенно важно для метода ИФА, в котором предусмотрено использование морских свинок для одновременной оценки иммунного ответа к столбнячному и дифтерийному компонентам комбинированных вакцин.
Цель работы — определение величины специфической активности фармакопейного стандартного образца адсорбированного столбнячного анатоксина методом летального заражения на морских свинках.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы:
- четвертый МСО адсорбированного СА с активностью 490 МЕ/ампула на морских свинках и 260 МЕ/ампула на мышах (4th WHO International Standard for tetanus toxoid adsorbed, 490 IU/ampoule for guinea pig, 260 IU/ampoule for mice; NIBSC code: 08/218)12;
- ФСО для оценки активности адсорбированного СА (реестровый номер ФСО.3.2.00247, серия 011-210619). Лиофилизат в виде пористой таблетки белого цвета; ампулы, 1 мл. Производитель кандидата в ФСО: АО «НПО «Микроген» (Россия, 2018 г.). ФСО приготовлен из очищенного СА, адсорбированного на гидроксиде алюминия, с добавлением стабилизаторов: 1,5% желатина (конечная концентрация) и 10% сахарозы (конечная концентрация). Содержание СА в ампуле — 20 ЕС (единицы связывания). Специфическая активность (аттестованная характеристика), установленная методом летального заражения на мышах — 180 МЕ/ампула;
- глицериновый раствор столбнячного токсина («Пермское НПО «Биомед», Россия);
- стерильный 0,9% раствор натрия хлорида (ФГБУ «НЦЭСМП» Минздрава России).
Лабораторные животные
Исследование проводили на аутбредных морских свинках весом от 250 до 350 г, полученных из питомника филиала «Андреевка» ФГБУН «Научный центр биомедицинских технологий» ФМБА России. Всего в исследовании было использовано 352 морские свинки (самцы, самки). Животные одного пола были равномерно распределены по клеткам (по 4–5 особей в зависимости от экспериментальной группы). В период проведения исследования животных содержали в изолированном помещении конвенционального вивария при температуре 22–24 °C и относительной влажности воздуха 45–60% в условиях свободного доступа к воде и корму на стандартном рационе кормления. В качестве подстилки использовали древесные опилки.
Морских свинок иммунизировали подкожно исследуемыми ФСО и МСО в объеме 1 мл. Контрольная группа состояла из неиммунизированных животных, взятых из той же партии. Через 28–30 сут вводили подкожно опытную дозу 50 LD50/мл раствора столбнячного токсина. Все манипуляции (иммунизация, заражение, наблюдение) проводили в утренние часы. В ходе исследования применяли принцип «гуманной конечной точки». Животных, у которых регистрировали клинические признаки столбнячной интоксикации, соответствующие стадии Т3 (тяжелые симптомы, вызывающие чрезмерные страдания), подвергали эвтаназии с использованием автоматизированной системы подачи углекислого газа в соответствии с существующими нормами гуманного обращения с лабораторными животными13. После завершения исследований всех оставшихся животных также подвергали эвтаназии тем же методом.
Протокол исследования с использованием экспериментальных животных был одобрен Локальным этическим комитетом ФГБУ «НЦЭСМП» Минздрава России (протокол № 11 от 17.04.2025). Исследование проводили в соответствии с требованиями Европейской конвенции по защите позвоночных животных, используемых в экспериментальных и иных научных целях14, принципами Международного совета медицинских научных обществ (CIOMS)15, ГОСТ 33216-201416 и нормами надлежащей лабораторной практики (GLP)17.
Оборудование
Дозаторы одноканальные переменного объема (100–1000 мкл, 500–5000 мкл, Eppendorf AG, Германия) относительная погрешность не более 1%; холодильник POZIS ХФ-400 (з-д Серго Орджоникидзе, Россия); морозильник Саратов 106 (ООО «СЭПО-ЗЭМ», Россия); весы электронные Tanita BD-590 (Tanita Corporation, Япония), предел допустимой погрешности ±0,05 г, класс точности III; ламинарный бокс микробиологической безопасности II класса, тип B2 (БМБ-II-1,2, ЗАО «Ламинарные системы», Россия).
Методы
Метод летального заражения (метод множественных разведений). Животных распределяли на опытные группы — по 8–10 особей для иммунизации МСО и ФСО (по 4 группы на каждый препарат). Для подтверждения корректности выбранной дозы столбнячного токсина формировали 4 контрольные группы по 4 неиммунизированные особи из той же партии.
Разведения МСО и ФСО готовили ex tempore в асептических условиях. После вскрытия ампул МСО и ФСО с соблюдением мер предосторожности (избегая распыления содержимого) вносили стерильный 0,9% раствор натрия хлорида для получения исходного разведения (исходный раствор, ИР). Далее готовили серию двукратных разведений (табл. 1, 2).
Таблица 1. Схема приготовления разведений международного стандартного образца (МСО) адсорбированного столбнячного анатоксина (пример)
Table 1. Scheme for preparing dilutions of the International Standard (IS) for tetanus toxoid adsorbed (example)
Разведение Dilution | Объем МСО, мл IS volume, mL | Объем 0,9% раствора натрия хлорида, мл Sodium chloride 0.9% volume, mL | Содержание столбнячного анатоксина, МЕ/мл (иммунизирующая доза) Tetanus toxoid content, IU/mL (immunizing dose) |
I (исходный раствор) I (stock solution) | 1 ампула (490 МЕ/ампула) 1 ampoule (490 IU/ampoule) | 1,3 | 377 (исходный раствор; не вводят животным) 377 (stock solution; do not administer to animals) |
II | 0,25 мл разведения I 0.25 mL of dilution I | 23,25 | 4 |
III | 11,0 мл разведения II 11.0 mL of dilution II | 11,0 | 2 |
IV | 11,0 мл разведения III 11.0 mL of dilution III | 11,0 | 1 |
V | 11,0 мл разведения IV 11.0 mL of dilution IV | 11,0 | 0,5 |
Таблица составлена авторами / The table is prepared by the authors
Таблица 2. Схема приготовления разведений фармакопейного стандартного образца для оценки активности адсорбированного столбнячного анатоксина (пример)
Table 2. Scheme for preparing dilutions of the pharmacopoeial reference standards for potency testing of tetanus toxoid adsorbed (example)
Разведение Dilution | Объем ФСО, мл FSO volume, mL | Объем 0,9% раствора натрия хлорида, мл Sodium chloride 0.9% volume, mL | Содержание исходного раствора в 1 мл (иммунизирующая доза) Stock solution content per 1 mL (immunizing dose) |
I | 1 ампула, МЕ/ампула 1 ampoule, IU/ampoule | 1,0 (исходный раствор) 1.0 (stock solution) | Исходный раствор; не вводят животным Stock solution; not administered to animals |
II | 0,8 мл разведения I 0.8 mL of dilution I | 31,2 | 0,025 |
III | 16,0 мл разведения II 16.0 mL of dilution II | 16,0 | 0,0125 |
IV | 16,0 мл разведения III 16.0 mL of dilution III | 16,0 | 0,00625 |
V | 16,0 мл разведения IV 16.0 mL of dilution IV | 16,0 | 0,003125 |
Таблица составлена авторами / The table is prepared by the authors
Примечание. ФСО — фармакопейный стандартный образец (ФСО 3.2.00247, серия 011-210619).
Note. FSO, pharmacopoeial reference standard (FSO.3.2.00247, series 011-210619).
Растворы с разведениями ФСО и МСО (по 1 мл) вводили животным подкожно в брюшную область (у окончания грудины). Через 28–30 сут вводили 1 мл столбнячного токсина в дозе 50 LD50 подкожно в бедро (верхняя треть задней поверхности бедра). LD50 определяли как дозу, вызывающую гибель 50% зараженных морских свинок в течение 5 сут. Контроль активности токсина проводили на неиммунизированных морских свинках, вводя подкожно 2; 1; 0,5; 0,25 LD50 (расчетная величина) столбнячного токсина в объеме 1 мл.
За животными опытных и контрольной групп наблюдали ежедневно в течение 5 сут, регистрируя количество павших особей и клинические проявления столбняка в каждой группе. Признаки столбнячной интоксикации определяли по шкале оценки клинических проявлений столбняка18: Т1 — небольшая ригидность конечности, трудно определяемая визуально; Т2 — парез конечности, с сохранением частичной функциональности; Т3 — паралич одной задней конечности, неохотное передвижение животного, формирование сколиоза с характерной «бананообразной» деформацией туловища; Т4 — конечность полностью ригидна, пальцы неподвижны, выраженное мышечное сокращение конечности, обычно наблюдается сколиоз; Т5 — столбнячные судороги, продолжительные тонические спазмы мышц; летальный исход.
Животных, достигших стадии Т3 или выше по шкале клинических проявлений столбняка, подвергали эвтаназии. Стадию Т3 рассматривали в качестве «гуманной конечной точки», поскольку она характеризуется клиническими признаками, приводящими к летальному исходу животного [9][10]. Согласно биоэтическим нормам «гуманная конечная точка» определяется как один или несколько физиологических или поведенческих показателей, свидетельствующих о необходимости прекращения или уменьшения боли и страданий экспериментального животного, закончив болезненную процедуру или прибегнув к эвтаназии [9][10].
На основании полученных результатов рассчитывали величины ЕD50 (доза препарата, обеспечивающая защиту от гибели 50% иммунизированных животных в течение 5 сут) для МСО и ФСО, введенных иммунизированным животным, используя формулу Кербера (1) [11]:
lg ED50 = lg DN – lg b × (∑ Li – 0,5), (1)
где DN — максимальная испытанная доза (МЕ/мл — для МСО, ИР/мл — для ФСО); b — кратность разведения; Li — отношение количества выживших животных без признаков столбняка к общему числу животных, получивших данную дозу; ∑ Li — сумма значений Li для всех использованных доз.
Значение LD50 столбнячного токсина, введенного животным, вычисляли согласно формуле Кербера (2):
lg LD50 = lg DN – lg b × (∑ Li – 0,5), (2)
где DN — максимальная испытанная доза токсина; b — кратность разведения; Li — отношение количества особей с признаками столбнячной интоксикации к общему числу животных в контрольной группе; ∑ Li — сумма значений Li для всех использованных доз.
Было проведено четыре испытания ФСО адсорбированного СА.
Расчет значений аттестованной характеристики фармакопейного стандартного образца для оценки специфической активности адсорбированного столбнячного анатоксина. Количество МЕ в 1 мл исследуемого препарата рассчитывали, сравнивая дозы МСО и ФСО, вызывающие одинаковый защитный эффект (ED50). Специфическую активность ФСО в МЕ/мл (А) вычисляли по формуле (3):
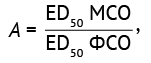 (3)
(3)
где значения ЕD50 МСО (МЕ) и ЕD50 исследуемого ФСО (мл) рассчитывали по формуле Кербера (1).
С учетом исходного разведения исследуемого ФСО определяли содержание МЕ в одной ампуле лиофилизированного препарата ФСО.
Расчет значений LD50 столбнячного токсина. Вычисляли значение LD50 столбнячного токсина, введенного иммунизированным животным, используя формулу Кербера (2). Экспериментальный протокол предусматривал введение животным не менее 50 LD50.
Пример расчета значения LD50 столбнячного токсина. Для кратности разведения b=2 и ∑ Li=2,25: lg LD50 = lg 2 – lg 2 × (2,25 – 0,5) = 0,301 – 0,301 × 1,75 = –0,22577. Соответственно, расчетное значение LD50 = anti lg (–0,22577) = 0,5946. Таким образом, иммунизированным животным введена заражающая доза 84,1 LD50 (50 / 0,5946) столбнячного токсина.
Критерии приемлемости испытания
- Наименьшее разведение МСО и ФСО (максимальная доза) должно защищать более половины животных.
- Наибольшее разведение МСО и ФСО (минимальная доза) должно защищать менее половины животных.
- Рассчитанные значения ЕД50 для ФСО и МСО должны находиться между максимальной и минимальной введенными дозами.
- Все морские свинки, получившие дозу токсина 2 LD50/мл, должны погибнуть или иметь клинические проявления столбнячной интоксикации стадии Т3 и выше.
- Все животные, получившие дозу токсина 0,25 LD50/мл, должны выжить без клинических проявлений столбнячной интоксикации.
- Заражающая доза столбнячного токсина не менее 50 LD50.
Статистическая обработка результатов. Значение аттестованной характеристики определяли как среднее арифметическое всех повторностей. Статистический анализ выполняли с использованием программы Microsoft Office Exсel, рассчитывая среднеарифметическое значение.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Программа аттестации
Определение значения аттестованной характеристики проводили биологическим методом летального заражения (challenge assay) в соответствии с Европейской фармакопеей (метод А)19 по методике, применявшейся в международных коллаборативных исследованиях при аттестации четвертого МСО адсорбированного СА [12]. Четвертый МСО был аттестован в 2011 г. в рамках исследований с участием 34 лабораторий из 22 стран мира, включая лабораторию анатоксинов и антитоксических препаратов Государственного научно-исследовательского института стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича (в настоящее время — ФГБУ «НЦЭСМП» Минздрава России). Согласно протоколу, разработанному ВОЗ, испытания проводили на двух видах животных (морские свинки и мыши), одновременно оценивая возможность применения данного МСО в серологическом методе ИФА [12].
На основании экспериментальных материалов проведенных исследований была разработана Программа аттестации ФСО адсорбированного СА (ФСО.3.2.00247, серия 011-210619). Подбор разведений МСО и исследуемого ФСО осуществляли на основе ретроспективного анализа данных, полученных участниками исследований.
Испытания по аттестации специфической активности ФСО адсорбированного СА на морских свинках проводили одновременно с испытаниями по аттестации ФСО 3.2.00247 на мышах в период с 2021 по 2024 гг. Сроки проведения испытаний были обусловлены ограниченной доступностью МСО (NIBSC code: 08/218). Всего было проведено четыре испытания.
Определение специфической активности фармакопейного стандартного образца адсорбированного столбнячного анатоксина
Было проведено четыре испытания ФСО адсорбированного СА (ФСО 3.2.00247, серия 011-210619) (табл. 3). В рамках предварительных испытаний (испытания № 1 и № 2) были отработаны экспериментальные условия. На основании степени проявлений столбнячной интоксикации у животных оптимальными разведениями ФСО для дальнейшей работы были признаны условия испытания № 2.
Таблица 3. Результаты определения специфической активности фармакопейного стандартного образца адсорбированного столбнячного анатоксина (ФСО 3.2.00247, серия 011-210619) методом летального заражения на морских свинках
Table 3. Results of the potency determination for the pharmacopoeial reference standard of tetanus toxoid adsorbed (FSO.3.2.00247, series 011-210619) by the lethal challenged assay in guinea pigs
№ испытания Study No. | СО (n — число животных в группе) SS (n —number of animals per group) | Иммунизирующая доза СО Immunizing dose of SS | Li | ED50 (рассчетные единицы) ED50 (calculated units) | Специфическая активность (А), МЕ/мл Potency (А), IU/mL | Контроль активности столбнячного токсина Tetanus toxin activity control | ||
Содержание исходного раствора СО в 1 мл Stock solution content of SS per 1 mL | МЕ/мл IU/mL | Li # (n=16) | Заражающая доза Challenge dose | |||||
1 | ФСО / FSO (n=8) | 0,0182 | – | 0,8750 | 0,0091 (мл) / (mL) | 239,7 | 2,25 | 84,1 LD50 |
0,0091 | – | 0,5000 | ||||||
0,0046 | – | 0,1250 | ||||||
0,0023 | – | 0,0000 | ||||||
МСО / IS (n=8) | – | 4 | 1,0000 | 2,1810 (МЕ) / (IU) | ||||
– | 2 | 0,3750 | ||||||
– | 1 | 0,0000 | ||||||
– | 0,5 | 0,0000 | ||||||
2 | ФСО / FSO (n=8) | 0,025 | – | 0,7500 | 0,0149 (мл) / (mL) | 190,27 | 3,00 | 141 LD50 |
0,0125 | – | 0,3750 | ||||||
0,00625 | – | 0,1250 | ||||||
0,003125 | – | 0,0000 | ||||||
МСО / IS (n=8) | – | 4 | 0,7500 | 2,8284 (МЕ) / (IU) | ||||
– | 2 | 0,1250 | ||||||
– | 1 | 0,1250 | ||||||
– | 0,5 | 0,0000 | ||||||
3 | ФСО / FSO (n=10) | 0,025 | – | 1,0000 | 0,0077 (мл) / (mL) | 226,27 | 2,00 | 70,7 LD50 |
0,0125 | – | 0,8000 | ||||||
0,00625 | – | 0,3000 | ||||||
0,003125 | – | 0,1000 | ||||||
МСО / IS (n=10) | – | 4 | 0,9000 | 1,7411 (МЕ) / (IU) | ||||
– | 2 | 0,6000 | ||||||
– | 1 | 0,2000 | ||||||
– | 0,5 | 0,0000 | ||||||
4 | ФСО / FSO (n=10) | 0,025 | – | 0,9000 | 0,0103 (мл) / (mL) | 226,27 Аavg = 220,6 | 1,75 | 59,5 LD50 |
0,0125 | – | 0,6000 | ||||||
0,00625 | – | 0,2000 | ||||||
0,003125 | – | 0,1000 | ||||||
МСО / IS (n=10) | – | 4 | 0,8000 | 2,2974 (МЕ) / (IU) | ||||
– | 2 | 0,4000 | ||||||
– | 1 | 0,1000 | ||||||
– | 0,5 | 0,0000 | ||||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. СО — стандартный образец; ФСО — фармакопейный стандартный образец (ФСО 3.2.00247, серия 011-210619); МСО — международный стандартный образец; МЕ — международные единицы; ED50 — доза препарата, обеспечивающая защиту от гибели 50% иммунизированных животных в течение 5 сут; Li — отношение количества выживших животных без явлений столбняка к общему числу животных в группе; # показатель Li (контроль активности токсина проводили суммарно по 4 группам) — отношение количества особей с признаками столбнячной интоксикации к общему числу животных в контрольной группе; Аavg — среднее значение специфической активности; «–» — не применимо.
Note. SS, standard sample; FSO, pharmacopoeial reference standard (FSO.3.2.00247, series 011-210619); IS, international standard; IU, international units; ED50, dose providing 50% protection of immunized animals from death within 5 days; Li, ratio of animals surviving without tetanus symptoms to total animals in group; # Li, index (control of toxin activity was carried out in total for 4 groups) — ratio of animals exhibiting tetanus intoxication signs to total animals in the control group; Аavg, average value of potency; –, not applicable.
Было продемонстрировано, что все четыре испытания соответствовали критериям приемлемости. На основании проведенных испытаний среднее значение специфической активности адсорбированного СА, определенное на морских свинках, составило 220 МЕ/ампула.
Таким образом, аттестованная характеристика действующего ФСО (серия 011-210619) активности адсорбированного СА, помимо ранее установленного значения специфической активности на мышах (180 МЕ/ампула), может быть дополнена значением активности, определенным методом летального заражения на морских свинках (220 МЕ/ампула).
В рамках гармонизации Фармакопеи ЕАЭС с Европейской фармакопеей аттестация ФСО адсорбированного СА приобретает существенное практическое значение. ФСО (серия 011-210619) применим не только в методе летального заражения, но и в ИФА — методе для определения титра противостолбнячных антител у морских свинок. Данный метод предполагает оценку специфической активности дифтерийного и столбнячного анатоксинов в сыворотке крови одного животного, что требует иммунизации морских свинок как дифтерийной, так и столбнячной референс-вакцинами. Наличие аттестованного национального стандартного образца для оценки специфической активности на двух видах животных, позволит: 1) расширить область применения стандарта; 2) исключить зависимость от зарубежных СО; 3) существенно снизить стоимость проведения испытаний.
Оценка стабильности фармакопейного стандартного образца адсорбированного столбнячного анатоксина
Для изучения стабильности был проведен ретроспективный анализ данных по применению ФСО для оценки активности адсорбированного СА (серия 011-210619), аттестованного в 2018 г. взамен отраслевого СО предыдущей серии (серия 10; использовалась в период с 1990 по 2018 г.). За период использования данного СО было выполнено более 800 испытаний, при этом снижения специфической активности зарегистрировано не было. СО хранился при температуре не выше минус 18 °С (при долговременном хранении), в условиях транспортировки, а также в условиях хранения у потребителя (от 2 до 8 °С в защищенном от света месте). Подтверждение значения специфической активности осуществлялось ежегодно относительно действующего МСО.
ФСО (серия 011-210619) был изготовлен по методике, аналогичной применяемой для производства предыдущей серии СО (серия 10). Образцы кандидата в ФСО хранились при температуре не выше минус 18 °С. Данные, полученные в 2018–2024 гг. при проведении аттестации и подтверждения значения специфической активности ФСО (серия 011-210619) относительно МСО, а также в ходе рутинного контроля качества вакцин и адсорбированного СА на мышах (суммарно более 80 результатов), достоверно подтверждают стабильность ФСО. На основании этих данных можно предположить, что значение аттестованной характеристики, установленное на морских свинках, будет стабильным. Мониторинг стабильности ФСО (серия 011-210619) по дополнительной аттестованной характеристике предусмотрен программой аттестации.
ВЫВОДЫ
- Проведена аттестация фармакопейного стандартного образца для оценки активности адсорбированного столбнячного анатоксина (ФСО.3.2.00247, серия 011-210619) методом летального заражения на морских свинках. Значение аттестованной характеристики, установленное относительно международного стандартного образца (NIBSC code: 08/218), составило 220 МЕ/ампула.
- Полученные экспериментальные данные являются основанием для внесения изменений в паспорт ФСО 3.2.00247 (серия 011-210619) путем дополнения его значением активности, определенным на морских свинках (220 МЕ/ампула).
- Представленные результаты свидетельствуют о возможности использования ФСО 3.2.00247 (серия 011-210619) не только в методе летального заражения, но и в альтернативных методах контроля качества.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.И. Комаровская — разработка дизайна и проведение экспериментальных исследований, систематизация, статистическая обработка, оформление и интерпретация результатов; написание текста рукописи, формулировка выводов исследования; О.В. Фадейкина — анализ результатов, написание, редактирование и переработка текста рукописи; К.А. Лыско — редактирование и формулировка выводов; Р.А. Волкова — обсуждение программы аттестации, редактирование текста рукописи; О.Г. Корнилова — обсуждение и анализ результатов.
Соответствие принципам этики. Протокол исследования с использованием экспериментальных животных был одобрен локальным этическим комитетом ФГБУ «НЦЭСМП» Минздрава России (протокол № 11 от 17.04.2025).
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. E.I. Komarovskaya designed the study; conducted experimental research; performed statistical analysis; systematized, and interpreted the results; drafted the manuscript and formulated the conclusions. O.V. Fadeikina analyzed the results, drafted and revised the manuscript. K.A. Lysko edited the text, formulated the conclusions. R.A. Volkova discussed the certification program and edited the manuscript. O.G. Kornilova discussed and analyzed the results.
Ethics approval. The protocol of the animal study was approved by the Local Ethics Committee at the Scientific Centre for Expert Evaluation of Medicinal Products of the Ministry of Health of the Russian Federation (Protocol No. 11 of 17 April 2025).
1. https://immunizationdata.who.int/global/wiise-detail-page/vaccination-schedule-for-tetanus?ISO_3_CODE=&TARGETPOP_GENERAL=GENERAL
2. WHO Expert Committee on Biological Standardization. 40th report. Technical Report Series No. 800. WHO; 1990.
3. Там же.
4. WHO Expert Committee on Biological Standardization. 40th report. Technical Report Series No. 800. WHO; 1990.
Manual for quality control of diphtheria, tetanus and pertussis vaccines. WHO; 2013.
5. https://nibsc.org/documents/ifu/08-218.pdf
6. Manual for quality control of diphtheria, tetanus and pertussis vaccines. WHO; 2013.
7. Lyng J. Potency assays in mice and in guinea-pigs of adsorbed tetanus toxoid. WHO/BS/83.1395. Geneva: WHO; 1983.
https://iris.who.int/handle/10665/60067
8. ОФС 1.7.2.0004.15 Иммуногенность адсорбированного столбнячного анатоксина. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
9. 2.7.8 Assay of tetanus vaccine (adsorbed). European Pharmacopoeia. 11th ed.; 2008.
10. https://eur-lex.europa.eu/eli/dir/2010/63/oj/eng
11. Методические руководства по созданию Фармакопеи Евразийского экономического союза и иных документов по контролю качества лекарственных средств. Евразийская экономическая комиссия, Фармакопейный комитет евразийского экономического союза. М.; 2024.
12. https://nibsc.org/documents/ifu/08-218.pdf
13. Рекомендация Коллегии Евразийской экономической комиссии от 14.09.2023 № 33 «О Руководстве по работе с лабораторными (экспериментальными) животными при проведении доклинических (неклинических) исследований».
14. European Convention for the protection of vertebrate animals used for experimental and other scientific purposes. ETS No.123. Strasbourg; 1986. https://norecopa.no/media/2iydns5h/ets-123-original.pdf
15. https://cioms.ch/
16. ГОСТ 33216-2014. Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами.
17. Приказ Минздрава России от 01.04.2016 № 199н «Об утверждении Правил надлежащей лабораторной практики».
18. 2.7.8 Assay of tetanus vaccine (adsorbed). European Pharmacopoeia. 11th ed.; 2008.
Manual for quality control of diphtheria, tetanus and pertussis vaccines. WHO; 2013.
19. 2.7.8 Assay of tetanus vaccine (adsorbed). European Pharmacopoeia. 11th ed.; 2008.
Список литературы
1. Jones CE, Danovaro-Holliday MC, Mwinnyaa G, Gacic-Dobo M, Francis L, Grevendonk J, et al. Routine vaccination coverage — Worldwide, 2023. MMWR. 2024;73(43):978–84. https://doi.org/10.15585/mmwr.mm7343a4
2. Shattock AJ, Johnson HC, Sim SY, Carter A, Lambach P, Hutubessyet RCW, et al. Contribution of vaccination to improved survival and health: modelling 50 years of the Expanded Programme on Immunization. Lancet. 2024;403(10441):2307–16. https://doi.org/10.1016/s0140-6736(24)00850-x
3. Popoff MR. Tetanus in animals. J Vet Diagn Invest. 2020; 32(2):184–91. https://doi.org/10.1177/1040638720906814
4. Gupta RK, Anderson R, Cecchini D, Rost B, Xu J, Gendreau K, et al. Evaluation of a guinea pig model to assess interference in the immunogenicity of different components of a combination vaccine comprising diphtheria, tetanus and acellular pertussis (DTaP) vaccine and haemophilus influenzae type B capsular polysaccharide conjugate vaccine. Biologicals. 1999;27(2):167–76. https://doi.org/10.1006/biol.1999.0204
5. Lilley E, Coppens E, Das P, Galaway F, Isbrucker R, Sheridan S, et al. Integrating 3Rs approaches in WHO guidelines for the batch release testing of biologicals: Responses from a survey of vaccines and biological therapeutics manufacturers. Biologicals. 2023;81:101660. https://doi.org/10.1016/j.biologicals.2022.11.002
6. Hassall L, Yara DA, Riches-Duit R, Rigsby P, Dobly A, Vermeulen M, et al. Development of a monoclonal antibody sandwich ELISA for the quality control of human and animal tetanus vaccines. ALTEX. 2024;41(4):588–604. https://doi.org/10.14573/altex.2401171
7. Шахназаров БА. Фармакопея ЕАЭС как гармонизирующая основа требований к качеству лекарственных средств в ЕАЭС и за его пределами. Актуальные проблемы российского права. 2022;17(11):183–93. https://doi.org/10.17803/1994-1471.2022.144.11.183-193
8. Корнилова ОГ, Багирова ВЛ. Фармакопейная стандартизация биологических лекарственных препаратов: основные принципы в условиях единого фармацевтического рынка стран Евразийского экономического союза. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(1):71–82. https://doi.org/10.30895/2221-996X-2025-25-1-71-82
9. Hendriksen CFM, Steen B. Refinement of vaccine potency testing with the use of humane endpoints. ILAR J. 2000;41(2):105–13. https://doi.org/10.1093/ilar.41.2.105
10. Stokes W. Humane endpoints for laboratory animals used in regulatory testing. ILAR J. 2002;43(Suppl 1):31–8. https://doi.org/10.1093/ilar.43.Suppl_1.S31
11. Ашмарин ИП, Воробьев АА. Статистические методы в микробиологических исследованиях. Л.: Медгиз; 1962.
12. Tierney R, Stickings P, Hockley J, Rigsby P, Iwaki M, Sesardic D. Collaborative study for the calibration of a replacement International Standard for Tetanus Toxoid Adsorbed. Biologicals. 2011;39(6):404–16. https://doi.org/10.1016/j.biologicals.2011.09.007
Об авторах
Е. И. КомаровскаяРоссия
Комаровская Елена Игоревна
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. В. Фадейкина
Россия
Фадейкина Ольга Васильевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
К. А. Лыско
Россия
Лыско Ксения Андреевна, канд. техн. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Р. А. Волкова
Россия
Волкова Рауза Асхатовна, д-р биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. Г. Корнилова
Россия
Корнилова Ольга Геннадьевна, д-р фарм. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Комаровская Е.И., Фадейкина О.В., Лыско К.А., Волкова Р.А., Корнилова О.Г. Аттестация фармакопейного стандартного образца для оценки специфической активности адсорбированного столбнячного анатоксина на морских свинках. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):182-192. https://doi.org/10.30895/2221-996X-2025-25-2-182-192
For citation:
Komarovskaya E.I., Fadeikina O.V., Lysko K.A., Volkova R.A., Kornilova O.G. Certification of a pharmacopoeial reference standard for potency testing of adsorbed tetanus toxoid in guinea pigs. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):182-192. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-2-182-192


































