Перейти к:
Разработка количественной иммуноферментной тест-системы для определения концентрации Е2 антигена вируса Чикунгунья и расчета массы цельновирионного антигена в культуральных образцах
https://doi.org/10.30895/2221-996X-2025-632
Резюме
ВВЕДЕНИЕ. Вирус Чикунгунья (ВЧИК) за последние годы широко распространился во многих частях мира, вызывая крупномасштабные вспышки с серьезными экономическими и социальными последствиями. Для повышения эффективности борьбы с вирусом необходимо разрабатывать и совершенствовать методы диагностики ВЧИК не только в сыворотке крови пациентов, но и в полевых материалах — для выявления и уничтожения очагов инфекции. Определение антигенов ВЧИК также важно проводить в образцах культуральной жидкости на разных этапах разработки и производства вакцин.
ЦЕЛЬ. Разработка количественной тест-системы на основе одностадийного сэндвич-варианта иммуноферментного анализа для выявления Е2 антигена вируса Чикунгунья в культуральных жидкостях, а также методики расчета массы цельновирионного антигена в образце.
МАТЕРИАЛЫ И МЕТОДЫ. В работе использовали два мышиных моноклональных антитела к ВЧИК; очищенный вирус Чикунгунья (штамм Nika21, GenBank ID PQ673601) и рекомбинантный Е2 антиген ВЧИК. Для сравнения чувствительности методов иммуноферментного анализа (ИФА) и обратной транскрипции с последующей количественной ПЦР в режиме реального времени (ОТ-кПЦР-РВ) использовали образцы культуральной жидкости, которые собирали в разные временные точки (18, 24, 46, 72 ч) после заражения ВЧИК клеток Vero. Основные аналитические и технические характеристики разработанной ИФА тест-системы определяли в соответствии с требованиями ГОСТ 51352–2013.
РЕЗУЛЬТАТЫ. Аналитическая чувствительность метода составила не менее 0,625 нг/мл, значение коэффициента вариации — не более 3,56%, тест на «открытие» — 100%, результаты теста на «линейность» в диапазоне концентраций 1,5–16 нг/мл были в пределах 90–110%. Специфичность метода составила 100%; перекрестная реактивность не наблюдалась с образцами, содержащими вирусы денге, желтой лихорадки, Синдбис, краснухи и вирус Западного Нила. Разработанная ИФА тест-система и метод ОТ-кПЦР-РВ продемонстрировали схожие результаты при определении массы цельновирионного антигена в вируссодержащей жидкости — 1,06 и 1,09 мкг/мл соответственно при использовании коэффициента пересчета.
ВЫВОДЫ. Для количественного определения E2 антигена ВЧИК в культуральных образцах была разработана простая, специфичная и чувствительная ИФА тест-система, которую также можно использовать для быстрого анализа полевых образцов. Предложен метод расчета массы цельновирионного антигена по количеству Е2 белка (ИФА) и геномным эквивалентам (ОТ-кПЦР-РВ). Между оптической плотностью в ИФА и пороговым циклом в ПЦР-РВ установлена сильная обратная корреляция.
Ключевые слова
Для цитирования:
Тахан Б., Притворова Л.Н., Самарцева Т.Г., Кедик С.А., Оксанич А.С. Разработка количественной иммуноферментной тест-системы для определения концентрации Е2 антигена вируса Чикунгунья и расчета массы цельновирионного антигена в культуральных образцах. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):214-225. https://doi.org/10.30895/2221-996X-2025-632
For citation:
Tahhan B., Pritvorova L.N., Samartseva T.G., Kedik S.A., Oksanich A.S. Development of an enzyme-linked immunosorbent assay test system for quantifying Chikungunya virus E2 protein and calculating the mass of whole-virion antigen in culture fluid samples. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):214-225. (In Russ.) https://doi.org/10.30895/2221-996X-2025-632
ВВЕДЕНИЕ
Вирус Чикунгунья (ВЧИК) является представителем рода Alphavirus семейства Togaviridae. Вирус чаще всего передается людям через укусы комаров видов Aedes aegypti и Aedes albopictus при попадании вируса в слои эпидермиса и дермы кожи. Далее вирус реплицируется и распространяется в различные жизненно важные органы. Заражение ВЧИК обычно приводит к лихорадке, сыпи, миалгии и артралгии, которые могут длиться от нескольких недель до нескольких месяцев [1–3].
Геном ВЧИК представляет собой положительную одноцепочечную РНК (+ssRNA) размером около 12 тыс. нуклеотидов, содержащую 5’-метилгуанилатный кэп, полиаденилированный 3’-конец и две открытые рамки считывания. Геном ВЧИК кодирует четыре неструктурных белка (nsP1–4) и пять структурных белков (C, E3, E2, 6K и E1) [4][5]. ВЧИК — это сферическая частица диаметром 70 нм. Вирион состоит из белкового капсида и липопротеиновой оболочки хозяина.
У ВЧИК выделяют четыре генотипа: Азиатский (Asian), Западно-Африканский (West African, WAf), Восточно-Центральный Южно-Африканский (East/Central/South African, ECSA) и Восточно-Центральный Южно-Африканский — линия Индийского океана (East/Central/South African genotype, Indian Ocean Lineage, ECSA-IOL). Однако указанные генотипы не имеют четкой территориальной локализации, то есть на одной территории могут одновременно выявляться разные генотипы ВЧИК. После 2004 г. во время вспышек заболеваний, вызванных ВЧИК, на островах Индийского океана была выявлена эволюция линии генотипа ECSA, в которой аланин в положении 226 E1 гликопротеина был заменен на валин (E1-A226V). Эта замена, наряду со специфическими мутациями в Е2 белке, позволила переносить ВЧИК комарам вида Ae. albopictus. Комары вида Ae. albopictus, в отличие от Ае. aegypti, обладают более высокой способностью выживать в прохладных регионах. Таким образом, адаптация ВЧИК к Ae. albopictus как переносчику, вероятно, содействовала резкому распространению ВЧИК и может привести к дальнейшему расширению ареала вируса как в тропических, так и в нетропических регионах [5–7].
В последние годы инфекция ВЧИК была зарегистрирована в различных частях мира, включая регион Индийского океана, Европу, Ближний Восток и Тихоокеанский регион, тогда как ранее ВЧИК выявляли спорадически только в странах Африки и Азии. Широкое распространение ВЧИК представляет проблему для общественного здравоохранения и подчеркивает острую необходимость принятия мер предосторожности и изучения вариантов борьбы с инфекцией [8–10].
Профилактика и контроль распространения ВЧИК сопряжены с совершенствованием существующих диагностических подходов для правильного обнаружения различий между заболеваниями, вызванными ВЧИК, и другими лихорадками [11]. Возбудителями последних являются другие альфа-вирусы и, что наиболее важно, иные семейства арбовирусов, например вирусы денге и Зика, способные циркулировать в тех же географических регионах и вызывать схожие клинические симптомы, что и ВЧИК [12–14].
Обнаружение антигена может быть положено в основу одного из подходов для быстрого обнаружения ВЧИК в полевых образцах (экстракты комаров), поскольку присутствие антигена напрямую связано с присутствием вируса. В то же время при анализе полевых материалов можно также использовать реакцию обратной транскрипции с последующей количественной ПЦР в режиме реального времени (ОТ-кПЦР-РВ). Этот метод обладает более высокой чувствительностью, но ограниченно применим в условиях экспедиций в предполагаемые вирусные очаги.
Е2 белок ВЧИК является потенциальным целевым антигеном для серодиагностики, который может стимулировать иммунный ответ у инфицированного и выработку высокого уровня специфических антител [3][4][11]. Таким образом, контроль вируссодержащих жидкостей (ВСЖ) имеет важное значение, поскольку они содержат Е2 антиген в виде рекомбинантного белка или цельновирионного антигена и используются при изготовлении вакцинных препаратов [15–18].
В настоящее время не существует специфической терапии против ВЧИК, но в 2024 г. была зарегистрирована первая живая аттенуированная вакцина Ixchiq® (Valneva Austria GmbH, Австрия)1. Несмотря на появление вакцины, профилактика ВЧИК по-прежнему во многом зависит от использования мер индивидуальной защиты и борьбы с переносчиками, эффективность которых ограничена [19–22].
Цель работы — разработка количественной тест-системы на основе одностадийного сэндвич-варианта иммуноферментного анализа для выявления Е2 антигена вируса Чикунгунья в культуральных жидкостях, а также методики расчета массы цельновирионного антигена в образце.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Вирусы. Для проведения исследования использовали вирусы Чикунгунья (штамм Nika21, генотип ECSA, GenBank ID PQ673601) и денге 2 типа [23], полученные из коллекции ФГБНУ НИИВС им. И.И. Мечникова. При постановке ИФА и ОТ-кПЦР-РВ использовали образцы ВСЖ, содержащие ВЧИК (штамм Nika21), отобранные через 18, 24, 46 и 72 ч после заражения клеток Vero вирусом Чикунгунья, и образцы культуральной жидкости, содержащие вирус денге и отобранные через 46 ч после заражения клеток Vero вирусом денге 2 типа (множественность заражения 0,001 MOI2), в качестве отрицательного контроля.
Антигены. При проведении ИФА использовали инактивированные β-пропиолактоном экстракты мозговых антигенов новорожденных мышей, зараженных вирусами денге (1 тип — штамм Hawaii, 2 тип — New Guinea C (NGC), 3 тип — H-87, 4 тип — H241), желтой лихорадки (штамм 17D), Западного Нила (штамм Ast-986) и Синдбис (штамм 574). Инактивированные мозговые антигены были любезно предоставлены Биотехнологической компанией «Биосервис» (Россия). Также в исследовании использовали культуральные жидкости, содержащие ВЧИК (штамм Nika21) и вирус краснухи (штамм RA-27). Вирусы были получены из коллекции вирусов ФГБНУ НИИВС им. И.И. Мечникова.
Клеточная линия Vero была получена из коллекции клеточных культур ФГБНУ НИИВС им. И.И. Мечникова.
Рекомбинантный антиген. Для построения калибровочной прямой зависимости оптической плотности при длине волны 450 нм (ОП450) от концентрации Е2 антигена ВЧИК использовали коммерческий аффинно-очищенный рекомбинантный Е2 антиген ВЧИК (штамм SL-CK1, GenBank ID ADG95913.1), полученный в бакуловирусной системе экспрессии белка (Sino Biological, Китай). Белок включает в себя 352 аминокислоты и His-метку на C-конце (молекулярная масса белка 39,8 кДа). Пробы, содержащие Е2 антиген ВЧИК в концентрациях 0,5, 1, 2, 4, 8 и 16 нг/мл, использовали при построении калибровочной прямой для его количественной оценки в исследуемых образцах ВСЖ.
Моноклональные антитела. В работе использовали специфические к ВЧИК мышиные моноклональные антитела (МАт), полученные по классической гибридомной технологии и любезно предоставленные Биотехнологической компанией «Биосервис» (Россия). Всего были получены два препарата МАт, узнающие различные эпитопы Е2 белка ВЧИК. Одно МАт (клон МАт25) использовали для сорбции на 96-луночных планшетах, а второе (клон МАт26) было конъюгировано с пероксидазой хрена.
Методы
Подготовка иммуносорбента. На поверхности лунок 96-луночных ИФА-планшетов (кат. № 2592, Corning, США) с высоким уровнем сорбции (до 500 нг IgG/см²) адсорбировали МАт25 в концентрации 2 мкг/мл, разведенные в карбонатно-бикарбонатном буфере (рН 9,6), из расчета 100 мкл/лунка. Планшеты инкубировали в течение 16–18 ч при температуре 4 °C. После сорбции планшеты пятикратно промывали фосфатно-солевым буфером (рН 7,5) с добавлением 0,05% Твин-20 (ФСБ-Т), а затем поверхность лунок блокировали в течение 2 ч при комнатной температуре 1% раствором казеина в ФСБ из расчета 200 мкл/лунка.
Положительный контрольный образец инактивированный (К+). В качестве положительного контрольного образца при постановке ИФА использовали рекомбинантный коммерческий Е2 антиген ВЧИК (Sino Biological, Китай), описание которого приведено выше.
Отрицательный контрольный образец инактивированный (К–). В качестве отрицательного контроля при постановке ИФА использовали лизат интактной культуры клеток Vero.
Приготовление культуральной жидкости, содержащей вирус Чикунгунья. В экспериментах для получения ВСЖ использовали ВЧИК (штамм Nika21). Нуклеотидная последовательность штамма Nika21 депонирована в GenBank ID PQ6736013. Доза заражения ВЧИК составляла 0,0001 MOI, что соответствовало 100 ТЦД50/100 мкл (ТЦД50 — показатель тканевой цитопатической дозы, вызывающей гибель 50% клеток). Вирус наносили на монослой клеток линии Vero, выращенных в культуральных флаконах Corning® (США) площадью 25 см². Вирус адсорбировали в течение 1 ч, после чего во флаконы добавляли среду поддержки DMEM (ФГАНУ «ФНЦИРИП им. М.П. Чумакова РАН»), содержащую 2% фетальной эмбриональной сыворотки (Gibco, США). Флаконы находились в термостате в течение 3 сут при температуре 32 °С и с 5% содержанием СО2, после чего полученную ВСЖ исследовали в ИФА или ОТ-кПЦР-РВ.
Пробоподготовка ВСЖ для ИФА и ОТ-кПЦР-РВ. В четыре пробирки добавляли по 500 мкл ВСЖ, в две из них вносили 25 мкл РНКазы («Биолот», Россия) до конечной концентрации 50 мкг/мл, а в остальные пробирки — 25 мкл ФСБ и инкубировали в течение 30 мин при 37 °С. Образцы ВСЖ, обработанные и необработанные РНКазой, анализировали в ИФА в четырех повторах согласно разработанному нами протоколу. ОТ-кПЦР-РВ проводили в трех повторах, как это было описано ранее. По калибровочным прямым оценивали геном-эквиваленты на 1 мл по данным ОТ-кПЦР-РВ, и концентрацию Е2 белка по данным ИФА, а затем рассчитывали общую концентрацию вирусного антигена.
Протокол одностадийного сэндвич-варианта метода ИФА. При постановке ИФА все образцы вносили в лунки в двух повторах. Для анализа брали по 50 мкл исследуемых образцов культуральной жидкости, содержащей вирус Чикунгунья, и контрольных образцов в рабочем разведении, а также калибровочные пробы в концентрациях 0,5, 1, 2, 4, 8 и 16 нг/мл. Затем вносили по 50 мкл раствора конъюгата МАт26 с пероксидазой хрена в рабочем разведении. Планшеты инкубировали в течение 1 ч при 37 °С, после чего лунки пятикратно промывали ФСБ-Т. Затем в лунки вносили по 100 мкл 3,3',5,5'-тетраметилбензидина (ТМБ) с пероксидом водорода и инкубировали при комнатной температуре (23–25 °С). Реакцию ИФА останавливали через 15 мин добавлением в лунки 50 мкл раствора 0,5 M серной кислоты и сразу определяли ОП450 с помощью микропланшетного спектрофотометра LisaScan EM (Erba Mannheim, Чехия) при длине волны сравнения 620 нм.
Выделение РНК из образцов ВСЖ проводили при помощи комплекта реагентов «АмплиСенс®Магно-Сорб» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) согласно инструкции производителя.
ОТ-кПЦР-РВ. Для количественной оценки геном-эквивалентов (ГЭ) ВЧИК в ВСЖ использовали реакцию обратной транскрипции (ОТ) с последующей количественной ПЦР в режиме реального времени (ОТ-кПЦР-РВ) [23]. Для проведения реакций ОТ и ПЦР применяли реагенты НПК «Синтол» (Россия).
Статистический анализ полученных данных проводили с использованием стандартного пакета программ Microsoft Office Excel 2016. Данные представлены в виде среднего значения (М) и стандартного отклонения среднего (SD), где это было приемлемо. Достоверность различий сравниваемых величин оценивали с помощью непарного двухстороннего t-критерия Стьюдента. Различия считали статистически достоверными при уровне значимости р<0,05. При построении калибровочных графиков рассчитывали коэффициент детерминации (R²) с использованием пакета программ Microsoft Office Excel 2016. Коэффициент корреляции Пирсона (rxy) применяли для оценки связи между параметрами количественных методов.
Дизайн исследования
При оценке диагностических характеристик разработанной ИФА тест-системы для количественного определения Е2 антигена ВЧИК руководствовались требованиями ГОСТ 51352–20134. Оценивали аналитическую чувствительность, специфичность, воспроизводимость и коэффициент вариации, проводили тесты на «линейность» и на «открытие» (метод добавок). После определения эффективности ИФА тест-системы проводили ее сравнение с ранее разработанным методом ОТ-кПЦР-РВ, для чего анализируемую ВСЖ разделяли на 4 пробирки. Образцы в первых двух пробирках обрабатывали РНКазой, а в остальных — обработку не проводили. Далее образцы анализировали методом ИФА и ОТ-кПЦР-РВ. Обработку РНКазой проводили для оценки только той РНК, которая находилась внутри вирионов; образцы без обработки РНКазой использовали в качестве сравнения. Исходя из данных о молекулярных массах вириона и Е2 белка ВЧИК пересчитывали установленные при помощи двух количественных методов геном-эквиваленты и массы Е2 белка в массу цельновирионного антигена.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Количественное определение Е2 белка вируса Чикунгунья методом одностадийного сэндвич-варианта иммуноферментного анализа
Основной целью нашего исследования была разработка иммуноферментной тест-системы для количественного определения Е2 белка ВЧИК в культуральной жидкости с использованием двух МАт к различным эпитопам Е2 белка ВЧИК, одно из которых сорбировали на твердую фазу, а второе было конъюгировано с пероксидазой хрена. Принцип разработанной тест-системы основан на одновременном взаимодействии МАт25, адсорбированных на поверхности лунок ИФА-планшетов, и конъюгата МАт26 с пероксидазой хрена, с Е2 антигеном ВЧИК, присутствующим в образцах культуральной жидкости и калибровочных пробах. При добавлении раствора, содержащего хромоген TMБ и пероксид водорода, образуется окрашенный комплекс, что подтверждает связывание конъюгата с комплексом МАт25–Е2 антигена ВЧИК. Интенсивность окраски раствора, возникающей при остановке реакции, прямо пропорциональна концентрации Е2 белка ВЧИК в исследуемых образцах.
Существующие методы диагностики ВЧИК до сих пор имеют недостатки, несмотря на большое количество исследований в этой области. Совершенствование диагностики особенно актуально для раннего выявления вируса в острой фазе заболевания и в природных очагах [24][25]. Чувствительность и специфичность ИФА с захватом антигена зависят от качества самого антигена и мышиных моноклональных антител, используемых в экспериментах [26][27]. Поскольку недавние исследования показали, что большинство гуморальных реакций человека при инфекции ВЧИК направлено против E2 белка, то это свидетельствует о том, что основные нейтрализующие антитела имеют специфичность именно к этому белку [28]. Поверхностный Е2 антиген обычно входит в состав разрабатываемых вакцинных препаратов против ВЧИК. Для контроля их качества, а также расчета дозы в лекарственной форме необходима ИФА тест-система для количественного определения E2 белка ВЧИК.
Обширная перекрестная реактивность среди близкородственных представителей рода Alphavirus требует использования высокоселективных и специфических антител для дифференцирования вируса Чикунгунья от других альфа-вирусов с высокой степенью точности [29]. Таким образом, использование МАт является наиболее надежным вариантом для разработки оптимальных недорогих диагностических методов [30][31]. Иммуноферментные тест-системы, основанные на использовании МАт, имеют более высокую специфичность при дифференциальной диагностике вируса Чикунгунья, чем ИФА тест-системы, в которых применяют поликлональные антитела [32].
Определение количественного содержания антигенного Е2 белка ВЧИК в образцах культуральной жидкости
Для количественного определения Е2 белка ВЧИК в исследуемых образцах при каждой постановке ИФА использовали калибровочную прямую. Оптимальный диапазон концентраций калибруемых образцов (0,5–16 нг/мл Е2 белка) определяли путем титрования серии различных концентраций при условии R²≥0,99 (рис. 1).
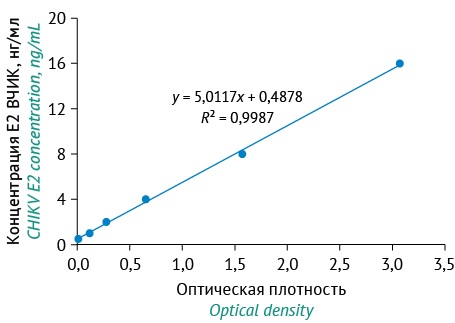
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. График зависимости оптической плотности при длине волны 450 нм от концентрации Е2 белка вируса Чикунгунья (ВЧИК) в калибровочных образцах в диапазоне концентраций от 0,5 до 16 нг/мл.
Fig. 1. Optical density at 450 nm as a function of Сhikungunya virus (CHIKV) E2 protein concentration in calibration samples (concentration range: 0.5–16 ng/mL).
Количественное содержание Е2 белка ВЧИК в исследуемых образцах культуральной жидкости определяли по уравнению линейной регрессии, выведенному по результатам титрования калибранта. Для расчета концентрации антигена в каждом из исследуемых образцов культуральной жидкости подставляли значения оптической плотности для каждого образца в уравнение линейной регрессии по формуле (1):
y = ax + b, (1)
где y — концентрация Е2 белка вируса Чикунгунья в исследуемых образцах (нг/мл); х — оптическая плотность исследуемых образцов при длине волны 450 нм; a и b — постоянные коэффициенты.
Полученное через уравнение линейной регрессии значение концентрации умножали на коэффициент разведения исследуемого образца, равный 10.
Оценка основных функциональных характеристик разработанной тест-системы
Оценку аналитической чувствительности, специфичности, воспроизводимости и других характеристик разработанной тест-системы проводили в соответствии с рекомендациями ГОСТ Р 51352-2013.
Аналитическую чувствительность оценивали следующим образом. В лунки ИФА-планшета трех разных серий вносили нулевую калибровочную пробу в 8 повторах и калибровочные пробы, содержащие 0,5–16 нг/мл Е2 белка (рис. 1), и затем проводили ИФА согласно разработанному протоколу. По результатам калибровки строили калибровочный график и рассчитывали среднее значение ОП нулевой калибровочной пробы и стандартное отклонение. Подставляли полученные значения в формулу (2):
B0 + 2σ, (2)
где B0 — среднее значение оптической плотности нулевой калибровочной пробы; σ — стандартное отклонение оптической плотности нулевой калибровочной пробы.
Из полученного значения ОП проводили прямую, перпендикулярную оси абсцисс, до пересечения с калибровочным графиком; затем из точки пересечения проводили параллель на ось ординат. Соответствующая этому значению концентрация характеризовала аналитическую чувствительность метода. Эксперимент по аналитической чувствительности повторяли трижды и затем рассчитывали среднее значение (табл. S1, опубликована на сайте журнала5).
Таким образом, среднее значение аналитической чувствительности разработанной ИФА тест-системы составило 0,625 нг/мл.
Тест на «линейность» проводили на 3 сериях планшетов, для чего сформировали две группы разведений калибровочной пробы, содержащей Е2 белок ВЧИК. В первую группу были включены калибраторы с концентрациями 1,25, 2,5, 5 и 10 нг/мл, во вторую — 0,75, 1,5, 3 и 6 нг/мл Е2 белка. Затем сравнивали концентрации, полученные в ИФА (фактическое практическое значение) с рассчитанными концентрациями Е2 белка в этих разведенных пробах (теоретическое значение), и рассчитывали значение параметра «линейность» (Л) по формуле (3):
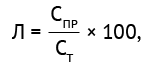 (3)
(3)
где СПР — полученное по калибровочному графику фактическое практическое значение концентрации анализируемого Е2 белка ВЧИК в исследуемой пробе; СТ — расчетное теоретическое значение концентрации Е2 белка ВЧИК в исследуемой пробе.
Результаты теста на «линейность» представлены в таблице S2 (опубликована на сайте журнала6).
Экспериментально установлено, что тест на «линейность» разработанной ИФА тест-системы в диапазоне концентрации 1,5–16 нг/мл допустим в пределах 90–110%.
Коэффициент вариации. Для оценки коэффициента вариации (КВ) выбирали 3 различные концентрации Е2 белка ВЧИК в калибровочных пробах: 16 нг/мл (высокая), 8 нг/мл (средняя) и 2 нг/мл (низкая). ИФА проводили на трех сериях планшетов, анализируя пробы с исследуемыми значениями концентрации в 8 повторах. Затем рассчитывали КВ, разделив значение стандартного отклонения на среднее значение для каждой из трех концентраций по формуле (4):
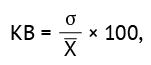 (4)
(4)
где σ — стандартное отклонение оптической плотности анализируемой пробы, содержащей Е2 белок ВЧИК; X — среднее значение оптической плотности анализируемой пробы, содержащей Е2 белок ВЧИК; КВ — коэффициент вариации.
Результаты оценки КВ представлены в таблице S3 (опубликована на сайте журнала7).
Среднее значение КВ разработанной тест-системы составило 3,56%, что считается удовлетворительным, поскольку данное значение ниже 8%.
Тест на «открытие». Для проведения ИФА использовали один и тот же объем двух разных концентраций калибровочной пробы и, смешав их вместе, анализировали каждую смешанную пробу в 8 повторах. Эксперимент проводили на трех сериях планшетов, после чего рассчитывали значение параметра теста на «открытие» (ОТ) путем сравнения значения концентрации Е2 белка в калибровочных пробах (фактическое практическое значение) с рассчитанным теоретическим значением по формуле (5):
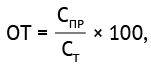 (5)
(5)
где СПР — полученное по калибровочному графику фактическое практическое значение концентрации анализируемого Е2 белка ВЧИК в исследуемой пробе; СТ — расчетное теоретическое значение концентрации Е2 белка ВЧИК в исследуемой пробе. Результаты эксперимента приведены в таблице S4 (опубликована на сайте журнала8).
Тест на «открытие» разработанной ИФА тест-системы составил 100%.
Специфичность. Для оценки специфичности разработанной ИФА тест-системы изучали перекрестную реактивность с другими арбовирусами, передаваемыми комарами. В экспериментах использовали вирусы денге (1 тип — штамм Hawaii, 2 тип — New Guinea C, 3 тип — H-87, 4 тип — H241), желтой лихорадки (штамм 17D), Синдбис (штамм 574), краснухи (RA-27) и лихорадки Западного Нила (штамм Ast-986). В результате выполненного ИФА не наблюдали положительных реакций с перечисленными вирусами. Таким образом, специфичность разработанной тест-системы составила 100%.
По результатам проведенных тестов были определены значения следующих параметров текст-системы: аналитическая чувствительность — 0,625 нг/мл; тест на «линейность» — 90–110% в диапазоне концентраций 1,5–16 нг/мл Е2 белка ВЧИК; тест на «открытие» — 100%; среднее значение коэффициента вариации — 3,56%; специфичность — 100%. Оценка основных характеристик разработанной количественной ИФА тест-системы показывает, что она обладает высокой точностью, специфичностью и аналитической чувствительностью при выявлении Е2 белка вируса Чикунгунья.
Сравнение чувствительности методов ОТ-кПЦР-РВ и ИФА при выявлении ВЧИК в культуральной жидкости
После заражения ВЧИК клеток Vero отбирали пробы культуральной жидкости, содержащей ВЧИК (ВСЖ), в разные временные точки от начала заражения клеток (18, 24, 46 и 72 ч). В качестве контроля заражали клетки Vero вирусом денге 2. Затем проводили ИФА по протоколу, описанному в разделе «Материалы и методы», и ОТ-кПЦР-РВ по методике, описанной в работе А.С. Оксанич с соавт. [33].
С помощью ОТ-кПЦР-РВ (табл. 1) удалось обнаружить вирус Чикунгунья в образцах культуральной жидкости на всех стадиях заражения клеток, при этом количество вирусной РНК нарастало к 72 ч. По данным ИФА ВЧИК был выявлен в образцах начиная с 46 ч после заражения ВЧИК клеток Vero. Таким образом, для контроля наличия антигена при наработке вируса количественный ИФА можно использовать не ранее чем через двое суток после заражения.
Таблица 1. Результаты анализа образцов культуральной жидкости в разные временные точки от начала заражения клеток Vero вирусом Чикунгунья
Table 1. Results of analysis of culture fluid samples taken at different time points after infection of Vero cells with CHIKV
Вид образца Sample type | ИФА ELISA | ОТ-ПЦР в реальном времени Real-time RT-PCR |
ОП450 / OD450 | ПЦ / Ct | |
Контроль среды выделения / Isolation medium control | н/о / n/d | ≥40,0 |
Контроль среды клеток / Culture fluid control | 0,004 | н/о / n/d |
Контроль клеток (46 ч) / Cell control (46 h) | 0,003 | ≥40,0 |
ВСЖ ВЧИК (18 ч) / CHIKV VCF (18 h) | 0,024 | 24,4 |
ВСЖ ВЧИК 24 ч / CHIKV VCF (24 h) | 0,017 | 25,9 |
ВСЖ ВЧИК 46 ч / CHIKV VCF (46 h) | 2,419 | 18,2 |
ВСЖ ВЧИК 72 ч / CHIKV VCF (72 h) | 3,124 | 16,2 |
Положительный контроль / Positive control | 1,660 | 13,1 |
Отрицательный контроль / Negative control | 0,011 | ≥40,0 |
ВСЖ денге (46 ч) / Dengue VCF (46 h) | 0,008 | ≥40,0 |
Исходный образец / Original sample | н/о / n/d | 30,6 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ИФА — иммуноферментный анализ; ОТ-ПЦР — полимеразная цепная реакция с обратной транскрипцией; ОП450 — оптическая плотность при 450 нм; ПЦ — пороговый цикл; ВСЖ — вируссодержащая жидкость; ВЧИК — вирус Чикунгуньи; н/о — не определяли.
Note. ELISA, enzyme-linked immunosorbent assay; RT-PCR, reverse transcription polymerase chain reaction; OD450, optical density at 450 nm; Ct, cycle threshold; VCF, virus-containing fluid; CHIKV, Chikungunya virus; n/d, not determined.
Расчет массы цельновирионного антигена вируса Чикунгунья через концентрацию Е2 антигена
На поверхности вируса Чикунгунья располагаются 80 шипов, представляющих собой тримеры, состоящие из гетеродимеров поверхностных гликопротеинов Е1 и Е2. Количество молекул Е2 гликопротеина в одном вирионе составляет 240 [36][37]. Известно, что молекулярная масса (ММ) целого вириона альфа-вирусов составляет 52 мДа, а ММ одного Е2 гликопротеина — 50 кДа [38], то есть масса всего Е2 белка в вирусной частице составляет 12 мДа (240×50). Таким образом, для пересчета количества Е2 белка в массу цельновирионного препарата необходимо использовать коэффициент 4,33 (52/12).
Для проверки коэффициента, используемого при расчете массы цельновирионного антигена, массу вирусных частиц рассчитывали двумя способами. В первом способе исходили из количества геномных эквивалентов на 1 мл (ГЭ/мл) исследуемого образца, определенных методом ОТ-кПЦР-РВ, подразумевая, что один ГЭ соответствует одной вирусной частице. Во втором способе расчет проводили по массе Е2 белка, определенной в количественном ИФА, и умножали это значение на рассчитанный коэффициент. Для чистоты эксперимента культуральную жидкость, содержащую ВЧИК, разделяли на четыре части: две части обрабатывали РНКазой (50 мкг/мл), а другие две части не обрабатывали (вместо РНКазы добавляли эквивалентный объем ФСБ). Все образцы анализировали обоими методами. Целью предварительной обработки ВСЖ РНКазой было удаление всей свободной вирусной РНК, при этом РНК внутри вирионов оставалась защищенной от фермента, что позволило нам точно определить количество ГЭ/мл методом ОТ-кПЦР-РВ и фактическую массу цельновирионного антигена в образце.
Вес одной вирусной частицы, как было отмечено выше, составляет 52 мДа, или 8,64×10⁻¹⁷ г. С учетом пересчета разведений при выделении РНК, постановке обратной транскрипции и ПЦР в ВСЖ нами было выявлено 1,26×10¹⁰ ГЭ/мл, или 1,09 мкг/мл (1,26×10¹⁰×8,64×10⁻¹⁷=1,09×10⁻⁶ г).
Результаты количественного ИФА указали на то, что содержание Е2 белка в этих же образцах составляет 244,64 нг/мл (табл. 2). Для пересчета концентрации Е2 антигена в массу цельновирионного препарата использовали коэффициент 4,33 (4,33×244,64=1059 нг/мл ≈ 1,06 мкг/мл).
Таблица 2. Расчет массы цельновирионного антигена в образцах ВСЖ, обработанных и не обработанных РНКазой
Table 2. Calculation of the mass of whole-virion antigen in RNAse-treated and non-treated VCF samples
ОТ-ПЦР в реальном времени Real-time RT-PCR | ИФА ELISA | ||||
Параметр Parameter | ВСЖ с РНКазой VCF with RNase | ВСЖ с ФСБ VCF with PBS | Параметр Parameter | ВСЖ с РНКазой VCF with RNase | ВСЖ с ФСБ VCF with PBS |
Уравнение калибровки Calibration equation | y=-3,6357x+53,221 R²=0,9991 | Уравнение калибровки Calibration equation | y=6,448x+1,0025 R²=0,9969 | ||
Среднее значение Ct±SD Mean Ct±SD | 17,6±0,36 | 16,0±0,20 | Среднее значение ОП450±SD Mean OD450±SD | 3,64±0,26 | 3,59±0,27 |
lg(ГЭ/мл)±SD lg(GE/mL)±SD | 9,80±0,10 | 10,24±0,06 | Конц. b Аг ВЧИК (нг/мл)±SD CHIKV E2 concentrationb (ng/mL)±SD | 244,64±16,90 | 241,59±17,60 |
ГЭ/мл±SDa GE/mL±SDa | 1,26×10¹⁰± 0,26×10¹⁰ | 3,46×10¹⁰± 0,43×10¹⁰ | Конц. Аг ВЧИК (нг/мл)±SD CHIKV E2 concentration (ng/mL)±SD | 1059,29±73,29 | 1046,09±76,27 |
Конц. Аг ВЧИК (мкг/мл) ±SD CHIKV E2 concentration (µg/mL)±SD | 1,090±0,001 | 2,990±0,002 | Конц. Аг ВЧИК (мкг/мл)±SD CHIKV E2 concentration (µg/mL)±SD | 1,060±0,073 | 1,050±0,076 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ОТ-ПЦР — количественная полимеразная цепная реакция с обратной транскрипцией; ИФА — иммуноферментный анализ; ВСЖ — вируссодержащая жидкость; ФСБ — фосфатно-солевой буфер; R² — коэффициент детерминации; Ct — пороговый цикл; ОП450 — оптическая плотность при 450 нм; SD — стандартное отклонение; Аг — E2 антиген; ВЧИК — вирус Чикунгунья; ГЭ — геном-эквивалент; Конц. — концентрация.
a умножали полученное значение ГЭ на коэффициент разведения 2.
b умножали концентрацию E2 антигена на коэффициент разведения 10.
Note. RT-PCR, reverse transcription polymerase chain reaction; ELISA, enzyme-linked immunosorbent assay; VCF, virus-containing fluid; PBS, phosphate-buffered saline; R², coefficient of determination; Ct, cycle threshold; OD450, optical density at 450 nm; SD, standard deviation; CHIKV, Chikungunya virus; GE, genomic equivalent.
a The GE value obtained was multiplied by a dilution factor of 2.
b The E2 concentration was multiplied by a dilution factor of 10.
При расчете концентрации цельновирионного антигена в двух образцах, не обработанных РНКазой, получено два значения: 2,99 мкг/мл (данные ОТ-кПЦР-РВ) и 1,05 мкг/мл (данные ИФА). Отметим, что по данным ОТ-кПЦР-РВ расчетное значение концентрации антигена без обработки образца РНКазой превышало почти в 2 раза концентрацию, установленную в ИФА. Это объясняется большим количеством вирусной РНК в ВСЖ, которая присутствует как в виде свободной РНК, вышедшей из разрушенных клеток, так и РНК, заключенной внутри вирусных частиц. Тогда как в ИФА обработка ВСЖ РНКазой не влияет на полученный результат (разница не превышает 1%).
Таким образом, при сравнении двух количественных методов, ИФА и ОТ-кПЦР-РВ с обработкой РНКазой образцов и последующим пересчетом в массу цельновирионного препарата, нами были получены схожие результаты: 1,06 и 1,09 мкг/мл соответственно. Разница в концентрациях не превышает 3% и является недостоверной, что свидетельствует о возможности использования коэффициента 4,33 для пересчета массы Е2 белка ВЧИК в массу цельновирионного антигена.
При расчете коэффициента корреляции Пирсона с использованием стандартного пакета программ Microsoft Office Excel 2016 было получено значение rxy=–0,94. Это указывает на то, что между значениями оптической плотности и пороговыми циклами, полученными с помощью двух методов, существует очень сильная обратная корреляция (0,9<r<1 по шкале Чеддока).
ЗАКЛЮЧЕНИЕ
Разработанная ИФА тест-система для количественного выявления поверхностного Е2 антигена ВЧИК показала высокую эффективность: аналитическая чувствительность метода составила не более 0,625 нг/мл; тест на «линейность» в диапазоне концентраций 1,5–16 нг/мл допустим в пределах 90–110%; среднее значение коэффициента вариации составило 3,56%; тест на «открытие» — 100%. Специфичность ИФА составила 100%, перекрестная реактивность не наблюдалась с образцами, содержащими вирусы денге, желтой лихорадки, Синдбис, краснухи и вирус Западного Нила. Рассчитанный коэффициент пересчета концентрации Е2 белка ВЧИК в цельновирионный антиген составил 4,33. С помощью него можно вычислить значения, достоверно близкие значениям, полученным при пересчете массы вирионов с использованием геномных эквивалентов на 1 мл. Это позволяет говорить о применимости обеих методик расчета на практике, в частности при разработке вакцин, основанных на цельновирионном антигене. При статистическом анализе обнаружена прямая зависимость между двумя количественными методами, ИФА и ОТ-кПЦР-РВ, а также сильная обратная корреляция (rxy=–0,94) между значениями оптической плотности и пороговыми циклами.
Таким образом, разработанная ИФА тест-система для количественного определения Е2 антигена ВЧИК в комплексе с методикой пересчета в цельновирионный антиген помогут внести серьезный вклад в разработку вакцинных препаратов и позволят повысить качество и точность дозировки специфического антигена.
Дополнительная информация. На сайте журнала «БИОпрепараты. Профилактика, диагностика, лечение» размещены таблицы S1–S4.
https://doi.org/10.30895/2221-996X-2025-632-table-s1
https://doi.org/10.30895/2221-996X-2025-632-table-s2
https://doi.org/10.30895/2221-996X-2025-632-table-s3
https://doi.org/10.30895/2221-996X-2025-632-table-s4
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Б. Тахан — постановка экспериментов, написание текста рукописи, формулировка выводов; Л.Н. Притворова — тестирование моноклональных антител, планирование экспериментов по оценке эффективности ИФА; Т.Г. Самарцева — конструирование калибратора ПЦР, отработка методики ОТ-кПЦР-РВ; С.А. Кедик — обоснование концепции исследования, критический пересмотр текста рукописи; А.С. Оксанич — планирование исследования, оценка и обобщение результатов экспериментов, написание и редактирование текста рукописи, формулировка выводов.
Additional information. Tables S1–S4 are published on the website of Biological Products. Prevention, Diagnosis, Treatment.
https://doi.org/10.30895/2221-996X-2025-632-table-s1
https://doi.org/10.30895/2221-996X-2025-632-table-s2
https://doi.org/10.30895/2221-996X-2025-632-table-s3
https://doi.org/10.30895/2221-996X-2025-632-table-s4
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. B. Tahhan performed experiments, wrote the manuscript, formulated conclusions. L.N. Pritvorova tested monoclonal antibodies, planned the experiments to evaluate the effectiveness of ELISA. T.G. Samartseva constructed a PCR calibrator and developed the RT-qPCR-RT technique. S.A. Kedik substantiated the study concept and critically revised the manuscript. A.S. Oksanich planned the study, evaluated and summarised the experimental results, wrote and edited the manuscript, and formulated conclusions.
1. https://www.ema.europa.eu/en/medicines/human/EPAR/ixchiq
2. Multiplicity of infection — количество инфекционных доз вируса в расчете на одну клетку.
3. https://www.ncbi.nlm.nih.gov/nuccore/PQ673601
4. ГОСТ 51352–2013. Медицинские изделия для диагностики ин витро. Методы испытаний.
5. https://doi.org/10.30895/2221-996X-2025-632-table-s1
6. https://doi.org/10.30895/2221-996X-2025-632-table-s2
7. https://doi.org/10.30895/2221-996X-2025-632-table-s3
8. https://doi.org/10.30895/2221-996X-2025-632-table-s4
Список литературы
1. Moizéis RN, Fernandes TA, Guedes PM, Pereira HW, Lanza DC, Azevedo JW, et al. Chikungunya fever: A threat to global public health. Pathog Glob Health. 2018;112(4):182–94. https://doi.org/10.1080/20477724.2018.1478777
2. de Souza WM, de Lima ST, Mello LM, Candido DS, Buss L, Whittaker C, et al. Spatiotemporal dynamics and recurrence of chikungunya virus in Brazil: An epidemiological study. Lancet Microbe. 2023;4(5):e319–29. https://doi.org/10.1016/S2666-5247(23)00033-2
3. Andrew A, Navien TN, Yeoh, TS, Citartan M, Mangantig E, Sum MS, Tang TH. Diagnostic accuracy of serological tests for the diagnosis of Chikungunya virus infection: A systematic review and meta-analysis. PLoS Negl Trop Dis. 2022;16(2):e0010152. https://doi.org/10.1371/journal.pntd.0010152
4. Vu DM, Jungkind D, LaBeaud AD. Chikungunya virus. Clin Lab Med. 2017;37(2):371–82. https://doi.org/10.1016/j.cll.2017.01.008
5. Kendall C, Khalid H, Müller M, Banda DH, Kohl A, Merits A, et al. Structural and phenotypic analysis of Chikungunya virus RNA replication elements. Nucleic Acids Res. 2019;47(17):9296–312. https://doi.org/10.1093/nar/gkz640
6. Tsetsarkin KA, Vanlandingham DL, McGee CE, Higgs S. A single mutation in chikungunya virus affects vector specificity and epidemic potential. PLoS Pathog. 2007;3(12):e201. https://doi.org/10.1371/journal.ppat.0030201
7. Tsetsarkin KA, McGee CE, Volk SM, Vanlandingham DL, Weaver SC, Higgs S. Epistatic roles of E2 glycoprotein mutations in adaption of chikungunya virus to Aedes albopictus and Ae. aegypti mosquitoes. PloS One. 2009;4(8):e6835. https://doi.org/10.1371/journal.pone.0006835
8. Deeba F, Haider MS, Ahmed A, Tazeen A, Faizan MI, Salam N, et al. Global transmission and evolutionary dynamics of the Chikungunya virus. Epidemiol Infect. 2020;148:e63. https://doi.org/10.1017/S0950268820000497
9. Montalvo ZFG, Reyes-Sandoval A, Kim YC. Chikungunya virus: Priority pathogen or passing trend? Vaccines. 2023;11(3):568. https://doi.org/10.3390/vaccines11030568
10. Morrison TE. Reemergence of chikungunya virus. J Virol. 2014;88(20):11644–7. https://doi.org/10.1128/jvi.01432-14
11. Ingoba LL, Adedoja A, Peko SM, Vairo F, Haider N, Kock R, Ntoumi F. Diagnosis of Chikungunya virus in febrile patients from a malaria holoendemic area. Int J Infect Dis. 2021;109:247–52. https://doi.org/10.1016/j.ijid.2021.06.043
12. Dayakar S, Goud IK, Pillai H, Remadevi V, Dharmaseelan S, Nair RR, Pillai MR. Molecular diagnosis of Chikungunya virus (CHIKV) and dengue virus (DENV) and its concomitant circulation in South Indian population. Virol Rep. 2015;5:56–62. https://doi.org/10.1016/j.virep.2015.05.001
13. Beltrán-Silva SL, Chacón-Hernández SS, Moreno-Palacios E, Pereyra-Molina JÁ. Clinical and differential diagnosis: Dengue, chikungunya and Zika. Rev Med Hosp Gen (Mex). 2018;81(3):146–53. https://doi.org/10.1016/j.hgmx.2016.09.011
14. Ravindran S, Lahon A. Tropism and immune response of Chikungunya and Zika viruses: An overview. Cytokine. 2023;170:156327. https://doi.org/10.1016/j.cyto.2023.156327
15. Simo FBN, Burt FJ, Makoah NA. Chikungunya virus diagnosis: A review of current antigen detection methods. Trop Med Infect Dis. 2023;8(7):365. https://doi.org/10.3390/tropicalmed8070365
16. Musso D, Gubler DJ. Zika virus: Following the path of Dengue and Chikungunya? Lancet. 2015;386(9990):243–4. https://doi.org/10.1016/S0140-6736(15)61273-9
17. Замарина ТВ, Пименова ЕВ, Храпова НП, Батурин АА. Современное состояние лабораторной диагностики лихорадки чикунгунья (обзор литературы). Клиническая лабораторная диагностика. 2021;66(9):558–64. https://doi.org/10.51620/0869-2084-2021-66-9-558-564
18. Burdino E, Calleri G, Caramello P, Ghisetti V. Unmet needs for a rapid diagnosis of Chikungunya virus infection. Emerg Infect Dis. 2016;22(10):1837–9. https://doi.org/10.3201/eid2210.151784
19. Segato-Vendrameto CZ, Zanluca C, Zucoloto AZ, Zaninelli TH, Bertozzi MM, Saraiva-Santos T, et al. Chikungunya virus and its envelope protein E2 induce hyperalgesia in mice: Inhibition by anti-E2 monoclonal antibodies and by targeting TRPV1. Cells. 2023;12(4):556. https://doi.org/10.3390/cells12040556
20. Powers AM. Vaccine and therapeutic options to control Chikungunya virus. Clin Microbiol Rev. 2018;31(1):e00104–16. https://doi.org/10.1128/cmr.00104-16
21. Subudhi BB, Chattopadhyay S, Mishra P, Kumar A. Current strategies for inhibition of chikungunya infection. Viruses. 2018;10(5):235. https://doi.org/10.3390/v10050235
22. Sofyantoro F, Frediansyah A, Priyono DS, Putri WA, Septriani NI, Wijayanti N, et al. Growth in Chikungunya virus-related research in ASEAN and South Asian countries from 1967 to 2022 following disease emergence: A bibliometric and graphical analysis. Global Health. 2023;19(1):9. https://doi.org/10.1186/s12992-023-00906-z
23. Игнатьев ГМ, Оксанич АС, Казакова ЕВ, Самарцева ТГ, Отрашевская ЕВ, Уйба СВ, Трухин ВП. Изоляция и генетический анализ вируса Чикунгунья из комаров Aedes aegypti и Aedes albopictus, отловленных в Центральной Америке. Журнал микробиологии, эпидемиологии и иммунобиологии. 2023;100(5):310–18. https://doi.org/10.36233/0372-9311-354
24. Mardekian SK, Roberts AL. Diagnostic options and challenges for Dengue and Chikungunya viruses. Biomed Res Int. 2015;2015(1):834371. https://doi.org/10.1155/2015/834371
25. Johnson BW, Russell BJ, Goodman CH. Laboratory diagnosis of Chikungunya virus infections and commercial sources for diagnostic assays. J Infect Dis. 2016;214(suppl_5):S471–4. https://doi.org/10.1093/infdis/jiw274
26. Kumar J, Khan M, Gupta G, Bhoopati M, Lakshmana Rao PV, Parida M. Production, characterization, and application of monoclonal antibodies specific to recombinant (E2) structural protein in antigen-capture ELISA for clinical diagnosis of Chikungunya virus. Viral Immunol. 2012;25(2):153–60. https://doi.org/10.1089/vim.2011.0068
27. Shukla J, Khan M, Tiwari M, Sannarangaiah S, Sharma S, Rao PV, Parida M. Development and evaluation of antigen capture ELISA for early clinical diagnosis of Chikungunya. Diagn Microbiol Infect Dis. 2009;65(2):142–9. https://doi.org/10.1016/j.diagmicrobio.2009.06.017
28. Verma A, Chandele A, Nayak K, Kaja MK, Arulandu A, Lodha R, Ray P. High yield expression and purification of Chikungunya virus E2 recombinant protein and its evaluation for serodiagnosis. J Virol Methods. 2016;235:73–9. https://doi.org/10.1016/j.jviromet.2016.05.003
29. Weber C, Berberich E, von Rhein C, Henß L, Hildt E, Schnierle BS. Identification of functional determinants in the Chikungunya virus E2 protein. PLoS Negl Trop Dis. 2017;11(1):e0005318. https://doi.org/10.1371/journal.pntd.0005318
30. Goh LY, Kam YW, Metz SW, Hobson-Peters J, Prow NA, McCarthy S, et al. A sensitive epitope-blocking ELISA for the detection of Chikungunya virus-specific antibodies in patients. J Virol Methods. 2015;222:55–61. https://doi.org/10.1016/j.jviromet.2015.05.011
31. Guo M, Du S, Lai L, Wu W, Huang X, Li A, et al. Development and evaluation of recombinant E2 protein based IgM capture enzyme-linked immunosorbent assay (ELISA) and double antigen sandwich ELISA for detection of antibodies to Chikungunya virus. PLoS Negl Trop Dis. 2022;16(12):e0010829. https://doi.org/10.1371/journal.pntd.0010829
32. Kim J, Yang J, Kim YB, Lee HJ, Kim S, Poo H. Development of a specific CHIKV-E2 monoclonal antibody for Chikungunya diagnosis. Virol Sin. 2019;34(5):563–71. https://doi.org/10.1007/s12250-019-00135-y
33. Оксанич АС, Самарцева ТГ, Каа КВ, Отрашевская ЕВ, Красько АГ, Лапутина АГ и др. Молекулярно-генетические методы контроля качества инактивированных вакцин на модели вируса Чикунгунья: подлинность штамма и полнота инактивации вируса. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(3):279–93. https://doi.org/10.30895/2221-996X-2024-24-3-279-293
34. Frolov I, Frolova EI. Molecular virology of Chikungunya virus. Curr Top Microbiol Immunol. 2022;435:1–31. https://doi.org/10.1007/82_2018_146
35. Delang L, Li C, Tas A, Quérat G, Albulescu IC, De Burghgraeve T, et al. The viral capping enzyme nsP1: A novel target for the inhibition of Chikungunya virus infection. Sci Rep. 2016;6(1):31819. https://doi.org/10.1038/srep31819
36. Jose J, Snyder JE, Kuhn RJ. A structural and functional perspective of alphavirus replication and assembly. Future Microbiol. 2009;4(7):837–56. https://doi.org/10.2217/fmb.09.59
37. Sharma R, Kesari P, Kumar P, Tomar S. Structure-functioninsights into Chikungunya virus capsid protein: Small molecules targeting capsid hydrophobic pocket. Virology. 2018;515:223–34. https://doi.org/10.1016/j.virol.2017.12.020
38. Strauss JH, Strauss EG. The alphaviruses: Gene expression, replication, and evolution. Microbiol Rev.1994;58(3):491–562. https://doi.org/10.1128/mr.58.3.491-562.1994
39. Wu L, Xu Y, Zhao H, Li Y. RNase T2 in inflammation and cancer: Immunological and biological views. Front Immunol. 2020;11:1554. https://doi.org/10.3389/fimmu.2020.01554
Об авторах
Б. ТаханСирия
Тахан Бана
просп. Вернадского, д. 78, Москва, 119454, Российская Федерация;
г. Алеппо, 12212, Сирийская Арабская Республика
Л. Н. Притворова
Россия
Притворова Людмила Николаевна, канд. мед. наук
Малый Казенный пер., д. 5а, Москва, 105064
Т. Г. Самарцева
Россия
Самарцева Татьяна Геннадьевна
Малый Казенный пер., д. 5а, Москва, 105064
С. А. Кедик
Россия
Кедик Станислав Анатольевич, д-р техн. наук, проф.
просп. Вернадского, д. 78, Москва, 119454
А. С. Оксанич
Россия
Оксанич Алексей Сергеевич, канд. биол. наук
Малый Казенный пер., д. 5а, Москва, 105064
Дополнительные файлы

|
1. Таблица S1. Определение аналитической чувствительности разработанной иммуноферментной тест-системы | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(134KB)
|
Метаданные ▾ | |

|
2. Таблица S2. Результаты теста на «линейность» с использованием различных концентраций E2 белка вируса Чикунгунья | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(86KB)
|
Метаданные ▾ | |

|
3. Таблица S3. Оценка коэффициента вариации результатов определения Е2 белка ВЧИК в иммуноферментном анализе | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(121KB)
|
Метаданные ▾ | |

|
4. Таблица S4. Теоретические и практические значения концентраций Е2 белка ВЧИК в смешанных калибровочных образцах в тесте на «открытие» | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(122KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Тахан Б., Притворова Л.Н., Самарцева Т.Г., Кедик С.А., Оксанич А.С. Разработка количественной иммуноферментной тест-системы для определения концентрации Е2 антигена вируса Чикунгунья и расчета массы цельновирионного антигена в культуральных образцах. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):214-225. https://doi.org/10.30895/2221-996X-2025-632
For citation:
Tahhan B., Pritvorova L.N., Samartseva T.G., Kedik S.A., Oksanich A.S. Development of an enzyme-linked immunosorbent assay test system for quantifying Chikungunya virus E2 protein and calculating the mass of whole-virion antigen in culture fluid samples. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):214-225. (In Russ.) https://doi.org/10.30895/2221-996X-2025-632


































