Перейти к:
Влияние условий хранения цельноклеточной коклюшной вакцины на ее токсичность: исследование на аутбредных мышах
https://doi.org/10.30895/2221-996X-2025-25-1-111-120
Резюме
ВВЕДЕНИЕ. Цельноклеточная коклюшная вакцина (ЦКВ) обладает высокой эффективностью, однако побочное действие (повышение температуры, отечность в месте введения, аллергические реакции, фебрильные судороги) ограничивает ее широкое использование. Актуальными являются исследования, направленные на снижение токсических свойств ЦКВ.
ЦЕЛЬ. Оценка токсических свойств цельноклеточной коклюшной вакцины в экспериментах на мышах при изменении условий в процессе хранения вакцины.
МАТЕРИАЛЫ И МЕТОДЫ. Использовали штаммы Bordetella pertussis — производственные штаммы, а также циркулирующие штаммы, выделенные от больных коклюшем детей. Десять образцов ЦКВ готовили путем проведения смыва выращенной бактериальной культуры и внесения в суспензию формальдегида (инактивирующий агент) и тиомерсала (консервант). Использовали аутбредных мышей, которых распределяли в 10 опытных групп и 1 контрольную, содержащих по 10 животных каждая. Мышам опытных групп внутрибрюшинно вводили образцы ЦКВ, мышам контрольной группы — 0,9% раствор натрия хлорида с тиомерсалом. Проводили взвешивание мышей до введения препарата, а также на 1 и 7 сут после введения. Сроки взвешивания животных обусловлены сроками максимального проявления действия основных токсинов B. pertussis — липоолигосахарида (на 1 сут) и коклюшного токсина (на 7 сут). Определяли значения показателя специфической безопасности образцов ЦКВ на протяжении срока хранения вакцины (12 мес.) как отношение прироста массы тела мышей группы опытных животных к приросту массы тела контрольных животных, выраженное в процентах.
РЕЗУЛЬТАТЫ. Введение животным коклюшной суспензии после ее выдерживания с инактивирующим агентом в условиях хранения в течение 1–3 мес. приводило к снижению массы тела мышей на (-2,84%) относительно исходного веса на 1 сут после введения вакцины, а в случае коклюшной суспензии, инактивированной в течение 10–12 мес., снижение массы тела составило (-1,62%). Установлено, что при введении коклюшной суспензии, выдержанной с инактивирующим агентом в течение 1–3 мес., прирост массы тела мышей через 7 сут после введения вакцины составил 31,0% по отношению к исходному весу, а показатель специфической безопасности — 69,38%. В случае коклюшной суспензии, инактивированной в течение 10–12 мес., прирост массы тела составлял 43,22%, а показатель специфической безопасности — 84,31%. Это указывает на снижение остаточной токсичности вакцины через 12 мес., а также на то, что процесс обезвреживания коклюшного токсина носит пролонгированный характер и продолжается на протяжении всего срока хранения вакцины. Величина коэффициента корреляции Спирмена, характеризующая силу связи между значениями специфической безопасности и приростом массы тела мышей, составила: на 7 сут — 0,55 (р<0,01), что указывает на заметную силу связи между изучаемыми показателями; на 1 сут — 0,349 (р<0,01), что свидетельствует об умеренной силе связи.
ВЫВОДЫ. Полученные результаты продемонстрировали более полную детоксикацию коклюшного токсина в образцах вакцин, выдержанных с инактивирующим агентом не менее 10–12 мес. в условиях хранения. Для повышения безопасности АКДС-вакцины целесообразно использовать серии ЦКВ после 10–12 мес. хранения в регламентированных условиях.
Ключевые слова
Для цитирования:
Алексеева И.А., Лепихова Д.Н., Борисова О.Ю., Пименова А.С., Андриевская И.Ю., Ибрагимхалилова И.В. Влияние условий хранения цельноклеточной коклюшной вакцины на ее токсичность: исследование на аутбредных мышах. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(1):111-120. https://doi.org/10.30895/2221-996X-2025-25-1-111-120
For citation:
Alekseeva I.A., Lepikhova D.N., Borisova O.Yu., Pimenova A.S., Andrievskaya I.Yu., Ibragimkhalilova I.V. Influence of storage conditions on the toxicity of whole-cell pertussis vaccine in outbred mice. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(1):111-120. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-1-111-120
ВВЕДЕНИЕ
Включение цельноклеточной коклюшной вакцины (ЦКВ) в календарь профилактических прививок значительно снизило заболеваемость коклюшем1 [1], хотя не устранило эпидемические вспышки, происходящие по всему миру каждые 3–5 лет. Данные по динамике заболеваемости коклюшем подтверждают высокую эффективность ЦКВ. Например, в Англии с середины 1940-х гг., когда началась вакцинация, до середины 1970-х гг. заболеваемость коклюшем неуклонно снижалась [2]. Однако в результате антипрививочной кампании охват населения вакцинацией сократился, что привело к резкому росту заболеваемости. В Англии 1970-е гг. на фоне роста числа отказов от вакцинации было зарегистрировано более 100 летальных исходов [3]. Эти данные свидетельствуют о том, что польза вакцинации значительно превышает риск возможных побочных эффектов [2].
Проблема возможных побочных реакций ЦКВ вызвала широкую обеспокоенность. В некоторых странах, включая Японию, проведение профилактических прививок было приостановлено [4]. Помимо риска поствакцинальных реакций была обозначена проблема непродолжительного поствакцинального иммунитета. Решение этой проблемы видели в проведении ревакцинаций среди детей старшего возраста. Однако из-за реактогенности ЦКВ это невозможно было реализовать [3].
Были предприняты попытки по разработке менее реактогенных и более стандартизованных бесклеточных коклюшных вакцин (БКВ) [3]. БКВ включают в состав от одного до пяти очищенных антигенов: коклюшный анатоксин, филаментозный гемагглютинин, пертактин, агглютиногены (фимбрии) типов 2 и 3. В клинических исследованиях продемонстрирована безопасность и иммуногенная активность БКВ [5]. Тем не менее многолетнее (более 20 лет) применение БКВ не оправдало всех ожиданий. В странах, где используется исключительно БКВ, несмотря на высокий уровень охвата населения вакцинацией, отмечался рост заболеваемости и зарегистрированы эпидемии, что свидетельствовало о кратковременности адаптивного иммунитета, индуцированного БКВ [6–8]. Предложено несколько основных причин данного явления: неоптимальный баланс клеточно-опосредованных иммунных реакций (Th1, Th2, Th17) [9]; отсутствие ключевых защитных антигенов в составе вакцины; несбалансированное содержание антигенов в составе вакцины или их недостаточное количество; различия между защитными антигенами в вакцине и аналогичными антигенами современных циркулирующих штаммов [10–13].
Таким образом, в настоящее время сложилась непростая ситуация в области вакцинопрофилактики коклюша: существует ЦКВ, доказавшая свою эффективность, но обладающая реактогенностью, и менее эффективная, но малореактогенная БКВ. Очевидно, что необходимы усилия для совершенствования существующих вакцин. Требуется снизить реактогенность ЦКВ при сохранении ее защитной активности и повысить эффективность БКВ. Защитную активность БКВ можно увеличить путем изменения соотношения антигенов в составе вакцины, добавления новых антигенов [14][15], использования новых адъювантов, способных изменить характер иммунного ответа (баланс Th1, Th2, Th17) [16], оптимизации путей доставки антигенов [14]. Реализация этих шагов потребует проведения доклинических и клинических исследований, дополнительного финансирования, значительных временных затрат.
Снижение специфической токсичности ЦКВ возможно осуществить, вероятно, менее затратными способами. К ним относятся уменьшение количества убитых бактериальных клеток в дозе вакцины [17], генетическая модификация токсинов B. pertussis [18], а также изменения в технологическом процессе производства ЦКВ.
В рамках данной работы рассматривалась возможность снижения токсических свойств ЦКВ путем воздействия на технологический процесс изготовления коклюшной вакцины.
Цель работы — оценка токсических свойств ЦКВ в экспериментах на мышах при изменении условий в процессе хранения вакцины.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Штаммы. В работе использовали производственные штаммы B. рertussis 38, 305, 312, 475, 703, хранящиеся в Государственной коллекции патогенных микроорганизмов ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России (ФГБУ «НЦЭСМП» Минздрава России) и применяемые для изготовления ЦКВ как компонента АКДС-вакцины, а также циркулирующие штаммы, выделенные от больных коклюшем детей: 16-16, 28(1)-18, 30-18, 31(2)-17, 33-18.
Экспериментальные животные. Исследования проводили на аутбредных мышах обоего пола массой тела 15±1 г, полученных из питомника филиала «Андреевка» ФГБУН «Научный центр биомедицинских технологий» ФМБА России. Животных рандомизировали с формированием десяти опытных групп и одной контрольной, каждая из которых включала по 10 особей (равномерное распределение с учетом разницы в массе тела). Мышам опытных групп внутрибрюшинно (в/б) вводили образцы вакцины (10 образцов, указанных в разделе «Штаммы»), мышам контрольной группы — в/б 0,9% раствор натрия хлорида с тиомерсалом (консервант). Период наблюдения за характеристиками ЦКВ был разделен на 4 интервала: 1–3 мес., 4–6 мес., 7–9 мес. и 10–12 мес. Для 10 образцов вакцины в каждом временном интервале оценивали специфическую безопасность. В течение периода исследования животные содержались в стандартных условиях вивария со свободным доступом к пище и воде.
Протокол исследования с использованием экспериментальных животных был одобрен локальным этическим комитетом ФГБУ «НЦЭСМП» Минздрава России (№ 8 от 03.12.2024). Все исследования проводились в соответствии с рекомендациями Директивы 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях2, принципами Международного совета медицинских научных обществ (CIOMS)3, Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях4, ГОСТ 33216-20145.
Методы
Подготовка образцов вакцины. Из штаммов B. pertussis в соответствии с МУК 4.2.2317-08 «Отбор, проверка и хранение производственных штаммов коклюшных, паракоклюшных и бронхисептикозных бактерий» были изготовлены 10 образцов ЦКВ. Их готовили на основе суспензии из агаровой бактериальной культуры возбудителя, в которую были внесены инактивирующий агент (формальдегид) и тиомерсал в требуемых концентрациях. С этой целью культуру B. pertussis выращивали на среде КУА (АО «НПО «Микроген», филиал «НПО «Питательные среды», Россия). В среду добавляли кровь барана дефибринированную (АО «ЭКОлаб», Россия) до концентрации 10%. Далее с 3 или 4 пассажа проводили смыв бактериальной культуры 0,9% раствором натрия хлорида, содержащим формальдегид (PanReac AppliChem). Концентрацию бактериальных клеток в суспензии определяли с помощью фармакопейного стандартного образца мутности бактериальных взвесей 10 МЕ (ФСО 3.1.00085, ФГБУ «НЦЭСМП» Минздрава России). В качестве консерванта в смытую коклюшную суспензию (КС) вносили тиомерсал (Sigma-Aldrich). Изготовленные образцы вакцины хранили при 5±3 °С на протяжении 12 мес. (срок хранения ЦКВ).
Оценка токсического действия вакцины. Из емкости, в которой хранили изготовленную ЦКВ, в указанные выше интервалы времени отбирали пробы вакцины для оценки токсического действия. С этой целью определяли значения показателя «Специфическая безопасность» образцов вакцин на протяжении 12 мес. (срок наблюдения) в экспериментах на мышах в соответствии с требованиями Государственной фармакопеи Российской Федерации (ГФ РФ) ФС.3.3.1.0010.156. Этот показатель рекомендован Всемирной организацией здравоохранения (ВОЗ) и используется на производстве при оценке остаточной токсичности ЦКВ7. Мышам опытных групп вводили в/б дозу вакцины с концентрацией убитых клеток, эквивалентной таковой в коммерческих вакцинах (10⁹ клеток/0,5 мл). Контрольным животным вводили 0,5 мл 0,9% раствора натрия хлорида с концентрацией тиомерсала, соответствующей его содержанию в изготовленных вакцинах. Взвешивание мышей проводили до введения препарата, а также на 1 сут, через 72 ч и на 7 сут после введения. Выбор сроков взвешивания животных обусловлен временем максимального проявления действия основных токсинов B. pertussis — липоолигосахарида (ЛОС) и коклюшного токсина (КТ): ЛОС оказывает свое действие через 1 сут после введения препарата, КТ — на 7 сут8. Восстановление массы тела мышей до исходных значений через 72 ч после введения вакцины служит одним из критериев в рамках данного подхода. Все исследованные образцы ЦКВ соответствовали этому требованию.
Показатель «Специфическая безопасность» для образцов вакцин рассчитывали как отношение изменения массы тела опытных животных (после введения вакцины) к изменению массы тела контрольных животных на 7 сут, выраженное в процентах. Согласно требованиям ГФ РФ ФС.3.3.1.0010.159, значение этого показателя через 7 сут после введения препарата должно составлять не менее 60%. Меньшее значение показателя указывает на высокую остаточную токсичность вакцины, обусловленную содержанием необезвреженного КТ. Токсическое действие ЛОС оценивали по изменению массы тела мышей на 1 сут (%) после введения препарата. Требования к величине показателя, отражающего токсическое действие препарата на 1 сут после введения вакцины, в документах ВОЗ и ГФ РФ отсутствуют.
Для определения изменения показателя массы тела мышей вычисляли разницу между показателем массы, зафиксированной через 1 или 7 сут, и массы тела, определенную до введения препарата (исходная масса). Значения изменения массы тела мышей выражали в процентах относительно исходного веса.
Статистическая обработка данных. За период наблюдения проведено более 100 измерений значений показателей, отражающих остаточную токсичность препарата. Полученные данные по изменению массы тела мышей в опытных группах и значения показателя специфической безопасности группировали (с учетом четырех интервалов срока хранения вакцины: 1–3 мес., 4–6 мес., 7–9 мес. и 10–12 мес.) и рассчитывали среднее арифметическое значение и стандартное отклонение. Взаимосвязь между показателями специфической безопасности вакцины и изменением массы тела мышей на 1 и 7 сут устанавливали с помощью коэффициента ранговой корреляции Спирмена10 [19].
РЕЗУЛЬТАТЫ
Динамика изменения массы тела мышей на 1 и 7 сут после введения им исследуемых образцов ЦКВ, выдержанных с инактивирующим агентом в условиях хранения в зависимости от его срока, представлена на рисунке 1.
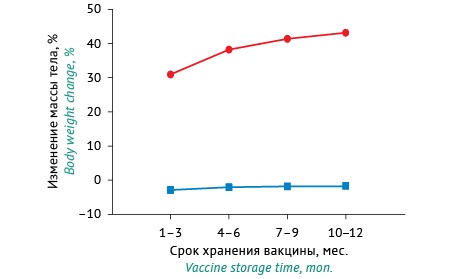
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Изменение массы тела мышей после введения цельноклеточной коклюшной вакцины, выдержанной с инактивирующим агентом в условиях хранения на разных сроках. Красным цветом изображена кривая, отражающая изменение массы тела, определенное на 7 сут после введения вакцины; синим цветом — кривая, отражающая изменение массы тела на 1 сут после введения вакцины. Данные представлены в виде средних арифметических значений.
Fig. 1. Time course of changes in the body weight of mice after administration of whole-cell pertussis vaccines that contained the inactivating agent and were stored under recommended conditions. The red line shows the body weight changes on Day 7 after vaccine administration, and the blue line reflects the body weight changes on Day 1 after vaccine administration. The data are presented as arithmetic means.
Расчетные значения изменения массы тела мышей представлены в таблице 1. Установлено, что при введении животным КС, выдержанной с инактивирующим агентом в течение 1–3 мес., средний прирост массы тела мышей через 7 сут после введения вакцины составил 31,0% по отношению к исходному весу, а в случае введения КС, инактивированной на протяжении других сроков хранения, прирост массы тела составил: 4–6 мес. — 38,28%, 7–9 мес. — 41,47%, 10–12 мес. — 43,22%.
Таблица 1. Изменения массы тела мышей на 1 и 7 сутки после введения цельноклеточной коклюшной вакцины (ЦКВ) и значения показателя специфической безопасности вакцины
Table 1. Changes in the body weight of mice on Days 1 and 7 after administration of whole-cell pertussis vaccines (WCPVs) and the specific toxicity index values
Срок инактивации ЦКВ WCPV inactivation time | Изменение массы тела мышей, % Changes in the body weight of mice, % | Показатель специфической безопасности, % Specific toxicity index, % | |
на 1 сут on Day 1 | на 7 сут on Day 7 | ||
1–3 мес. 1–3 months | -2,84 (-4,19–(-1,50)) | 31,00 (28,46–33,52) | 69,4 (59,57–79,20) |
4–6 мес. 4–6 months | -1,99 (-2,64–(-1,35)) | 38,28 (33,50–43,06) | 76,3 (63,18–89,37) |
7–9 мес. 7–9 months | -1,79 (-2,48–(-0,09) | 41,47 (40,12–42,82) | 81,7 (66,32–96,99) |
10–12 мес. 10–12 months | -1,62 (-3,14–(-0,09)) | 43,22 (38,36–46,08) | 84,3 (77,78–90,85) |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Так как действие остаточного количества необезвреженного КТ, присутствующего в вакцине, максимально проявляется на 7 сут11, то по динамике значений изменения массы тела можно сделать вывод о степени эффективности процесса обезвреживания КТ в КС. Так, если прирост массы тела мышей через 1–3 мес. составил 31,0%, а в конце срока хранения (10–12 мес.) — 43,22%, то общий прирост массы тела составил 12,22%. Следовательно, в ЦКВ, инактивированной на протяжении 10–12 мес. в условиях хранения, содержится меньшее количество активного КТ по сравнению с вакциной на начальном этапе хранения, что проявляется в более выраженном приросте массы тела животных. Можно заключить, что обезвреживание КТ происходит на протяжении всего срока хранения вакцины (12 мес.).
Поскольку, предположительно, на 1 сут после введения вакцины проявляется действие содержащегося в препарате ЛОС12, то определение значений изменения массы тела мышей на 1 сут позволяет оценить токсическое действие ЛОС. Показатели прироста массы тела мышей на 1 сут после введения КС имели отрицательные значения, что свидетельствует о значительном токсическом действии ЛОС. Следует отметить, что значения прироста массы тела с течением времени достоверно не изменялись.
При введении животным КС, выдержанной с инактивирующим агентом в течение 1–3 мес., среднее значение изменения массы тела мышей на 1 сут после введения вакцины составило (-2,84%) относительно исходного веса (табл. 1). В случае введения КС, инактивированной на протяжении других сроков хранения (4–6, 7–9 и 10–12 мес.), этот показатель составил (-1,99%), (-1,79%), (-1,62%) соответственно. Различия между значениями на начальном и конечном этапах хранения КС оказались статистически незначимы и составили 1,22%. Эти результаты свидетельствуют о том, что формальдегид, содержащийся в ЦКВ, практически не оказывает детоксицирующего эффекта на ЛОС и его токсическое действие при хранении вакцины изменяется крайне незначительно.
Величина показателя специфической безопасности ЦКВ в зависимости от срока выдерживания с инактивирующим агентом в условиях хранения (рис. 2) увеличивается в интервале наблюдения. Следовательно, процесс обезвреживания КТ после добавления в КС формальдегида продолжается в течение всего срока хранения вакцины. Так, через 1–3 мес. выдерживания КС с инактивирующим агентом показатель специфической безопасности составлял 69,4%, через 4–6 мес. — 76,3%, через 7–9 мес. — 81,7%, через 10–12 мес. — 84,3%. Таким образом, остаточная токсичность, определяемая косвенно через показатель специфической безопасности, снизилась на 14,9%.
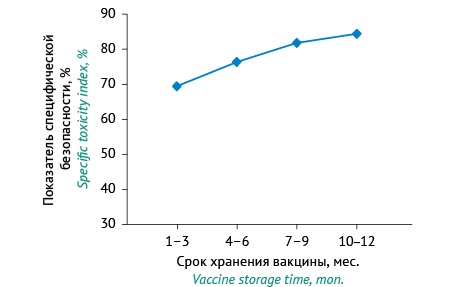
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Изменение показателя специфической безопасности цельноклеточной коклюшной вакцины, выдержанной с инактивирующим агентом в условиях хранения на разных сроках. Данные представлены в виде средних арифметических значений.
Fig. 2. Time course of changes in the specific toxicity index of whole-cell pertussis vaccines that contained the inactivating agent and were stored under recommended conditions. The data are presented as arithmetic means.
Следует отметить, что представленные результаты получены на образцах ЦКВ, изготовленных с использованием твердой питательной среды КУА. Поэтому сделанные выводы применимы исключительно к процессу производства, в котором культивирование бактериальной массы осуществляется на твердой среде КУА.
Срок хранения цельноклеточного коклюшного компонента на предприятии до сведения (объединения) его с дифтерийным и столбнячным анатоксинами в АКДС-вакцину составляет 1 год. В течение этого срока, начиная с 3 мес. хранения, ЦКВ может использоваться для сведения с компонентами АКДС-вакцины. Согласно представленным результатам процесс обезвреживания КТ носит пролонгированный характер и продолжается как в течение 1 года хранения, так и после его истечения (неопубликованные данные). Следовательно, целесообразно использовать ЦКВ для сведения ее с другими компонентами АКДС-вакцины ближе к концу срока хранения, когда остаточное количество КТ в вакцине максимально обезврежено. Это позволит минимизировать содержание необезвреженного КТ в дозе вакцины, предназначенной для введения ребенку. Исходя из этого производителям АКДС-вакцин рекомендуется для сведения с дифтерийным и столбнячным анатоксинами использовать ЦКВ, находящуюся на хранении не менее 10–12 мес., то есть в конце допустимого срока хранения.
Для оценки взаимосвязи между изучаемыми показателями был проведен корреляционный анализ с использованием коэффициента корреляции Спирмена. Величина коэффициента Спирмена, характеризующая силу связи между значениями специфической безопасности и приростом массы тела мышей, составила: на 7 сут — 0,55 (р<0,01), что указывает на заметную силу связи; на 1 сут — 0,349 (р<0,01), что свидетельствует об умеренной силе связи. Таким образом, показатель качества вакцины «Специфическая безопасность» отражает наличие как активного КТ, так и ЛОС в ЦКВ.
ОБСУЖДЕНИЕ
Длительное наблюдение за эффективностью БКВ позволило сделать заключение, что эти вакцины и применяемые программы вакцинации не обеспечивают полного контроля над заболеваемостью коклюшем [20][21]. Более того, высказано предположение о наличии связи между использованием БКВ и ростом заболеваемости коклюшем в странах Европы, США, Японии [10][22–24]. В настоящее время в Российской Федерации также наблюдается рост заболеваемости коклюшем. Так, показатель заболеваемости коклюшем в 2023 г. составил 36,2 случая на 100 тыс. населения, что превышает уровень заболеваемости 2022 г. в 16,4 раза [25][26]. Учитывая тот факт, что в России практически отказались от использования отечественной ЦКВ и широко используют зарубежные БКВ (например, Пентаксим, Адасель), можно предположить, что одной из причин роста заболеваемости коклюшем является масштабное использование для вакцинации детского населения зарубежных бесклеточных вакцин. Для проверки данного предположения необходимо провести анализ корреляционной взаимосвязи между количеством использованных в Российской Федерации доз ЦКВ и БКВ и уровнем заболеваемости коклюшем.
Возрождение коклюша поднимает перед обществом проблему профилактики заболевания среди населения, особенно среди младенцев и детей младшего возраста, наиболее подверженных инфекции.
Альтернативой БКВ является ЦКВ, которая доказала свою эффективность в течение многолетнего периода использования [1]. ВОЗ высказано мнение о том, что опасения по поводу реактогенности ЦКВ необоснованно преувеличены, и рекомендовано продолжить использование этих вакцин в соответствии с утвержденными национальными календарями профилактических прививок13. Несмотря на это существующая настороженность в обществе к ЦКВ, хотя она в определенной мере оправданна, ограничивает широкое применение АКДС-вакцины [27].
В настоящее время предпринимаются попытки снизить остаточную токсичность ЦКВ, обусловленную ЛОС, посредством его экстракции из коклюшной бактериальной культуры [28] и других методов [29]. Было установлено, что ЛОС, помимо токсического эффекта, обладает выраженной защитной активностью14 и рассматривается как потенциальный кандидат для включения в состав БКВ.
Разрабатываются генно-инженерные подходы к конструированию новых вакцин. Предполагается, что вакцины, содержащие генетически инактивированные коклюшные токсины, смогут вызывать длительный иммунный ответ, аналогичный реакции организма при естественной инфекции. В Российской Федерации и Франции ведутся разработки живых аттенуированных вакцин для интраназального применения, которые находятся на стадии клинических исследований [30–33]. От разработчиков этих вакцин требуются доказательства генетической стабильности препаратов, их безопасности и исключения возможности передачи штамма контактным лицам [34]. Новые вакцины должны соответствовать ряду требований: обеспечение безопасности, индуцирование длительного эффективного иммунитета, минимизация влияния антигенного дрейфа, индуцирование образования бактерицидных антител, исключение передачи бактерий B. рertussis.
Таким образом, в настоящее время исследования идут в разных направлениях: создание новых вакцин и совершенствование имеющихся.
В ходе данного исследования авторами продемонстрирована возможность снижения остаточной токсичности ЦКВ. Был установлен факт длительного обезвреживающего действия формальдегида на КТ убитых бактерий B. pertussis. В дальнейшем авторами планируется представить рекомендации производителям по использованию ЦКВ для сведения с дифтерийным и столбнячным анатоксинами в АКДС-вакцину в конце допустимого срока ее хранения, когда КТ в значительной степени обезврежен. Это позволит повысить безопасность ЦКВ и в определенной степени снизить реактогенность. Повышение качества АКДС-вакцины обеспечит более широкое ее применение в профилактических программах, способствуя успешному контролю над коклюшной инфекцией.
Проблема снижения токсических свойств ЛОС в ЦКВ остается актуальной. Эндотоксичность ЛОС обусловлена входящими в его структуру липидами A и X. Разрушение бактериальных клеток B. pertussis приводит к высвобождению липидов в кровь, что может вызывать серьезные токсические реакции [35]. Из-за влияния на остаточную токсичность ЦКВ в настоящее время ЛОС не используется в качестве защитного антигена в БКВ.
Важно отметить, что приготовление образцов ЦКВ в рамках данной работы проводилось в соответствии с технологическим процессом, применяемым на производстве при изготовлении коклюшной вакцины. Соблюдение всех требований процесса обеспечивает сохранение биологических свойств производственных штаммов, включая важный показатель качества вакцины — защитную активность. Более подробное изучение этого аспекта требует дополнительных исследований.
ВЫВОДЫ
- При введении мышам коклюшной суспензии, выдержанной с инактивирующим агентом (формальдегид) в течение 1–3 мес. в условиях хранения, средний прирост массы тела мышей через 7 сут после введения вакцины составил 31,0% по отношению к исходному весу, а в случае инактивации в течение 10–12 мес. — 43,22% (общий прирост — 12,22%). Это указывает на меньшее количество активного коклюшного токсина в ЦКВ через 12 мес. Следовательно, процесс обезвреживания коклюшного токсина носит пролонгированный характер и продолжается на протяжении всего срока хранения вакцины (12 мес.).
- Повышение значений показателя «Специфическая безопасность» ЦКВ в процессе ее хранения с 69,4% (через 1–3 мес.) до 84,3% (через 10–12 мес.) подтверждает снижение остаточной токсичности вакцины после 10–12 мес. хранения. Для повышения безопасности АКДС-вакцины целесообразно использовать ЦКВ для сведения с другими компонентами АКДС-вакцины после 10–12 мес. ее хранения в регламентированных условиях, когда остаточное содержание коклюшного токсина в вакцине максимально обезврежено.
- Введение мышам коклюшной суспензии после ее выдерживания с инактивирующим агентом приводило к снижению массы тела мышей на 1 сут после введения вакцины. Этот эффект регистрировался как на начальном, так и конечном этапах хранения вакцины, что указывает на сохранение токсического воздействия, связанного с наличием ЛОС в ЦКВ даже спустя 10–12 мес. и недостаточном детоксицирующем действии формальдегида на ЛОС B. pertussis. Установление возможных путей для снижения токсических свойств ЛОС в вакцине требует дальнейших исследований.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: И.А. Алексеева — формирование цели и задач исследования; анализ и систематизация данных научной литературы, анализ и интерпретация результатов исследования, написание и редактирование текста рукописи; Д.Н. Лепихова — проведение экспериментальных исследований, сбор и анализ данных научной литературы, редактирование текста рукописи; О.Ю. Борисова — планирование исследования, обобщение экспериментальных данных, анализ и интерпретация результатов, анализ и обобщение данных научной литературы, редактирование текста рукописи; А.С. Пименова — проведение экспериментальных исследований, анализ и интерпретация результатов исследования; редактирование текста рукописи; И.Ю. Андриевская, И.В. Ибрагимхаллова — проведение экспериментальных исследований, сбор и анализ данных научной литературы, работа с графическим материалом.
Соответствие принципам этики. Протокол исследования с использованием экспериментальных животных был одобрен локальным этическим комитетом ФГБУ «НЦЭСМП» Минздрава России (протокол № 8 от 03.12.2024).
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. I.A. Alekseeva formulated the study aim and objectives, analysed and systematised literature data, analysed and interpreted the study results, and drafted and edited the manuscript. D.N. Lepikhova conducted experiments, collected and analysed literature data, and edited the manuscript. O.Yu. Borisova designed the study, analysed and interpreted literature data, summarised the experimental data obtained, analysed and interpreted the study results, and edited the manuscript. A.S. Pimenova conducted experiments, analysed and interpreted the study results, and edited the manuscript. I.Yu. Andrievskaya, I.V. Ibragimkhalilova conducted experiments, collected and analysed literature data, and worked with the graphical material.
Ethics approval. The protocol of the animal study was approved by the Local Ethics Committee at the Scientific Centre for Expert Evaluation of Medicinal Products of the Ministry of Health of the Russian Federation (Protocol No. 8 of 3 December 2024).
1. https://www.cdc.gov/pertussis/vaccines/index.html
2. https://ruslasa.ru/wp-content/uploads/2017/06/Directive_201063_rus.pdf
3. https://cioms.ch/
4. European Convention for the protection of vertebrate animals used for experimental and other scientific purposes. Strasbourg; 1986. https://norecopa.no/media/2iydns5h/ets-123-original.pdf
5. ГОСТ 33216-2014. Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами.
6. ФС.3.3.1.0010.15 Вакцина коклюшно-дифтерийно-столбнячная адсорбированная (АКДС-вакцина). Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
7. Recommendations for whole-cell pertussis vaccine, Annex 6, Technical report series No. 941. WHO; 2007.
8. Там же.
9. ФС.3.3.1.0010.15 Вакцина коклюшно-дифтерийно-столбнячная адсорбированная (АКДС-вакцина). Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
10. https://infamed.com/stat/
11. Recommendations for whole-cell pertussis vaccine, Annex 6, Technical report series No. 941. WHO; 2007.
12. Там же.
13. Revised guidance on the choice of pertussis vaccines. Wkly Epidemiol Rec. 2014;89(30):337–44.
Pertussis Vaccines: WHO position paper — August 2015. Wkly Epidemiol Rec. 2015;90(35):433–60.
14. Селезнева ТС. Научно-эпидемиологическое обоснование снижения антигенной нагрузки АКДС-вакцины в условиях нового календаря прививок: дис. … канд. мед. наук. М.; 1986.
Список литературы
1. Klein NP. Licensed pertussis vaccines in the United States. Hum Vaccin Immunother. 2014;10(9):2684–90. https://doi.org/10.4161/hv.29576
2. Amirthalingam G, Gupta S, Campbell H. Pertussis immunization and control in England and Wales, 1957 to 2012: A historical review. Euro Surveill. 2013;18(38):20587. https://doi.org/10.2807/1560-7917.es2013.18.38.20587
3. Guiso N, Meade BD, Wirsing von König CH. Pertussis vaccines: The first hundred years. Vaccine. 2020;38(5):1271–6. https://doi.org/10.1016/j.vaccine.2019.11.022
4. Sato Y, Kimura M, Fukumi H. Development of a pertussis component vaccine in Japan. Lancet. 1984;1(8369):122–6. https://doi.org/10.1016/s0140-6736(84)90061-8
5. Edwards KM, Meade BD, Decker MD, Reed GF, Rennels MB, Steinhoff MC, et al. Comparison of 13 acellular pertussis vaccines: Overview and serologic response. Pediatrics. 1995;96(3 Pt 2):548–57. PMID: 7659475
6. Sheridian SL, Ware RS, Grimwood K, Lambert SB. Number and order of whole cell pertussis vaccines in infant and disease protection. JAMA. 2012;308(5):454–6. https://doi.org/10.1001/jama.2012.6364
7. Klein NP, Bartiett J, Rowhani-Rahbar A, Fireman B, Baxter R. Waning protection after fifth dose of acellular pertussis vaccine in children. N Engl J Med. 2012;367(11):1012–9. https://doi.org/10.1056/nejmoa1200850
8. MisegadesLK, WinterK, HarrimanK, TalaricoJ, MessonnierNE, Clark TA, et al. Association of childhood pertussis with receipt of 5 doses of pertussis vaccine by time since last vaccine dose, California, 2010. JAMA. 2012;308(20):2126–32. https://doi.org/10.1001/jama.2012.14939
9. Ross PJ, Sutton CE, Higgins S, Allen AC, Walsh K, Misiak A, et al. Relative contribution of Th1 and Th17 cells in adaptive immunity to Bordetella pertussis: Towards the rational design of an improved acellular pertussis vaccine. PLoS Pathog. 2013;9(4):e1003264. https://doi.org/10.1371/journal.ppat.1003264
10. Mooi FR, NA VDM, De Melker HE. Pertussis resurgence: Waning immunity and pathogen adaptation — two sides of the same coin. Epidemiol Infect. 2014;142(4):685–94. https://doi.org/10.1017/s0950268813000071
11. Koide K, Yao S, Chiang CS, Thuy PTB, Nga DTT, Huong DT, et al. Genotyping and macrolide-resistant mutation of Bordetella pertussis in East and South-East Asia. J Glob Antimicrob Resist. 2022;31:263–9. https://doi.org/10.1016/j.jgar.2022.10.007
12. Ma L, Caulfield A, Dewan KK, Harvill ET. Pertactin-deficient Bordetella pertussis, vaccine-driven evolution, and reemergence of pertussis. Emerg Infect Dis. 2021;27(6):1561–6. https://doi.org/10.3201/eid2706.203850
13. Ring N, Davies H, Morgan J, Sundaresan M, Tiong A, Preston A, et al. Comparative genomics of Bordetella pertussis isolates from New Zealand, a country with an uncommonly high incidence of whooping cough. Microb Genom. 2022;8(1):000756. https://doi.org/10.1099/mgen.0.000756
14. Locht C, Mielcarek N. New pertussis vaccination approaches: En route to protect newborns? FEMS Immunol Med Microbiol. 2012;66(2):121–33. https://doi.org/10.1111/j.1574-695x.2012.00988.x
15. Gao J, Huang L, Luo S, Qiao R, Liu F, Li X. A novel vaccine formulation candidate based on lipooligosaccharides and pertussis toxin against Bordetella pertussis. Front Immunol. 2023; 14:1124695. https://doi.org/10.3389/fimmu.2023.1124695
16. Polewicz M, Gracia A, Garlapati S, van Kessel J, Strom S, Halperin SA, et al. Novel vaccine formulations against pertussis offer earlier onset of immunity and provide protection in the presence of maternal antibodies. Vaccine. 2013;31(31): 3148–55. https://doi.org/10.1016/j.vaccine.2013.05.008
17. Чупринина РП, Алексеева ИА. Возможность повышения иммуногенной активности и стабильности цельноклеточного коклюшного компонента комбинированных вакцин. Эпидемиология и вакцинопрофилактика. 2014;(2):89–95. EDN: SBEUOR
18. Джидарян АА, Матуа АЗ, Медкова АЮ, Семин ЕГ, Синяшина ЛН, Дьяков ИН и др. Безопасность и иммуногенность препарата живой коклюшной вакцины ГамЖВК интраназального применения на экспериментальной модели детенышей обезьян вида павиан гамадрил. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(2):203–14. https://doi.org/10.36233/0372-9311-190
19. Glantz SA, ed. Primer of biostatistics. New York: McGraw-Hill; 1992.
20. Chiappini E, Stival A, Galli L, de Martino M. Pertussis re-emergence in the post-vaccination era. BMC Infect Dis. 2013;13:151. https://doi.org/10.1186/1471-2334-13-151
21. Clark TA, Messionier NE, Hadler SC. Pertussis control: Time for something new? Trends Microbiol. 2012;20(5):211–3. https://doi.org/10.1016/j.tim.2012.03.003
22. Esposito S, Stefanelli P, Fry NK, Fedele G, He Q, Paterson P, et al. Pertussis prevention: Reasons for resurgence, and differences in the current acellular pertussis vaccines. Front Immunol. 2019;10:1344. https://doi.org/10.3389/fimmu.2019.01344
23. Zomer A, Otsuka N, Hiramatsu Y, Kamachi K, Nishimura N, Ozaki T, et al. Bordetella pertussis population dynamics and phylogeny in Japan after adoption of acellular pertussis vaccines. Microb Genom. 2018;4(5):e000180. https://doi.org/10.1099/mgen.0.000180
24. Mir-Cros A, Moreno-Mingorance A, Martín-Gómez MT, Codina G, Cornejo-Sánchez T, Rajadell M, et al. Population dynamics and antigenic drift of Bordetella pertussis following whole cell vaccine replacement, Barcelona, Spain, 1986–2015. Emerg Microbes Infect. 2019;8(1):1711–20. https://doi.org/10.1080/22221751.2019.1694395
25. Басов АА, Высочанская СО, Цвиркун ОВ, Белова ТР, Адугюзелов СЭ, Жернов ЮВ и др. Критерии оценки эпидемиологической ситуации коклюша в Российской Федерации. Эпидемиология и вакцинопрофилактика. 2024;23(1):4–13. https://doi.org/10.31631/2073-3046-2024-23-1-4-13
26. Борисова ОЮ, Андриевская ИЮ, Пименова АС, Гадуа НТ, Чагина ИА, Борисова АБ и др. Генотипическая характеристика штаммов Bordetella pertussis — кандидатов для получения коклюшного компонента вакцинных препаратов (сообщение I). Вестник РГМУ. 2024;(2):4–10. https://doi.org/10.24075/vrgmu.2024.017
27. Терешкина НВ, Снегирева ИИ, Дармостукова МА. Возможные причины и меры по минимизации рисков развития абсцессов после прививки АКДС-вакциной. Безопасность и риск фармакотерапии. 2021;9(1):3–14. https://doi.org/10.30895/2312-7821-2021-9-1-3-14
28. Dias WO, van der Ark AA, Sakauchi MA, Kubrusly FS, Prestes AF, Borges MM, et al. An improved whole cell pertussis vaccine with reduced content of endotoxin. Hum Vaccin Immunother. 2013;9(2):339–48. https://doi.org/10.4161/hv.22847
29. Yılmaz Çolak Ç, Tefon Öztürk BE. Bordetella pertussis and outer membrane vesicles. Pathogens and Global Health. 2023;117(4):342–55. https://doi.org/10.1080/20477724.2022.2117937
30. Медкова АЮ, Лиджиева АА, Семин ЕГ, Синяшина ЛН, Сюндюкова РА, Дьяков ИН и др. Клинические исследования безопасности и переносимости живой вакцины интраназального применения для профилактики коклюша. Разработка и регистрация лекарственных средств. 2021;10(1):114–9. https://doi.org/10.33380/2305-2066-2021-10-1-114-119
31. Медкова АЮ, Лиджиева АА, Семин ЕГ, Синяшина ЛН, Сюндюкова РА, Снегирева НА и др. Иммуногенность препарата «Живая вакцина интраназального применения для профилактики коклюша» (ГамЖВК) при однократном применении у здоровых добровольцев. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(6):706–20. https://doi.org/10.36233/0372-9311-194
32. Skerry CM, Cassidy JP, English K, Feunou-Feunou P, Locht C, Mahon BP. A live attenuated Bordetella pertussis candidate vaccine does not cause disseminating infection in gamma interferon receptor knockout mice. Clin Vaccine Immunol. 2009;16(9):1344–51. https://doi.org/10.1128/CVI.00082-09
33. Feunou PF, Kammoun H, Debrie AS, Mielcarek N, Locht C. Long-term immunity against pertussis induced by a single nasal administration of live attenuated B. pertussis BPZE1. Vaccine. 2010;28(43):7047–53. https://doi.org/10.1016/j.vaccine.2010.08.017
34. Meade BD, Plotkin SA, Locht C. Possible options for new pertussis vaccines. J Infect Dis. 2014;209(Suppl):S24–7. https://doi.org/10.1093/infdis/jit531
35. Caroff M, Deprun C, Richards JC, Karibian D. Structural characterization of the lipid A of Bordetella pertussis 1414 endotoxin. J Bacteriol. 1994;176(16):5156–9. https://doi.org/10.1128/jb.176.16.5156-5159.1994
Об авторах
И. А. АлексееваРоссия
Алексеева Ирина Андреевна, д-р мед. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Д. Н. Лепихова
Россия
Лепихова Дарья Николаевна
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. Ю. Борисова
Борисова Ольга Юрьевна, д-р мед. наук, проф.
ул. Адмирала Макарова, д. 10, Москва, 125212
А. С. Пименова
Пименова Алена Сергеевна, канд. мед. наук
ул. Адмирала Макарова, д. 10, Москва, 125212
И. Ю. Андриевская
Андриевская Ирина Юрьевна
ул. Адмирала Макарова, д. 10, Москва, 125212
И. В. Ибрагимхалилова
Россия
Ибрагимхалилова Ильхамья Вейсаловна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Алексеева И.А., Лепихова Д.Н., Борисова О.Ю., Пименова А.С., Андриевская И.Ю., Ибрагимхалилова И.В. Влияние условий хранения цельноклеточной коклюшной вакцины на ее токсичность: исследование на аутбредных мышах. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(1):111-120. https://doi.org/10.30895/2221-996X-2025-25-1-111-120
For citation:
Alekseeva I.A., Lepikhova D.N., Borisova O.Yu., Pimenova A.S., Andrievskaya I.Yu., Ibragimkhalilova I.V. Influence of storage conditions on the toxicity of whole-cell pertussis vaccine in outbred mice. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(1):111-120. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-1-111-120


































