Перейти к:
Особенности регулирования обращения лекарственных препаратов бактериофагов: международный опыт и перспективы развития
https://doi.org/10.30895/2221-996X-2024-24-3-322-334
Резюме
ВВЕДЕНИЕ. Увеличение распространенности штаммов возбудителей заболеваний с множественной лекарственной устойчивостью определяет необходимость применения принципиально новых средств борьбы с бактериями, в том числе лекарственных препаратов бактериофагов. Стабильному внедрению фаготерапии мешает отсутствие общепринятых стандартизированных нормативных правовых и методических документов, регламентирующих проведение доклинических и клинических исследований, а также производство препаратов бактериофагов.
ЦЕЛЬ. Анализ международного опыта в области организации производства и обращения лекарственных препаратов бактериофагов, а также основных нормативных требований к контролю их качества, эффективности и безопасности.
ОБСУЖДЕНИЕ. Разработка препаратов вирулентных бактериофагов в соответствии с существующими требованиями к лекарственным средствам труднореализуема в связи с биологическими характеристиками бактериофагов, большим разнообразием их штаммов, возможными быстрыми изменениями, происходящими как в популяции бактериофагов, так и в популяции возбудителей. В связи с этим целесообразна разработка облегченных подходов к регистрации препаратов фаготерапии и упрощенных методов оценки их эффективности и безопасности. При этом необходима оценка специфических для этой группы препаратов нежелательных явлений, таких как риск развития лизогении и резистентности к бактериофагам, а также возможности переноса генов устойчивости к антибиотикам между штаммами бактерий. Во многих странах мира, в том числе в США, при фармацевтической разработке препаратов бактериофагов используется несколько подходов: концепция «качество через разработку» (Quality by Design); подход, основанный на формировании «мастер-файла на биологическую активную фармацевтическую субстанцию» (Biological Master File), согласно которому подается на одобрение регулирующих органов отдельный пакет документов, охватывающий только часть досье; программа «расширенного доступа» (Expanded Access), открывающая отдельному пациенту возможность применять инновационные препараты без утвержденных протоколов лечения. В России промышленное производство лекарственных препаратов бактериофагов осуществляется в соответствии со стандартами качества, указанными в Государственной фармакопее Российской Федерации.
ЗАКЛЮЧЕНИЕ. Подходы к фаготерапии и ее регулированию, принятые в мире и на территории Российской Федерации, в значительной степени отличаются. Представляется целесообразным дополнить существующие национальные рекомендации в сфере анализа эффективности и безопасности лекарственных препаратов бактериофагов, в частности регламентировать обязательность проведения доклинических исследований.
Ключевые слова
Для цитирования:
Давыдов Д.С., Парфенюк Р.Л., Дурманова З.В., Казаков Р.Е., Мовсесянц А.А. Особенности регулирования обращения лекарственных препаратов бактериофагов: международный опыт и перспективы развития. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(3):322-334. https://doi.org/10.30895/2221-996X-2024-24-3-322-334
For citation:
Davydov D.S., Parfenyuk R.L., Durmanova Z.V., Kazakov R.E., Movsesyants A.A. Specific aspects of bacteriophage regulation: international practices and future developments. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(3):322-334. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-3-322-334
ВВЕДЕНИЕ
На протяжении последних десятилетий актуальность поиска средств и методов сдерживания распространения лекарственно-устойчивых патогенных микроорганизмов неуклонно возрастает как на макрорегиональном, так и на глобальном уровне. Как одно из перспективных средств лечения и профилактики инфекционных заболеваний, вызываемых патогенными микроорганизмами с множественной лекарственной устойчивостью, все большее внимание специалистов в области здравоохранения, эпидемиологии, фармакологии, биотехнологии привлекают к себе бактериофаги — убиквитарные вирусы различных таксономических групп, которые являются симбионтами или специфическими патогенами для бактерий, включая возбудителей инфекционных заболеваний [1][2]. Мировой опыт использования живых культур бактериофагов в качестве активного компонента лекарственных препаратов антимикробного действия насчитывает уже 100 лет. Культуры бактериофагов представляют собой сложные, гетерогенные, поликомпонентные, динамически вариативные системы, вследствие чего готовые лекарственные формы, содержащие бактериофаги, являются препаратами с вариативным составом. В связи с этим в каждой стране, на территории которой осуществляется использование бактериофагов в медицинских целях, аспекты стандартизации данной категории препаратов, а также разработки единых нормативных правовых и методических подходов к производству, проведению доклинических и клинических исследований и обеспечению качества чрезвычайно сложны для всех субъектов государственного регулирования обращения лекарственных средств и в полной мере не решены.
В настоящее время в мировой практике рассматривается два основных подхода к созданию препаратов бактериофагов [2–4]. В первом случае создается комбинация литических бактериофагов широкого спектра действия, которые активны в отношении отдельного вида патогенного микроорганизма. Такой подход был внедрен изначально, еще в 30-е гг. ХХ века, так как он позволял проводить стандартизацию процессов промышленного производства препаратов. Второй вариант фаготерапии предусматривает индивидуальный подбор культуры бактериофага, литически активного в отношении штамма возбудителя, выделенного у конкретного пациента (персонализированные препараты).
Однако уже к середине XX века бурное развитие промышленного производства химических антимикробных препаратов фактически остановило внедрение обоих вариантов фаготерапии в схемы лечения и профилактики инфекционных заболеваний во всех странах мира, кроме СССР и некоторых стран Организации Варшавского договора. Таким образом, только в СССР, а в настоящее время в Российской Федерации, в здравоохранении накоплен релевантный опыт промышленного производства и практического применения лекарственных препаратов бактериофагов. За пределами России увеличение интенсивности исследований в области фаготерапии началось только в 1990-е гг. — после объявления Всемирной организацией здравоохранения об угрозе глобального распространения устойчивости возбудителей инфекционных заболеваний к лекарственным препаратам1.
Стандарты производства и контроля качества готовых лекарственных форм бактериофагов промышленного производства включены в Государственную фармакопею Российской Федерации (ГФ РФ)2. В проектах монографий Европейской фармакопеи и Фармакопеи США приведено только перечисление показателей качества и методов контроля. В других странах мира в данный момент национальные фармакопейные стандарты производства и контроля качества бактериофагов отсутствуют, применение бактериофагов на популяционном уровне не является системным явлением и носит единичный характер.
К странам, в которых имеется опыт изучения возможности применения бактериофагов для медицинских целей, относятся США, ряд стран Европейского союза (Бельгия, Польша, ФРГ, Великобритания), Япония, Китай, Индия, Бразилия, Канада. В настоящее время в этих странах выработаны общие принципы обращения препаратов бактериофагов [5][6]:
- препараты изготавливаются только для персонализированного применения, промышленное производство не предусмотрено;
- изготовление препаратов бактериофагов может проводиться только с использованием зарегистрированных в установленном порядке компонентов, внесенных в национальные реестры продукции, подлежащей к использованию в рамках осуществления фармацевтической деятельности;
- регистрации и применению подлежат только препараты с фиксированным составом, тогда как регистрация препаратов с вариабельным составом не предусмотрена;
- применение бактериофагов в терапевтических целях возможно в соответствии со статьей 37 Хельсинкской декларации Всемирной медицинской ассоциации, которая предусматривает возможность отхода лечащим врачом от стандартов оказания медицинской помощи с согласия пациента и применение средств и методов с недоказанной (непроверенной) эффективностью и безопасностью при отсутствии иных средств и неэффективности имеющихся в угрожающих жизни состояниях, для облегчения страданий. В этом случае предусмотрена возможность упрощенной регистрации препаратов бактериофагов при условии успешного применения на протяжении определенного времени на территории других стран. Кроме того, предусмотрено сокращение объема клинических исследований или отказ от их проведения.
Таким образом, в связи с бурным развитием сегмента биологических лекарственных препаратов, в том числе бактериофагов, в Российской Федерации и во всем мире и недостаточной проработанностью механизмов регулирования обращения препаратов данной группы актуальным представляется освещение аспектов регистрации препаратов и подходов к проведению их доклинических и клинических исследований, принятых в разных странах и имеющих свои особенности.
Цель работы — анализ международного опыта в области организации производства и обращения лекарственных препаратов бактериофагов, а также основных нормативных требований к контролю качества, эффективности и безопасности.
ОСНОВНАЯ ЧАСТЬ
Специфические особенности лекарственных средств на основе вирулентных бактериофагов
С 2018 г. Европейское агентство по лекарственным средствам (European Medicines Agency, EMA) и Управление по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA) разрабатывают новые отдельные регуляторные механизмы, которые способствовали бы совершенствованию процедуры регистрации и контроля обращения препаратов бактериофагов. В Европейском союзе (ЕС) эта группа препаратов отнесена к биомедицинским продуктам для фаготерапии (phage therapy medicinal products, РТМР), а в США — к лекарственным средствам (drugs). В связи с этим к бактериофагам предъявляются те же требования к производству, клиническим исследованиям, составу регистрационного досье, как и к любой другой продукции, относящейся к категории антимикробных лекарственных препаратов. Из этого следует, что любая выделенная культура бактериофага, обладающая литической активностью в отношении патогенных микроорганизмов, должна пройти полный комплекс исследований in vitro — для определения подлинности, специфичности, механизмов действия, а также in vivo — для оценки токсичности, иммуногенности и режима дозирования.
Фармакодинамика и фармакокинетика бактериофагов изучены недостаточно. В организме бактериофаги, с одной стороны, эффективно элиминируются иммунной системой пациента, особенно ретикулоэндотелиальной системой, но одновременно могут экспоненциально размножаться в присутствии бактерий-хозяев [1][2].
Препараты бактериофагов могут быть как моно-, так и поликомпонентными (в состав входят несколько штаммов бактериофагов), что усложняет дизайн предрегистрационных исследований. Поликомпонентные препараты имеют ряд преимуществ, но сложность их состава затрудняет получение релевантных результатов при оценке эффективности. При использовании таких комплексных препаратов (коктейль бактериофагов) основной целью является предотвращение возникновения резистентности бактерий, поскольку как in vitro, так и in vivo было показано появление резистентности в популяции патогенов к бактериофагам постоянного состава [3][4][7]. Комплексные препараты обладают более широким спектром действия, что снижает необходимость постоянной интенсивной ротации действующего вещества и в большей степени соответствует общим принципам надлежащей клинической практики [8]. Поликомпонентные препараты могут применяться в начале эмпирической терапии, особенно при выявлении генерализованных инфекций, вызванных возбудителями с множественной лекарственной устойчивостью [9].
На рисунке 1 показаны возможные алгоритмы действия при проведении фаготерапии. В одном случае предлагается готовый продукт, находящийся в свободной продаже. При этом лечение может быть комбинированным с другой антибактериальной терапией, а при положительном результате лечения конечных анализов можно не проводить. Согласно другой схеме предполагается индивидуальный подбор состава препарата. Это дорогостоящий путь лечения мультирезистентных инфекций, при котором конечный контроль, как правило, обязателен.
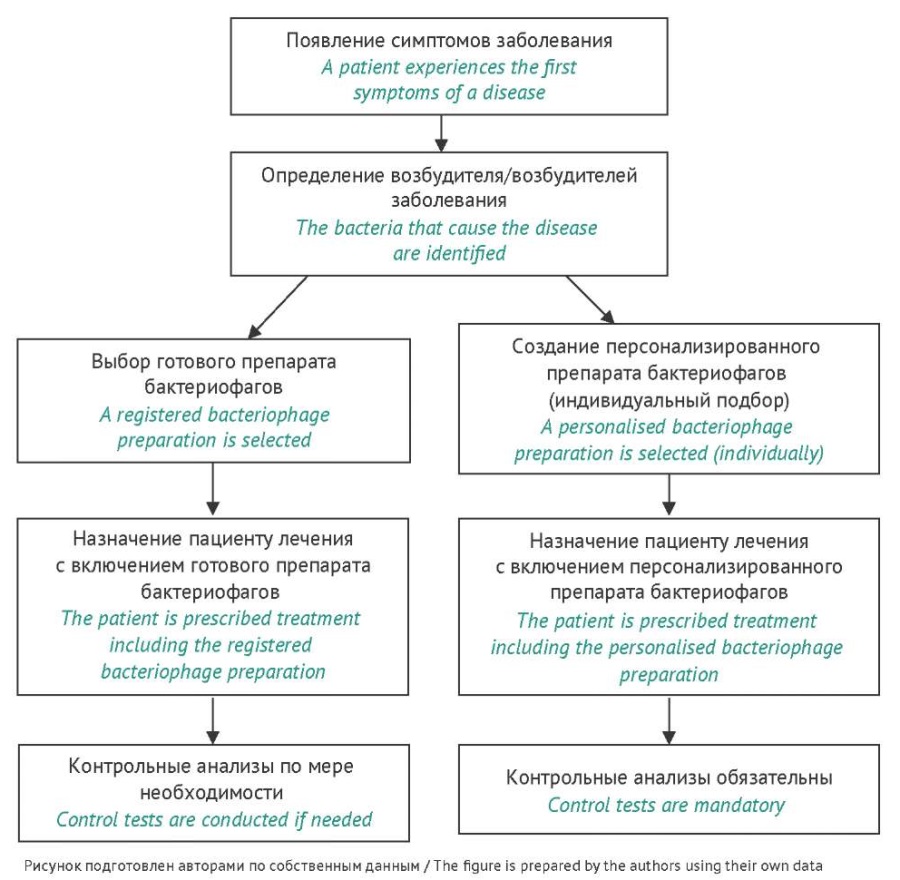
Рис. 1. Алгоритмы действия при назначении препаратов бактериофагов.
Fig. 1. Prescription algorithms for bacteriophage preparations.
Применимость существующих общих требований к лекарственным средствам по отношению к препаратам бактериофагов
В настоящее время в США и ЕС отсутствуют требования к порядку проведения клинических испытаний фаз I–IV для оценки безопасности и эффективности препаратов бактериофагов. При этом, согласно позиции регуляторных органов, специальных нормативных требований для предрегистрационных исследований бактериофагов и составления регистрационного досье не требуется [5]. Однако это в большей степени применимо к препаратам постоянного состава.
В соответствии с требованиями регуляторных органов в США и ЕС при регистрации препаратов бактериофагов необходимо предоставлять информацию о профиле и уровне литической активности не только комплекса бактериофагов, входящих в состав препарата, но и каждого его штамма в отдельности, а также результаты изучения динамики изменения количественного содержания каждого штамма бактериофага при совместном культивировании.
Многие специалисты справедливо полагают, что в дальнейшем при применении этого подхода в регулировании обращения препаратов бактериофагов возникнут трудности, связанные с происходящими в течение времени изменениями структуры и свойств популяций микроорганизмов в зависимости от области их распространения, а также с появлением в популяции патогенных бактерий, резистентных к препаратам постоянного состава. О скорости и механизмах формирования фагорезистентности в настоящее время мало известно, в том числе о случаях устойчивости в клинических условиях (например, у человека во время курса терапии бактериофагами). Имеются клинические наблюдения об отдельных случаях резистентности к культурам бактериофагов, когда она возникала с такой же или даже более высокой частотой, чем устойчивость к антибиотикам [4][7][10][11]. Это определяет необходимость постоянной адаптации комбинаций бактериофагов и включение новых культур в состав готовой лекарственной формы. Согласно позиции регуляторных органов необходима регистрация каждой комбинации в отдельности [1].
Следует отметить, что существующий общепринятый порядок разработки и регистрации лекарственных препаратов (или биомедицинских продуктов) не в полной мере применим для препаратов бактериофагов. С учетом большого количества фагов, являющихся активными компонентами готовой лекарственной формы, стоимость проведения предрегистрационных исследований каждого бактериофага в отдельности и в полном объеме становится очень дорогостоящей и недоступной ни одному фармацевтическому предприятию как в случае препаратов промышленного производства, так и в случае препаратов для персонализированной терапии [12].
Фармацевтическая промышленность на глобальном уровне в настоящее время не готова инвестировать в массовые исследования и разработку препаратов бактериофагов. Несмотря на относительно невысокую стоимость выделения и культивирования бактериофагов при соблюдении правил GMP и требований регуляторной практики, а также при постоянном обновлении состава комплексных препаратов бактериофагов, мониторинге фагорезистентности и ее профилактике общий размер материального обеспечения таких работ будет сопоставим с затратами на разработку антимикробных препаратов химической природы [13]. Так, согласно экономическому анализу медианная и средняя стоимость фармацевтической разработки для вывода препарата бактериофагов на рынок (во второй декаде XXI века) составили 985 и 1336 млн долларов США соответственно, а стоимость разработки пяти новых антибиотиков составила 1260 и 1297 млн долларов США соответственно [14]. Среди причин неготовности фарминдустрии к таким проектам: недостаточная защита прав интеллектуальной собственности в отношении биообъектов, таких как бактериофаги; проблема сохранения специфичности и устойчивости свойств бактериофагов; малое количество рандомизированных клинических исследований эффективности фаготерапии [6].
Следует отметить, что ряд фармацевтических компаний, тем не менее, проводят регистрацию препаратов бактериофагов по сложному и дорогостоящему пути согласно стандартной процедуре регистрации лекарственных препаратов. Одним из примеров является проект «PhagoBurn», финансируемый Европейской комиссией, — первое крупное исследование бактериофаговой терапии в соответствии с современными стандартами регулирования лекарственных средств в ЕС [15]. В этом рандомизированном контролируемом двойном слепом исследовании фазы I/II оценивалась эффективность и переносимость смеси бактериофагов для лечения ожоговых ран, инфицированных Pseudomonas aeruginosa. Производство исследуемой смеси заняло 20 мес., на что была затрачена большая часть бюджета [16]. Кроме того, ретроспективно было показано, что сложный коктейль, состоящий из не менее чем 12 бактериофагов P. aeruginosa, неактивен (in vitro) в отношении штаммов P. aeruginosa, обнаруженных у трех из десяти пациентов [15]. Поскольку действие исследуемого биомедицинского продукта для фаготерапии было направлено только на один из многих видов бактерий, вызывающих инфекции ожоговых ран, формирование групп пациентов было крайне затруднено [16]. Вне зависимости от результатов относительно неудачного клинического исследования [15], предварительная фаза проекта «PhagoBurn» позволила выявить ряд ограничений методических подходов, нуждающихся в адаптации требований к производству (изготовлению) и обращению таких препаратов в целом. Исследование подтвердило необходимость создания специальных нормативных требований для персонализированных подходов к фаготерапии, для обеспечения безопасности и эффективности, а также для реагирования на актуальные угрозы общественному здравоохранению, такие как резкое распространение мульти- и панрезистентных штаммов Klebsiella pneumoniae или вспышка особо опасной инфекции, вызванной Escherichia coli STEC O104:H4 в Германии в 2011 г. [17].
Подходы к регулированию обращения препаратов бактериофагов в США
Начиная с 2015 г. национальные регуляторные органы в ряде стран, в том числе в США, подняли вопрос о необходимости углубленного системного взаимодействия с производителями лекарственных препаратов бактериофагов в части адаптации процедур государственной регистрации применительно к таким препаратам. Это подходит для коммерческих препаратов промышленного производства с фиксированным штаммовым составом, однако не может использоваться для препаратов экстемпорального изготовления, если при их получении используются бактериофаги, в отношении которых ранее не были проведены исследования эффективности и безопасности. В связи с этим возникла необходимость разработки порядка создания централизованных банков штаммов бактериофагов, аттестованных в соответствии с требованиями регуляторных органов и надлежащих практик, что позволило бы своевременно регистрировать поликомпонентные препараты бактериофагов (коктейли) [1]. Для этого необходима характеристика отдельных бактериофагов in vitro с использованием структурного и геномного анализа, а также оценка эффективности. Безопасность и эффективность также могут быть установлены в ходе испытаний in vivo на животных моделях [1].
Нормативно-правовые требования, регулирующие процесс производства препаратов бактериофагов и контроль его стадий, также может облегчить и удешевить обновление коктейлей бактериофагов [18]. Подход, основанный на концепции «качество через разработку» (Quality by Design, QbD), все чаще применяется в США при разработке и производстве биофармацевтических молекул [19]. Подход QbD базируется на качестве процесса и продукта, реализуемого на основе научных знаний и рисков. Понимание потребностей пациентов и определение конкретных качественных характеристик продукта, связанных с безопасностью и эффективностью, являются важнейшими компонентами QbD.
Для регулирования обращения препаратов бактериофагов было предложено использовать подход, основанный на формировании «мастер-файла на биологическую активную фармацевтическую субстанцию» (Biological Master File, BMF). Такой подход применяется в настоящее время к некоторым препаратам химического происхождения [20], при котором составляется и подается на одобрение регуляторных органов отдельный пакет документов, охватывающий только часть регистрационного досье. Например, BMF может включать только активный компонент (бактериофаг) препарата бактериофага; и для каждого отдельного бактериофага будет представлен свой BMF. Концепция BMF в основном фокусируется на качестве производственного процесса (GMP) и вопросах безопасности. Однако следует отметить, что европейское законодательство не позволяет применять это понятие к биологически активным веществам.
В США регулирование обращения бактериофагов как лекарственных препаратов осуществляется Центром экспертизы и исследования биологических препаратов (Center for Biologics Evaluation and Research, CBER) при FDA. Правила, применимые к таким препаратам, требуют, чтобы клинические исследования проводились по процедуре рассмотрения заявки на регистрацию нового экспериментального лекарственного средства (Investigational New Drug Application, IND).
Препараты бактериофагов, предназначенные для лечения или профилактики заболеваний, считаются биологическими препаратами и лекарствами и регулируются подразделением CBER. Правила, применимые к биологическим препаратам, которые соответствуют определению «лекарства», данному в Законе о пищевых продуктах, лекарственных препаратах и косметических средствах (Federal Food, Drug, and Cosmetic Act, FD&C), можно найти в Cводе федеральных нормативных актов (Code of Federal Regulations, CFR) 21, часть 312 (22, 23, 24, 25, 26)3. За редким исключением, эти правила требуют, чтобы клинические исследования проводились в соответствии с досье на IND.
Подача заявки на регистрацию обеспечивает регулирующий надзор за использованием исследуемого препарата на людях. Хотя целью подачи заявки может быть регистрация препарата в США, заявки также необходимы для заявителей, которые намереваются проводить исследования с участием людей с использованием незарегистрированных биологических препаратов исключительно в исследовательских целях4. Перед подачей заявки на регистрацию можно запросить предварительную встречу с представителями CBER. В этом формальном процессе заявитель может инициировать взаимодействие с FDA для обсуждения данных, необходимых для организации первого исследования на людях, планирования первоначального клинического исследования, нормативных требований к демонстрации безопасности и эффективности, а также вопросов по составу, производству и контролю качества (Chemistry, Manufacturing, and Controls, CMC), связанных с безопасностью исследуемого нового препарата, предложенного для использования в первоначальных клинических исследованиях5 [21].
Клинические исследования проводятся на последовательно увеличивающемся количестве участников. Исследования фазы I сосредоточены исключительно на безопасности участников исследования, получающих препарат; фаза II направлена на определение оптимальной дозы и/или продолжительности лечения, а также на получение некоторых доказательств эффективности; целью фазы III является сбор дополнительной информации об эффективности и безопасности, необходимой для оценки общего соотношения «польза–риск». На всех этапах рассмотрения заявки на регистрацию дорабатываются показатели и методы контроля готовой лекарственной формы, уточняется перечень критических точек производственного процесса, при этом перечень показателей качества и методы их исследования должны быть определены, а все методики полностью валидированы до начала проведения исследований фазы III.
При подаче заявки на регистрацию биологического препарата (Biologics License Application, BLA) заявитель представляет на рассмотрение FDA полный пакет данных6, при этом заявитель должен продемонстрировать, что препарат соответствует стандартам, разработанным для обеспечения «постоянной безопасности, чистоты и специфической активности»7. Для взаимодействия заявители могут обращаться в CBER, в том числе перед подачей заявки на регистрацию (BLA)8.
В некоторых исследованиях описано использование фаготерапии для лечения отдельных пациентов в США в условиях программы «расширенного доступа» (Expanded Access) [22–25]. Этот подход делает исследуемые препараты доступнее для пациентов с тяжелыми заболеваниями (состояниями), когда нет сопоставимой альтернативы9. Программа расширенного доступа представляет собой практику законного использования препарата вне клинических исследований для лечения человека — в случаях, когда имеется серьезное или непосредственно угрожающее жизни заболевание или отсутствуют утвержденные протоколы лечения. Расширенный доступ регулируется FDA в каждом конкретном случае для отдельного пациента или групп пациентов, которые не соответствуют критериям для участия в клиническом исследовании.
Существуют три категории расширенного доступа: для отдельных пациентов (в том числе для экстренного использования); для небольших популяций пациентов; для широкого применения. Для всех видов использования расширенного доступа требуется информированное согласие пациентов.
Следует отметить, что разработка препаратов бактериофагов и их последующая регистрация имеет ряд уникальных особенностей, в том числе касающихся представления информации о составе, производстве и контроле качества в соответствующих модулях регистрационного досье.
Свойства бактериофагов, влияющие на качество лекарственных препаратов бактериофагов
Бактериофаги, выделяемые из природных источников (сточные воды, почва), проявляют литическую активность в отношении большинства видов бактерий. Спектр встречающихся в природе специфически активных бактериофагов для каждого патогена потенциально может быть весьма большим. Кроме того, варианты и формы взаимодействия в паре «бактериофаг–клетка» уникальны, в связи с чем сформулировать общие принципы взаимодействия между бактериофагом и целевым микроорганизмом, основываясь на ограниченном количестве известных исследований, затруднительно. По этой причине досье заявки на регистрацию (IND) должно включать достаточную информацию, чтобы гарантировать правильную идентификацию, качество, чистоту, специфичность и эффективность бактериофага, предназначенного для клинических исследований с участием людей.
Хотя некоторые бактериофаги способны инфицировать несколько видов бактерий, в большинстве своем бактериофаги узкоспецифичны [26–35]. Это является преимуществом препаратов бактериофагов, поскольку незначительно нарушает баланс в нативной микробиоте по сравнению с антибиотиками широкого спектра действия. Специфичность бактериофагов одновременно усложняет лечение, поскольку обеспечение эффективности требует предварительной идентификации инфекционного агента и оценки активности препарата бактериофага против изолята (изолятов) возбудителя. Специфичность бактериофагов чаще всего определяется взаимодействием «бактериофаг-рецептор», однако на это также оказывают влияние и другие факторы, в том числе уровень экспрессии определенных генов [36–39].
Бактериофаги могут обладать иммуногенностью, и при их использовании существует вероятность возникновения адаптивного иммунного ответа [40]. Формирование комплексов «антитело-бактериофаг» и другие последствия иммунного ответа на бактериофаги потенциально могут представлять угрозу для безопасности терапии. Степень иммунного ответа может зависеть от пути введения. Иммуногенность может быть изучена in vivo или при проведении клинических исследований.
Некоторые бактериофаги способствуют переносу генов между бактериями [39]. Одним из механизмов этого процесса является лизогенная конверсия, то есть приобретение и/или изменение фенотипических признаков бактерии-носителя, образование токсинов и некоторых ферментов и др., при котором интеграция бактериофага в геном бактерии-хозяина обеспечивает ее потенциальное селективное преимущество. В результате бактерия-хозяин может становиться более вирулентной, чем раньше. Кроме того, бактерии, лизогенные для данного бактериофага, обычно также становятся невосприимчивыми к уничтожению им, что снижает эффективность препарата. В связи с этим бактериофаги, опосредующие лизогенную конверсию, не являются подходящими кандидатами для терапевтического использования.
Бактериофаги могут опосредовать генетический перенос с использованием трансдукции, то есть передачи генетической информации от одной бактериальной клетки (донора) к другой (реципиенту) [41–43]. Различают неспецифическую (генерализованную), ограниченную (специфическую) и абортивную трансдукцию, а также котрансдукцию. При неспецифической трансдукции сегменты бактериальной ДНК хозяина случайным образом упаковываются в частицы бактериофага, и когда они встречаются с новыми бактериальными хозяевами, частицы могут передавать свою ДНК, которая, путем гомологичной рекомбинации может быть включена в геном клетки-хозяина. В результате происходит перенос бактериальной ДНК от одной бактерии к другой [41–43]. При молекулярно-биологическом анализе наличие трансдуцирующих частиц в лизате можно обнаружить с помощью праймеров для ПЦР, специфичных для последовательностей бактериальных хозяев, таких как гены 16SрРНК.
Следует отметить, что при использовании в фаготерапии бактериофагов, не способных к лизогении, устраняется возможность как лизогенной конверсии, так и специализированной трансдукции. Способность бактериофагов к лизогении можно оценить с помощью нескольких методов [27][28]. При микробиологическом тесте наличие непрозрачной фаговой бляшки свидетельствует о вероятной лизогении. Молекулярно-биологические методы также можно использовать для определения способности бактериофага к лизогении. ДНК бактериофага можно секвенировать и анализировать на наличие генов-репрессоров, генов интегразы, других гомологий с известными лизогенными бактериофагами или других индикаторов лизогении. Кроме того, последовательность генома предполагаемого лизогена можно проанализировать на наличие профага, отсутствующего в родительском штамме.
С учетом описанных выше биологических характеристик сформирован перечень необходимых свойств бактериофагов, предназначенных для использования в терапии. Так, геном бактериофага не должен включать гены факторов вирулентности или устойчивости к антибиотикам. Бактериофаги должны быть нелизогенными, чтобы избежать проблем лизогенной конверсии и специфической трансдукции. В идеале бактериофаги также должны быть неспособны к генерализованной трансдукции. Если обнаружено, что бактериофаг, предназначенный для терапии, обладает способностью к трансдукции, его следует размножать на непатогенном штамме, в котором отсутствуют детерминанты устойчивости к антибиотикам, которые можно легко трансдуцировать, и отсутствуют профаги, которые могут снизить чистоту препарата бактериофага. Однако в некоторых случаях такого подхода к ограничению переноса нежелательных генов может оказаться недостаточно.
Для обеспечения надлежащей идентификации, качества, чистоты и эффективности исследуемых препаратов бактериофагов, при формировании досье заявки на регистрацию (IND) необходимо предоставить следующую информацию:
- источники получения и история штаммов бактериофагов;
- полногеномные последовательности и аннотации геномов бактериофагов, включая анализы на наличие известных факторов вирулентности и элементов устойчивости к антибиотикам, с подробным описанием методик;
- данные о способности бактериофагов к лизогении;
- данные о том, способны ли бактериофаги к генерализованной трансдукции;
- информацию о бактериальных штаммах-хозяевах, используемых для размножения бактериофагов, включая источники и историю штаммов бактерий-хозяев, а также полногеномные последовательности и аннотации штаммов бактерий-хозяев, включая анализы на наличие известных факторов вирулентности, элементов устойчивости к антибиотикам и профагов, с пояснениями того, как проводились эти исследования.
Существуют некоторые дополнительные исследования, которые можно считать желательными для бактериофагов, предназначенных для терапевтического использования. Например, после серийного пассажа на мышах были выделены мутанты бактериофагов, которые дольше сохраняются в кровотоке [40], что потенциально увеличивает продолжительность времени, в течение которого бактериофаги могут встретиться со своими бактериальными мишенями. Кроме того, было обнаружено, что некоторые бактериофаги используют факторы вирулентности [44] или белки устойчивости к антибиотикам [45] в качестве рецепторов. В этих случаях бактерии, у которых развивается устойчивость к бактериофагу в результате мутации рецептора, становятся менее вирулентными или более чувствительными к антибиотикам, что является положительным шагом на пути к разрешению инфекции.
Поликомпонентные препараты бактериофагов (коктейли бактериофагов) предназначены для расширения спектра лечения, то есть для использования против нескольких видов бактерий или нескольких штаммов одного вида бактерий [4][46][47]. Коктейли бактериофагов помогут снизить вероятность возникновения бактериальной резистентности к лечению. Этот подход аналогичен использованию нескольких противоинфекционных препаратов для лечения туберкулеза или ВИЧ. Обоснование такого подхода заключается в том, что приобретение устойчивости к множеству бактериофагов менее вероятно, чем к одному, поскольку зависит от различных генетических факторов устойчивости для разных бактериофагов, и мутация, вызывающая устойчивость к одному бактериофагу, не приводит к устойчивости ко всем. При разработке эффективных коктейлей бактериофагов можно определять рецепторы к бактериофагам-кандидатам или использовать эмпирические методы для изучения способности различных комбинаций фагов подавлять рост целевых штаммов in vitro [4][46][47].
Следует отметить, что подходы к фаготерапии и ее регулированию, принятые в мире и на территории Российской Федерации, в значительной степени отличаются. В России установлен приоритет государственного регулирования безопасности, качества и эффективности лекарственных средств при их обращении. Лекарственные препараты бактериофагов, внесенные в Государственный реестр лекарственных средств, представляют собой комбинации литических бактериофагов, активных в отношении широкого спектра эпидемиологически актуальных групп возбудителей. ГФ РФ устанавливает перечень показателей качества и методов контроля качества лекарственных препаратов, основанный на результатах доклинических исследований. Несмотря на актуальность применения персонализированного подхода к лечению и профилактике инфекционных заболеваний человека, правовые основания для такого применения бактериофагов практически отсутствуют как в России, так и в других странах мира [48].
Недостаточность критериев оценки качества препаратов бактериофагов, произведенных в рамках персонализированного подхода, затрудняет деятельность медицинских организаций по формированию внутренней системы управления качеством при их изготовлении. Представляется целесообразным дополнить существующие национальные рекомендации в сфере анализа эффективности и безопасности лекарственных препаратов бактериофагов, в частности, регламентировать обязательность проведения доклинических исследований.
ЗАКЛЮЧЕНИЕ
Применение препаратов бактериофагов в практической медицине предполагает разработку нормативных правовых и методических документов, регламентирующих их производство, а также проведение доклинических и клинических исследований. Фармацевтическая разработка препаратов вирулентных бактериофагов в соответствии с существующими требованиями к лекарственным средствам труднореализуема в связи с биологическими характеристиками бактериофагов, большим разнообразием их штаммов, возможным быстрым изменениям, происходящим как в популяции бактериофагов, так и в популяции возбудителей. В связи с этим целесообразна разработка облегченных подходов к регистрации препаратов фаговой терапии и упрощенные методы оценки их эффективности и безопасности. При этом необходимо оценивать специфические для этой группы препаратов нежелательные явления, такие как риск развития лизогении и резистентности к бактериофагам, а также возможность переноса генов устойчивости к антибиотикам между штаммами бактерий.
Во многих странах мира, в том числе в США, при фармацевтической разработке препаратов бактериофагов используются следующие подходы: концепция «качество через разработку» (Quality by Design); подход, основанный на формировании «мастер-файла на биологическую активную фармацевтическую субстанцию» (Biological Master File), который подается на одобрение регулирующих органов как отдельный пакет, охватывающий только часть досье; программа «расширенного доступа» (Expanded Access), открывающая отдельному пациенту возможность применять инновационные препараты без утвержденных протоколов лечения.
В России промышленное производство лекарственных препаратов бактериофагов осуществляется в соответствии со стандартами качества, указанными в Государственной фармакопее Российской Федерации.
В результате проведенного аналитического исследования установлено наличие принципиальных различий в подходах к фаготерапии и ее регулированию, принятых в мире и на территории Российской Федерации. На основании проведенного анализа рекомендовано дополнить существующие национальные рекомендации в сфере анализа эффективности и безопасности лекарственных препаратов бактериофагов, в частности регламентировать обязательность проведения доклинических исследований.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Д.С. Давыдов — дизайн исследования, обработка и анализ данных литературы, написание текста рукописи; Р.Л. Парфенюк, З.В. Дурманова, Р.Е. Казаков — анализ данных литературы, редактирование текста рукописи; А.А. Мовсесянц — критическое обсуждение текста рукописи, утверждение окончательной версии статьи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. D.S. Davydov designed the study, processed and analysed literature data, and drafted the manuscript. R.L. Parfenyuk, Z.V. Durmanova, and R.E. Kazakov analysed literature data and edited the manuscript. A.A. Movsesyants critically discussed the manuscript and approved the final version of the manuscript for publication.
1. Глобальная стратегия ВОЗ по сдерживанию устойчивости к противомикробным препаратам (WHO/CDS/CSR/DRS/2001.2а). WHO; 2001.
2. ОФС.1.7.1.0002.15 Бактериофаги. Государственная фармакопея Российской Федерации. XIVизд. Т. 2; 2018.
3. Federal Food, Drug, and Cosmetic Act. https://www.govinfo.gov/content/pkg/COMPS-973/pdf/COMPS-973.pdf
4. Title 21. Code of Federal Regulations, Part 312 (2018). Investigational new drug application.
5. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Biologics Evaluation and Research. Guidance for industry: IND meetings for human drugs and biologics. Chemistry, manufacturing and controls Information. FDA; 2001.
6. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Biologics Evaluation and Research. Biologics guidances. FDA; 2008.
7. Title 21. Code of Federal Regulations, Sec. 600.3 (2018). Definitions.
8. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Biologics Evaluation and Research. Guidance for industry: IND meetings for human drugs and biologics. Chemistry, manufacturing and controls Information. FDA; 2001.
9. Title 21. Code of Federal Regulations, Part 312, Subpart I (2018). Expanded access to investigational drugs for treatment use.
Список литературы
1. Cooper CJ, Khan Mirzaei M, Nilsson AS. Adapting drug approval pathways for bacteriophage-based therapeutics. Front Microbiol. 2016;7:1209. https://doi.org/10.3389/fmicb.2016.01209
2. Pirnay JP, Ferry T, Resch G. Recent progress toward the implementation of phage therapy in Western medicine. FEMS Microbiol Rev. 2022;46(1):fuab040 https://doi.org/10.1093/femsre/fuab040
3. Hall AR, Vos DD, Friman V-P, Pirnay J-P, Buckling A. Effects of sequential and simultaneous applications of bacteriophages on populations of Pseudomonas aeruginosa in vitro and in wax moth larvae. Appl Environ Microbiol. 2012;78(16):5646–52. https://doi.org/10.1128/aem.00757-12
4. Schooley RT, Biswas B, Gill JJ, Hernandez-Morales A, Lancaster J, Lessor L. Development and use of personalized bacteriophage-based therapeutic cocktails to treat a patient with a disseminated resistant Acinetobacter baumannii infection. Antimicrob Agents Chemother. 2017;61(10):e00954–17. https://doi.org/10.1128/AAC.00954-17
5. Verbeken G, Pirnay JP, Lavigne R, Jennes S, De Vos D, Casteels M, Huys I. Call for a dedicated European legal framework for bacteriophage therapy. Arch Immunol Ther Exp. 2014;62(2):117–29. https://doi.org/10.1007/s00005-014-0269-y
6. Pirnay JP, Verbeken G, Rose T, Jennes S, Zizi M, Huys I, et al. Introducing yesterday’s phage therapy in today’s medicine. Future Virol. 2012;7(4):379–90. https://doi.org/10.2217/fvl.12.24
7. Van Nieuwenhuyse B, Van der Linden D, Chatzis O, Lood C, Wagemans J, Lavigne R, et al. Bacteriophage-antibiotic combination therapy against extensively drug-resistant Pseudomonas aeruginosa infection to allow liver transplantation in a toddler. Nat Commun. 2022;13(1):5725. https://doi.org/10.1038/s41467-022-33294-w
8. Gill JJ, Hyman P. Phage choice, isolation, and preparation for phage therapy. Curr Pharm Biotechnol. 2010;11(1):2–14. https://doi.org/10.2174/138920110790725311
9. Glonti T, Pirnay JP. In vitro techniques and measurements of phage characteristics that are important for phage therapy success. Viruses. 2022;14(7):1490. https://doi.org/10.3390/v14071490
10. Carlton RM. Phage therapy: past history and future prospects. Arch Immunol Ther Exp. 1999;47(5):267–74. PMID: 10604231
11. Egido JE, Costa AR, Aparicio-Maldonado C, Haas PJ, Brouns SJJ. Mechanisms and clinical importance of bacteriophage resistance. FEMS Microbiol Rev. 2022;46(1):fuab048. https://doi.org/10.1093/femsre/fuab048
12. Pirnay JP, De Vos D, Verbeken G, Merabishvili M, Chanishvili N, Vaniichoutte M, et al. The phage therapy paradigm: preˆt-a`-porter or sur-mesure? Pharm Res. 2011;28(4):934–7. https://doi.org/10.1007/s11095-010-0313-5
13. Mattey M, Spencer J. Bacteriophage therapy — cooked goose or phoenix rising? Curr Opin Biotechnol. 2008;19(6):608–12. https://doi.org/10.1016/j.copbio.2008.09.001
14. Wouters OJ, McKee M, Luyten J. Estimated research and development investment needed to bring a new medicine to market, 2009–2018. JAMA. 2020;323(9):844–53. https://doi.org/10.1001/jama.2020.1166
15. Jault P, Leclerc T, Jennes S, Pirnay JP, Que Y-A, Resch G, et al. Efficacy and tolerability of a cocktail of bacteriophages to treat burn wounds infected by Pseudomonas aeruginosa (PhagoBurn): a randomised, controlled, double-blind phase 1/2 trial. Lancet Infect Dis. 2019;19(1):35–45. https://doi.org/10.1016/S1473-3099(18)30482-1
16. Servick K. Drug development. Beleaguered phage therapy trial presses on. Science. 2016;352(6293):1506. https://doi.org/10.1126/science.352.6293.1506
17. Merabishvili M, De Vos D, Verbeken G, Kropinski AM, Vandenheuvel D, Lavigne R, et al. Selection and characterization of a candidate therapeutic that lyses the Escherichia coli O104:H4 strain from the 2011 outbreak in Germany. PLoS One. 2012;7(12):e52709. https://doi.org/10.1371/journal.pone.0052709
18. Henein A. What are the limitations on the wider thera peutic use of phage? Bacteriophage. 2013;3(2):e24872. https://doi.org/10.4161/bact.24872
19. Verbeken G, Pirnay JP, De Vos D, Jennes S, Zizi M, Lavigne R, et al. Optimizing the European regulatory frame-work for sustainable bacteriophage therapy in human medicine. Arch Immunol Ther Exp (Warsz). 2012;60(3):161–72. https://doi.org/10.1007/s00005-012-0175-0
20. Fauconnier A. Regulating phage therapy: the biolog ical master file concept could help to overcome regulatory challenge of personalized medicines. EMBO Rep. 2017;18(2):198–200. https://doi.org/10.15252/embr.201643250
21. Shapiro SZ. The HIV/AIDS vaccine researchers’ orientation to the process of preparing a US FDA application for an investigational new drug (IND): what it is all about and how you start by preparing for your pre-IND meeting. Vaccine. 2002;20(9–10):1261–80. https://doi.org/10.1016/s0264-410x(01)00453-4
22. Aslam S, Yung G, Dan J, Reed S, LeFebvre M, Logan C, et al. Bacteriophage treatment in a lung transplant recipient. J Heart Lung Transplant. 2018;37(4):S155–6. https://doi.org/10.1016/j.healun.2018.01.376
23. Chan BK, Turner PE, Kim S, Mojibian HR, Elefteriades JA, Narayan D. Phage treatment of an aortic graft infected with Pseudomonas aeruginosa. Evol Med Public Health. 2018;(1):60–6. https://doi.org/10.1093/emph/eoy005
24. Furr CLL, Lehman SM, Morales SP, Rosas FX, Gaidamaka A, Bilinsky IP, et al. P084 bacteriophage treatment of multidrug-resistant Pseudomonas aeruginosa pneumonia in a cystic fibrosis patient. J Cyst Fibros. 2018;17:S83. https://doi.org/10.1016/S1569-1993(18)30381-3
25. LaVergne S, Hamilton T, Biswas B, Kumaraswamy M, Schooley RT, Wooten D. Phage therapy for a multidrugresistant Acinetobacter baumannii craniectomy site infection. Open Forum Infect Dis. 2018;5(4):ofy064. https://doi.org/10.1093/ofid/ofy064
26. Greene J, Goldberg RB. Isolation and preliminary characterization of lytic and lysogenic phages with wide host range within the streptomycetes. J Gen Microbiol. 1985;131(9):2459–65. https://doi.org/10.1099/00221287-131-9-2459
27. Harshey RK. Phage Mu. In: Calendar R, ed. The bacteriophages. Boston: Springer; 1988.
28. Yarmolinsky MB, Sternberg N. Bacteriophage P. In: Calen dar R, ed. The bacteriophages. Boston: Springer;1988.
29. Jensen EC, Schrader HS, Rieland B, Thompson TL, Lee KW, Nickerson KW, Kokjohn TA. Prevalence of broad-host-range lytic bacteriophages of Sphaerotilus natans, Escherichia coli, and Pseudomonas aeruginosa. Appl Environ Microbiol. 1998;64(2):575–80. https://doi.org/10.1128/AEM.64.2.575-580.1998
30. Pantucek R, Rosypalova A, Doskar J, Kailerova J, Ruzicko va V, Borecka P, et al. The polyvalent staphylococcal phage phi 812: its host-range mutants and related phages. Virology. 1998;246(2):241–52. https://doi.org/10.1006/viro.1998.9203
31. Khan MA, Satoh H, Katayama H, Kurisu F, Mino T. Bacteriophages isolated from activated sludge processes and their polyvalency. Water Res. 2002;36(13):3364–70. https://doi.org/10.1016/s0043-1354(02)00029-5
32. Sullivan MB, Waterbury JB, Chisholm SW. Cyanophages infecting the oceanic cyanobacterium Prochlorococcus. Nature. 2003;424(6952):1047–51. https://doi.org/10.1038/nature01929
33. O’Flaherty S, Ross RP, Meaney W, Fitzgerald GF, Elbreki MF, Coffey A. Potential of the polyvalent anti-Staphylococcus bacteriophage K for control of antibiotic-resistant staphylococci from hospitals. Appl Environ Microbiol. 2005;71(4):1836–42. https://doi.org/10.1128/AEM.71.4.1836-1842.2005
34. El-Arabi TF, Griffiths MW, She YM, Villegas A, Lingohr EJ, Kropinski AM. Genome sequence and analysis of a broadhost range lytic bacteriophage that infects the Bacillus cereus group. Virol J. 2013;10:48. https://doi.org/10.1186/1743-422X-10-48
35. Mirzaei KM, Nilsson AS. Isolation of phages for phage therapy: a comparison of spot tests and efficiency of plating analyses for determination of host range and efficacy. PLoS One. 2015;10(3):e0118557. https://doi.org/10.1371/journal.pone.0118557
36. DeWyngaert MA, Hinkle DC. Bacterial mutants affecting phage T7 DNA replication produce RNA polymerase resistant to inhibition by the T7 gene 2 protein. J Biol Chem. 1979;254(22):11247–53. PMID: 387768
37. Qimron U, Marintcheva B, Tabor S, Richardson CC. Genomewide screens for Escherichia coli genes affecting growth of T7 bacteriophage. Proc Natl Acad Sci USA. 2006;103(50):19039–44. https://doi.org/10.1073/pnas.0609428103
38. James TD, Cashel M, Hinton DM. A mutation within the beta subunit of Escherichia coli RNA polymerase impairs transcription from bacteriophage T4 middle promoters. J Bacteriol. 2010;192(21):5580–7. https://doi.org/10.1128/JB.00338-10
39. Azam AH, Hoshiga F, Takeuchi I, Miyanaga K, Tanji Y. Analysis of phage resistance in Staphylococcus aureus SA003 reveals different binding mechanisms for the closely related Twortlike phages SA012 and SA039. Appl Microbiol Biotechnol. 2018;102(20):8963–77. https://doi.org/10.1007/s00253-018-9269-x
40. Merril CR, Biswas B, Carlton R, Jensen NC, Creed GJ, Zullo S, Adhya S. Long-circulating bacteriophage as antibacterial agents. Proc Natl Acad Sci USA. 1996;93(8):3188–92. https://doi.org/10.1073/pnas.93.8.3188
41. Sander M, Schmieger H. Method for host-independent detection of generalized transducing bacteriophages in natural habitats. Appl Environ Microbiol. 2001;67(4):1490–3. https://doi.org/10.1128/AEM.67.4.1490-1493.2001
42. Beumer A, Robinson JB. A broad-host-range, generalized transducing phage (SN-T) acquires 16S rRNA genes from different genera of bacteria. Appl Environ Microbiol. 2005;71(12):8301–4. https://doi.org/10.1128/AEM.71.12.8301-8304.2005
43. DelCasale A, Flanagan PV, Larkin MJ, Allen CC, Kulakov LA. Analysis of transduction in wastewater bacterial populations by targeting the phage-derived 16S rRNA gene sequences. FEMS Microbiol Ecol. 2011;76(1):100–8. https://doi.org/10.1111/j.1574-6941.2010.01034.x
44. Yen M, Camilli A. Mechanisms of the evolutionary arms race between Vibrio cholerae and Vibriophage clinical isolates. Int Microbiol. 2017;20(3):116–20. https://doi.org/10.2436/20.1501.01.292
45. Chan BK, Sistrom M, Wertz JE, Kortright KE, Narayan D, Turner PE. Phage selection restores antibiotic sensitivity in MDR Pseudomonas aeruginosa. Sci Rep. 2016;6:26717. https://doi.org/10.1038/srep26717
46. Henry M, Biswas B, Vincent L, Mokashi V, Schuch R, Bishop-Lilly KA, Sozhamannan S. Development of a high throughput assay for indirectly measuring phage growth using the OmniLog(TM) system. Bacteriophage. 2012;2(3):159–67. https://doi.org/10.4161/bact.21440
47. Estrella LA, Quinones J, Henry M, Hannah RM, Pope RK, Hamilton T, et al. Characterization of novel Staphylococcus aureus lytic phage and defining their combinatorial virulence using the OmniLog(R) system. Bacteriophage. 2016;6(3):e1219440. https://doi.org/10.1080/21597081.2016.1219440
48. Давыдов ДС, Парфенюк РЛ, Дурманова ЗВ, Меркулов ВА, Мовсесянц АА. Особенности государственной регистрации и обеспечения качества лекарственных препаратов бактериофагов в Российской Федерации. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(2):181–93. https://doi.org/10.30895/2221-996X-2023-431
Об авторах
Д. С. ДавыдовРоссия
Давыдов Дмитрий Сергеевич, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Р. Л. Парфенюк
Россия
Парфенюк Римма Леонтьевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
З. В. Дурманова
Россия
Дурманова Зоя Владимировна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Р. Е. Казаков
Россия
Казаков Руслан Евгеньевич, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
А. А. Мовсесянц
Россия
Мовсесянц Арташес Авакович, д-р мед. наук, проф.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Давыдов Д.С., Парфенюк Р.Л., Дурманова З.В., Казаков Р.Е., Мовсесянц А.А. Особенности регулирования обращения лекарственных препаратов бактериофагов: международный опыт и перспективы развития. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(3):322-334. https://doi.org/10.30895/2221-996X-2024-24-3-322-334
For citation:
Davydov D.S., Parfenyuk R.L., Durmanova Z.V., Kazakov R.E., Movsesyants A.A. Specific aspects of bacteriophage regulation: international practices and future developments. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(3):322-334. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-3-322-334


































