Перейти к:
Исследование защитной эффективности препарата КомбиМаб-2 против вируса иммунодефицита человека типа 1 на мышах, гуманизированных CD4+ Т-лимфоцитами
https://doi.org/10.30895/2221-996X-2024-24-3-312-321
Резюме
ВВЕДЕНИЕ. Несмотря на существующие подходы к терапии инфекции, вызываемой вирусом иммунодефицита человека (ВИЧ), полное излечение остается труднодостижимым из-за высокой изменчивости ВИЧ типа 1 (ВИЧ-1), что требует пожизненного приема антиретровирусных препаратов, обладающих серьезными побочными эффектами. Разработка генотерапевтических препаратов с использованием векторов на основе аденоассоциированных вирусов (adeno-associated virus, AAV), кодирующих нейтрализующие антитела широкого спектра действия (широко нейтрализующие антитела), является перспективным направлением для создания долгосрочной терапии в отношении большого количества вариантов вируса.
ЦЕЛЬ. Оценка защитной эффективности препарата КомбиМаб-2, представляющего собой комбинацию трех AAV-векторов (AAV9-VRC07-523, AAV9-10-1074 и AAV9-PGDM1400), кодирующих широко нейтрализующие антитела против ВИЧ-1, на модели гуманизированных мышей.
МАТЕРИАЛЫ И МЕТОДЫ. В исследовании использована животная модель ВИЧ-инфекции на основе иммунодефицитных мышей линии B-NDG, гуманизированных человеческими CD4+ Т-лимфоцитами в количестве 1,5×10⁷ клеток на мышь, полученными из лейкоконцентрата здорового донора. В эксперименте использовали две группы мышей. Контрольной группе животных (3 особи) вводили физиологический раствор, опытной группе (5 особей) — Комбимаб-2. Препарат в виде трех отдельных компонентов вводили в разные мышцы за 6 нед. до инфицирования животных вирусом. CCR5-тропный ВИЧ-1 получали путем трансфекции клеток HEK293FT плазмидой рNL4-3(AD8), кодирующей полноразмерный вирус. В течение 4 нед. после заражения проводили мониторинг вирусной нагрузки в плазме крови методом ПЦР с обратной транскрипцией и числа CD4+ Т-лимфоцитов методом проточной цитометрии в периферической крови животных.
РЕЗУЛЬТАТЫ. Установлено, что через 6 нед. после введения исследуемого препарата гуманизированным мышам уровень широко нейтрализующих антител в сыворотке крови животных варьировал от 0,17 до 4,0 мкг/мл. После заражения ВИЧ-1 в контрольной группе мышей уровень вирусной нагрузки составил 10⁵ копий/мл через 1 нед., далее наблюдалось увеличение показателя в течение последующих 3 нед. В группе животных, получавших препарат, инфекция развилась только у одной мыши, имевшей самый низкий титр антител. У остальных мышей вирусная нагрузка не детектировалась, что указывает на эффективность препарата при условии достижения концентрации широко нейтрализующих антител в сыворотке крови от 0,5 мкг/мл и выше.
ВЫВОДЫ. Препарат на основе трех AAV-векторов (AAV9-VRC07-523, AAV9-10-1074 и AAV9-PGDM1400) обладает защитной эффективностью в отношении ВИЧ-1 в исследовании на гуманизированных мышах. Представленные данные позволяют рассматривать препарат как перспективное противовирусное средство, что может послужить основой для дальнейшей фармацевтической разработки.
Ключевые слова
Для цитирования:
Леонтьев Д.С., Урусов Ф.А., Глазкова Д.В., Белугин Б.В., Орлова О.В., Минтаев Р.Р., Цыганова Г.М., Богословская Е.В., Шипулин Г.А. Исследование защитной эффективности препарата КомбиМаб-2 против вируса иммунодефицита человека типа 1 на мышах, гуманизированных CD4+ Т-лимфоцитами. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(3):312-321. https://doi.org/10.30895/2221-996X-2024-24-3-312-321
For citation:
Leontyev D.S., Urusov F.A., Glazkova D.V., Belugin B.V., Orlova O.V., Mintaev R.R., Tsyganova G.M., Bogoslovskaya E.V., Shipulin G.A. Study of the protective efficacy of CombiMab-2 against human immunodeficiency virus type 1 in mice humanised with CD4+ T-lymphocytes. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(3):312-321. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-3-312-321
ВВЕДЕНИЕ
Пандемия инфекции, вызываемой вирусом иммунодефицита человека (ВИЧ), остается глобальной проблемой здравоохранения: по всему миру ВИЧ инфицировано более 38 млн человек1. В Российской Федерации на 31.12.2022 более 1 млн человек имели подтвержденный диагноз ВИЧ-инфекции, что составляло около 0,8% от населения России2. Хотя антиретровирусная терапия способствует значительному повышению продолжительности жизни инфицированных людей, она не приводит к полному излечению и требует пожизненного приема препаратов [1]. Кроме того, быстрая изменчивость ВИЧ позволяет ему развивать лекарственную устойчивость. Для решения указанных проблем необходимо разрабатывать новые и эффективные методы лечения ВИЧ-инфекции [2][3].
Перспективными для разработки новых подходов терапии ВИЧ-инфекции являются нейтрализующие антитела широкого спектра действия (широко нейтрализующие антитела, broadly neutralising antibodies, bNAbs) [4]. Эти антитела обладают способностью распознавать и нейтрализовать широкий спектр штаммов ВИЧ-1 [5].
Результаты ряда клинических исследований показали, что применение широко нейтрализующих антител в виде белковых препаратов имеет терапевтический потенциал при лечении ВИЧ-инфекции, значительно снижая уровень вирусной нагрузки у пациентов [6][7]. Однако эффект носил временный характер, что обусловлено наличием двух ограничивающих факторов: развитием резистентности вируса и относительно коротким периодом полужизни антител в организме [6]. Проблема резистентности вируса может быть решена путем применения комбинаций из нескольких широко нейтрализующих антител. Комбинация из двух и более антител позволяет значительно снижать вирусную нагрузку и предотвращает появление резистентных штаммов [8][9].
Короткий период полужизни антител in vivo требует частых повторных введений для поддержания их терапевтической концентрации в плазме крови, что затрудняет проведение лечения и приводит к его удорожанию [10][11]. Для решения этой проблемы разрабатываются новые подходы, одним из которых является использование векторов на основе аденоассоциированных вирусов (adeno-associated virus, AAV) для доставки в клетки организма трансгенов, кодирующих широко нейтрализующие антитела [12][13]. Эта стратегия может обеспечить долгосрочную (не менее одного года) экспрессию антител в организме человека и в перспективе стать более эффективным подходом к лечению ВИЧ-инфекции [14].
Ранее авторами данной статьи был разработан экспериментальный генотерапевтический препарат КомбиМаб-2 на основе трех AAV-векторов 9 серотипа (AAV9): AAV9-VRC07-523, AAV9-10-1074, AAV9-PGDM1400, кодирующих три широко нейтрализующих антитела [15]. Введение такой комбинации рекомбинантных векторов мышам приводило к выработке и длительной циркуляции антител в крови животных. Образцы сыворотки крови, полученные от животных, обладали нейтрализующей активностью в отношении глобальной панели штаммов ВИЧ-1 [15].
Для исследования защитных свойств разработанного препарата в данной работе в качестве модели in vivo применялись мыши с врожденным иммунодефицитом линии B-NDG (NOD.CB17-PrkdcscidIL2rgtm1/Bcgen). Выбор модели обусловлен возможностью обеспечить длительную циркуляцию человеческих лимфоцитов в организме мышей, что создает условия для заражения животных ВИЧ-1 и оценки эффективности тестируемого препарата. В отличие от общепринятого метода гуманизации мышей фракцией мононуклеарных клеток (peripheral blood mononuclear cells, PBMC) [16], в данной работе животным вводили выделенные человеческие CD4+ T-лимфоциты. Такая модификация стандартного протокола гуманизации иммунодефицитных мышей основана на данных исследования [17], подтверждающих, что использование фракции CD4+ Т-лимфоцитов замедляет наступление реакции «трансплантат против хозяина», характерной для мышей, гуманизированных PBMC.
Цель работы — оценка защитной эффективности препарата КомбиМаб-2, представляющего собой комбинацию трех AAV-векторов (AAV9-VRC07-523, AAV9-10-1074 и AAV9-PGDM1400), кодирующих широко нейтрализующие антитела против ВИЧ-1, на модели гуманизированных мышей.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальные животные
Исследования на животных проводились в соответствии с Протоколом биоэтической комиссии ФГБУ «Центр стратегического планирования и управления медико-биологическими рисками здоровью» ФМБА России (Протокол № 2 от 15.02.2024). В работе были использованы самки и самцы иммунодефицитных мышей линии B-NDG (Biocytogen, Китай) весом 20–23 г. Животные содержались в индивидуально вентилируемых клетках ISOCage (Тecniplast, Италия) для обеспечения микробиологического барьера и поддержания SPF-статуса иммунодефицитных животных. Все манипуляции с ВИЧ-1 и инфицированными животными проводили с соблюдением правил работы с микроорганизмами II группы патогенности.
Наработка КомбиМаб-2
Наработку AAV-векторов проводили в культуре клеток HEK293FT (Invitrogen, США) путем трансфекции тремя плазмидами (в эквимолярном соотношении) — pAAV-Helper (Cell Biolabs, США), pAAV-RC-9 (Cell Biolabs, США) и векторной плазмидой, кодирующей одно из антител [15]. Клетки трансфицировали с помощью полиэтиленимин гидрохлорида PEI MAX 40000 (Polysciences, США) в среде DMEM (Thermo Fisher Scientific, США), содержащей 10% фетальной бычьей сыворотки (Gibco, США). На следующий день после трансфекции заменяли ростовую среду на бессывороточную OptiMEM (Gibco, США) и культивировали при 37 °C и 5% CO2. Через 72 ч после трансфекции клетки собирали, лизировали путем трехкратного замораживания-оттаивания и обрабатывали бензоназой (Merck Life Science, США). Лизат клеток центрифугировали при 2300 g в течение 5 мин, полученный супернатант фильтровали через PES-мембрану с размером пор 0,45 мкм (TPP, Швейцария). Очистку AAV-векторов проводили ультрацентрифугированием при 175000 g в течение 2 ч в градиенте плотности йодиксанола (Unique Pharmaceuticals Laboratories, Индия) с дальнейшим диализом и концентрированием с использованием фильтров Amicon Ultra 50 kDa (Merck Life Science, США). Полученные препараты AAV-векторов разделяли на аликвоты и хранили при минус 70 °С. Число копий векторных геномов (вг) в образцах AAV-векторов определяли, используя метод капельной цифровой ПЦР (droplet digital PCR) с праймерами GGAACCCCTAGTGATGGAGTT, CGGCCTCAGTGAGCGA и зондом FAM-CACTCCCTCTCTGCGCGCTCG-BHQ1 (синтезированы АО «ГенТерра», Россия), которые были комплементарны последовательностям коротких инвертированных повторов (inverted terminal repeat, ITR) AAV.
Проведение пассивной иммунизации с использованием КомбиМаб-2
Экспериментальных животных вне зависимости от пола разделяли на две группы: контрольная группа (n=3) и опытная группа (n=5). За 6 нед. до введения Т-лимфоцитов и заражения животным опытной группы вводили исследуемый препарат КомбиМаб-2. Каждый из трех AAV-векторов, входящих в состав препарата, вводили по отдельности в разные мышцы: 100 мкл AAV9-VRC07-523 — в левую бедренную мышцу; 100 мкл AAV9-10-1074 — в правую бедренную мышцу; по 50 мкл AAV9-PGDM1400 — в правую и левую трехглавые мышцы передних лап. Доза каждого AAV-вектора составила 4×1011 вг/мышь. Животным контрольной группы вводили 0,9% раствор NaCl в эквивалентном объеме.
Для подтверждения экспрессии широко нейтрализующих антител спустя 28 сут после введения препарата оценивали концентрацию антител в сыворотке животных с помощью коммерческого набора для определения общего количества IgG человека — Human IgG ELISA Antibody Pair Kit (StemCell, Канада) в соответствии с инструкцией производителя.
Гуманизация животных
Мононуклеарные клетки человека выделяли из лейкоконцентрата здорового донора, полученного из цельной крови в тот же день, когда производился забор крови. Выделение фракции мононуклеаров проводили с помощью центрифугирования в градиенте плотности фиколла (Р050Е, ПанЭко, Россия) в соответствии с рекомендациями производителя. Из полученных мононуклеаров крови выделяли фракцию CD4+ Т-лимфоцитов методом негативной магнитной сепарации с помощью набора CD4+ T Cell Isolation Kit, human (кат. № 130-096-533, Miltenyi Biotec, Германия), клетки после выделения замораживали и хранили в жидком азоте.
За 8 сут до введения животным клетки размораживали и культивировали в бессывороточной среде X-VIVO 15 (Lonza, Швейцария). На 2 сут после разморозки клетки активировали магнитными частицами CD3/CD28 Dynabeads Human T-Activator (Gibco, Thermo Fisher Scientific, США) и добавляли IL-2 до конечной концентрации 100 МЕ/мл (ООО «Биотех», Россия). На 4 сут магнитные частицы удаляли и далее каждые два дня клетки рассевали в среде X-VIVO 15, содержащей 100 МЕ/мл IL-2, до плотности 1 млн кл/мл. На 9 сут культивирования клетки осаждали центрифугированием при 300 g в течение 5 мин, ресуспендировали в фосфатно-солевом буфере (DPBS, Gibco, США) до плотности 7,5×107 кл/мл. Жизнеспособность клеток перед введением животным оценивали в камере Горяева, окрашивая клетки 0,1% раствором трипанового синего. В работе использовали одну партию клеток, полученных от одного донора, жизнеспособность которых составляла не менее 93%, содержание CD4+ Т-лимфоцитов — не менее 95%.
Трансплатацию CD4+ Т-лимфоцитов человека мышам (гуманизацию) проводили путем введения клеток в хвостовую вену в количестве 1,5×107 кл/мышь в объеме 200 мкл. Через 3 нед. для временного купирования реакции «трансплантат против хозяина» всем животным внутрибрюшинно вводили нормальный человеческий иммуноглобулин (АО «НПО «Микроген», Россия) в дозе 2 г/кг.
Наработка ВИЧ-1
Штамм ВИЧ-1 NL4-3(AD8), тропный к рецептору CCR5, получали в клетках HEK293FT путем трансфекции клеток плазмидой рNL4-3(AD8), кодирующей полноразмерный вирус, предоставленной по программе Национальных институтов здравоохранения США (National Institutes of Health AIDS Research and Reference Reagent Program). Для получения вируса клетки культивировали в флаконах площадью 75 см2 в ростовой среде DMEM (Thermo Fisher Scientific, США), содержащей 10% фетальной бычьей сыворотки в условиях, обеспечивающих формирование на следующий день 50% клеточного монослоя. На следующий день клетки трансфицировали с помощью реагента FuGENE (Promega, США) плазмидной ДНК pNL4-3(AD8) в дозе 13 мкг на один культуральный флакон. Через 16 ч после трансфекции проводили замену среды на бессывороточную среду OptiMEM (Thermo Fisher Scientific, США). На 3 сут после трансфекции собирали клеточный супернатант, который фильтровали с использованием 0,45 мкм фильтра (TPP, Швейцария), обрабатывали бензоназой при 37 °C в течение 1 ч и концентрировали в 10 раз с помощью центрифужных концентраторов (Amicon® Ultra-15, Merck Life Science, США) с размером пор 100 кДа. Вирусную суспензию разделяли на аликвоты по 200 мкл и хранили при температуре минус 70 °C. Концентрацию антигена p24 ВИЧ в вирусной суспензии определяли с помощью набора реагентов р24-антиген-ИФА-БЕСТ (Вектор-Бест, Россия) в соответствии с инструкцией производителя.
Заражение животных ВИЧ-1 и отбор образцов крови
Заражение животных проводили на следующий день после введения CD4+ Т-лимфоцитов человека. Животных из опытной и контрольной групп заражали штаммом ВИЧ-1 NL4-3(AD8) в дозе 500 нг p24/мышь путем внутрибрюшинной инъекции. Кровь для мониторинга вирусной нагрузки и количества T-клеток отбирали из бедренной вены животных, предварительно анестезированных изофлураном. Отбирали не менее 70 мкл крови с помощью капиллярных пробирок (Microvette 200, Sarstedt, Германия).
Оценка вирусной нагрузки в образцах плазмы крови мышей
Образцы крови центрифугировали при 1000 g в течение 10 мин и отделяли плазму. Клеточный осадок использовали для цитометрического анализа. Определение концентрации РНК ВИЧ-1 в плазме крови экспериментальных животных проводили методом ОТ-ПЦР с помощью набора реагентов «АмплиСенс® ВИЧ-Монитор-FRT» (ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора) в соответствии с инструкцией производителя.
Цитометрический анализ
Полученные после центрифугирования клетки крови ресуспендировали в фосфатно-солевом буфере в объеме удаленной плазмы и окрашивали с помощью флуоресцентно-меченных антител, специфичных к человеческим рецепторам: hCD45-FITC, hCD3-APC, hCD4-PE (BD Biosciences, США). Цитометрический анализ образцов клеток и определение абсолютного числа CD3+/CD4+ Т-лимфоцитов проводили с использованием проточного цитометра Bio-Rad ZE5 (Bio-Rad, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Дизайн эксперимента
Схема дизайна эксперимента по оценке протективных свойств препарата КомбиМаб-2 на гуманизированных мышах представлена на рис. 1.
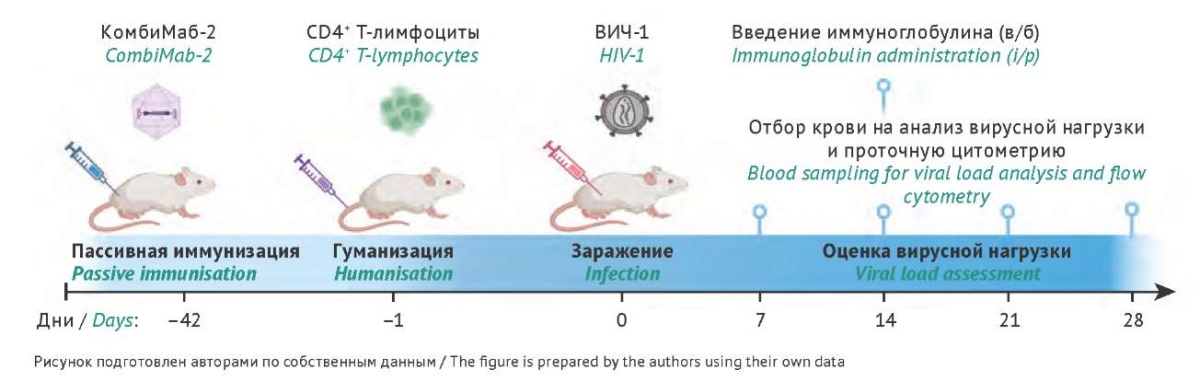
Рис. 1. Схема эксперимента.
Fig. 1. Experimental timeline.
Пассивная иммунизация
В соответствии с дизайном эксперимента (рис. 1) на 1 этапе животным вводили препарат КомбиМаб-2. Введение осуществлялось за 6 нед. до трансплатации CD4+ Т-лимфоцитов и заражения животных вирусом, так, чтобы к моменту инфицирования в крови мышей была достаточная для нейтрализации вируса концентрация антител. Схема эксперимента обусловлена временны́м ограничением периода его проведения (не более 4–5 нед.) из-за возможности развития у мышей реакции «трансплантат против хозяина». Через 4 нед. после введения препарата был достигнут детектируемый уровень широко нейтрализующих антител в сыворотке крови мышей — диапазон от 0,17 до 4,0 мкг/мл (табл. 1).
Таблица 1. Концентрация широко нейтрализующих антител и вирусной РНК в плазме крови мышей
Table 1. Plasma levels of broadly neutralising antibodies and viral RNA in mice
Группа Group | Номер мыши в группе Mouse No. | Концентрация IgG, мкг/мл IgG concentration, μg/mL | Вирусная нагрузка, копии/мл Viral load, copies/mL | |||
1 нед. Week 2 | 2 нед. Week 2 | 3 нед. Week 3 | 4 нед. Week 4 | |||
Опытная группа — КомбиМаб-2 CombiMab-2 group | 1 | 4,00 | 3,2×103 | 0 | 0 | 0 |
2 | 0,55 | 0 | 0 | * | * | |
6 | 0,50 | 0 | 0 | 0 | 2,9×104 | |
7 | 0,17 | 0 | 4,8×103 | 2,6×106 | * | |
8 | 1,80 | 0 | 0 | 0 | * | |
Контрольная группа Control group | 3 | – | 1,4×106 | 1,5×106 | 1,8×107 | 8,0×106 |
4 | – | 2,5×105 | 1,8×106 | 1,8×107 | 8,2×105 | |
5 | – | 1,8×105 | 1,9×106 | * | * | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. * — отсутствие данных вследствие гибели животного.
Note. * missing data due to the death of the animal.
Результаты цитометрического анализа лимфоцитов периферической крови
Через 6 нед. после введения исследуемого препарата мышам опытной и контрольной групп проводили трансплантацию CD4+ Т-лимфоцитов человека, на следующий день всех животных инфицировали ВИЧ-1. Спустя 1 нед. после заражения и далее еженедельно проводили цитометрическое исследование образцов периферической крови. На рисунке 2 показана стратегия гейтирования (выбора исследуемой популяции клеток) при проведении цитометрического анализа. Показано наличие у всех гуманизированных мышей CD4+ Т-лимфоцитов человека на протяжении всего срока наблюдения (табл. 2), что обеспечивает физиологические условия для заражения и протекания инфекции [16]. К концу срока наблюдения в обеих группах наблюдалось снижение числа CD4+ Т-лимфоцитов человека, что, видимо, связано с ограниченным периодом полужизни данных клеток после их активации и пролиферации в культуре.
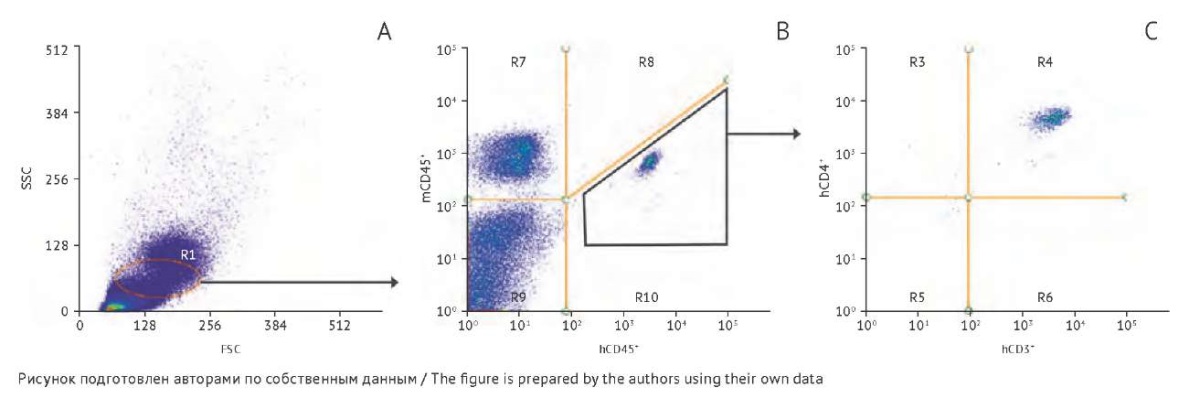
Рис. 2. Цитометрический анализ клеток периферической крови гуманизированной мыши через 1 нед. после трансплантации CD4+ Т-лимфоцитов человека. Стратегия гейтирования (выбора исследуемой популяции клеток) включала: А — выделение популяции (гейта) лимфоцитов по боковому и прямому светорассеиванию (side scattering/forward scattering, SSC/FSC); В — отделение популяции CD45+ клеток человека (hCD45+, квадрант R10) от популяции CD45+ мыши (mCD45+); С — выделение популяции CD3+/CD4+ Т-лимфоцитов человека (hCD3+/hCD4+, квадрант R4).
Fig. 2. Flow cytometry of peripheral blood cells obtained from a humanised mouse one week after transplantation of human CD4+ T-lymphocytes. The gating strategy included the following: A, selection of the lymphocyte population (gate) based on side and forward light scattering (SSC/FSC); separation of the human CD45+ cell population (hCD45+, quadrant R10) from the mouse CD45+ population (mCD45+); C, identification of the human CD3+/CD4+ T-lymphocyte population (hCD3+/hCD4+, quadrant R4).
Таблица 2. Количество CD4+ Т-лимфоцитов человека в образцах крови гуманизированных мышей (объем пробы — 40 мкл)
Table 2. Number of human CD4+ lymphocytes in blood samples (40 μL) from humanised mice
Группа Group | Номер мыши в группе Mouse No. | Количество СD4+ Т-лимфоцитов человека Number of human CD4+ cells | |||
1 нед. Week 2 | 2 нед. Week 2 | 3 нед. Week 3 | 4 нед. Week 4 | ||
Опытная группа — КомбиМаб-2 CombiMab-2 group | 1 | 2240 | # | 397 | 43 |
2 | 491 | 242 | * | * | |
6 | 64 | 299 | 34 | 9 | |
7 | 1738 | 1747 | 950 | * | |
8 | 1402 | 2104 | 2486 | * | |
Контрольная группа Control group | 3 | 3261 | 1516 | 215 | 112 |
4 | 1690 | 474 | 189 | 49 | |
5 | 401 | 2887 | * | * | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. * — отсутствие данных вследствие гибели животного, # — отсутствие данных по технической причине.
Note. * missing data due to the death of the animal; # unavailable data due to technical reasons.
Мониторинг вирусной нагрузки
У всех мышей контрольной группы после заражения ВИЧ-1, несмотря на неоднородное содержание человеческих CD4+ Т-лимфоцитов, развивалась инфекция. Вирусная нагрузка составила >105 копий/мл уже через 1 нед. после заражения и увеличивалась на протяжении 3 нед. (табл. 1). Уменьшение вирусной нагрузки в контрольной группе наблюдалось на 4 нед. у двух выживших мышей (№ 3 и 4), что совпало со снижением числа лимфоцитов. Применение мышей линии B-NDG, гуманизированных CD4+ Т-лимфоцитами человека, в качестве модельных животных позволяет адекватно воспроизводить ВИЧ-инфекцию.
В опытной группе только у одной мыши (№ 7) было отмечено развитие инфекции, которое началось с задержкой на 1 нед. по сравнению с контрольной группой. Следует отметить, что в сыворотке крови этого животного наблюдалась самая низкая концентрация человеческих антител до инфицирования — 0,17 мкг/мл (табл. 1). У остальных четырех мышей из опытной группы устойчивого развития инфекции не наблюдалось: у двух мышей (№ 2 и 8) вирусная нагрузка не детектировалась ни в одной временной точке; у одной мыши (№ 1) низкое число вирусных копий выявлено спустя 1 нед. после инфицирования, однако все дальнейшие пробы были отрицательные; у одной мыши (№ 6) невысокая вирусная нагрузка (2,9×104 копий/мл) обнаружилась только в последнюю неделю эксперимента. Таким образом, можно сделать вывод, что действие препарата КомбиМаб-2 приводит к блокированию развития ВИЧ-инфекции у гуманизированных мышей при достижении в крови концентрации антител 0,5 мкг/мл.
В настоящее время минимальный уровень антител, необходимый для эффективной нейтрализации ВИЧ-1, пока не определен. Согласно данным экспериментальных исследований in vitro разные комбинации антител могут быть эффективны в различных концентрациях, в том числе при <1 мкг/мл [18]. Диапазон эффективных концентраций антител в исследованиях in vivo также отличается от данных, полученных in vitro, что показано, например, в работе Y.U. van der Velden с соавт. [19]. В других исследованиях in vivo было продемонстрировано, что некоторые широко нейтрализующие антитела могут подавлять ВИЧ-1 при концентрации от 8,3 мкг/мл и выше [20][21]. В нашей работе при использовании комбинированного препарата КомбиМаб-2 эффективное подавление вирусной нагрузки в организме животных было достигнуто при более низких значениях антител — 0,5–4,0 мкг/мл. Однако следует отметить, что показатель снижения концентрации вирусной РНК зависит от многих факторов: специфической активности исследуемых антител, штамма вируса, применяемого для заражения, метода измерения IgG в крови и др. В связи с этим прямое сравнение результатов, полученных в разных экспериментальных условиях, не всегда оправдано.
При использовании AAV-векторов, кодирующих нейтрализующие антитела, обеспечение эффективной экспрессии антител в организме зависит от серотипа применяемого AAV-вектора. AAV-векторы 1 и 8 серотипов, которые ранее использовались для экспрессии широко нейтрализующих антител против ВИЧ-1 в клинических исследованиях, обладали ограниченной эффективностью. Так, в клиническом исследовании вектора на основе AAV8 для экспрессии антитела VRC07 показано, что иммунный ответ на вектор и его продукты существенно снижал эффективность препарата [22]. При использовании AAV1 были выявлены проблемы с низкой или недетектируемой экспрессией антител [23]. В нашей работе при разработке препарата КомбиМаб-2 применялся вектор на основе AAV9, поскольку согласно ранее полученным данным такой вектор обеспечивает более высокую концентрацию антител в крови у мышей, чем AAV8 [15].
Таким образом, согласно представленным данным разработанный генотерапевтический препарат КомбиМаб-2, состоящий из комбинации AAV-векторов 9 серотипа, обеспечивает экспрессию трех широко нейтрализующих антител (VRC07-523, 10-1074 и PGDM1400) in vivo, что позволяет эффективно подавлять репликацию ВИЧ-1 у гуманизированных мышей.
ВЫВОДЫ
- Гуманизация иммунодефицитных мышей линии B-NDG зрелыми CD4+Т-лимфоцитами человека обеспечивает физиологические условия для успешного заражения животных, и такой подход может быть использован для моделирования ВИЧ-инфекции.
- Пассивная иммунизация мышей препаратом КомбиМаб-2, состоящим из комбинации AAV9-векторов, кодирующих три широко нейтрализующих антитела против ВИЧ-1 (VRC07-523, 10-1074, PGDM1400), в дозе 4×1011вг/мышь (для каждого AAV-вектора) приводит к эффективной экспрессии антител с достижением уровня концентрации в сыворотке крови мышей в диапазоне от 0,17 до 4 мкг/мл.
- При использовании препарата КомбиМаб-2 у 4 из 5 животных опытной группы вирусная нагрузка в течение трех недель после заражения ВИЧ не детектировалась либо была существенно ниже, чем у животных контрольной группы, что свидетельствует о защитной эффективности разработанного препарата в отношении ВИЧ-1.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Д.С. Леонтьев — выполнение экспериментальных работ, написание текста рукописи; Ф.А. Урусов — работа с источниками литературы, статистическая обработка результатов; Д.В. Глазкова — редактирование текста рукописи, формулировка выводов; Б.В. Белугин — наработка препарата, редактирование текста рукописи (раздел «Материалы и методы»); О.В. Орлова — наработка и титрование вируса; Р.Р. Минтаев — проведение работ на экспериментальных животных; Г.М. Цыганова — проведение ПЦР-анализа образцов для определения вирусной нагрузки; Е.В. Богословская — концепция работы, редактирование текста рукописи; Г.А. Шипулин — дизайн исследования, утверждение окончательной версии статьи для публикации.
Соответствие принципам этики. Исследования на животных проводились в соответствии с Протоколом биоэтической комиссии ФГБУ «Центр стратегического планирования и управления медико-биологическими рисками здоровью» ФМБА России (Протокол № 2 от 15.02.2024).
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. D.S. Leontiev conducted experiments and drafted the manuscript. F.A. Urusov worked with literature sources and performed statistical processing of the results. D.V. Glazkova edited the manuscript and formulated the conclusions. B.V. Belugin produced the medicinal product and edited the manuscript (Materials and Methods section). O.V. Orlova produced and titrated virus samples. R.R. Mintaev handled experimental animals. G.M. Tsyganova conducted PCR analysis to determine the viral load. E.V. Bogoslovskaya conceptualised the study and edited the manuscript. G.A. Shipulin designed the study and approved the final version of the manuscript for publication.
Ethics approval. The animal experiments were approved by the Bioethics Committee at the Centre for Strategic Planning and Management of Biomedical Health Risks of the Federal Medical and Biological Agency of Russia (Meeting Minutes No. 2 dated 15 February 2024).
1. Путь к победе над СПИДом: Доклад ЮНЭЙДС о глобальной эпидемии СПИДа 2023. Женева: Объединенная программа Организации Объединенных Наций по ВИЧ/СПИДу (ЮНЭЙДС); 2023.
2. ВИЧ-инфекция в Российской Федерации на 31 декабря 2022 г. Справки по ВИЧ-инфекции в России. Федеральный научно-методический центр по профилактике и борьбе со СПИДом. https://www.hivrussia.info/wp-content/uploads/2023/09/Spravka-VICH-v-Rossii-na-31.12.2022.pdf
Список литературы
1. Kamal S, Bugnon O, Cavassini M, Schneider MP. HIV-infected patients’ beliefs about their chronic co-treatments in comparison with their combined antiretroviral therapy. HIV Med. 2018;19(1):49–58. https://doi.org/10.1111/hiv.12542
2. Wu HF, Morris-Natschke SL, Xu XD, Yang MH, Cheng YY, Yu SS, Lee KH, et al. Recent advances in natural anti-HIV triterpenoids and analogs. Med Res Rev. 2020;40(6):2339–85. https://doi.org/10.1002/med.21708
3. Chirenje ZM, Marrazzo J, Parikh UM. Antiretroviral-based HIV prevention strategies for women. Expert Rev Anti Infect Ther. 2010;8(10):1177–86. https://doi.org/10.1586/eri.10.79
4. Gruell H, Klein F. Antibody-mediated prevention and treatment of HIV-1 infection. Retrovirology. 2018;15(1):73. https://doi.org/10.1186/s12977-018-0455-9
5. Walker L, Huber M, Doores K, Falkowska E, Pejchal R, Julien J, et al. Broad neutralization coverage of HIV by multiple highly potent antibodies. Nature. 2011;477(7365):466–70. https://doi.org/10.1038/nature10373
6. Lynch RM, Boritz E, Coates EE, DeZure A, Madden P, Costner P, et al. Virologic effects of broadly neutralizing antibody VRC01 administration during chronic HIV-1 infection. Sci Transl Med. 2015;7(319):319ra206. https://doi.org/10.1126/scitranslmed.aad5752
7. Caskey M, Klein F, Lorenzi JC, Seaman MS, West AP Jr, Buckley N, et al. Viraemia suppressed in HIV-1-infected humans by broadly neutralizing antibody 3BNC117. Nature. 2015;522(7557):487–91. https://doi.org/10.1038/nature14411
8. Bar-On Y, Gruell H, Schoofs T, Pai JA, Nogueira L, Butler AL, et al. Safety and anti-viral activity of combination HIV-1 broadly neutralizing antibodies in viremic individuals. Nat Med. 2018;24(11):1701–7. https://doi.org/10.1038/s41591-018-0186-4
9. LaMont C, Otwinowski J, Vanshylla K, Gruell H, Klein F, Nourmohammad A. Design of an optimal combination therapy with broadly neutralizing antibodies to suppress HIV-1. Elife. 2022;11:e76004. https://doi.org/10.7554/eLife.76004
10. Waters L, Miguel-Buckley R, Poulin S, Arribas J. Broadly neutralizing antibodies for HIV treatment: broad in theory, narrow in reality. Clin Infect Dis. 2023;76(6):1136–41. https://doi.org/10.1093/cid/ciac835
11. Choudhry V, Zhang M, Dimitrova D, Prabakaran P, Dimitrov A, Fouts T, et al. Antibody-based inhibitors of HIV infection. Expert Opin Biol Ther. 2006;6(5):523–31. https://doi.org/10.1517/14712598.6.5.523
12. Wang D, Tai P, Gao G. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 2019;18(5):358–78. https://doi.org/10.1038/s41573-019-0012-9
13. Bennett MS, Akkina R. Gene therapy strategies for HIV/AIDS: preclinical modeling in humanized mice. Viruses. 2013;5(12):3119–41. https://doi.org/10.3390/v5123119
14. Van den Berg FT, Makoah NA, Ali SA, Scott TA, Mapengo RE, Mutsvunguma LZ, et al. AAV-mediated expression of broadly neutralizing and vaccine-like antibodies targeting the HIV-1 envelope V2 region. Mol Ther Methods Clin Dev. 2019;14:100–12. https://doi.org/10.1016/j.omtm.2019.06.002
15. Shipulin GA, Glazkova DV, Urusov FA, Belugin BV, Dontsova V, Panova AV, et al. Triple combinations of AAV9-vectors encoding Anti-HIV bNAbs provide longterm in vivo expression of human IgG effectively neutralizing pseudoviruses from HIV-1 global panel. Viruses. 2024;16(8):1296. https://doi.org/10.3390/v16081296
16. Kim KC, Choi BS, Kim KC, Park KH, Lee HJ, Cho YK, et al. A simple mouse model for the study of human immunodeficiency virus. AIDS Res Hum Retroviruses. 2016;32(2):194–202. https://doi.org/10.1089/AID.2015.0211
17. Søndergaard H, Kvist PH, Haase C. Human T cells de pend on functional calcineurin, tumour necrosis factor-α and CD80/CD86 for expansion and activation in mice. Clin Exp Immunol. 2013;172(2):300–10. https://doi.org/10.1111/cei.12051
18. Kochina E, Urusov F, Kruglov A, Glazkova D, Shipulin G, Bogoslovskaya E. Double and triple combinations of broadly neutralizing antibodies provide efficient neutralization of all HIV-1 strains from the global panel. Viruses. 2022;14(9):1910. https://doi.org/10.3390/v14091910
19. van der Velden YU, Villaudy J, Siteur-van Rijnstra E, van der Linden CA, Frankin E, Weijer K, et al. Short communication: protective efficacy of broadly neutralizing antibody PGDM1400 against HIV-1 challenge in humanized mice. AIDS Res Hum Retroviruses. 2018;34(9):790–3. https://doi.org/10.1089/AID.2018.0114
20. Horwitz JA, Halper-Stromberg A, Mouquet H, Gitlin AD, Tretiakova A, Eisenreich TR, et al. HIV-1 suppression and durable control by combining single broadly neutralizing antibodies and antiretroviral drugs in humanized mice. Proc Natl Acad Sci USA. 2013;110(41):16538–43. https://doi.org/10.1073/pnas.1315295110
21. Balazs AB, Chen J, Hong CM, Rao DS, Yang L, Baltimore D. Antibody-based protection against HIV infection by vectored immunoprophylaxis. Nature. 2011;481(7379):81–4. https://doi.org/10.1038/nature10660
22. Casazza JP, Cale EM, Narpala S, Yamshchikov GV, Coates EE, Hendel CS, et al. Safety and tolerability of AAV8 delivery of a broadly neutralizing antibody in adults living with HIV: a phase 1, dose-escalation trial. Nat Med. 2022;28(5):1022–30. https://doi.org/10.1038/s41591-022-01762-x
23. Lin A, Balazs AB. Adeno-associated virus gene delivery of broadly neutralizing antibodies as prevention and therapy against HIV-1. Retrovirology. 2018;15(1):66. https://doi.org/10.1186/s12977-018-0449-7
Об авторах
Д. С. ЛеонтьевРоссия
Леонтьев Данила Сергеевич, канд. биол. наук
Погодинская ул., д. 10, стр. 1, Москва, 119121
Ф. А. Урусов
Россия
Урусов Феликс Анатольевич, канд. биол. наук
Погодинская ул., д. 10, стр. 1, Москва, 119121
Д. В. Глазкова
Россия
Глазкова Дина Викторовна, канд. биол. наук
Погодинская ул., д. 10, стр. 1, Москва, 119121
Б. В. Белугин
Россия
Белугин Борис Владимирович, канд. биол. наук
Погодинская ул., д. 10, стр. 1, Москва, 119121
О. В. Орлова
Россия
Орлова Ольга Владимировна, канд. биол. наук
Погодинская ул., д. 10, стр. 1, Москва, 119121
Р. Р. Минтаев
Россия
Минтаев Рамиль Рафаилович
Погодинская ул., д. 10, стр. 1, Москва, 119121
Г. М. Цыганова
Россия
Цыганова Галина Михайловна
Погодинская ул., д. 10, стр. 1, Москва, 119121
Е. В. Богословская
Россия
Богословская Елена Владимировна, д-р мед. наук
Погодинская ул., д. 10, стр. 1, Москва, 119121
Г. А. Шипулин
Россия
Шипулин Герман Александрович, канд. мед. наук
Погодинская ул., д. 10, стр. 1, Москва, 119121
Дополнительные файлы
Рецензия
Для цитирования:
Леонтьев Д.С., Урусов Ф.А., Глазкова Д.В., Белугин Б.В., Орлова О.В., Минтаев Р.Р., Цыганова Г.М., Богословская Е.В., Шипулин Г.А. Исследование защитной эффективности препарата КомбиМаб-2 против вируса иммунодефицита человека типа 1 на мышах, гуманизированных CD4+ Т-лимфоцитами. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(3):312-321. https://doi.org/10.30895/2221-996X-2024-24-3-312-321
For citation:
Leontyev D.S., Urusov F.A., Glazkova D.V., Belugin B.V., Orlova O.V., Mintaev R.R., Tsyganova G.M., Bogoslovskaya E.V., Shipulin G.A. Study of the protective efficacy of CombiMab-2 against human immunodeficiency virus type 1 in mice humanised with CD4+ T-lymphocytes. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(3):312-321. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-3-312-321
JATS XML



































