Перейти к:
Определение специфической активности ротавирусной вакцины на основе вирусоподобных частиц с использованием иммуноферментного анализа: разработка и валидация методики
https://doi.org/10.30895/2221-996X-2024-24-4-389-402
Резюме
ВВЕДЕНИЕ. Создание вакцин на основе вирусоподобных частиц (virus-like particles, VLP), состоящих из рекомбинантных белков ротавируса типа А человека, имитирующих структуру нативного вируса, но не обладающих инфекционной активностью, является перспективным направлением для вакцинопрофилактики. Для оценки специфической активности таких вакцин оптимальным представляется применение метода иммуноферментного анализа (ИФА) для определения титра специфических IgG-антител к белкам ротавируса А в образцах сыворотки крови иммунизированных животных.
ЦЕЛЬ. Разработка и валидация методики оценки специфической активности ротавирусной вакцины на основе VLP с использованием метода ИФА для определения уровня антител к белкам VP2/6 ротавируса А в образцах сыворотки крови иммунизированных морских свинок.
МАТЕРИАЛЫ И МЕТОДЫ. Оценку специфической активности ротавирусной вакцины на основе VLP проводили in vivo с использованием трех видов экспериментальных животных: мышей линии BALB/c, морских свинок породы агути и новорожденных карликовых свиней. Вакцину в дозе 30 мкг вводили животным трехкратно внутримышечно. Оценивали уровни специфических иммуноглобулинов класса G (IgG) к белкам VP2/6 ротавируса А и вируснейтрализующих антител (ВНА) в образцах сыворотки крови животных методом непрямого ИФА и в реакции нейтрализации соответственно. Определяли среднее геометрическое значение титров (СГТ) антител. Валидацию методики оценки специфической активности проводили на двух сериях вакцины с использованием стандартных методов статистического анализа.
РЕЗУЛЬТАТЫ. Проведено сравнение уровней специфических IgG-антител к белкам VP2/6 и ВНА к ротавирусу типа A через 14 сут после первой, второй и третьей иммунизаций. Значительное увеличение титра антител и статистически значимые различия (p<0,05) между группами наблюдались уже после второй иммунизации. Двукратная иммунизация вакциной приводила к образованию IgG-антител и ВНА у новорожденных карликовых свиней (СГТ антител — 200,0 и 108,9 соответственно) и морских свинок (СГТ антител — 12800 и 2600 соответственно). У иммунизированных мышей наблюдался значительный рост уровня специфических IgG-антител (СГТ — 572440). В качестве релевантной модели для валидации методики ИФА для определения специфической активности были выбраны морские свинки при использовании двукратной схемы иммунизации. По результатам валидационных испытаний двух серий вакцины установлено, что метод ИФА удовлетворял критериям приемлемости по характеристикам: специфичность, повторяемость (коэффициент вариации не более 15% — для 1 и 2 серий вакцины 12,4 и 7,7%) и промежуточная прецизионность (коэффициент вариации не более 15% — для 1 и 2 серий вакцины 6,9 и 10,2%).
ВЫВОДЫ. Разработана и валидирована методика оценки специфической активности ротавирусной вакцины на основе VLP с использованием ИФА. Метод ИФА может быть использован для контроля показателя качества «Специфическая активность» ротавирусной вакцины на основе VLP.
Ключевые слова
Для цитирования:
Филатов И.Е., Силаенкова М.М., Цибезов В.В., Баландина М.В., Норкина С.Н., Латышев О.Е., Елисеева О.В., Черепушкин С.А., Гребенникова Т.В. Определение специфической активности ротавирусной вакцины на основе вирусоподобных частиц с использованием иммуноферментного анализа: разработка и валидация методики. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(4):389-402. https://doi.org/10.30895/2221-996X-2024-24-4-389-402
For citation:
Filatov I.E., Silaenkova M.M., Tsibezov V.V., Balandina M.V., Norkina S.N., Latyshev O.E., Eliseeva O.V., Cherepushkin S.A., Grebennikova T.V. Enzyme-linked immunosorbent assay to determine the potency of a rotavirus vaccine based on virus-like particles: analytical procedure development and validation. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(4):389-402. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-4-389-402
ВВЕДЕНИЕ
Ротавирусная инфекция (РВИ) человека представляет собой распространенное заболевание, вызванное ротавирусами типов A, B и С [1]. Наиболее частой причиной диареи у детей первых лет жизни являются ротавирусы типа А. Ежегодно в мире регистрируется около 1,8 млн случаев госпитализации детей с РВИ [2], из которых почти 130 тыс. заканчиваются летальным исходом [3]. На территории Российской Федерации в 2022 г. 49% случаев острых кишечных инфекций пришлось на РВИ. На 100 тыс. населения заболеваемость составила около 62 человек. Наиболее подверженными заболеванию оказались дети в возрасте до двух лет1.
В настоящее время единственным эффективным методом борьбы с заболеваемостью РВИ является вакцинопрофилактика. На территории Российской Федерации одобрены две вакцины для профилактики ротавирусной инфекции, пентавалентные, живые. Ротавирусные вакцины российского производства отсутствуют. Следует отметить, что использование живых ротавирусных вакцин первого поколения может быть ограничено, поскольку при широком охвате вакцинацией выявлены случаи таких нежелательных явлений, как инвагинация кишечника [4]. Перспективным направлением разработки вакцин представляется создание препарата на основе вирусоподобных частиц (virus-like particles, VLP). VLP, сформированные рекомбинантными белками, имитируют структуру нативного ротавируса и обладают высокой иммуногенностью. Небольшой размер (60–80 нм) позволяет им проникать в лимфу через поры стенок лимфатических сосудов и далее во вторичные лимфоидные органы с последующей активацией Т- и В-клеток [5][6]. VLP могут содержать поверхностные эпитопы различных генотипов вируса, что способствует выработке антител широкого спектра действия и формированию устойчивого гуморального или клеточного иммунного ответа в организме хозяина. Вакцины на основе VLP стимулируют В- и Т-лимфоциты по механизму, похожему на действие вируса, попавшего в организм хозяина [7][8]. VLP свободны от инфекционной вирусной РНК и не могут реплицироваться в клетках, что имеет важное значение, учитывая риск возникновения вирулентных ревертантов в случае применения живых аттенуированных вакцин [9]. Кроме того, защитный эффект VLP наблюдается при более низких дозах, что позволяет значительно снизить затраты на производство вакцины [8].
Согласно регуляторным требованиям к иммунобиологическим лекарственным препаратам, в том числе вакцинам, их качество должно соответствовать комплексу показателей на всех этапах производства препарата2. Одним из основных показателей качества является специфическая активность [10]. Для оценки этого показателя используют в том числе методы in vivo, основанные на определении иммунологического ответа у экспериментальных животных, привитых исследуемыми препаратами. В качестве модельных используют виды животных, максимально восприимчивых к изучаемому вирусу, у которых патогенез инфекционного процесса наиболее сходен с человеком3. Выбор для оценки иммуногенности VP2/6 был обоснован тем, что белок VP6 является основным высококонсервативным группоспецифическим белком вириона, а использование в качестве антигена в ИФА смеси белков VP2 и VP6 увеличивает чувствительность тест-системы на 15–30% [11].
Одной из наиболее релевантных моделей являются новорожденные поросята карликовых свиней, использование которых показало эффективность при оценке иммуногенности и протективной активности ротавирусных вакцин, что обусловлено значительным сходством в физиологическом развитии, анатомических аспектах и механизмах формирования системного и местного иммунитета младенцев и новорожденных поросят [12]. Однако их использование в качестве модели для контроля специфической активности вакцин при их серийном производстве является дорогостоящим и трудоемким процессом. В связи с этим представляется актуальной разработка метода определения данного показателя с использованием доступных видов лабораторных животных, в частности морских свинок.
Цель работы — разработка и валидация методики оценки специфической активности ротавирусной вакцины на основе VLP с использованием метода ИФА для определения уровня антител к белкам VP2/6 ротавируса А в образцах сыворотки крови иммунизированных морских свинок.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
В работе использовали разработанную в ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России (ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России) кандидатную вакцину против ротавируса человека типа А на основе вирусоподобных частиц, включающих рекомбинантные белки VP2, VP4, VP6, VP7 генотипов G1, G2, G4, G9, P4, P8, синтезированные в бакуловирусной системе экспрессии, с адъювантом на основе сквалена [11]. Были использованы две серии вакцины. Препараты представляли собой эмульсию для внутримышечного введения с содержанием антигена 30 мкг/доза, объем дозы 0,5 мл. В качестве контроля применяли натрия хлорид-СОЛОфарм, раствор для инфузий 0,9% (ООО «Гротекс», Россия).
Экспериментальные животные
В исследовании использовали мышей линии BALB/с (самки массой 14–16 г); морских свинок породы агути (самки массой 300–350 г). Животные получены из питомника ФГБУН «Научный центр биомедицинских технологий» ФМБА России, филиал «Столбовая». В работе использовали новорожденных поросят карликовых свиней (АО «НПО «ДОМ ФАРМАЦИИ», Россия) от свиноматок, не имеющих специфических антител к ротавирусу А человека. Возраст поросят на момент первой иммунизации составлял 4–5 сут. В течение периода исследования животные содержались в стандартных условиях вивария со свободным доступом к пище и воде.
Протокол исследования с использованием экспериментальных животных был одобрен биоэтической комиссией АО «НПО «ДОМ ФАРМАЦИИ» (№ БЭК 1.42/22 от 21.09.2022) и локальным комитетом по биомедицинской этике ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (№ 05/2022 от 06.10.2022). Эксперименты с животными, в том числе процедуру эвтаназии, проводили в соответствии с требованиями Директивы 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях4, а также в соответствии с ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики».
Методы
Иммунизация. Животных делили на опытные и контрольные группы по 5 особей в каждой. Мышам и морским свинкам в опытных группах вакцину в дозе 30 мкг вводили трехкратно внутримышечно с интервалом 10–14 сут, новорожденным карликовым свиньям — с интервалом 9–10 сут. Животным контрольных групп вводили 0,9% раствор натрия хлорида аналогичным способом. Отбор крови проводили через 10–14 сут после каждой иммунизации в сухие чистые пробирки без антикоагулянта. Пробирки с кровью выдерживали в термостате при 37 °С в течение 30 мин, отделяли образовавшийся сгусток крови, центрифугировали при 1100 об/мин в течение 10 мин (5430 G, Eppendorf, США) и аккуратно отбирали надосадочную жидкость в чистые пробирки. Гемолизированные образцы исключали из исследования.
Иммуноферментный анализ. Для определения титра специфических иммуноглобулинов IgG к белкам VP2/6 в сыворотке крови иммунизированных животных использовали метод непрямого иммуноферментного анализа (ИФА). В лунки иммунологического 96-луночного планшета (Greiner, Германия) вносили 0,1 мл очищенных белков VP2/6 (5 мкг/мл) в 0,1 М карбонатно-бикарбонатном буфере, рН 9,5. Планшет инкубировали 18 ч при 4 °C, после чего удаляли избыток антигена четырехкратной отмывкой фосфатно-солевым буфером, содержащим 0,1% Твин-20, ФСБТ (pH 7,4). Блокирование свободных участков связывания проводили 1% желатином (GERBU Biotechnik, Германия) в ФСБТ в течение 1 ч при 37 °C, далее удаляли раствор и вносили в лунки по 0,1 мл исследуемых сывороток в различных разведениях в ФСБТ с содержанием 0,5% бычьего сывороточного альбумина (Sigma, США), ФСБТ-БСА. Планшет инкубировали 1 ч при 37 °C, промывали ФСБТ и добавляли 0,1 мл меченых пероксидазой антител к IgG мыши, морской свинки или свиньи (Sigma, США) в ФСБТ-БСА. Через 1 ч инкубации при 37 °C планшет отмывали ФСБТ и вносили в лунки 0,1 мл субстратного раствора 3,3’,5,5’-тетраметилбензидина (ООО «Хема», Россия), далее проводили инкубацию 15 мин при комнатной температуре и останавливали реакцию добавлением 0,05 мл 1М серной кислоты. Оптическую плотность определяли с использованием спектрофотометра Multiskan FC (Thermo Fisher Scientific, США) при длине волны 450 нм (ОП450) [11]. За титр антител принимали разведение, в котором значение ОП450 образца сыворотки в 2 раза превышало значение ОП450 отрицательного контроля (сыворотка крови неиммунизированного животного).
Реакция нейтрализации. Определение уровня вируснейтрализующих антител (ВНА) к ротавирусу типа А проводили в реакции нейтрализации in vitro классическим методом [13]. Для постановки реакции использовали перевиваемую культуру клеток почки африканской зеленой мартышки MARC-145, полученную из коллекции культур клеток ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. Клетки культивировали в 96-луночном планшете в среде DMEM («ПанЭко», Россия), содержащей 5% фетальной сыворотки при 37 °С в атмосфере 5% СО2. Исследуемые образцы сыворотки предварительно термически инактивировали при 56 °C в течение 30 мин, затем готовили двукратные последовательные разведения образцов (начальное разведение — 1:100) в среде DMEM с глутамином («ПанЭко», Россия). Ко всем разведениям сыворотки добавляли аттенуированный штамм Wa G1P[ 8] ротавируса человека, любезно предоставленный профессором L.J. Saif (OARDC, FAHRP, университет штата Огайо, США) [12], титр которого по уровню показателя 50% тканевой цитопатической дозы (ТЦД50) составлял 5,5 lg ТЦД50/0,1 мл (100 ТЦД50/лунку). Разведение вируса готовили в питательной среде, содержащей 10 мкг/мл трипсина («Самсон-Мед», Россия). Образцы с сывороткой крови и вирусом выдерживали при температуре 37 °С в течение 1 ч, затем вносили к клеткам линии MARC-145, находящимся в состоянии 80–90% монослоя. Через 4–5 сут инкубации при 37 °С в атмосфере 5% СО2 проводили учет результатов с использованием микроскопии (Olympus, CKX31SF, Япония) для определения цитопатического действия (ЦПД) в клетках [11][14]. При учете результатов использовали следующие контроли: контроль клеток — лунки с клетками, не инфицированными вирусом (с полным сохранением клеточного монослоя); контроль инфицирующей дозы — лунки с клетками, инфицированными рабочим титром вируса (с полной деградацией клеточного монослоя). Нейтрализующим титром сыворотки считали ее наибольшее разведение, при котором наблюдалась нейтрализация вируса с отсутствием ЦПД в культуре клеток [14].
Статистическая обработка данных. Статистическую обработку результатов проводили с использованием программного пакета OriginPro 2023 (США). Для полученных данных в ИФА и реакции вирусной нейтрализации определяли среднее геометрическое значение обратных титров (СГТ) антител с указанием 95% доверительного интервала (95% ДИ).
Программа валидации включала исследование специфичности, повторяемости, промежуточной прецизионности. Регрессионный анализ калибровочной зависимости, расчет коэффициентов детерминации R² и статистический анализ данных проводили с использованием программы Microsoft Office Excel 2010.
РЕЗУЛЬТАТЫ
Выбор экспериментальной модели животных и схемы иммунизации
При выборе модели животных и схемы иммунизации для оценки специфической активности ротавирусной вакцины на основе VLP наиболее значимыми параметрами являлись следующие: достоверное повышение титра специфических IgG-антител к белкам VP2/6 ротавируса типа А в сыворотках иммунизированных животных с последующим его нарастанием; достоверное повышение титра ВНА, при котором не регистрировали признаков ЦПД в культуре клеток в реакции нейтрализации.
Было проведено сравнение данных показателей на трех моделях животных, иммунизированных ротавирусной вакциной на основе VLP: мыши, морские свинки и новорожденные карликовые свиньи (рис. 1–3). Выявлено, что однократная иммунизация не вызывает образования специфических IgG-антител и ВНА у карликовых свиней и морских свинок, однако приводит к значительной выработке IgG-антител у мышей — значение СГТ антител составило 128000.
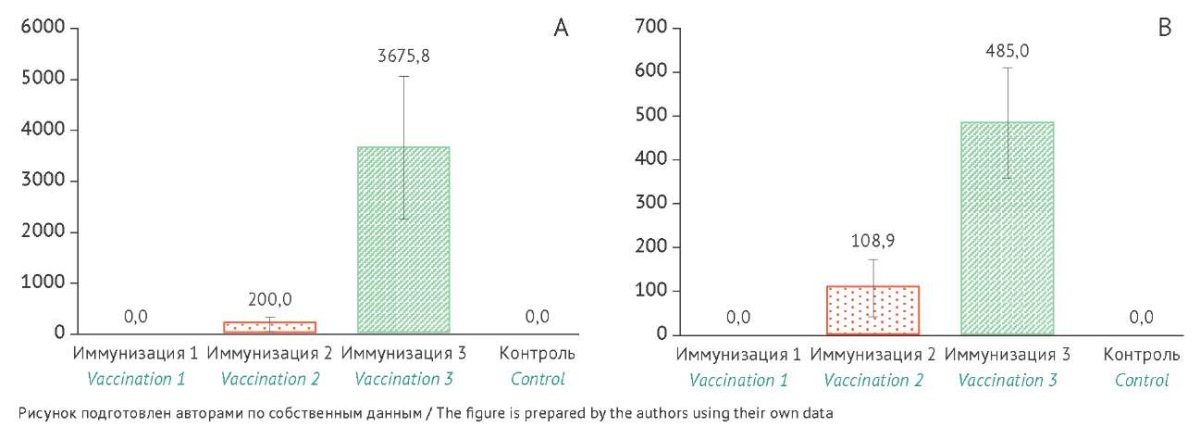
Рис. 1. Уровень специфических IgG-антител к белкам VP2/6 (A) и вируснейтрализующих антител (B) у новорожденных карликовых свиней после трехкратной иммунизации ротавирусной вакциной на основе вирусоподобных частиц (30 мкг/доза). Ось X — номер иммунизации, ось Y — среднее геометрическое значений обратных титров антител. Данные представлены с указанием значений доверительного интервала (95% доверительный интервал). Различия между группой иммунизированных животных (иммунизация 2 и 3) и контролем (введение физиологического раствора) статистически значимы (р<0,05).
Fig. 1. Levels of anti-VP2 and anti-VP6 IgG antibodies (A) and neutralising antibodies (B) to rotavirus after three vaccinations of newborn minipigs with a rotavirus vaccine based on virus-like particles (30 µg/dose). The X-axis represents the vaccination number, and the Y-axis shows the geometric means of reciprocal antibody titres. The data are presented with 95% confidence intervals. The differences between the vaccinated group (vaccinations 2 and 3) and the control group (normal saline administration) are statistically significant (p<0.05).
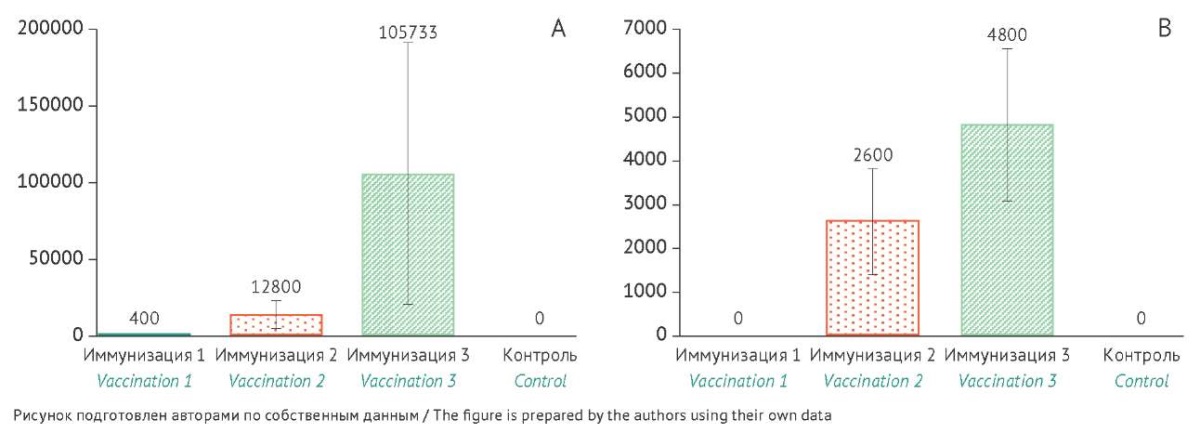
Рис. 2. Уровень специфических IgG-антител к белкам VP2/6 (A) и вируснейтрализующих антител (B) у морских свинок после трехкратной иммунизации ротавирусной вакциной на основе вирусоподобных частиц (30 мкг/доза). Ось X — номер иммунизации, ось Y — среднее геометрическое значений обратных титров антител. Данные представлены с указанием значений доверительного интервала (95% доверительный интервал). Различия между группой иммунизированных животных (иммунизация 2 и 3) и контролем (введение физиологического раствора) статистически значимы (р<0,05).
Fig. 2. Levels of anti-VP2 and anti-VP6 IgG antibodies (A) and neutralising antibodies (B) to rotavirus after three vaccinations of guinea pigs with a rotavirus vaccine based on virus-like particles (30 µg/dose). The X-axis represents the vaccination number, and the Y-axis shows the geometric means of reciprocal antibody titres. The data are presented with 95% confidence intervals. The differences between the vaccinated group (vaccinations 2 and 3) and the control group (normal saline administration) are statistically significant (p<0.05).
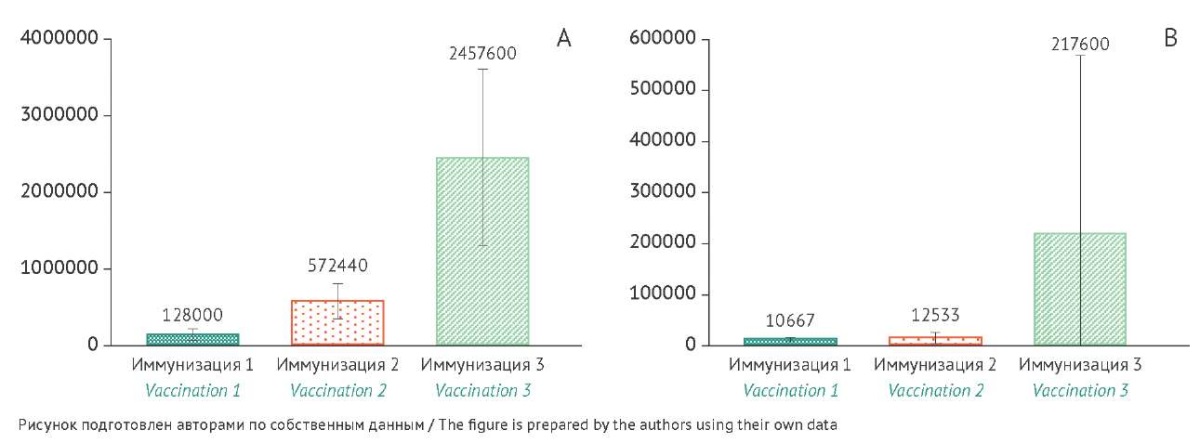
Рис. 3. Уровень специфических IgG-антител к белкам VP2/6 после трехкратной иммунизации мышей линии BALB/c ротавирусной вакциной на основе вирусоподобных частиц (30 мкг/доза) (А) и уровень IgG-антител в контрольной группе с введением физиологического раствора (В). Ось X — номер иммунизации, ось Y — среднее геометрическое значений обратных титров антител. Данные представлены с указанием значений доверительного интервала (95% доверительный интервал). Различия между группой иммунизированных животных и контролем (введение физиологического раствора) статистически значимы (р<0,05).
Fig. 3. Levels of anti-VP2 and anti-VP6 IgG antibodies after three vaccinations of BALB/c mice with a rotavirus vaccine based on virus-like particles (30 µg/dose) (A) and levels of IgG antibodies in the control group receiving normal saline (B). The X-axis represents the vaccination number, and the Y-axis shows the geometric means of reciprocal antibody titres. The data are presented with 95% confidence intervals. The differences between the vaccinated group and the control group (normal saline) are statistically significant (p<0.05).
После второй иммунизации наблюдалось статистически значимое повышение титра антител, а также были выявлены статистически значимые различия между группами животных. Двукратная иммунизация приводила к образованию специфических IgG-антител и ВНА у карликовых свиней (СГТ антител — 200,0 и 108,9 соответственно) и морских свинок (СГТ антител — 12800 и 2600 соответственно). У иммунизированных мышей наблюдался значительный рост уровня IgG-антител — значение СГТ антител составило 572440.
После третьей иммунизации наблюдался прирост специфических IgG-антител у всех трех видов модельных животных: у морских свинок уровень антител увеличился в 8 раз, у карликовых свиней — в 18,4 раза, у мышей — в 4,5 раза. Значения СГТ специфических IgG-антител составили: у мышей — 2457600, у морских свинок — 105733, у карликовых свиней — 3675,8. Эти данные коррелируют с результатами, полученными в реакции вирусной нейтрализации: уровень ВНА у морских свинок — 4800, у карликовых свиней — 485. Реакция вирусной нейтрализации у мышей не проводилась.
Следует отметить, что у мышей в контрольной группе с введением физиологического раствора были зарегистрированы фоновые значения уровня антител (СГТ антител 10667) после первого введения, а также отмечался дальнейший рост значений (СГТ антител 12533 и 217600 для 2 и 3 иммунизации), чего не наблюдалось в образцах сыворотки морских свинок и карликовых свиней. Полученные данные можно объяснить тем, что в организме мышей имеется определенный уровень гуморальной защиты в отношении ротавируса за счет уже сформированных собственных антител вне зависимости от вакцинации, вследствие чего их иммунная система адаптирована для борьбы с этим вирусом [15]. Так как получение достоверных данных об эффекте исследуемой вакцины на мышах оказалось затруднительным, в связи с этим было принято решение об отказе от дальнейшего их использования в качестве модельных животных.
Результаты исследований показали, что карликовые свиньи являются подходящим модельным объектом для оценки специфической активности ротавирусных вакцин, однако это достаточно дорогостоящая модель для рутинных исследований. Применение морских свинок в качестве модельных животных обладает рядом преимуществ. В контрольной группе морских свинок с введением физиологического раствора не наблюдалось фоновых значений СГТ антител, в то время как в опытной группе животных, иммунизированных вакциной на основе VLP, выявлен выраженный иммунный ответ — при трехкратной внутримышечной иммунизации показано достижение высоких уровней специфических IgG-антител и ВНА. Сопоставление результатов ИФА и реакции нейтрализации, полученных после второй иммунизации, свидетельствует о формировании иммунного ответа на достаточном уровне, в связи с чем схема с двукратной иммунизацией представляется наиболее оптимальной для снижения нагрузки на иммунную систему при сохранении эффективности вакцинации.
Применение реакции нейтрализации как стандартной для определения уровня ВНА показало хорошие результаты в ходе исследования, однако данный метод является достаточно трудоемким и требует специальной подготовки персонала и оснащения помещений для обеспечения вирусной безопасности. Метод ИФА более простой в выполнении, при этом обладает высокой чувствительностью, что позволяет выявлять специфические антитела даже при их минимальной концентрации. Вследствие согласованности результатов методов ИФА и вирусной нейтрализации дальнейшие исследования по валидации метода определения специфической активности ротавирусной вакцины на основе VLP были проведены с использованием ИФА.
Валидация методики определения специфической активности
Валидация проводилась в соответствии с требованиями Государственной фармакопеи Российской Федерации XV изд. ОФС.1.1.00125 с целью экспериментального подтверждения пригодности метода непрямого ИФА для определения антител, специфических к ротавирусу А, в сыворотках крови иммунизированных морских свинок. Программа валидации включала исследование специфичности, повторяемости, промежуточной прецизионности.
Специфичность. В ходе исследования оценивали способность методики ИФА однозначно определять антитела, специфичные к белкам VP2/6 ротавируса А. Для подтверждения специфичности методики были подготовлены следующие образцы: положительный контрольный образец (К+) — поликлональная гипериммунная сыворотка морской свинки в разведении 1:100 в ФСБТ-БСА; отрицательный контрольный образец (К-) — образцы сыворотки трех неиммунизированных морских свинок в разведениях от 1:100 до 1:12800 с шагом 2 в ФСБТ-БСА; модельные растворы № 1–3 — образцы гипериммунной сыворотки морской свинки в разведениях от 1:100 до 1:12800 с шагом 2 в ФСБТ-БСА; контроль реагентов (КР) — ФСБТ-БСА.
Критерии приемлемости:
- среднее значение оптической плотности (ОП450) в образцах, содержащих КР, не должно превышать 0,1, что также подтверждает отсутствие влияния компонентов ФСБТ-БСА на результаты реакции;
- среднее значение ОП450 в образце, содержащем К+, должно превышать 0,6;
- среднее значение ОП450 в образцах, содержащих К-, не должно превышать 0,2;
- ОП450 модельных растворов, содержащих антитела, специфичные к белкам VP2/6 ротавируса А, пропорциональна разведению модельных растворов.
Показано, что для полученных результатов соблюдены установленные критерии приемлемости (табл. 1).
Таблица 1. Результаты оценки специфичности методики иммуноферментного анализа
Table 1. Specificity validation results for the enzyme-linked immunosorbent assay
Наименование образца Sample name | Значения оптической плотности (ОП450) при разведениях Absorbance (А450) for the following dilutions | |||||||
1:100 | 1:200 | 1:400 | 1:800 | 1:1600 | 1:3200 | 1:6400 | 1:12800 | |
Сыворотка крови неиммунизированного животного № 1, К- Serum of non-vaccinated animal 1, К- | 0,136 | 0,105 | 0,079 | 0,068 | 0,055 | 0,048 | 0,046 | 0,046 |
Сыворотка крови неиммунизированного животного № 2, К- Serum of non-vaccinated animal 2, К- | 0,129 | 0,101 | 0,074 | 0,066 | 0,053 | 0,049 | 0,046 | 0,045 |
Сыворотка крови неиммунизированного животного № 3, К- Serum of non-vaccinated animal 3, К- | 0,135 | 0,106 | 0,077 | 0,065 | 0,055 | 0,048 | 0,046 | 0,046 |
Стандартное отклонение, SD Standard deviation, SD | 0,004 | 0,003 | 0,003 | 0,002 | 0,001 | 0,001 | 0,000 | 0,001 |
Среднее значение К- в каждом разведении Mean K- for each dilution | 0,133 | 0,104 | 0,077 | 0,066 | 0,054 | 0,048 | 0,046 | 0,046 |
Среднее значение К- Mean K- | 0,072 | |||||||
Коэффициент вариации, CV (%) Coefficient of variation, CV (%) | 2,8 | 2,5 | 3,3 | 2,3 | 2,1 | 1,2 | 0 | 1,3 |
Модельный раствор № 1 Model solution 1 | 0,643 | 0,539 | 0,480 | 0,462 | 0,407 | 0,392 | 0,302 | 0,243 |
Модельный раствор № 2 Model solution 2 | 0,618 | 0,546 | 0,506 | 0,470 | 0,396 | 0,396 | 0,294 | 0,246 |
Модельный раствор № 3 Model solution 3 | 0,684 | 0,627 | 0,534 | 0,508 | 0,427 | 0,349 | 0,333 | 0,267 |
Поликлональная гипериммунная сыворотка морской свинки (1:100), К+ Polyclonal hyperimmune guinea pig serum (1:100), К+ | 0,697 | 0,695 | – | – | – | – | – | – |
Контроль реагентов Reagent control | 0,049 | 0,046 | – | – | – | – | – | – |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. К-, отрицательный контрольный образец; К+, положительный контрольный образец; «–» — не применимо.
Note. K-, negative control sample; K+, positive control sample; –, not applicable.
Зависимость значений ОП450 модельных растворов от количественного содержания специфических к ротавирусу А антител представлена на рисунке 4 (опубликован на сайте журнала6).
Таким образом, в ходе исследования специфичности методики показана способность предложенной тест-системы селективно выявлять IgG к VP2/6 ротавируса А. Определены критерии работоспособности предложенной методики, при которых полученные результаты соответствуют критериям приемлемости, в частности, среднее значение ОП450 для образца К+ более 0,6; среднее значение ОП450 для образцов К- менее 0,2; значение ОП450 контроля реагентов менее 0,1. Таким образом, методика непрямого ИФА обеспечивает высокую селективность определения специфических IgG-антител к ротавирусу А в образцах сыворотки крови морских свинок, иммунизированных вакциной.
Повторяемость. В ходе исследования оценивали степень близости друг к другу результатов измерений, получаемых в пределах короткого промежутка времени, при использовании одних и тех же реактивов и одного и того же оборудования. Для оценки повторяемости в качестве образцов были использованы образцы сыворотки крови морских свинок, иммунизированных ротавирусной вакциной на основе VLP (30 мкг/доза), и сыворотки контрольных (неиммунизированных) морских свинок. Был произведен расчет среднего значения обратной величины титра IgG к VP 2/6 ротавируса А, стандартного отклонения (SD) и коэффициента вариации (CV, %).
Критерий приемлемости. Коэффициент вариации результатов, полученных в условиях повторяемости, не должен быть более 15%.
Показано, что результаты оценки повторяемости соответствуют критериям приемлемости (табл. 2). Значения CV для вакцины серии 01 (12,4%), и для серии 02 (7,7%) не превышали 15%, что свидетельствует о повторяемости методики.
Таблица 2. Результаты оценки повторяемости методики иммуноферментного анализа
Table 2. Repeatability validation results for the enzyme-linked immunosorbent assay
№ серии вакцины Vaccine batch No. | Обратная величина титра IgG к VP2/6 ротавируса А (индивидуальные и средние значения в измерениях) Reciprocal titres of IgGs to rotavirus A VP2 and VP6 (individual and mean values) | Среднее значение Mean | SD | CV, % | |||||||
Измерение 1 Measurement 1 | Измерение 2 Measurement 2 | Измерение 3 Measurement 3 | Измерение 4 Measurement 4 | ||||||||
01 | 25600 | 22400 | 25600 | 28800 | 25600 | 25600 | 25600 | 22400 | 24800 | 3063,8 | 12,4 |
12800 | 12800 | 25600 | 12800 | ||||||||
25600 | 51200 | 25600 | 25600 | ||||||||
25600 | 25600 | 25600 | 25600 | ||||||||
02 | 25600 | 25600 | 25600 | 22400 | 25600 | 25600 | 25600 | 22400 | 24000 | 1847,5 | 7,7 |
25600 | 12800 | 25600 | 12800 | ||||||||
25600 | 25600 | 25600 | 25600 | ||||||||
25600 | 25600 | 25600 | 25600 | ||||||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. SD — стандартное отклонение; CV — коэффициент вариации.
Note. IgG, immunoglobulin G; VP, virus protein; SD, standard deviation; CV, coefficient of variation.
Промежуточная прецизионность. В ходе исследования оценивали степень близости друг к другу результатов измерений, получаемых разными сотрудниками в разные дни при использовании одних и тех же реактивов и одного и того же оборудования. Для оценки промежуточной прецизионности анализ тех же образцов сывороток морских свинок, что и при оценке повторяемости, проводили на следующий день.
Критерий приемлемости. Сравнивали результаты оценки повторяемости и промежуточной прецизионности. Достоверность результатов (Р=95%) определяли по t-критерию Стьюдента. Рассчитанное значение критерия Стъюдента (tрас) должно быть меньше табличного (tтабл=2,45 при f=6).
Показано, что результаты оценки промежуточной прецизионности соответствуют критериям приемлемости (табл. 3). Значения CV для вакцины серии 01 (6,9%) и серии 02 (10,2%) не превышали 15%, что подтверждает внутрилабораторную прецизионность методики. Рассчитанное значение критерия Стъюдента (tрас=0) меньше табличного значения (tтабл=2,45), что свидетельствует об отсутствии существенных различий в результатах измерений, полученных при исследовании повторяемости и промежуточной прецизионности.
Таблица 3. Результаты оценки повторяемости методики иммуноферментного анализа в условиях промежуточной прецизионности
Table 3. Intermediate precision validation results for the enzyme-linked immunosorbent assay
№ серии вакцины Vaccine batch No. | Обратная величина титра IgG к VP2/6 ротавируса А (индивидуальные и средние значения в измерениях) Reciprocal titres of IgGs to rotavirus A VP2 and VP6 (individual and mean values) | Среднее значение Mean | SD | CV, % | |||||||
Измерение 1 Measurement 1 | Измерение 2 Measurement 2 | Измерение 3 Measurement 3 | Измерение 4 Measurement 4 | ||||||||
01 | 25600 | 25600 | 25600 | 22400 | 25600 | 22400 | 25600 | 22400 | 23200 | 1600 | 6,9 |
25600 | 12800 | 12800 | 12800 | ||||||||
25600 | 25600 | 25600 | 25600 | ||||||||
25600 | 25600 | 25600 | 25600 | ||||||||
02 | 25600 | 25600 | 25600 | 22400 | 25600 | 25600 | 25600 | 28800 | 25600 | 1600 | 10,2 |
25600 | 12800 | 25600 | 12800 | ||||||||
25600 | 25600 | 25600 | 51200 | ||||||||
25600 | 25600 | 25600 | 25600 | ||||||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. SD — стандартное отклонение; CV — коэффициент вариации.
Note. IgG, immunoglobulin G; VP, virus protein; SD, standard deviation; CV, coefficient of variation.
ОБСУЖДЕНИЕ
Оценка специфической активности вакцин проводится в том числе по степени активации гуморального иммунного ответа у иммунизированных животных, используемых в качестве экспериментальной модели. Учитывая сложность и специфику иммунобиологических лекарственных препаратов, выбор подходящей модели животных для исследований крайне важен.
Способ и кратность введения вакцины также играют существенную роль при проведении исследований, так как от этого зависит выраженность иммунного ответа. Эти параметры должны быть аналогичны используемым в клинической практике. Внутримышечное введение вакцины является предпочтительным из-за оптимальных показателей всасывания, иммуногенности, скорости формирования поствакцинального иммунитета и требуемой точности вводимой дозы. Кроме того, этот путь введения соответствует способу, наиболее часто используемому в клинической практике.
Для ротавирусных вакцин в настоящее время отсутствует определенная модель для оценки эффективности вакцин, что является существенной проблемой [16]. Для изучения формирования иммунитета против РВИ используются разные модели животных (мыши, крысы, кролики, свиньи и др.)7. Каждая из этих моделей имеет свои преимущества и недостатки, включая восприимчивость к инфекции, влияние микробиоты на проявление РВИ и др. Наиболее часто применяются модели мышей и свиней [16]. В данной работе были рассмотрены три модели животных: мыши, морские свинки и карликовые свиньи.
Использование мышей в качестве модельных животных имеет ряд преимуществ. Мыши являются наиболее изученными животными, в том числе для исследования инфекций, включая ротавирус. Применение мышей экономически целесообразно при проведении экспериментов, так как они имеют относительно короткий срок жизни и быстро размножаются. Мыши, как и человек, восприимчивы к РВИ, что позволяет изучать развитие инфекции и эффективность вакцин на этих животных. Кроме того, в организме мышей регистрируется высокий уровень антител против ротавируса, что позволяет исследовать иммунные механизмы защиты от РВИ. На результат исследований при использовании этой модели влияет выбор линии мышей. Уровень иммунной защиты, сформированный у инбредных мышей, как правило, выше, чем у беспородных мышей. В экспериментах чаще всего используются мыши линии BALB/c [17].
Применение морских свинок в качестве модельных животных широко распространено из-за их восприимчивости к РВИ и высокого уровня выработки антител против вируса. Чувствительность морских свинок к ротавирусу подтверждается серологическими данными. Кроме того, важное значение имеет доступность и экономичность этой модели.
Использование в качестве модели новорожденных карликовых свиней обусловлено подверженностью данных животных инфекции, вызванной ротавирусом человека. Этот вид животных является универсальной моделью для оценки качества ротавирусных вакцин, что объясняется значительным сходством физиологии, анатомических особенностей и механизмов формирования системного и местного иммунитета у человека и свиньи, а также возможностью воспроизведения клинических проявлений заболевания [12]. Результаты исследований по сравнению эффективности ротавирусных вакцин при заражении ротавирусом свиней показали, что применение данной модели позволяет проводить более объективную оценку потенциала вакцины в сопоставлении с моделью мышей [18]. Недостатком мышей в качестве модели является то, что они подвержены ротавирусной диарее только в возрасте до 2–3 нед. Это усложняет изучение формирования иммунного ответа к РВИ у мышей. В то же время поросята чувствительны к заражению ротавирусом по меньшей мере до возраста 8 нед., что достаточно для изучения поствакцинального иммунитета [12][19][20].
В ходе данного исследования было продемонстрировано формирование выраженного иммунного ответа при вакцинации ротавирусной вакциной на основе VLP на модели морских свинок, а также отсутствие фоновых значений СГТ антител в контрольной группе у морских свинок с введением физиологического раствора. Полученные результаты свидетельствуют о релевантности модели морских свинок в рамках нашего исследования.
Выбор вирусного антигена имеет важное значение при изучении антигенных и иммуногенных свойств ротавирусных вакцин. Белок ротавируса VP6 обладает как антигенными, так и иммуногенными свойствами и способен инициировать выработку специфических IgG и IgA слизистой оболочки [21]. Благодаря своей высокой иммуногенности, консервативным характеристикам белок VP6 рассматривается как основа для разработки кандидатных нереплицирующихся вакцин против РВИ, способный индуцировать гетерологичный перекрестный защитный иммунитет к РВИ на животных моделях [22][23]. Ранее была продемонстрирована способность белка VP6 формировать устойчивый, длительный и специфический IgG-опосредованный иммунный ответ против различных штаммов ротавируса типа А.
При оценке специфической активности ротавирусной вакцины на основе VLP при помощи ИФА для увеличения чувствительности метода была использована комбинация рекомбинантных белков VP2/6. Была показана взаимосвязь между титрами специфических IgG-антител и ВНА после иммунизации животных. Валидация разработанной методики ИФА для определения специфической активности ротавирусной вакцины на основе VLP на модели морских свинок показала ее специфичность, повторяемость и промежуточную прецизионность при соблюдении критериев приемлемости.
ВЫВОДЫ
- Разработан подход для оценки специфической активности ротавирусной вакцины на основе вирусоподобных частиц для определения титра специфических IgG-антител к белкам VP2/6 ротавируса А в образцах сыворотки крови иммунизированных животных с использованием двух методов — иммуноферментного анализа и реакции нейтрализации.
- Установлено, что для изучения иммунного ответа после иммунизации ротавирусной вакциной оптимальной моделью являются морские свинки. Двукратная схема иммунизации вакциной в дозе 30 мкг/доза достаточна для обеспечения выраженного поствакцинального иммунитета.
- В ходе валидационных испытаний установлено, что методика ИФА для определения титра специфических иммуноглобулинов класса G к VP2/6 ротавируса А в образцах сыворотки крови вакцинированных морских свинок удовлетворяет критериям приемлемости по таким характеристикам, как специфичность, повторяемость и промежуточная прецизионность, что обеспечивает получение достоверных результатов анализа.
- Метод ИФА может быть использован для контроля показателя качества «Специфическая активность» ротавирусной вакцины на основе вирусоподобных частиц.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: И.Е. Филатов — проведение экспериментальных исследований, написание текста рукописи; М.М. Силаенкова — проведение экспериментальных исследований, написание и редактирование текста рукописи; В.В. Цибезов — проведение экспериментальных исследований, редактирование текста рукописи; М.В. Баландина, С.Н. Норкина, О.Е. Латышев, О.В. Елисеева, С.А. Черепушкин — сбор и анализ результатов исследований, редактирование текста рукописи; Т.В. Гребенникова — формулирование выводов, утверждение окончательной версии статьи для публикации.
Соответствие принципам этики. Протокол исследования с использованием экспериментальных животных был одобрен биоэтической комиссией АО «НПО «ДОМ ФАРМАЦИИ» (№ БЭК 1.42/22 от 21.09.2022) и локальным комитетом по биомедицинской этике ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (№ 05/2022 от 06.10.2022).
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. I.E. Filatov conducted the experiments and drafted the manuscript. M.M. Silaenkova conducted the experiments, drafted and edited the manuscript. V.V. Tsibezov conducted the experiments and edited the manuscript. M.V. Balandina, S.N. Norkina, O.E. Latyshev, O.V. Eliseeva, and S.A. Cherepushkin collected and analysed the results and edited the manuscript. T.V. Grebennikova formulated the conclusions and approved the final version of the manuscript for publication.
Ethics approval. The research was approved by the Bioethics Committee of the research-and-manufacturing company ‘HOME OF PHARMACY’ (Approval No. BEC 1.42/22 dated 21 September 2022) and the Local Biomedical Ethics Committee of the Federal State Budgetary Institution ‘National Research Centre for Epidemiology and Microbiology named after honorary academician N.F. Gamaleya’ of the Ministry of Health of the Russian Federation (Approval No. 05/2022 dated 6 October 2022).
Дополнительная информация. На сайте журнала «БИОпрепараты. Профилактика, диагностика, лечение» размещен рисунок 4.
https://doi.org/10.30895/2221-996X-2024-24-4-389-402-fig4
Additional information. Figure 4 is published on the website of Biological Products. Prevention, Diagnosis, Treatment.
https://doi.org/10.30895/2221-996X-2024-24-4-389-402-fig4
1. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2022 году: Государственный доклад. М.: Роспотребнадзор; 2023. https://www.rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=25076
2. ОФС.1.7.1.0018.18 Иммунобиологические лекарственные препараты. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
3. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К.; 2012.
Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 2. М.: Гриф и К.; 2012.
4. Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes.
5. ОФС.1.1.0012 Валидация аналитических методик. Государственная фармакопея Российской Федерации. XV изд. Т. 1; 2023.
6. https://doi.org/10.30895/2221-996X-2024-24-4-389-402-fig4
7. Морозова ОВ. Генотиповое разнообразие и филодинамика циркулирующих на территории России ротавирусов, сравнение с вакцинными штаммами: автореф. дисс. ... канд. биол. наук. М.; 2021.
Список литературы
1. Estes MK. Rotaviruses and their replication. In: Knipe DN, Howeley PM, Griffin DE, eds. Fields virology. Philadelphia: Lippicott Williams and Wilkins; 2001. P. 1747–86.
2. Hallowell BD, Chavers T, Parashar U, Tate JE. Global estimates of rotavirus hospitalizations among children below 5 years in 2019 and current and projected impacts of rotavirus vaccination. J Pediatric Infect Dis Soc. 2022;11(4):149–58. https://doi.org/10.1093/jpids/piab114
3. Troeger C, Khalil IA, Rao PC, Cao S, Blacker BF, Ahmed T, et al. Rotavirus vaccination and the global burden of rotavirus diarrhea among children younger than 5 years. JAMA Pediatr. 2018;172(10):958–65. https://doi.org/10.1001/jamapediatrics.2018.1960
4. Yen C, Healy K, Tate JE, Parashar UD, Bines J, Neuzil K, et al. Rotavirus vaccination and intussusception — science, surveillance, and safety: a review of evidence and recommendations for future research priorities in low- and middle-income countries. Hum Vaccin Immunother. 2016;12(10):2580–9. https://doi.org/10.1080/21645515.2016.1197452
5. Черепушкин СА, Цибезов ВВ, Южаков АГ, Латышев ОЕ, Алексеев КП, Алтаева ЕГ и др. Синтез и характеристика вирусоподобных частиц ротавируса А (Reoviridae: Sedoreovirinae: Rotavirus: Rotavirus A) человека. Вопросы вирусологии. 2021;66(1):55–64. https://doi.org/10.36233/0507-4088-27
6. Bachmann MF, Jennings GT. Vaccine delivery: a matter of size, geometry, kinetics and molecular patterns. Nat Rev Immunol. 2010;10(11):787–96. https://doi.org/10.1038/nri2868
7. Li C, Luo G, Zeng Y, Song F, Yang H, Zhang S, et al. Establishment of sandwich ELISA for quality control in rotavirus vaccine production. Vaccines (Basel). 2022;10(2):243. https://doi.org/10.3390/vaccines10020243
8. Gupta R, Arora K, Singha Roy S, Joseph A, Rastogi R, Mehrotra Arora N. Platforms, advances, and technical challenges in virus-like particles-based vaccines. Front Immunol. 2023;14:1123805. https://doi.org/10.3389/fimmu.2023.1123805
9. Яговкин ЭА, Онищенко ГГ, Попова АЮ, Ежлова ЕБ, Мельникова АА, Соловьев МЮ и др. Состояние и перспективы разработки вакцин для специфической профилактики этеровирусной (неполио) инфекции. Эпидемиология и вакцинопрофилактика. 2016;15(4):74–82. https://doi.org/10.31631/2073-3046-2016-15-4-74-82
10. Воробьева МС, Афонина ОС, Бархалева ОА, Щербинина МС, Саркисян КА, Рукавишников АВ и др. Анализ многолетнего изучения инактивированных культуральных вакцин для профилактики клещевого энцефалита отечественного и зарубежного производства по показателю качества — специфическая активность (иммуногенность). БИОпрепараты. Профилактика, диагностика, лечение. 2015;(4):4–10. EDN: VAEGZN
11. Филатов ИЕ, Цибезов ВВ, Баландина МВ, Норкина СН, Латышев ОЕ, Елисеева ОВ и др. Использование вирусоподобных частиц на основе рекомбинантных вирусных белков VP2/VP6 ротавируса А для оценки гуморального иммунного ответа методом ИФА. Вопросы вирусологии. 2023;68(2):161–71. https://doi.org/10.36233/0507-4088-169
12. Хаметова КМ, Алексеев КП, Южаков АГ, Костина ЛВ, Раев СА, Мусиенко МИ и др. Молекулярно-биологические свойства клонированного штамма Wa ротавируса А человека. Вопросы вирусологии. 2019;64(1):16–22. https://doi.org/10.18821/0507-4088-2019-64-1-16-22
13. Sullivan EJ, Rosenbaum MJ. Methods for preparing tissue culture in disposable microplates and their use in virology. Am J Epidemiol. 1967;85(3):424–37.
14. Костина ЛВ, Филатов ИЕ, Елисеева ОВ, Латышев ОЕ, Чернорыж ЯЮ, Юрлов КИ и др. Исследование безопасности и иммуногенности вакцины на основе VLP для профилактики ротавирусной инфекции на модели новорожденных карликовых свиней. Вопросы вирусологии. 2023;68(5):415–28. https://doi.org/10.36233/0507-4088-194
15. Ward RL, McNeal MM, Sheridan JF. Evidence that active protection following oral immumization of mice with live rotavirus is not dependent on neutralizing antibody. Virology. 1992;188(1):57–66. https://doi.org/10.1016/0042-6822(92)90734-7
16. McAdams D, Estrada M, Holland D, Singh J, Sawant N, Hickey JM, et al. Concordance of in vitro and in vivo measures of non-replicating rotavirus vaccine potency. Vaccine. 2022;40(34):5069–78. https://doi.org/10.1016/j.vaccine.2022.07.017
17. Choi AH, McNeal MM, Basu M, Flint JA, Stone SC, Clements JD et al. Intranasal or oral immunization of inbred and outbred mice with murine or human rotavirus VP6 proteins protects against viral shedding after challenge with murine rotaviruses. Vaccine. 2002;20(27–28):3310–21. https://doi.org/10.1016/s0264-410x(02)00315-8
18. El-Attar L, Oliver SL, Mackie A, Charpilienne A, Poncet D, Cohen J, Bridger JC. Comparison of the efficacy of rotavirus VLP vaccines to a live homologous rotavirus vaccine in a pig model of rotavirus disease. Vaccine. 2009;27(24):3201–8. https://doi.org/10.1016/j.vaccine.2009.03.043
19. Franco MA, Greenberg HB. Immunity to rotavirus infection in mice. J Infect Dis. 1999;179(Suppl. 3):466–9. https://doi.org/10.1086/314805
20. Azevedo MP, Vlasova AN, Saif LJ. Human rotavirus virus-like particle vaccines evaluated in a neonatal gnotobiotic pig model of human rotavirus disease. Expert Rev Vaccines. 2013;12(2):169–81. https://doi.org/10.1586/erv.13.3
21. Niu X, Liu Q, Wang P, Zhang G, Jiang L, Zhang S, et al. Establishment of an indirect ELISA method for the detection of the bovine rotavirus VP6 protein. Animals (Basel). 2024;14(2):271. https://doi.org/10.3390/ani14020271
22. Afchangi A, Jalilvand S, Mohajel N, Marashi SM, Shoja Z. Rotavirus VP6 as a potential vaccine candidate. Rev Med Virol. 2019;29(2):e2027. https://doi.org/10.1002/rmv.2027
23. Shoja Z, Jalilvand S, Latifi T, Roohvand F. Rotavirus VP6: involvement in immunogenicity, adjuvant activity, and use as a vector for heterologous peptides, drug delivery, and production of nano-biomaterials. Arch Virol. 2022;167(4):1013–23. https://doi.org/10.1007/s00705-022-05407-9
Об авторах
И. Е. ФилатовРоссия
Филатов Илья Евгеньевич
ул. Гамалеи, д. 18, Москва, 123098
М. М. Силаенкова
Силаенкова Мария Михайловна
ул. Гамалеи, д. 18, Москва, 123098
В. В. Цибезов
Россия
Цибезов Валерий Владимирович, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098
М. В. Баландина
Россия
Баландина Марина Владимировна, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098
С. Н. Норкина
Россия
Норкина Светлана Николаевна, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098
О. Е. Латышев
Россия
Латышев Олег Евгеньевич, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098
О. В. Елисеева
Россия
Елисеева Олеся Васильевна, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098
С. А. Черепушкин
Россия
Черепушкин Станислав Андреевич
ул. Гамалеи, д. 18, Москва, 123098
Т. В. Гребенникова
Россия
Гребенникова Татьяна Владимировна, д-р биол. наук, проф., член-корр. РАН
ул. Гамалеи, д. 18, Москва, 123098
Дополнительные файлы

|
1. Рис. 4. Калибровочный график зависимости оптической плотности (ОП₄₅₀) модельных растворов № 1–3 от количественного содержания специфических антител к ротавирусу А, построенный с использованием метода линейной регрессии. На графике представлены формулы регрессионного уравнения и значения R² для каждого модельного раствора. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(500KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Филатов И.Е., Силаенкова М.М., Цибезов В.В., Баландина М.В., Норкина С.Н., Латышев О.Е., Елисеева О.В., Черепушкин С.А., Гребенникова Т.В. Определение специфической активности ротавирусной вакцины на основе вирусоподобных частиц с использованием иммуноферментного анализа: разработка и валидация методики. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(4):389-402. https://doi.org/10.30895/2221-996X-2024-24-4-389-402
For citation:
Filatov I.E., Silaenkova M.M., Tsibezov V.V., Balandina M.V., Norkina S.N., Latyshev O.E., Eliseeva O.V., Cherepushkin S.A., Grebennikova T.V. Enzyme-linked immunosorbent assay to determine the potency of a rotavirus vaccine based on virus-like particles: analytical procedure development and validation. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(4):389-402. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-4-389-402


































