Перейти к:
МикроРНК-направленные олигонуклеотидные конструкции с различным механизмом действия для эффективного подавления процессов канцерогенеза
https://doi.org/10.30895/2221-996X-2024-24-2-140-156
Резюме
ВВЕДЕНИЕ. Развитие злокачественных новообразований ассоциировано с изменениями в экспрессии малых некодирующих РНК (микроРНК), что подчеркивает необходимость исследований в области разработки микроРНК-направленных ингибиторов как перспективного подхода к лечению онкологических заболеваний.
ЦЕЛЬ. Сравнительная оценка и определение возможностей практического применения существующих в настоящее время стратегий подавления функциональной активности опухоль-ассоциированных микроРНК, основанных на использовании терапевтических нуклеиновых кислот.
ОБСУЖДЕНИЕ. Проведен анализ известных ингибиторов микроРНК на основе олигонуклеотидов, характеризующихся различными механизмами действия. Ингибиторы микроРНК по механизму действия можно условно разделить на две группы. Первая группа соединений оказывает опосредованное ингибирующее влияние либо за счет блокирования функциональных связей между микроРНК и определенными мРНК-мишенями путем использования микроРНК-маскирующих олигонуклеотидов, либо за счет введения мутаций в гены микроРНК и нарушения процессов их биосинтеза с помощью системы CRISPR/Cas. Эти стратегии обладают сравнительно высоким биологическим потенциалом, однако в большинстве случаев используются в качестве поисковых инструментов для изучения функциональной роли микроРНК и определения их молекулярных взаимодействий в процессах канцерогенеза. Вторая группа олигонуклеотидных конструкций взаимодействует с микроРНК-мишенями напрямую, приводя к их стерическому блокированию или деградации. Такие микроРНК-связывающие олигонуклеотидные конструкции представлены множеством структурных вариантов, включая микроРНК-спонжи, РНК-зипперы, антисмысловые олигонуклеотиды и миРНКазы, демонстрирующие высокий терапевтический потенциал in vitro и in vivo.
ЗАКЛЮЧЕНИЕ. Представленный анализ биологических свойств, терапевтического потенциала и ключевых преимуществ разработанных микроРНК-направленных олигонуклеотидных конструкций позволяет обозначить области их потенциального практического применения при лечении злокачественных новообразований.
Ключевые слова
Для цитирования:
Мирошниченко С.К., Патутина О.А., Зенкова М.А. МикроРНК-направленные олигонуклеотидные конструкции с различным механизмом действия для эффективного подавления процессов канцерогенеза. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(2):140-156. https://doi.org/10.30895/2221-996X-2024-24-2-140-156
For citation:
Miroshnichenko S.K., Patutina O.A., Zenkova M.A. miRNA-targeting oligonucleotide constructs with various mechanisms of action as effective inhibitors of carcinogenesis. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(2):140-156. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-2-140-156
ВВЕДЕНИЕ
Некодирующие РНК (нкРНК) являются важнейшими элементами системы регуляции в клетке. Среди нкРНК особого внимания заслуживают микроРНК — короткие РНК-транскрипты длиной 18–25 нуклеотидов, осуществляющие посттранскрипционную регуляцию экспрессии генов [1]. МикроРНК выполняют контроль всех фундаментальных клеточных процессов, таких как пролиферация, дифференцировка, апоптоз, миграция, адгезия и ангиогенез [2]. Нарушение уровня и функциональной активности микроРНК приводит к глобальной патологической реорганизации метаболизма клеток и часто ассоциировано с развитием широкого спектра заболеваний, в том числе онкологических [3]. В связи с этим ведется активная разработка противоопухолевых препаратов на основе микроРНК-направленных терапевтических нуклеиновых кислот.
Большинство опубликованных в настоящее время работ посвящены изучению роли определенных микроРНК в развитии конкретных типов неоплазий, оценке эффектов различных микроРНК-направленных конструкций in vitro и in vivo и анализу эффективности систем доставки РНК-направленных препаратов в рамках противоопухолевой терапии [4–6]. Накопленный объем экспериментальных данных в этой области нуждается в критическом анализе, обобщающем достоинства и недостатки основных терапевтических микроРНК-направленных технологий, а также определении перспектив и практического назначения разработанных подходов, что детально рассмотрено в настоящем обзоре. Представлены данные, опубликованные в научных статьях и открытых интернет-ресурсах за период с 2007 г., когда были предложены первые стратегии подавления функций микроРНК, по настоящее время.
Цель работы — сравнительная оценка и определение возможностей практического применения существующих в настоящее время стратегий подавления функциональной активности опухоль-ассоциированных микроРНК, основанных на использовании терапевтических нуклеиновых кислот.
ОСНОВНАЯ ЧАСТЬ
МикроРНК: от молекулярных механизмов к терапевтическому применению
Геном человека кодирует более 2300 уникальных последовательностей микроРНК [7], при этом до 60% всех генов, кодирующих белки, подвергаются посттранскрипционной регуляции, обеспечиваемой микроРНК [8]. Многообразие функций микроРНК в организации сложных генных сетей, а также контекстно-зависимая природа управления генами подчеркивает их важность в регуляции и поддержании клеточного гомеостаза, а также развития и функционирования целого организма.
Биогенез и механизм функционирования микроРНК
Синтез зрелых форм микроРНК происходит эндогенно [9–11]. Биогенез микроРНК инициируется РНК-полимеразой II с образованием первичного транскрипта при-микроРНК — сложно разветвленной шпилечной последовательности длиной до нескольких тысяч нуклеотидов. Далее путем последовательных этапов эндонуклеазного катализа происходит процессинг при-микроРНК. Эндонуклеазный комплекс Drosha-DGCR8 (DiGeorge syndrome critical region 8) разрезает при-микроРНК с высвобождением микроРНК предшественника — пре-микроРНК, которая экспортируется белком-транспортером Expo-5 в цитоплазму и подвергается дальнейшему процессингу рибонуклеазой Dicer с образованием дуплекса микроРНК длиной приблизительно 22 нуклеотида (н.). На заключительном этапе биогенеза белки семейства Ago распознают микроРНК-дуплекс, инициируют его плавление, приводящее к деградации «пассажирской» цепи (passеnger strand), и осуществляют последующую сборку РНК-индуцируемого комплекса выключения гена RISC (RNA-induced silencing complex), содержащего ведущую эффекторную цепь микроРНК. Описанная выше схема биогенеза характерна для большинства микроРНК, однако возможны альтернативные механизмы [11].
Основная функция микроРНК — ингибирование мРНК-мишеней (посттранскрипционная регуляция), которое осуществляется путем комплементарного связывания затравочной области микроРНК (seed region, 2–8 н. с 5'-конца микроРНК) со специфическими сайтами узнавания, расположенными в 3'-нетранслируемых областях (3'UTR) мРНК генов-мишеней [12][13]. В ряде случаев это взаимодействие сопровождается образованием дополнительных комплементарных пар между участком микроРНК в области 13–16 н. с мРНК (supplementary interaction region, 13–16 н.) [12][13]. Далее в сформировавшемся комплексе центральная область (8–12 н.) и 3'-концевой район (17–12/25 н.) микроРНК обеспечивают установление конформации гетеродуплекса, необходимой для последующей инактивации мРНК.
Посттранскрипционная регуляция мРНК-мишеней, индуцируемая микроРНК, может происходить посредством дестабилизации мРНК либо путем подавления трансляции [12][14]. Первый способ инактивации мРНК осуществляется путем привлечения комплексом RISC адапторного белка TNRC6 (trinucleotide repeat-containing gene 6) и деаденилаз PAN2-PAN3 (poly(A) specific ribonuclease subunits PAN2-PAN3) и CCR4-NOT (carbon catabolite repression–negative on TATA-less), укорачивающих поли(А)-хвост мРНК, что вызывает ее дестабилизацию при помощи декэпирования и экзонуклеолитической 5'→3' деградации транскрипта. Второй способ основан на привлечении хеликазы DDX6 (DEAD-box helicase 6), которая способствует непосредственному ингибированию трансляции [12][13][15].
Накапливается все больше данных о том, что кроме основной функции микроРНК участвуют в активации трансляции, эпигенетической регуляции, активации транскрипции — процессах, включающих в том числе транспорт и функционирование в ядре и митохондриях [16–18].
Стоит отметить, что микроРНК обладают уникальной мультифункциональностью, которая выражается в том, что одна микроРНК имеет широкий спектр мРНК-мишеней и может управлять клеточными сигнальными каскадами [13]. Поскольку каждый сигнальный путь, как правило, регулируется несколькими микроРНК, это приводит к созданию сложной и мощной регуляторной сети, управляющей физиологическими процессами в клетке как в норме, так и при патологии [13].
Роль микроРНК при онкологических заболеваниях
Значительный объем данных, накопленный к данному моменту, однозначно указывает на то, что аберрантно экспрессированные микроРНК играют важную роль в развитии многих заболеваний человека, включая злокачественные новообразования [3], аутоиммунные нарушения [19], нейродегенеративные [20][21] и сердечно-сосудистые заболевания [22].
Дисрегуляция экспрессии микроРНК при канцерогенезе происходит с вовлечением различных механизмов, включая делеции или амплификации локусов микроРНК, мутации генов микроРНК, эпигенетическую и транскрипционную регуляцию, посттранскрипционную модификацию, а также нарушение регуляции процессинга микроРНК [23]. Развитие злокачественных неоплазий сопровождается избытком или дефицитом определенных микроРНК по сравнению с нормальными тканями [24]. Специфическое накопление онкогенных микроРНК способствует канцерогенезу за счет подавления генов — супрессоров опухолей, тогда как глобальная потеря микроРНК-супрессоров приводит к гиперэкспрессии онкогенов. Следует подчеркнуть, что данная классификация является в определенной степени условной, поскольку в зависимости от типа злокачественного новообразования некоторые микроРНК могут играть прямо противоположную роль [25].
МикроРНК-направленные подходы к управлению процессами канцерогенеза
Для эффективного подавления процессов канцерогенеза активно разрабатываются различные микроРНК-направленные конструкции, целью которых является восстановление уровня онкосупрессорных микроРНК или снижение экспрессии и подавление функциональной активности онкогенных микроРНК. Существуют два основных подхода для восстановления уровня онкосупрессорных микроРНК: векторные вирусные системы, обеспечивающие постоянную наработку зрелых форм или молекул-предшественников онкосупрессорных микроРНК в клетке; микроРНК мимики, представляющие собой синтетические аналоги микроРНК-онкосупрессоров, обеспечивающие после введения временное повышение их уровня в клетках [26]. Следствием индуцированного повышения уровня онкосупрессорных микроРНК является подавление экспрессии онкогенных белков-мишеней и торможение процессов развития опухоли [26].
Активные исследования ведутся в области разработки микроРНК-ингибиторов на основе олигонуклеотидных конструкций. Отличительной особенностью микроРНК является их высокая внутриклеточная копийность (от 1000 до 30000 копий на клетку) в сравнении с мРНК (не превышает 100 копий) [27]. Кроме того, микроРНК отличает высокая скорость биогенеза, на порядок превосходящая скорость образования мРНК, а также рекордная продолжительность жизни, в среднем составляющая 25 ч, в сравнении с 2,2 ч — для мРНК [28][29]. Высокая внутриклеточная концентрация микроРНК, достигающая 22 мкМ, в сочетании с их устойчивостью делает их непростой мишенью для подавления под действием терапевтических нуклеиновых кислот.
По механизму действия микроРНК ингибиторы можно условно разделить на две группы: молекулярные конструкции, оказывающие опосредованное воздействие на функциональную активность микроРНК, и олигонуклеотидные агенты, ограничивающие функционирование микроРНК посредством их прямого блокирования или деградации. Вне зависимости от способа воздействия на микроРНК основной задачей применения микроРНК-ингибиторов является нарушение их взаимодействия с мРНК-мишенями, приводящее к восстановлению синтеза белков — супрессоров опухоли и подавлению процессов канцерогенеза. В таблице 1 представлены основные преимущества и недостатки различных типов микроРНК-направленных олигонуклеотидных конструкций и данные по актуальной стадии их разработки.
Таблица 1. Механизм действия и основные характеристики конструкций,
подавляющих активность онкогенных микроРНК
Table 1. Mechanisms of action and main characteristics of oligonucleotide constructs
aimed at inhibition of oncogenic miRNAs
|
Тип микроРНК-направленной олигонуклеотидной конструкции Type of miRNA-targeted oligonucleotide construct |
Механизм действия Mechanism of action |
Преимущества Advantages |
Недостатки Disadvantages |
|
МикроРНК маскирующие олигонуклеотидыa miRNA-masking oligonucleotidesa |
Формирование комплекса с мРНК мишенями Binding to mRNA targets |
Возможность оценить влияние взаимодействия микроРНК с определенной мРНК-мишенью на процессы канцерогенеза Ability to assess the impact of miRNA interaction with a specific mRNA target on carcinogenesis processes |
· Недостаточная универсальность: требует подтверждения функциональной связи пары микроРНК-мРНК в каждом типе клеток. · Воздействие лишь на одну мРНК-мишень из всего пула мРНК, регулируемого целевой микроРНК · Lacks universality and requires confirmation of functional binding of the miRNA–mRNA dyad in each cell type. · Affects only one mRNA target from the entire mRNA pool regulated by the miRNA |
|
МикроРНК-направленные системы геномного редактирования CRISPR/Cas9b miRNA-targeted CRISPR/Cas9 genome editing systemsb |
Нарушение биосинтеза микроРНК путем внесения мутаций в гены микроРНК Disruption of miRNA biosynthesis by introduction of mutations in miRNA genes |
· Высокая селективность метода. · Возможность получения клеточных линий с полным нокаутом по гену микроРНК · High selectivity of the method. · Possibility to obtain cell lines with complete miRNA gene knockout |
· Спектр микроРНК-мишеней ограничен доступностью сайтов посадки систем геномного редактирования в геноме. · Эффективность подавления зависит от количества копий генов микроРНК в геноме · The spectrum of miRNA targets is limited by the availability of target sites in the genome for recognition by genome editing systems. · Suppression efficiency depends on the number of miRNA gene copies in the genome |
|
МикроРНК спонжиb miRNA spongesb |
Стерическое блокирование микроРНК Steric blocking of miRNAs |
· Одновременное подавление большого числа копий микроРНК. · Возможность комбинирования в единой структуре сайтов посадки к нескольким различным микроРНК. · Высокая продолжительность эффектов · Simultaneous suppression of a large number of miRNA copies. · Possibility of combining binding sites of several different miRNAs in a single structure. · Long-lasting effects |
· Высокая трудоемкость конструирования. · Иммуногенность · Labour-intensiveness of construction. · Immunogenicity due to the substantial size of the constructs |
|
Малые РНК зипперыb Small RNA zippersb |
Стерическое блокирование микроРНК Steric blocking of miRNAs |
Высокая эффективность подавления онкогенных микроРНК High efficiency of oncogenic miRNA inhibition |
Отсутствие исследований биологической активности in vitro и in vivo Lack of biological activity studies in vitro and in vivo |
|
Антисмысловые олигонуклеотидыc Antisense oligonucleotidesc |
Стерическое блокирование или расщепление микроРНК мишени при активации внутриклеточных ферментов Steric blocking or degradation of the target miRNA via activation of intracellular enzymes |
· Высокая биологическая активность in vitro и in vivo. · Высокая нуклеазоустойчивость. · Синергическое действие с другими терапевтическими агентами · High biological activity in vitro and in vivo. · High nuclease resistance. · Synergistic action with other therapeutic agents |
· Большинство химических модификаций не обеспечивает РНКаза Н-активирующую способность. · Необходимость оптимизации режима введения препаратов · Most chemical modifications do not confer RNase H-activating ability. · Dosing regimens need optimisation |
|
МиРНКазыb miRNAsesb |
Расщепление микроРНК мишени в каталитическом режиме посредством собственной каталитической группы и активации внутриклеточных ферментов Degradation of the miRNA target in the catalytic mode due to its own ribonuclease activity accompanied by activation of intracellular enzymes |
· Наличие собственной каталитической активности. · Синергическое действие с РНКазой Н. · Высокая стабильность к действию нуклеаз · Intrinsic catalytic activity. · Synergistic action with RNase H. · High nuclease stability |
· Зависимость эффективности расщепления микроРНК от последовательности мишени. · Высокая чувствительность конструкций к введению химических модификаций · Dependence of miRNA cleavage efficiency on the sequence of the target. · High sensitivity of constructs to chemical modifications |
Таблица составлена авторами / The table is prepared by the authors
a Конструирование микроРНК-маскирующих олигонуклеотидов возможно на платформе miScript Target Protectors (QIAGEN, США) https://www.qiagen.com/kr/spotlight-pages/ias/automated-qpcr-workflow/detection/miscript-target-protectors/
b Данный тип конструкций находится на стадии доклинических исследований.
c На рынке представлены различные варианты коммерческих ингибиторов микроРНК на основе антисмысловых олигонуклеотидов производства ThermoFisher Scientific (США), Integrated DNA Technologies (США), Exiqon (Дания), GenePharma (Китай) и др. На этапе клинических исследований находятся три микроРНК-направленных препарата на основе антисмысловых олигонуклеотидов: LNA-i-miR-221 (Azienda Ospedaliera Universitaria Mater Domini), MRG106 (miRagen therapeutics), RG-012 (Regulus Therapeutics).
a The platform miScript Target Protectors by QIAGEN, USA (https://www.qiagen.com/kr/spotlight-pages/ias/automated-qpcr-workflow/detection/miscript-target-protectors/) provides means to construct miRNA-masking oligonucleotides.
b This type of oligonucleotide constructs is at the preclinical development stage.
c At the moment, commercially available variants of miRNA inhibitors based on antisense oligonucleotides include products by Thermo Fisher Scientific (USA), Integrated DNA Technologies (USA), Exiqon (Denmark), GenePharma (China), and other companies. Three miRNA-targeted inhibitors based on antisense oligonucleotides, including LNA-i-miR-221 (Azienda Ospedaliera Universitaria Mater Domini), MRG106 (miRagen Therapeutics), and RG-012 (Regulus Therapeutics), are at the clinical development stage.
Молекулярные системы и конструкции, оказывающие опосредованное влияние на функциональную активность микроРНК
На рисунке 1 представлены микроРНК-ингибиторы, обеспечивающие подавление функций микроРНК без непосредственного связывания со зрелыми микроРНК-мишенями.
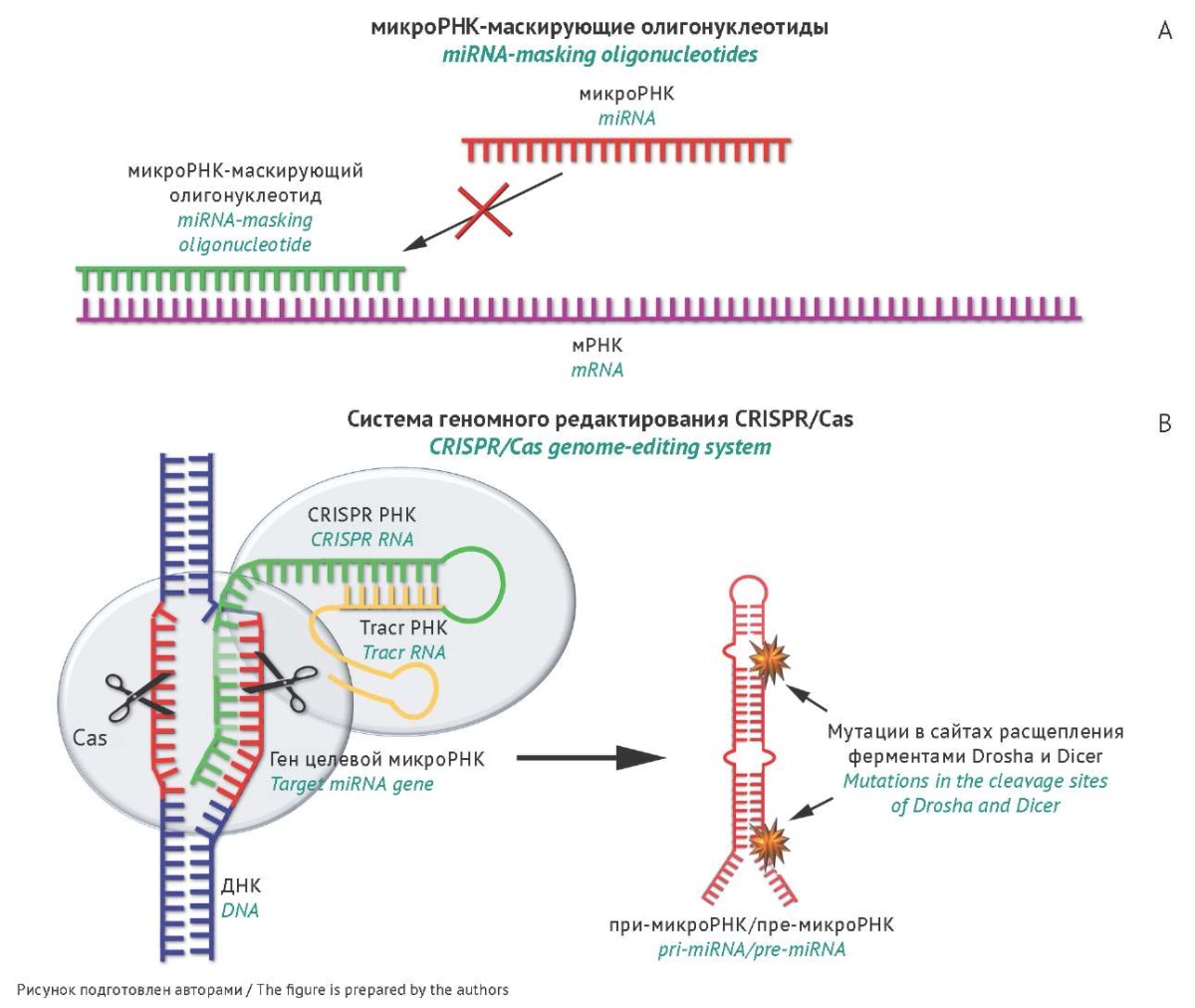
Рис. 1. Олигонуклеотидные конструкции, оказывающие опосредованное действие на функциональную активность микроРНК: А — микроРНК-маскирующие олигонуклеотиды, блокирующие сайты узнавания микроРНК на определенных мРНК-мишенях; В — системы геномного редактирования CRISPR/Cas, вызывающие нарушение биосинтеза микроРНК за счет введения мутаций в гены целевых микроРНК. При-микроРНК — первичный транскрипт, содержащий последовательность зрелой микроРНК, пре-микроРНК — предшественник микроРНК, tracr РНК — trans-activating (транс-активирующая) РНК, CRISPR — короткие палиндромные повторы, регулярно расположенные группами (clustered, regularly interspaced short palindromic repeats).
Fig. 1. Oligonucleotide constructs indirectly influencing the functional activity of miRNAs. (А) miRNA-masking oligonucleotides blocking miRNA recognition sites on mRNA targets. (B) CRISPR/Cas genome-editing systems causing miRNA biosynthesis disruption due to miRNA gene mutations. Pri-miRNA, primary transcript containing mature miRNA sequence; pre-miRNA, precursor miRNA; tracr RNA, trans-activating RNA; CRISPR RNA, clustered regularly interspaced short palindromic repeats RNA.
МикроРНК-маскирующие олигонуклеотиды
Одним из способов подавления функций микроРНК являются микроРНК-маскирующие олигонуклеотиды (далее микроРНК-маски). Эти олигонуклеотиды образуют прочные комплементарные комплексы с мРНК и блокируют сайты узнавания микроРНК (рис. 1А, табл. 1).
В большинстве работ микроРНК-маски используются для подтверждения взаимосвязи микроРНК-мРНК-мишень для определения их вовлеченности в процессы онкотрансформации. Так, с использованием микроРНК-масок было установлено, что микроРНК-145 негативно регулирует уровень биосинтеза белка CFTR (cystic fibrosis transmembrane conductance regulator), низкий уровень которого в клетках аденокарциномы легкого человека связан с повышенным риском развития опухоль-ассоциированного кистозного фиброза [30]. Выявлено, что микроРНК-203 подавляла экспрессию белка LASP-1 (LIM and SH3 protein 1) и стимулировала пролиферацию опухолевых клеток. В работе Т. Colangelo с соавт. показано, что микроРНК-17 обеспечивала NOR-1 (nuclear hormone receptor-1)-опосредованную регуляцию ангиогенеза, а микроРНК-27а обладала анти-апоптотическим эффектом за счет регуляции экспрессии белка CALR (calreticulin) [31]. Было установлено, что микроРНК-маски, блокирующие связывание микроРНК-522 с мРНК гена DENND2D (DENN domain containing 2D), вызывали замедление пролиферации и индукцию апоптоза клеток немелкоклеточного рака легкого в исследовании in vitro [32]. Использование микроРНК-масок, препятствующих связыванию микроРНК-30 с мРНК DLL4 (delta like canonical Notch ligand 4), приводило к подавлению ангиогенеза [33], а микроРНК-маски, выключающие взаимодействие микроРНК-9 и мРНК PTCH1А (protein patched homologue 1А), восстанавливали чувствительность клеток глиобластомы к темозоломиду [34].
Важно отметить, что применение микроРНК-масок имеет большое значение для фундаментальных исследований, поскольку позволяет изучить молекулярные основы канцерогенеза и оценить степень вовлеченности любой пары микроРНК–мРНК в ключевые клеточные процессы. Высокую значимость этого молекулярно-биологического инструмента подтверждает наличие коммерческого препарата miScript Target Protectors (QIAGEN, США) для конструирования препаратов1. Однако применение микроРНК-масок в качестве терапевтических агентов весьма ограничено. Существенным недостатком подхода является меньшая эффективность действия микроРНК-масок по сравнению с микроРНК-блокирующими конструкциями — при использовании микроРНК-масок происходит блокирование взаимодействий микроРНК лишь с одной терапевтической мишенью, тогда как молекулярные связи микроРНК с остальными регулируемыми мРНК сохраняются [32]. Низкая биологическая активность микроРНК-масок на клеточных моделях, вероятно, является причиной отсутствия данных о применении данного типа препаратов на опухолевых моделях in vivo.
МикроРНК-направленные системы геномного редактирования CRISPR/Cas
C начала 2010-х гг. активно развивается и применяется технология геномного редактирования с использованием системы CRISPR/Cas (clustered regularly interspaced short palindromic repeats and their associated Cas proteins) [35]. Система CRISPR/Cas с высокой специфичностью и селективностью вносит двуцепочечные разрывы в выбранных областях ДНК, стимулируя репарацию по механизму негомологичного соединения концов, что способствует возникновению мутаций по типу делеции или инсерции в гене-мишени и вызывает последующее снижение уровня экспрессии мишени (в данном контексте микроРНК).
Эта технология нашла свое применение и в качестве инструмента подавления функций онкогенных микроРНК. Нарушения в геноме, вносимые с помощью CRISPR/Cas, делают невозможным узнавание при- и пре-микроРНК белками биогенеза Drosha и Dicer, приводят к блокированию процессинга микроРНК, способствуют утилизации мутантных транскриптов и нарушению взаимодействий микроРНК с мРНК-мишенями (рис. 1B, табл. 1). Установлено, что эффективность подавления уровня микроРНК в клетке под действием CRISPR/Cas существенно варьирует в зависимости от количества копий генов микроРНК в геноме, а также доступности протоспейсера PAM (protospacer adjacent motif) вблизи гена микроРНК [36]. Использование CRISPR/Cas9 позволило снизить на 55–96% экспрессию микроРНК-17, микроРНК-200c и микроРНК-141 в клетках колоректального рака in vitro [37][38]. При ингибировании микроРНК-93 в клетках HeLa с применением CRISPR/Cas было показано, что делеция даже одного нуклеотида в 5'-области микроРНК приводила к ее нокауту [39].
В настоящее время системы CRISPR/Cas чаще используются в исследованиях в качестве эффективного инструмента изучения молекулярных механизмов канцерогенеза, так как этот подход позволяет как выделить ключевые микроРНК-драйверы канцерогенеза, так и оценить влияние взаимодействий микроРНК с определенными мРНК-мишенями на изменение фенотипа опухолевых клеток [40][41]. Широко исследуется и терапевтический потенциал систем CRISPR/Cas. Установлено, что при использовании CRISPR/Cas9 для ингибирования онкогенных микроРНК (микроРНК-17, микроРНК-21, микроРНК-141 и микроРНК-3188) на опухолевых клетках различного гистогенеза наблюдались следующие эффекты: двукратное снижение пролиферации и инвазии опухолевых клеток; в 5 раз снижались их миграция и эпителиально-мезенхимальный переход; значительно увеличивались чувствительность клеток к цитостатикам и индукция апоптоза [42]. Значительный противоопухолевый эффект был выявлен на трех типах глиом (GL261, CT2A и U87) при использовании системы CRISPR/Cas9, направленной к микроРНК-21. Установлено, что интракраниальное введение опухолевых клеток с нокаутом по микроРНК-21 приводило к многократному снижению скорости роста опухоли и увеличению продолжительности жизни животных-опухоленосителей с 20 до 40 или 60 дней, в зависимости от типа опухоли [43].
Наряду с очевидными достоинствами системы CRISPR/Cas9 следует отметить и ряд существенных недостатков терапии с ее использованием: высокая вероятность неспецифического встраивания в геном; нежелательный иммунный ответ, ассоциированный с иммуногенностью как систем геномного редактирования, так и вирусных векторов, используемых в качестве доставляющих агентов [44]; ограниченный спектр микроРНК, чувствительных к действию CRISPR/Cas9, что определяется доступностью PAM мотивов вблизи генов микроРНК [36]; отсутствие контроля за степенью подавления микроРНК, который меняется в зависимости от копийности мишени в геноме.
Олигонуклеотидные конструкции, обеспечивающие стерическое блокирование или деградацию онкогенных микроРНК
На рисунке 2 представлены микроРНК-направленные конструкции на основе терапевтических нуклеиновых кислот, которые подавляют функциональную активность микроРНК в результате их стерического блокирования или необратимой деградации.
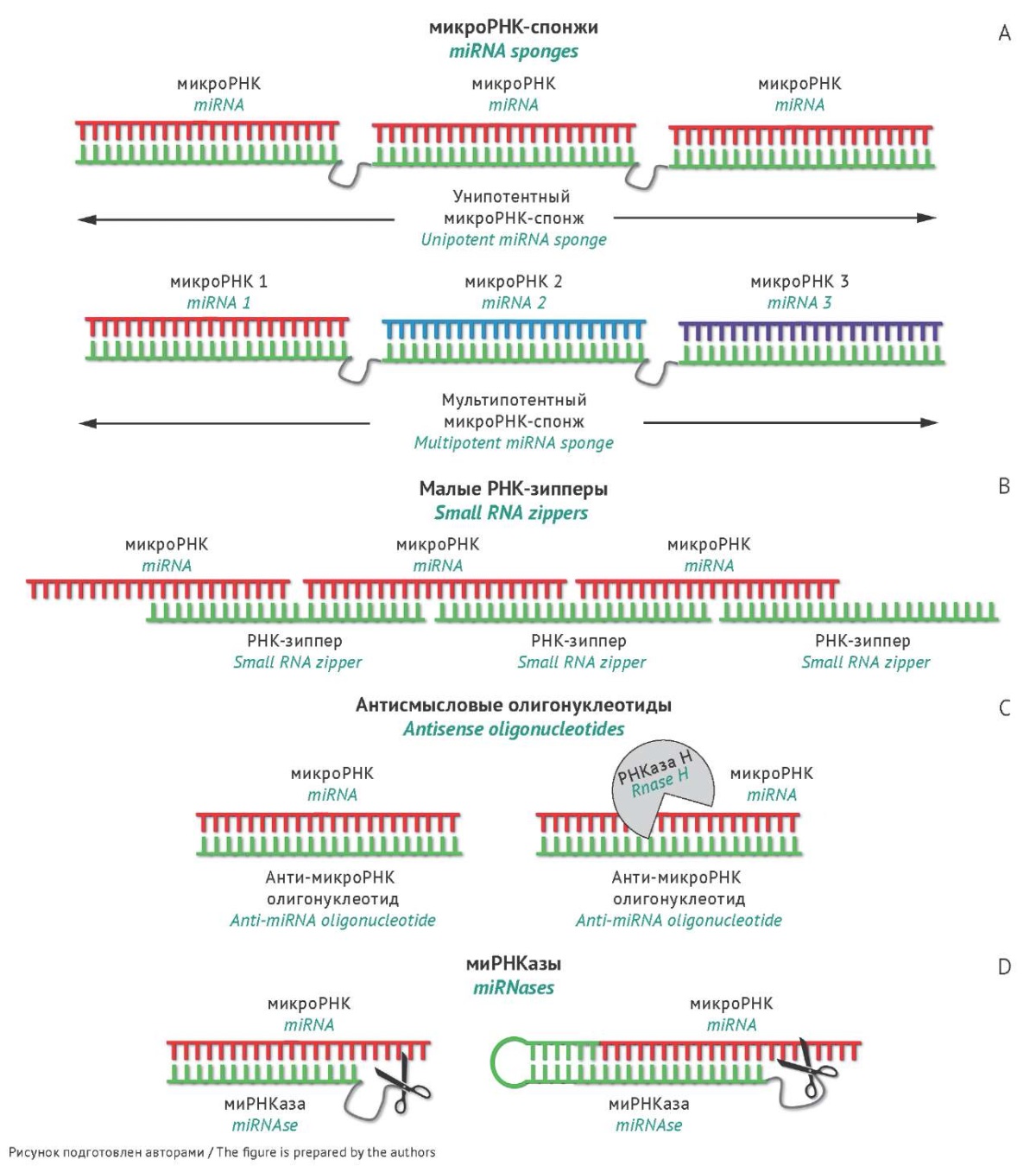
Рис. 2. МикроРНК-связывающие конструкции, вызывающие стерическое блокирование или деградацию микроРНК. Схематичное изображение комплексов микроРНК с уни- и мультипотентными микроРНК-спонжами (А); малыми РНК-зипперами (B); антисмысловыми олигонуклеотидами, вызывающими стерическое блокирование или деградацию микроРНК под действием РНКазы Н (C); миРНКазами (D).
Fig. 2. miRNA-binding constructs exhibiting steric blocking or degradation of miRNAs. Schematic depiction of miRNA complexes with mono- or multipotent miRNA sponges (A), small RNA-zippers (B), antisense oligonucleotides exhibiting steric blocking or RNAse H-mediated miRNA degradation (C), miRNases (D).
МикроРНК-спонжи
МикроРНК-спонжи представляют собой синтетический транскрипт, содержащий несколько тандемно расположенных сайтов посадки целевой микроРНК, соединенных линкерами [45] (рис. 2А, табл. 1). Были разработаны синтетические микроРНК-спонжи как линейной структуры, так и замкнутой формы, имитирующей природные кольцевые молекулы РНК [46]. Выбор кольцевых конструкций микроРНК-спонжей обычно объясняется их повышенной нуклеазоустойчивостью, тогда как для линейных форм увеличение биологической стабильности обеспечивается введением модифицированных звеньев [47].
Существенным достоинством спонжей является способность связывать одновременно до 20 копий микроРНК, что приводит к быстрому подавлению ее функциональной активности и восстановлению уровней белков-мишеней [48]. Так, использование микроРНК-спонжей к микроРНК-21 привело к двукратному подавлению пролиферации и колониеобразования клеток аденокарциномы легкого и снижению резистентности клеток рака молочной железы к доксорубицину [49][50]. Применение спонжей к микроРНК-10b обеспечивало 1,5-кратное снижение миграции и инвазии клеток рака молочной железы in vitro [51]. Спонжи к микроРНК-155 пятикратно подавляли пролиферацию клеток множественной миеломы [52]. В исследовании in vitro показано, что введение спонжа к микроРНК-221/222 способствовало двукратному подавлению роста опухоли на модели колоректального рака [53].
Важным преимуществом микроРНК-спонжей является возможность конструировать мультитаргетные варианты, содержащие сайты посадки различных микроРНК одновременно (рис. 2А). В ряде работ продемонстрировано, что такой подход более эффективен в сравнении с применением как моновалентных спонжей (одна микроРНК), так и комбинаций нескольких разнонаправленных спонжей. Бивалентный спонж к микроРНК-31 и микроРНК-155, а также спонж, блокирующий одновременно 4 микроРНК (микроРНК-17, микроРНК-18а, микроРНК-19 и микроРНК-92), примерно в 2 раза более эффективно снижали пролиферацию клеток рака легкого и лимфомы Ходжкина соответственно по сравнению с моновалентным спонжем [46]. Антипролиферативный эффект на клетках рака молочной железы полифункциональных спонжей, направленных к микроРНК-21, микроРНК-155 и микроРНК-17, был в 4 раза выше, чем у спонжей, направленных к одной микроРНК [54].
Существенным недостатком спонжей является сложность конструирования такого типа микроРНК-ингибиторов: необходимо использование линкера подходящей длины и выбор оптимального количества сайтов посадки микроРНК (не менее 4 и не более 20, что связано с зависимостью эффективности связывания микроРНК от количества сайтов посадки микроРНК на спонже — наибольший рост эффективности инактивации микроРНК наблюдается при последовательном добавлении в структуру спонжа от 1 до 4 таких сайтов, а введение более 20 сайтов связывания не приводит к усилению ингибирующего эффекта) [48][55]; введение определенного паттерна мисмэтчей в сайты посадки микроРНК для предотвращения расщепления спонжа белком Ago2, которое возникает в случае полной комплементарности спонжа и микроРНК; клонирование последовательности спонжа в структуру вирусного вектора [46].
Данное направление развивается в сторону изучения микроРНК-связывающего потенциала природных длинных кольцевых РНК, о чем свидетельствуют несколько тысяч публикаций на эту тему за последние 5 лет [56][57].
Малые РНК-зипперы
Перспективным подходом к ингибированию микроРНК является конструирование малых РНК-зипперов — олигонуклеотидов, которые одновременно связываются с двумя молекулами микроРНК, стыкуя их по принципу «голова» к «хвосту» (рис. 2B, табл. 1). Это достигается за счет того, что первые 10–12 н. зиппера комплементарны 3'-концу молекулы целевой микроРНК, а следующие 10–12 н. — ее 5'-концу [58]. В результате в клетке образуется протяженный гетеродуплекс, похожий на застежку типа «молния», приводящий к выведению существенной доли целевой микроРНК из пула функционально активных молекул. На клетках рака молочной железы было установлено, что трансфекция клеток зипперами к микроРНК-17 и микроРНК-221 позволяла снизить уровень этих микроРНК в клетках на 90%, что сопровождалось подавлением миграции и снижением резистентности опухолевых клеток к доксорубицину в 1,5 раза [58]. На сегодня это единственный пример использования данного типа конструкций. Очевидным преимуществом этой стратегии является высокая эффективность подавления онкогенных микроРНК в опухолевых клетках. Однако недостаточное количество данных о применении РНК-зипперов на клетках иного гистогенеза или моделях опухоли in vivo не позволяет исчерпывающе оценить терапевтический потенциал данных конструкций.
МикроРНК-направленные антисмысловые олигонуклеотиды
Антисмысловые олигонуклеотиды (antisense oligonucleotide, ASO) являются в настоящее время наиболее применяемой технологией подавления онкогенных микроРНК на опухолевых моделях различного гистогенеза in vitro и in vivo. Данный подход основан на использовании коротких синтетических олигонуклеотидов длиной 15–20 н., комплементарных определенным микроРНК (рис. 2C, табл. 1). Для увеличения продолжительности и эффективности действия антисмысловых олигонуклеотидов в клетке в их структуру вводят различные модификации, что обеспечивает улучшение гибридизационных свойств и нуклеазоустойчивости соединений, а также во многом определяет механизм действия антисмысловых олигонуклеотидов. Основным механизмом ингибирования под действием ASO является образование прочного комплементарного комплекса с микроРНК-мишенью. Затем в случае, если используется ASO дезокси-ряда, происходит рекрутирование внутриклеточного фермента РНКазы Н, который способен распознавать гетеродуплекс РНК-ДНК и вызывать эндонуклеазную деградацию РНК в составе гетеродуплекса. Однако часть разработанных модификаций, включая 2'-O-мeтильную (2'OMe), 2'-фтор-содержащую (2'F), 2'-O-мeтоксиэтильную (2'MOE), замкнутые нуклеиновые кислоты (locked nucleic acids, LNA) и пептидил-нуклеиновые кислоты (peptidyl nucleic acids, PNA), при введении в структуру олигонуклеотида препятствуют рекрутингу РНКазы Н. В связи с этим олигонуклеотиды, содержащие химические группы, несовместимые с работой РНКазы Н, обеспечивают ингибирование микроРНК за счет ее стерического блокирования.
Оценка биологических эффектов ASO показала, что применение анти-микроРНК-221 и анти-микроРНК-222 2'OMe-ASO способствовало 1,5-кратному подавлению пролиферации клеток глиобластомы [59]. Использование коммерческих 2'МОЕ-модифицированных ASO против микроРНК-23а и микроРНК-93 приводило к двукратному подавлению миграции клеток карциномы почек и выживаемости клеток рака желудка соответственно [60][61]. Введение 2'MOE ASO к микроРНК-10b способствовало более чем двукратному снижению роста интракраниальной формы глиобластомы и значительному увеличению продолжительности жизни мышей-опухоленосителей [62].
Более перспективным представляется использование модификаций ASO, способных активировать РНКазу Н. В связи с этим широкое распространение получили фосфоротиоатные (phosphorothioate, PS) ASO, которые отличаются повышенной нуклеазоустойчивостью и способностью активировать РНКазу Н. Такие ASO эффективны при применении как in vitro, так и in vivo. Показано, что PS-ASO к микроРНК-182 обеспечивали двукратное снижение количества метастазов в печени при меланоме [63], а PS-ASO к микроРНК-21 способствовали двукратному подавлению роста опухоли эпидермоидной карциномы in vivo [64].
Стоит отметить, что основным недостатком PS-ASO является неспецифическая токсичность, ассоциированная с высоким сродством PS-групп к серосодержащим белкам, а также несколько худшие гибридизационные свойства, чем у олигонуклеотидов дезокси-ряда.
Исследовательской группой ФГБУН Институт химической биологии и фундаментальной медицины Сибирского отделения Российской академии наук (ИХБФМ СО РАН) впервые были изучены свойства микроРНК-направленных олигонуклеотидов, содержащих новую модификацию межнуклеотидных связей — N(метансульфонил)фосфорамидную (µ). Введение µ-групп по всем межнуклеотидным связям наделяет ASO рядом исключительных характеристик, включая высокие гибридизационные свойства, рекордную нуклеазоустойчивость (168 ч против 96 ч для µ- и PS-ASO соответственно), способность рекрутировать РНКазу Н, двукратно превышающую возможности PS-ASO [65]. Исследование потенциала разработанных олигонуклеотидов на опухолевых клетках подтвердило преимущество µ-ASO над PS-аналогами. µ-ASO к микроРНК-21 обеспечивал 4-кратное (1,3 раза для PS-ASO) снижение пролиферации, 19-кратное (5 раз для PS-ASO) подавление миграции и 3-кратное увеличение количества клеток меланомы В16 в состоянии апоптоза (5-кратное для PS-ASO в основном из-за общей неспецифической токсичности PS-модификации) [65][66]. Важным результатом применения µ-олигонуклеотидов являлось 8-кратное подавление роста опухоли эпидермоидной карциномы KB-8-5 человека и 6-кратное подавление метастазирования в легких на модели меланомы B16 мыши [64][66]. Следует отметить, что µ-олигонуклеотиды практически не оказывали неспецифического токсического действия на организм, при этом было выявлено уменьшение деструктивных изменений в печени животных-опухоленосителей, ассоциированных с развитием неоплазии [64].
Действие ASO может быть усилено при их комбинированном применении, аналогично микроРНК-спонжам. В случае использования комбинаций нескольких микроРНК-направленных ASO происходит одновременное разнонаправленное подавление процессов канцерогенеза за счет восстановления уровня белков супрессоров опухоли. Так, на модели лимфосаркомы RLS40 in vivo было установлено, что перитуморальное инъекционное введение парных и тройной комбинации µ-ASO, направленных к микроРНК-21, микроРНК-17 и микроРНК-155, обеспечивало в 3,5 раза более эффективное подавление роста опухоли по сравнению с монотерапией, способствуя практически полному торможению ее роста [66].
Важнейшим достоинством анти-микроРНК-олигонуклеотидов является их выраженное синергическое действие с традиционными химиотерапевтическими агентами. Так, установлено, что использование LNA-ASO к микроРНК-21 совместно с сунитинибом обеспечивало двукратное усиление противоопухолевого эффекта при терапии глиобластомы in vivo [67]. Применение метокси-анти-микроРНК-21 олигонуклеотида на клетках рака поджелудочной железы приводило к снижению значения показателя цитотоксической активности (IC50) для препарата гемцитабин в 6 раз; на модели in vivo продемонстрирован в 4 раза более выраженный противоопухолевый эффект и полное блокирование метастазирования в печени по сравнению с терапией олигонуклеотидом или гемцитабином по отдельности [68]. Вероятно, применение анти-микроРНК ASO в таких комбинациях способствует подавлению белков, связанных с формированием резистентности клеток к цитостатическим препаратам, и усиливает эффект последующей химиотерапии.
В настоящее время в клинических исследованиях (КИ) находятся несколько кандидатных противоопухолевых препаратов на основе микроРНК-направленных ASO. Так, в 2022 г. успешно завершена 1 фаза КИ препарата на основе PS и LNA-модифицированного ASO к онкогенной микроРНК-221 для терапии множественной миеломы [69]2. В результате проведенных исследований с участием 17 пациентов с прогрессирующими солидными формами неоплазий было показано, что инъекции разработанного препарата LNA-i-miR-221 не вызывают неспецифических токсических эффектов 3–4 степени в дозовом диапазоне 0,5–5,0 мг/кг [69]. Исследование противоопухолевого эффекта LNA-i-miR-221 показало, что у большей части пациентов наблюдается стабильное течение заболевания, а для одного из пациентов был установлен частичный ответ на лечение, выражающийся в увеличении чувствительности к последующей радиотерапии [69]. К настоящему моменту закончена 2 фаза КИ препарата LNA-ASO к микроРНК-155 (miRagen Therapeutics, Inc, США) для терапии лимфосаркомы и Т-клеточной лимфомы3. В результате проведенных исследований лишь у двух пациентов из 19 наблюдались серьезные побочные эффекты, проявившиеся в виде кожных инфекций. Успешно завершена 1 фаза КИ препарата RG-012 (Regulus Therapeutics, США), представляющего собой ASO к микроРНК-21 для терапии патологии почек4.
Основную проблему, связанную с терапевтическим использованием микроРНК-направленных олигонуклеотидов, представляет оптимизация способа доставки и режима их введения. В большинстве случаев доставка микроРНК-направленных ASO происходит с использованием различных доставляющих агентов, включая наночастицы, таргетные лиганды, дендримеры, катионные липосомы, а время их действия определяется скоростью деградации в физиологической среде. Для поддержания стабильного противоопухолевого эффекта требуется многократное введение препаратов. В связи с этим для каждого типа опухолевого заболевания, отличающегося по степени агрессивности и скорости деления клеток, необходимо определять концентрационные и кинетические параметры накопления анти-микроРНК олигонуклеотидов для выбора дозы и периодичности введения препаратов.
МиРНКазы
МикроРНК-направленные искусственные рибонуклеазы (иРНКазы) объединяют в единой структуре олигонуклеотидную компоненту, обеспечивающую связывание с определенной микроРНК-мишенью, и каталитический домен, который может быть представлен коротким пептидом, производными имидазола или аминов, способный катализировать расщепление РНК-субстрата (рис. 2D, 3, табл. 1). Структура каталитического домена определяет механизм действия разработанных иРНКаз. Если каталитическая группа представлена производными имидазола или остатками гистидина, деградация микроРНК происходит по механизму кислотно-основного катализа подобно ферменту РНКазы А [70][71]. Если в качестве расщепляющей группы выступает пептид на основе остатков аргинина, то расщепление мишени осуществляется посредством реакции трансэтерификации [72].
Конъюгаты, работающие по механизму кислотно-основного катализа, в настоящий момент исследованы только in vitro. Так, установлено, что конъюгаты линейных PNA-олигнуклеотидов с трис-(2-аминобензимидазолом) обеспечивали расщепление микроРНК-20а на 85% через 60 ч [71]. иРНКазы на основе линейных PNA-олигонуклеотидов и каталитических групп в виде короткого трипептида [His(Gly)2] или диэтилентриамина (ДЭТА) приводили к расщеплению синтетической микроРНК-1323 на 47,5 или 90% через 24 ч соответственно [70]. Активность данных конструкций in vivo пока не изучена.
В совместном исследовании ИХБФМ СО РАН и Университета Манчестера были разработаны и изучены конъюгаты антисмысловых олигонуклеотидов и каталитического пептида из чередующихся остатков аргинина, лейцина и глицина [(LeuArg)2Gly]2, которые получили название «миРНКазы» (рис. 3). В настоящее время авторами данной статьи разработано несколько структурных вариантов миРНКаз, включая линейные, шпилечные, двойные и петлеобразующие миРНКазы, направленные к онкогенным микроРНК-21, микроРНК-17, микроРНК-18а и микроРНК-155, которые отличаются по структуре олигонуклеотидного домена (рис. 3) [72–74]. Линейные конъюгаты содержали в качестве адресной компоненты 16-звенный олигонуклеотид, полностью комплементарный 5'-концу микроРНК (рис. 3А) [72]. Шпилечные миРНКазы включали олигонуклеотид, содержащий обогащенную пурином шпильку и 14-звенную последовательность, связывающую 5'-конец микроРНК (рис. 3B) [72]. Двойные конъюгаты содержали два олигонуклеотидных плеча длиной 8–10 н., комплементарных 5'- и 3'-области мишени, соединенные между собой гибким линкером, и при связывании с микроРНК формировали центральный свободный гэп в последовательности мишени (рис. 3C) [73]. Структура петлеобразующих миРНКаз включала линейный олигонуклеотид, комплементарный полноразмерной микроРНК, формирующий при связывании с ней тринуклеотидную петлю в ее центральной области (рис. 3D) [74].
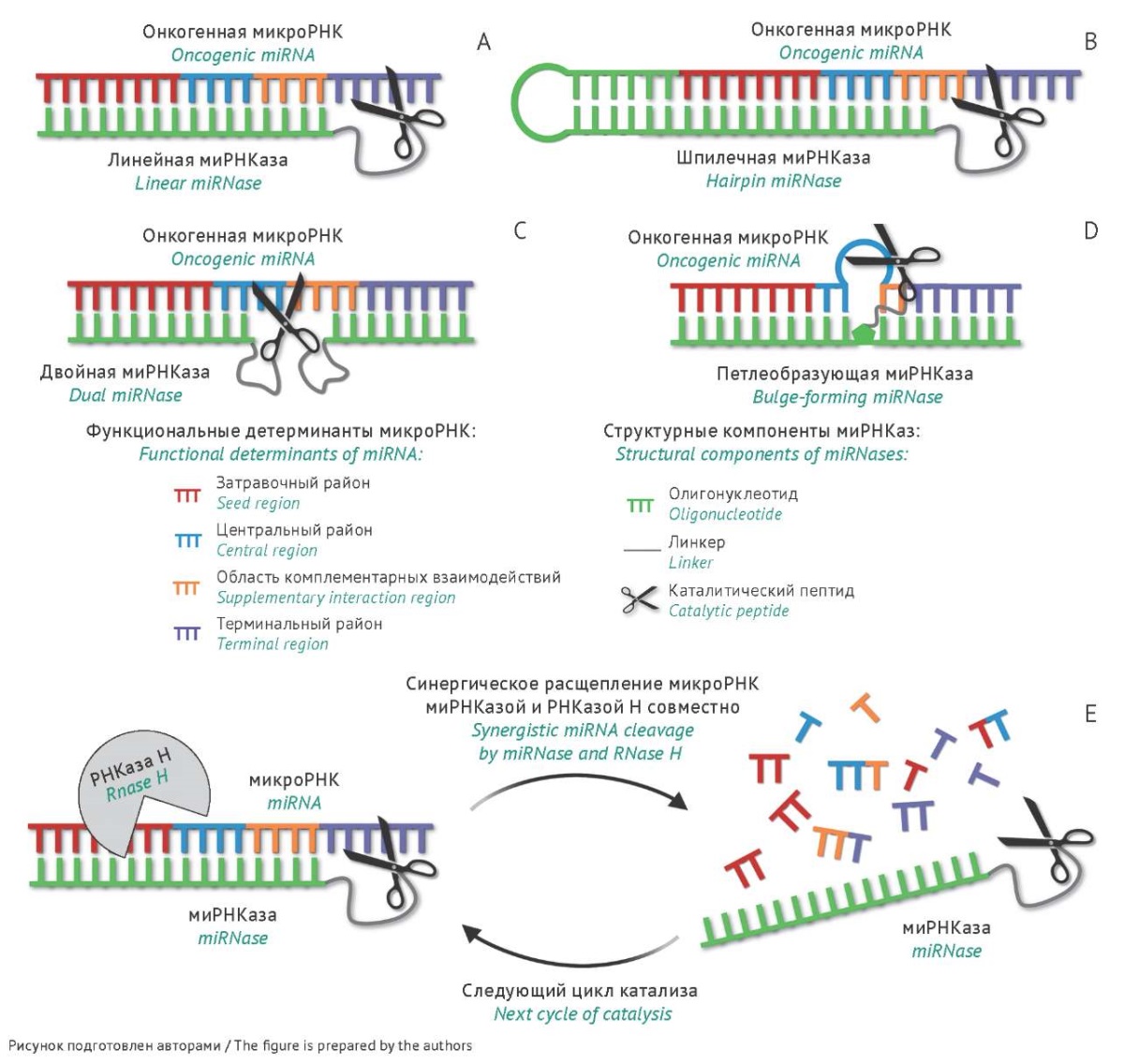
Рис. 3. МикроРНК-направленные искусственные РНКазы (миРНКазы). Структурные варианты миРНКаз, сконструированных на основе микроРНК-связывающих олигонуклеотидов и каталитического пептида [(LeuArg)2Gly]2: А — линейная миРНКаза, B — шпилечная миРНКаза, C — двойная миРНКаза, D — петлеобразующая миРНКаза. E — упрощенная схема синергического расщепления микроРНК под действием миРНКазы и РНКазы Н совместно.
Fig. 3. miRNA-targeted artificial RNases (miRNases). Structural variants of miRNases constructed on the basis of miRNA-binding oligonucleotides and the catalytic peptide [(LeuArg)2Gly]2: linear miRNase (A), hairpin miRNase (B), dual miRNase (C), bulge-forming miRNase (D). Simplified representation of synergistic miRNA cleavage by miRNase and RNase H (E).
Исследование рибонуклеазных свойств разработанных миРНКаз показало, что эффективность расщепления микроРНК увеличивается в ряду: двойные < петлеобразующие < линейные и шпилечные миРНКазы [72–74]. Среди разработанных миРНКаз наибольшую каталитическую активность продемонстрировали шпилечные аналоги. Дальнейшее исследование их биологических свойств выявило их значительный потенциал в качестве противоопухолевых агентов: для этих миРНКаз наблюдалось двукратное уменьшение уровня целевой микроРНК в клетках, ассоциированное с двукратным снижением пролиферации, трехкратным подавлением инвазии, а также увеличением в 2 раза доли клеток в состоянии апоптоза [75]. Значительным результатом применения шпилечных миРНКаз является 17-кратное подавление роста солидной формы лимфосаркомы RLS40 in vivo, достигнутое после трансфекции опухолевых клеток миРНКазой ex vivo [75].
Основным преимуществом разработанных миРНКаз является наличие собственной высокой рибонуклеазной активности — они эффективно расщепляют микроРНК, находящуюся в избытке по отношению к миРНКазе, что было продемонстрировано в эксперименте с расщеплением 10-кратного избытка РНК субстрата [75]. Таким образом, миРНКазы работают в истинно каталитическом режиме. Это свойство, характерное для природных рибонуклеаз, подразумевает способность ферментов после совершения акта расщепления микроРНК диссоциировать из комплекса, связываться с новой молекулой субстрата и осуществлять ее расщепление. Стоит отметить, что способность к реакции многооборотного расщепления субстрата труднодостижима при конструировании искусственных ферментов. В настоящее время каталитический режим работы был установлен только для некоторых металл-зависимых иРНКаз и для миРНКаз.
Исключительной характеристикой всех разработанных миРНКаз является их синергическое действие с РНКазой Н. Поскольку олигонуклеотидный домен сконструированных конъюгатов представляет собой ДНК олигонуклеотид, формирование гетеродуплексов миРНКаз с микроРНК-мишенью обеспечивает рекрутинг РНКазы Н и дополнительное расщепление микроРНК в таком комплексе, причем сайты расщепления РНКазой Н и миРНКазой не перекрываются, а расщепление микроРНК происходит по всем функциональным детерминантам [74]. При совместном действии миРНКазы и РНКазы Н скорость и эффективность деградации микроРНК возрастает в 15–20 раз по сравнению с действием только миРНКаз или РНКазы Н (рис. 3Е) [73][75].
Дополнительным преимуществом сконструированных миРНКаз является их относительно высокая стабильность к действию нуклеаз. На примере шпилечных аналогов установлено, что сочетание обогащенной пурином высокостабильной шпильки на 3'-конце и каталитического пептида на 5'-конце обеспечивает существенное увеличение периода полужизни конъюгатов до 48 ч и более по сравнению с линейным олигонуклеотидом, для которого 50% расщепление наблюдается уже через 1 ч [75].
Таким образом, сочетание высокой каталитической активности, синергического действия с РНКазой Н и высокой нуклеазоустойчивости является основой для достижения значительной продолжительности биологических эффектов миРНКаз в клетках. Показано, что однократное введение миРНКаз мышам с лимфосаркомой обеспечивало существенный противоопухолевый эффект в течение 20 сут [75].
Нерешенные задачи в области разработки микроРНК-направленных олигонуклеотидных ингибиторов
Несмотря на впечатляющие результаты, достигнутые в области разработки микроРНК-направленных олигонуклеотидных конструкций, существуют не решенные на данный момент задачи. Одним из таких вопросов является их таргетная доставка в опухолевые клетки, которая позволяет снизить и непродуктивное расходование препарата, и вероятность возникновения нежелательных побочных эффектов.
Кроме того, остается открытым вопрос специфичности действия олигонуклеотидных агентов. В некоторых случаях олигонуклеотидные конструкции способны связываться неспецифично как с нецелевыми микроРНК (в частности, принадлежащими к одному семейству и имеющими высокое сходство последовательностей), так и с другими РНК в клетках, в связи с чем требуется дополнительная оптимизация структуры микроРНК-направленных препаратов.
В целом перспективность разработки микроРНК-ингибиторов подтверждается результатами доклинических и клинических исследований, наглядно демонстрирующими, что использование данных препаратов позволяет одновременно регулировать уровень многих белков, инициировать глобальные перестройки в генных сетях и комплексно воздействовать на процессы канцерогенеза. Таргетное выключение микроРНК оказывает высокий противоопухолевый и антиметастатический эффект, а в случае комбинированной терапии обеспечивает увеличение чувствительности к другим противоопухолевым препаратам.
ЗАКЛЮЧЕНИЕ
Создание микроРНК-направленных олигонуклеотидных конструкций является перспективным и быстро развивающимся направлением молекулярной онкологии. Разработанный к настоящему моменту спектр препаратов позволяет как расширить арсенал молекулярно-биологических методов, так и обеспечить в будущем высокоселективную терапию онкологических заболеваний. Выбор микроРНК-направленной конструкции может быть осуществлен в соответствии с ключевыми преимуществами того или иного типа препаратов для решения конкретной исследовательской задачи, в частности:
- микроРНК-маскирующие олигонуклеотиды могут быть использованы для выявления роли определенной пары микроРНК-мРНК в процессах канцерогенеза, что не только способствует расширению фундаментальных знаний о патогенезе злокачественных заболеваний, но и открывает возможности для разработки новых лекарственных препаратов, направленных как к микроРНК, так и к мРНК или белковым формам идентифицированных мишеней;
- микроРНК-направленные системы геномного редактирования CRISPR/Cas ввиду высокой селективности могут применяться для «выключения» одной определенной онкогенной микроРНК из целого микроРНК-семейства, что может найти применение в случае, если ингибирование других микроРНК-мишеней нежелательно;
- микроРНК-спонжи перспективны для создания средств комплексной терапии, подразумевающей одновременное подавление нескольких онкогенных микроРНК в клетках;
- микроРНК-направленные антисмысловые олигонуклеотиды обладают высоким противоопухолевым потенциалом и могут быть использованы как в рамках монотерапии, так и в составе комбинаций с химиопрепаратами или другими ASO, что может приводить к синергическому усилению ингибирующих эффектов;
- миРНКазы перспективны в применении в качестве монопрепаратов, используемых в низких концентрациях, ввиду наличия собственной каталитической активности и способности работать в режиме многооборотной реакции, действуя синергически с внутриклеточными ферментативными системами.
Таким образом, применение микроРНК-направленных олигонуклеотидных конструкций представляет собой новую стратегию в борьбе с онкологическими заболеваниями, предоставляя возможность как создания новых протоколов терапии злокачественных новообразований, так и улучшения уже существующих схем лечения.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: C.K. Мирошниченко и О.А. Патутина — работа с источниками литературы, написание текста рукописи; М.А. Зенкова — концепция работы, утверждение окончательной версии рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. S.K. Miroshnichenko and O.A. Patutina worked with literature sources and drafted the manuscripts. M.A. Zenkova conceptualiaed the study, edited the manuscript, and approved the final version for publication.
1. miScript Target Protectors For miRNA functional studies performed by interfering with miRNA-target interaction. https://www.qiagen.com/kr/spotlight-pages/ias/automated-qpcr-workflow/detection/miscript-target-protectors/
2. https://clinicaltrials.gov/study/NCT04811898?term=NCT04811898&rank=1
3. https://clinicaltrials.gov/study/NCT03713320?term=NCT03713320&rank=1
4. https://clinicaltrials.gov/study/NCT03373786?term=NCT03373786&rank=1
Список литературы
1. Lagos-Quintana M, Rauhut R, Lendeckel W, Tuschl T. Identification of novel genes coding for small expressed RNAs. Science. 2001;294(5543):853–8. https://doi.org/10.1126/SCIENCE.1064921
2. Kloosterman WP, Plasterk RHA. The diverse functions of microRNAs in animal development and disease. Dev Cell. 2006;11(4):441–50. https://doi.org/10.1016/J.DEVCEL.2006.09.009
3. Ilieva M, Panella R, Uchida S. MicroRNAs in cancer and cardiovascular disease. Cells. 2022;11(22):3551. https://doi.org/10.3390/cells11223551
4. Tabasi H, Mollazadeh S, Fazeli E, Abnus K, Taghdisi SM, Ramezani M, et al. Transitional insight into the RNA-based oligonucleotides in cancer treatment. Appl Biochem Biotechnol. 2024;196(3):1685–711. https://doi.org/10.1007/s12010-023-04597-5
5. Raue R, Frank AC, Syed SN, Brüne B. Therapeutic targeting of microRNAs in the tumor microenvironment. Int J Mol Sci. 2021;22(4):2210. https://doi.org/10.3390/ijms22042210
6. Reda El Sayed S, Cristante J, Guyon L, Denis J, Chabre O, Cherradi N. MicroRNA therapeutics in cancer: current advances and challenges. Cancers (Basel). 2021;13(11):2680. https://doi.org/10.3390/cancers13112680
7. Alles J, Fehlmann T, Fischer U, Backes C, Galata V, Minet M, et al. An estimate of the total number of true human miRNAs. Nucleic Acids Res. 2019;47(7):3353–64. https://doi.org/10.1093/NAR/GKZ097
8. Friedman RC, Farh KKH, Burge CB, Bartel DP. Most mammalian mRNAs are conserved targets of microRNAs. Genome Res. 2009;19(1):92–105. https://doi.org/10.1101/GR.082701.108
9. Dexheimer PJ, Cochella L. MicroRNAs: from mechanism to organism. Front Сell Dev Biol. 2020;8:409. https://doi.org/10.3389/FCELL.2020.00409
10. Bofill-De Ros X, Vang Ørom UA. Recent progress in miRNA biogenesis and decay. RNA Biol. 2024;21(1):1–8. https://doi.org/10.1080/15476286.2023.2288741
11. Treiber T, Treiber N, Meister G. Regulation of microRNA biogenesis and its crosstalk with other cellular pathways. Nat Rev Mol Cell Biol. 2019; 20(1):5–20. https://doi.org/10.1038/S41580-018-0059-1
12. Bartel DP. Metazoan microRNAs. Cell. 2018;173(1):20–51. https://doi.org/10.1016/j.cell.2018.03.006
13. Gebert LFR, MacRae IJ. Regulation of microRNA function in animals. Nat Rev Mol Cell Biol. 2019;20(1):21–37. https://doi.org/10.1038/S41580-018-0045-7
14. Nakanishi K. Anatomy of four human Argonaute proteins. Nucleic Acids Res. 2022;50(12):6618–38. https://doi.org/10.1093/nar/gkac519
15. Chen CYA, Shyu A. Mechanisms of deadenylation-dependent decay. Wiley Interdiscip Rev RNA. 2011;2(2):167–83. https://doi.org/10.1002/WRNA.40
16. Diener C, Keller A, Meese E. The miRNA-target interactions: an underestimated intricacy. Nucleic Acids Res. 2024;52(4):1544–57. https://doi.org/10.1093/NAR/GKAD1142
17. Hu X, Yin G, Zhang Y, Zhu L, Huang H, Lv K. Recent advances in the functional explorations of nuclear microRNAs. Front Immunol. 2023;14:1097491. https://doi.org/10.3389/FIMMU.2023.1097491
18. Liu H, Lei C, He Q, Pan Z, Xiao D, Tao Y. Nuclear functions of mammalian microRNAs in gene regulation, immunity and cancer. Mol Cancer. 2018;17(1):64. https://doi.org/10.1186/S12943-018-0765-5
19. Failer T, Amponsah-Offeh M, Neuwirth A, Kourtzelis I, Subramanian P, Mirtschink P, et al. Developmental endothelial locus-1 protects from hypertension-induced cardiovascular remodeling via immunomodulation. J Clin Invest. 2022;132(6):126155. https://doi.org/10.1172/JCI126155
20. Angelucci F, Cechova K, Valis M, Kuca K, Zhang B, Hort J. MicroRNAs in Alzheimer’s disease: diagnostic markers or therapeutic agents? Front Pharmacol. 2019;10:665. https://doi.org/10.3389/FPHAR.2019.00665
21. Li S, Lei Z, Sun T. The role of microRNAs in neurodegenerative diseases: a review. Cell Biol Toxicol. 2023;39(1):53–83. https://doi.org/10.1007/s10565-022-09761-x
22. Siasos G, Bletsa E, Stampouloglou PK, Oikonomou E, Tsigkou V, Paschou SA, et al. MicroRNAs in cardiovascular disease. Hell J Cardiol. 2020;61(3):165–73. https://doi.org/10.1016/j.hjc.2020.03.003
23. Peng Y, Croce CM. The role of microRNAs in human cancer. Signal Transduct Target Ther. 2016;1:15004. https://doi.org/10.1038/SIGTRANS.2015.4
24. Zhang B, Pan X, Cobb GP, Anderson TA. MicroRNAs as oncogenes and tumor suppressors. Dev Biol. 2007;302(1):1–12. https://doi.org/10.1016/J.YDBIO.2006.08.028
25. Svoronos AA, Engelman DM, Slack FJ. OncomiR or tumor suppressor? The duplicity of microRNAs in cancer. Cancer Res. 2016;76(13):3666–70. https://doi.org/10.1158/0008-5472.CAN-16-0359
26. Mollaei H, Safaralizadeh R, Rostami Z. MicroRNA replacement therapy in cancer. J Cell Physiol. 2019;234(8):12369–84. https://doi.org/10.1002/JCP.28058
27. Ragan C, Zuker M, Ragan MA. Quantitative prediction of miRNA-mRNA interaction based on equilibrium concentrations. PLoS Comput Biol. 2011;7(2):1001090. https://doi.org/10.1371/journal.pcbi.1001090
28. Kingston ER, Bartel DP. Global analyses of the dynamics of mammalian microRNA metabolism. Genome Res. 2019;29(11):1777–90. https://doi.org/10.1101/gr.251421.119
29. Zlotorynski E. Insights into the kinetics of microRNA biogenesis and turnover. Nat Rev Mol Cell Biol. 2019;20(9):511. https://doi.org/10.1038/S41580-019-0164-9
30. Sultan S, Rozzi A, Gasparello J, Manicardi A, Corradini R, Papi C, et al. A peptide nucleic acid (PNA) masking the miR-145-5p binding site of the 3’UTR of the cystic fibrosis transmembrane conductance regulator (CFTR) mRNA enhances CFTR expression in Calu-3 cells. Molecules. 2020;25(7):1677. https://doi.org/10.3390/molecules25071677
31. Colangelo T, Polcaro G, Ziccardi P, Muccillo L, Galgani M, Pucci B, et al. The miR-27a-calreticulin axis affects drug-induced immunogenic cell death in human colorectal cancer cells. Cell Death Dis. 2016;7(2):2108. https://doi.org/10.1038/cddis.2016.29
32. Zhang T, Hu Y, Ju J, Hou L, Li Z, Xiao D, et al. Downregulation of miR-522 suppresses proliferation and metastasis of nonsmall cell lung cancer cells by directly targeting DENN/ MADD domain containing 2D. Sci Rep. 2016;6(1):19346. https://doi.org/10.1038/srep19346
33. Bridge G, Monteiro R, Henderson S, Emuss V, Lagos D, Georgopoulou D, et al. The microRNA-30 family targets DLL4 to modulate endothelial cell behavior during angiogenesis. Blood. 2012;120(25):5063–72. https://doi.org/10.1182/blood-2012-04-423004
34. Munoz JL, Rodriguez-Cruz V, Ramkissoon SH, Ligon KL, Greco SJ, Rameshwar P. Temozolomide resistance in glioblastoma occurs by miRNA-9-targeted PTCH1, independent of sonic hedgehog level. Oncotarget. 2015;6(2):1190–201. https://doi.org/10.18632/oncotarget.2778
35. Doudna JA, Charpentier E. The new frontier of genome engineering with CRISPR-Cas9. Science. 2014;346(6213):1258096. https://doi.org/10.1126/science.1258096
36. Hussen BM, Rasul MF, Abdullah SR, Hidayat HJ, Faraj GSH, Ali FA, et al. Targeting miRNA by CRISPR/Cas in cancer: advantages and challenges. Mil Med Res. 2023;10(1):32. https://doi.org/10.1186/S40779-023-00468-6
37. Chang H, Yi B, Ma R, Zhang X, Zhao H, Xi Y. CRISPR/cas9, a novel genomic tool to knock down microRNA in vitro and in vivo. Sci Rep. 2016;6(1):22312. https://doi.org/10.1038/srep22312
38. Matano M, Date S, Shimokawa M, Takano A, Fujii M, Ohta Y, et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nat Med. 2015;21(3):256–62. https://doi.org/10.1038/NM.3802
39. Jiang Q, Meng X, Meng L, Chang N, Xiong J, Cao H, et al. Small indels induced by CRISPR/Cas9 in the 5’ region of microRNA lead to its depletion and Drosha processing retardance. RNA Biol. 2014;11(10):1243–9. https://doi.org/10.1080/15476286.2014.996067
40. Kurata JS, Lin RJ. MicroRNA-focused CRISPRCas9 library screen reveals fitness-associated miRNAs. RNA. 2018;24(7):966–81. https://doi.org/10.1261/rna.066282.118
41. Wu Q, Michaels YS, Fulga TA. Interrogation of functional miRNA-target interactions by CRISPR/Cas9 genome engineering. Methods Mol Biol. 2023;2630:243–64. https://doi.org/10.1007/978-1-0716-2982-6_16
42. Aquino-Jarquin G. Emerging role of CRISPR/Cas9 technology for microRNAs editing in cancer research. Cancer Res. 2017;77(24):6812–7. https://doi.org/10.1158/0008-5472.CAN-17-2142
43. Nieland L, van Solinge TS, Cheah PS, Morsett LM, El Khoury J, Rissman JI, et al. CRISPR-Cas knockout of miR21 reduces glioma growth. Mol Ther Oncolytics. 2022;25:121–36. https://doi.org/10.1016/j.omto.2022.04.001
44. Ahi Y, Bangari D, Mittal S. Adenoviral vector immunity: its implications and circumvention strategies. Curr Gene Ther. 2011;11(4):307–20. https://doi.org/10.2174/156652311796150372
45. Ebert MS, Neilson JR, Sharp PA. MicroRNA sponges: competitive inhibitors of small RNAs in mammalian cells. Nat Methods. 2007;4(9):721–6. https://doi.org/10.1038/nmeth1079
46. Jie J, Liu D, Wang Y, Wu Q, Wu T, Fang R. Generation of MiRNA sponge constructs targeting multiple MiRNAs. J Clin Lab Anal. 2022;36(7):24527. https://doi.org/10.1002/jcla.24527
47. Liu J, Carmell MA, Rivas FV, Marsden CG, Thomson JM, Song JJ, et al. Argonaute2 is the catalytic engine of mammalian RNAi. Science. 2004;305(5689):1437–41. https://doi.org/10.1126/science.1102513
48. Kluiver J, Slezak-Prochazka I, Smigielska-Czepiel K, Halsema N, Kroesen BJ, van den Berg A. Generation of miRNA sponge constructs. Methods. 2012;58(2):113–7. https://doi.org/10.1016/j.ymeth.2012.07.019
49. Rama AR, Quiñonero F, Mesas C, Melguizo C, Prados J. Synthetic circular miR-21 sponge as tool for lung cancer treatment. Int J Mol Sci. 2022;23(6):2963. https://doi.org/10.3390/ijms23062963
50. Gao S, Tian H, Guo Y, Li Y, Guo Z, Zhu X, et al. miRNA oligonucleotide and sponge for miRNA-21 inhibition mediated by PEI-PLL in breast cancer therapy. Acta Biomater. 2015;25:184–193. https://doi.org/10.1016/j.actbio.2015.07.020
51. Liang AL, Zhang TT, Zhou N, Wu CY, Lin MH, Liu YJ. miRNA-10b sponge: an anti-breast cancer study in vitro. Oncol Rep. 2016;35(4):1950–8. https://doi.org/10.3892/or.2016.4596
52. Mignacca L, Saint-Germain E, Benoit A, Bourdeau V, Moro A, Ferbeyre G. Sponges against miR-19 and miR-155 reactivate the p53-Socs1 axis in hematopoietic cancers. Cytokine. 2016;82:80–6. https://doi.org/10.1016/j.cyto.2016.01.015
53. Liu S, Sun X, Wang M, Hou Y, Zhan Y, Jiang Y, et al. A microRNA 221– and 222–mediated feedback loop maintains constitutive activation of NFκB and STAT3 in colorectal cancer cells. Gastroenterology. 2014;147(4):847–59. https://doi.org/10.1053/j.gastro.2014.06.006
54. Lu Y, Xiao J, Lin H, Bai Y, Luo X, Wang Z, et al. A single anti-microRNA antisense oligodeoxyribonucleotide (AMO) targeting multiple microRNAs offers an improved approach for microRNA interference. Nucleic Acids Res. 2009;37(3):24. https://doi.org/10.1093/nar/gkn1053
55. Mukherji S, Ebert MS, Zheng GXY, Tsang JS, Sharp PA, van Oudenaarden A. MicroRNAs can generate thresholds in target gene expression. Nat Genet. 2011;43(9):854–9. https://doi.org/10.1038/ng.905
56. Alkan AH, Akgül B. Endogenous miRNA sponges. Methods Mol Biol. 2022;2257:91–104. https://doi.org/10.1007/978-1-0716-1170-8_5
57. Olesen MT, Kristensen L. Circular RNAs as microRNA sponges: evidence and controversies. Essays Biochem. 2021;65(4):685–96. https://doi.org/10.1042/EBC20200060
58. Meng L, Liu C, Lü J, Zhao Q, Deng S, Wang G, et al. Small RNA zippers lock miRNA molecules and block miRNA function in mammalian cells. Nat Commun. 2017;8:13964. https://doi.org/10.1038/ncomms13964
59. Zhang C, Kang C, You Y, Pu P, Yang W, Zhao P, et al. Co-suppression of miR-221/222 cluster suppresses human glioma cell growth by targeting p27Kip1 in vitro and in vivo. Int J Oncol. 2009;34(6):1653–60. https://doi.org/10.3892/ijo_00000296
60. Quan J, Jin L, Pan X, He T, Lai Y, Chen P, et al. Oncogenic miR-23a-5p is associated with cellular function in RCC. Mol Med Rep. 2017;16(2):2309–17. https://doi.org/10.3892/mmr.2017.6829
61. Zhang R, Li F, Wang W, Wang X, Li S, Liu J. The effect of antisense inhibitor of miRNA 106b~25 on the proliferation, invasion, migration, and apoptosis of gastric cancer cell. Tumor Biol. 2016;37(8):10507–15. https://doi.org/10.1007/s13277-016-4937-x
62. Teplyuk NM, Uhlmann EJ, Gabriely G, Volfovsky N, Wang Y, Teng J, et al. Therapeutic potential of targeting microRNA-10b in established intracranial glioblastoma: first steps toward the clinic. EMBO Mol Med. 2016;8(3):268–87. https://doi.org/10.15252/emmm.201505495
63. Huynh C, Segura MF, Gaziel-Sovran A, Menendez S, Darvishian F, Chiriboga L, et al. Efficient in vivo microRNA targeting of liver metastasis. Oncogene. 2011;30(12):1481–8. https://doi.org/10.1038/onc.2010.523
64. Patutina OA, Gaponova (Miroshnichenko) SK, Sen’kova AV, Savin IA, Gladkikh DV, Burakova EA, et al. Mesyl phosphoramidate backbone modified antisense oligonucleotides targeting miR-21 with enhanced in vivo therapeutic potency. Proc Natl Acad Sci. 2020;117(51):32370–9. https://doi.org/10.1073/pnas.2016158117
65. Miroshnichenko SK, Patutina OA, Burakova EA, Chelobanov BP, Fokina AA, Vlassov VV, et al. Mesyl phosphoramidate antisense oligonucleotides as an alternative to phosphorothioates with improved biochemical and biological properties. Proc Natl Acad Sci USA. 2019;116(4):1229–34. https://doi.org/10.1073/pnas.1813376116
66. Gaponova S, Patutina O, Sen’kova A, Burakova E, Savin I, Markov A, et al. Single shot vs. cocktail: a comparison of mono- and combinative application of miRNA-targeted mesyl oligonucleotides for efficient antitumor therapy. Cancers (Basel). 2022;14(18):4396. https://doi.org/10.3390/cancers14184396
67. Costa PM, Cardoso AL, Custódia C, Cunha P, Pereira de Almeida L, Pedroso de Lima MC. MiRNA-21 silencing mediated by tumor-targeted nanoparticles combined with sunitinib: a new multimodal gene therapy approach for glioblastoma. J Control Release. 2015;207:31–9. https://doi.org/10.1016/j.jconrel.2015.04.002
68. Li Y, Chen Y, Li J, Zhang Z, Huang C, Lian G, et al. Co-delivery of microRNA-21 antisense oligonucleotides and gemcitabine using nanomedicine for pancreatic cancer therapy. Cancer Sci. 2017;108(7):1493–503. https://doi.org/10.1111/cas.13267
69. Tassone P, Di Martino MT, Arbitrio M, Fiorillo L, Staropoli N, Ciliberto D, et al. Safety and activity of the first-in-class locked nucleic acid (LNA) miR-221 selective inhibitor in refractory advanced cancer patients: a first-in-human, phase 1, open-label, dose-escalation study. J Hematol Oncol. 2023;16(1):68. https://doi.org/10.1186/s13045-023-01468-8
70. Gaglione M, Milano G, Chambery A, Moggio L, Romanelli A, Messere A. PNA-based artificial nucleases as antisense and anti-miRNA oligonucleotide agents. Mol Biosyst. 2011;7(8):2490–9. https://doi.org/10.1039/c1mb05131h
71. Dogandzhiyski P, Ghidini A, Danneberg F, Strömberg R, Göbel MW. Studies on tris(2-aminobenzimidazole)-PNA based artificial nucleases: a comparison of two analytical techniques. Bioconjug Chem. 2015;26(12):2514–9. https://doi.org/10.1021/acs.bioconjchem.5b00534
72. Patutina OA, Bichenkova EV, Miroshnichenko SK, Mironova NL, Trivoluzzi LT, Burusco KK, et al. miRNases: novel peptide-oligonucleotide bioconjugates that silence miR-21 in lymphosarcoma cells. Biomaterials. 2017;122:163–78. https://doi.org/10.1016/j.biomaterials.2017.01.018
73. Patutina O, Chiglintseva D, Bichenkova E, Gaponova S, Mironova N, Vlassov V, et al. Dual miRNases for triple incision of miRNA target: design concept and catalytic performance. Molecules. 2020;25(10):2459. https://doi.org/10.3390/MOLECULES25102459
74. Patutina O, Chiglintseva D, Amirloo B, Clarke D, Gaponova S, Vlassov V, et al. Bulge-forming miRNases cleave oncogenic miRNAs at the central loop region in a sequence-specific manner. Int J Mol Sci. 2022;23(12):6562. https://doi.org/10.3390/ijms23126562
75. Patutina OA, Miroshnichenko SK, Mironova NL, Sen’kova AV, Bichenkova EV, Clarke DJ, et al. Catalytic knockdown of MIR-21 by artificial ribonuclease: biological performance in tumor model. Front Pharmacol. 2019;10:879. https://doi.org/10.3389/fphar.2019.00879
Об авторах
С. К. МирошниченкоРоссия
Мирошниченко Светлана Константиновна, канд. биол. наук
проспект Академика Лаврентьева, д. 8, г. Новосибирск, 630090
О. А. Патутина
Россия
Патутина Ольга Александровна, канд. биол. наук
проспект Академика Лаврентьева, д. 8, г. Новосибирск, 630090
М. А. Зенкова
Россия
Зенкова Марина Аркадьевна, д-р биол. наук, проф., член-корр. РАН
проспект Академика Лаврентьева, д. 8, г. Новосибирск, 630090
Дополнительные файлы
Рецензия
Для цитирования:
Мирошниченко С.К., Патутина О.А., Зенкова М.А. МикроРНК-направленные олигонуклеотидные конструкции с различным механизмом действия для эффективного подавления процессов канцерогенеза. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(2):140-156. https://doi.org/10.30895/2221-996X-2024-24-2-140-156
For citation:
Miroshnichenko S.K., Patutina O.A., Zenkova M.A. miRNA-targeting oligonucleotide constructs with various mechanisms of action as effective inhibitors of carcinogenesis. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(2):140-156. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-2-140-156


































