Перейти к:
Пробиотические свойства композиции индигенных штаммов Bifidobacterium bifidum ICIS-310 и Bifidobacterium longum ICIS-505 в условиях in vitro
https://doi.org/10.30895/2221-996X-2025-565
Резюме
ВВЕДЕНИЕ. Активный поиск пробиотических штаммов микроорганизмов, в том числе относящихся к индигенным штаммам бифидобактерий, является важной задачей при создании лечебно-профилактических пробиотических препаратов. При определении пробиотического потенциала кандидатных штаммов необходима их оценка по показателям жизнеспособности бактерий, чувствительности к антибиотикам, устойчивости к желудочному соку и желчи, лизоцимрезистентности и биопленкообразованию.
ЦЕЛЬ. Характеристика композиции индигенных штаммов Biffdobacterium biffdum ICIS-310 и Biffdobacterium longum ICIS-505 в качестве потенциального пробиотического препарата.
МАТЕРИАЛЫ И МЕТОДЫ. Использованы штаммы B. biffdum ICIS-310 и B. longum ICIS-505. Оценивали чувствительность штаммов к антибиотикам, а также устойчивость к желудочному соку и желчи. Проводили исследование монокультур бифидобактерий B. biffdum ICIS-310 и B. longum ICIS-505 и их композиции по количеству жизнеспособных клеток при культивировании, антилизоцимной активности (лизоцимрезистентности), биопленкообразованию. При определении антагонистической активности в качестве тест-штаммов условно-патогенных и патогенных культур использовали Candida albicans ATCC 24433, Proteus mirabilis ATCC 29906, Staphylococcus aureus ATCC 29213, Escherichia coli ATCC 25922, Shigella flexneri ATCC 12022, Klebsiella pneumoniaе ICIS-278_PBV. Содержание уксусной кислоты в среде культивирования определяли методом газожидкостной хроматографии.
РЕЗУЛЬТАТЫ. Отобранные по критериям численности, лизоцимрезистентности и биопленкообразования индигенные штаммы B. biffdum ICIS-310 и B. longum ICIS-505 не имели генов патогенности, обладали устойчивостью к ряду антимикробных препаратов (бензилпенициллин, стрептомицин и эритромицин) и сохраняли свою жизнеспособность в присутствии желчи в течение 2 ч и желудочного сока — 30 мин. Исследуемые культуры бифидобактерий обладали биосовместимостью: в композиции штаммов через 48 ч количество микробных клеток было выше, чем в монокультурах. При совместном культивировании штаммы B. biffdum ICIS-310 и B. longum ICIS-505 проявляли синергетический эффект, повышая уровень лизоцимрезистентности до 2,2±0,30 мкг/мл×ОП450, биопленкообразования до 0,89±0,20 ед. ОП630 и продукцию ацетата до 33,2 мМ/л. Композиция бифидобактерий обладала более выраженной антагонистической активностью по отношению к тест-штаммам бактерий и грибов (зоны угнетения роста тест-культур 30–36 мм) в сравнении с монокультурами (зоны угнетения роста тест-культур 18–24 мм).
ВЫВОДЫ. Индигенные штаммы B. biffdum ICIS-310 и B. longum ICIS-505 устойчивы к антимикробным препаратам, желчи и желудочному соку. При совместном культивировании штаммов выявлен синергетический эффект в отношении усиления показателей лизоцимрезистентности, биопленкообразования и антагонистической активности. Исследованные штаммы бифидобактерий и их композиция перспективны с целью создания новых пробиотических препаратов. Оценка лизоцимрезистентности и биопленкообразования может быть рекомендована в качестве показателей адаптивного потенциала микробиоты при отборе и тестировании пробиотических штаммов.
Ключевые слова
Для цитирования:
Перунова Н.Б., Бухарин О.В., Иванова Е.В., Бекпергенова А.В., Бондаренко Т.А. Пробиотические свойства композиции индигенных штаммов Bifidobacterium bifidum ICIS-310 и Bifidobacterium longum ICIS-505 в условиях in vitro. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):203-213. https://doi.org/10.30895/2221-996X-2025-565
For citation:
Perunova N.B., Bukharin O.V., Ivanova E.V., Bekpergenova A.V., Bondarenko T.A. Probiotic properties of an indigenous strain composition of Bifidobacterium bifidum ICIS-310 and Bifidobacterium longum ICIS-505 in vitro. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):203-213. (In Russ.) https://doi.org/10.30895/2221-996X-2025-565
ВВЕДЕНИЕ
Нарушения микробиоты — важный фактор в патогенезе инфекционных и соматических заболеваний. Индигенная (постоянно присутствующая) микробиота человека выступает одним из ключевых компонентов системы физиологической защиты организма человека [1][2]. Бифидобактерии входят в состав индигенной микробиоты человека [3], являясь одними из немногих симбиотических микроорганизмов, не обладающих патогенными свойствами, отличающихся при этом рядом полезных характеристик [1][2]. Наличие бифидобактерий в кишечнике человека оказывает влияние на развитие иммунной системы, поддержание кишечного гомеостаза и обеспечение защиты биотопа организма-хозяина от проникновения патогенов [4][5]. Бифидобактерии активно продуцируют различные биологически активные соединения: витамины, полифенолы, конъюгированные линолевые кислоты, короткоцепочечные жирные кислоты и др. [6]. Многофункциональная роль бифидобактерий в организме человека определила перспективы их использования в качестве основы для пробиотических препаратов [1][2][7] и продуктов функционального питания [8].
Пробиотические свойства бифидобактерий штаммоспецифичны и связаны с определенным, уникальным набором биологических характеристик конкретных штаммов [1][9], которые оцениваются на этапе отбора культур микроорганизмов [10]. Так как на этапе отбора не всегда учитываются особенности адаптации и выживания микробных культур в организме хозяина и возможность их быстрой элиминации из биотопа кишечника, то это обусловливает в ряде случаев низкую клиническую эффективность применяемых пробиотиков [11]. Одним из способов повышения эффективности пробиотических препаратов является создание микробных консорциумов [12]. Известно, что штаммы бифидо- и лактобактерий могут вступать в конкурентные взаимоотношения как между собой, так и с представителями нормальной микробиоты [13], и лишь транзиторно сохраняются в организме.
В проведенных ранее исследованиях с использованием штаммов из коллекции бифидобактерий лаборатории инфекционной симбиологии Института клеточного и внутриклеточного симбиоза Уральского отделения Российской академии наук (ИКВС УрО РАН) были выявлены критерии индигенности микроорганизмов с учетом особенностей их персистенции (адаптации) — длительного выживания микроорганизмов в организме хозяина [3][14]. Было установлено два стабильных параметра персистенции индигенных микросимбионтов, определяющих высокий уровень их присутствия в толстом кишечнике человека, — лизоцимрезистентность (ЛР) и биопленкообразование (БПО) [3][15]. Известно, что процесс формирования биопленок бактериями является универсальным и рассматривается как форма существования микроорганизмов [16].
Указанные параметры могут быть пригодны при отборе индигенных штаммов бифидобактерий для их включения в состав пробиотических препаратов [17], а также при определении уровня биосовместимости штаммов в композиции [18] в контексте создания мультиштаммовых пробиотиков. Важным аспектом при создании пробиотических препаратов является изучение межмикробных взаимодействий используемых культур, которые могут проявлять в отношении друг друга антагонистическую активность или конкурировать за питательные вещества [19].
Цель работы — характеристика композиции индигенных штаммов Bifidobacterium bifidum ICIS-310 и Bifidobacterium longum ICIS-505 в качестве потенциального пробиотического препарата.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Штаммы бифидобактерий. В работе использовали штаммы B. bifidum ICIS-310 и B. longum ICIS-505, ранее выделенные из испражнений здоровых лиц в лаборатории инфекционной симбиологии ИКВС УрО РАН. Предварительно штаммы бифидобактерий были идентифицированы по культурально-морфологическим и физиолого-биохимическим признакам [20][21]. Видовую принадлежность штаммов определяли по масс-спектру белков методом масс-спектрометрии MALDI-TOF MS с помощью системы Microflex LT (Bruker Daltonics, Германия), а также с использованием высокопроизводительного секвенирования 16S рРНК на платформе MiSeq (Illumina, США). Геномные последовательности штаммов B. bifidum ICIS-310 и B. longum ICIS-505 представлены в базе данных NCBI (National Center for Biotechnology Information) GenBank (NBYL0000000001, RJZF00000000.12). Штаммы депонированы в Государственной коллекции нормальной микрофлоры ФБУН «Московский научно-исследовательский институт эпидемиологии и микробиологии имени Г.Н. Габричевского» Роспотребнадзора (№ 1258 и 1260 соответственно) и в сетевой коллекции симбионтных микроорганизмов и их консорциумов (СКСМ) ИКВС УрО РАН (№ 00004B и 00005B соответственно).
Тест-штаммы. Для определения антагонистической активности индигенных штаммов использовали культуры из коллекции АТСС (American Type Culture Collection, США) — Candida albicans ATCC 24433, Proteus mirabilis ATCC 29906, Staphylococcus aureus ATCC 29213, Escherichia coli ATCC 25922, Shigella flexneri ATCC 12022; коллекции СКСМ ИКВС УрО РАН Klebsiella pneumoniaе ICIS-278_PBV (DDBJ/ENA/GenBank NCVU00000000.13; СКСМ ИКВС УрО РАН № 00007B). Для определения лизоцимрезистентности использован штамм Micrococcus luteus ATCC 15307 (АТСС, США).
Питательные среды. Бифидум-среда (кат. № О53) и агар бактериологический (кат. № О58) производства ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии» Роспотребнадзора (Россия), агар Шадлера (кат. № M291, HiMedia Laboratories, Индия), бульон Шадлера (кат. № M292, HiMedia Laboratories, Индия).
Методы
Аннотация и анализ генома. Аннотацию и первичный анализ генов проводили с использованием онлайн-инструментов RAST4. Итоговая аннотация геномов бифидобактерий была выполнена автоматически с помощью сервиса NCBI PGAP (Prokaryotic Genome Annotation Pipeline)5 после их депонирования в базе данных NCBI GenBank (NIH, США).
Определение чувствительности к антибиотикам. Чувствительность к антибиотикам in vitro определяли диско-диффузионным методом с использованием Бифидум-среды и дисков для оценки антибиотикочувствительности (ФБУН НИИ эпидемиологии и микробиологии имени Пастера, Россия)6. Для получения плотной питательной среды в Бифидум-среду дополнительно вносили агар бактериологический (15 г/л). Исследовали чувствительность к антимикробным препаратам, относящимся к группам пенициллинов, аминогликозидов, тетрациклинов, фторхинолонов, макролидов, сульфаниламидов, гликопептидов и фузидина.
Оценка выживаемости бифидобактерий в биологических средах. Для оценки выживаемости использовали имитацию желудочного сока (NaCl — 2,2 г; HCl — 9,9 мл 0,11 M; пепсин свиной — 3,5 ЕД/мг; вода дистиллированная до 1 л, pH 2,8±0,1) и желчь (медицинская консервированная, HiMedia Laboratories, Индия). Монокультуры и композицию штаммов бифидобактерий (10⁸ КОЕ/мл) инкубировали при 37±1 °C в присутствии желудочного сока в течение 30 мин, в присутствии желчи — в течение 2 ч. Контрольные образцы монокультуры и композиции штаммов (10⁸ КОЕ/мл) инкубировали в 0,9% растворе NaCl в течение 30 мин и 2 ч соответственно. Опытные и контрольные образцы монокультуры и композиции штаммов высевали на агар Шадлера и инкубировали в анаэробных условиях при 37±1 °C в CO2-инкубаторе (Binder, Германия) в течение 48±1 ч.
Определение жизнеспособных бактерий (чашечный метод)7. Для определения жизнеспособных клеток монокультур B. bifidum ICIS-310 и B. longum ICIS-505 готовили микробную взвесь, соответствующую 0,5 ед. по стандарту МакФарланда (McFarland standard 1×10⁸ КОЕ/мл; кат. № R092; HiMedia Laboratories, Индия). Каждый штамм (1 мл) засевали в 9 мл бульона Шадлера. Приготовленные по стандарту МакФарланда суспензии двух штаммов, B. bifidum ICIS-310 и B. longum ICIS-505 (1 мл), смешивали в соотношении 1:1 и засевали в 9 мл бульона Шадлера. Монокультуры и смешанную культуру помещали в CO2-инкубатор при 37±1 °C в течение 0, 24, 48 и 72 ч. После инкубирования культуры перемешивали на шейкере (Heidolph Reax, Германия), проводили серийные разведения, высевали на агар Шадлера и помещали в CO2-инкубатор при 37±1 °C в течение 48±1 ч. Далее учитывали количество выросших колоний бифидобактерий и определяли количество колониеобразующих единиц (КОЕ) в 1 мл. В смешанной культуре штаммы различали по морфотипам, описывая форму колоний. Колонии B. bifidum ICIS-310: мелкие (диаметр колонии 1–2 мм), плоские, кремового цвета, округлые. Колонии B. longum ICIS-505: более крупные по размеру (диаметр колонии 3–4 мм) и более выпуклые в сравнении с B. bifidum ICIS-310, сметанообразные, белые, округлые.
Определение антагонистической активности индигенных штаммов. Антагонистическую активность бифидобактерий в отношении патогенных и условно-патогенных микроорганизмов оценивали методом отсроченного антагонизма на плотной среде8. По 5 мкл суспензии каждого штамма и композиции бифидобактерий (10⁸ КОЕ/мл) пипеткой вносили в центр чашки с агаром Шадлера. После инкубации при 37±1 °C в CO2-инкубаторе в течение 48±1 ч культуры были обработаны парами хлороформа (100 мкл, 30 мин). Далее на чашку Петри наносили полужидкий агар Шадлера (4,9 мл, 0,7%), предварительно инокулированный тест-штаммами (0,1 мл, 10⁸ КОЕ/мл). После инкубации в течение 18±1 ч при температуре 37±1 °C измеряли диаметр зон задержки роста тест-штаммов (мм). Штаммы бифидобактерий обладали антагонистической активностью по отношению к тест-штаммам при наличии зоны угнетения роста более 10 мм.
Оценка биопленкообразования. Образование биопленок изучали по адгезии микроорганизмов к поверхности 96-луночного полистиролового стерильного планшета [22]. Бифидобактерии культивировали на агаре Шадлера при 37±1 °С в течение 48±1 ч. Затем готовили бактериальную суспензию (10⁸ КОЕ/мл) и добавляли 15 мкл к 135 мкл бульона Шадлера в 96-луночный планшет. В качестве контроля использовали 150 мкл стерильного бульона Шадлера. После инкубации планктонные клетки удаляли встряхиванием, а образование биопленок анализировали с помощью окрашивания кристаллическим фиолетовым (0,1%). Количественную оценку биомассы биопленки проводили путем измерения оптической плотности при 630 нм (OП630) с помощью фотометра ELx 808 (BioTek, США).
Лизоцимрезистентность (антилизоцимная активность). Для определения ЛР бактерий использовали фотометрический метод, описанный в работе О.В. Бухарина [14]. Культуры бифидобактерий выращивали в бульоне Шадлера при 37±1 °С в CO2-инкубаторе в течение 48±1 ч. Затем измеряли ОП бульонной культуры (ОП450) против чистого бульона Шадлера. Полученные бульонные культуры центрифугировали в течение 15 мин при 3200 g, стерилизовали фильтрованием (0,22 мкм, MF-Millipore, Германия) и получали бесклеточные супернатанты бифидобактерий. В качестве тест-штамма для определения ЛР использовали ацетонированную агаровую культуру M. luteus ATCC 15307. Культуру растворяли в 0,9% растворе NaCl, доводили оптическую плотность до 0,30 (0,28–0,32). Готовили раствор лизоцима (Sigma Aldrich, США) с концентрацией 20 мкг/мл в 1/15 М фосфатном буфере (рН 6,2). Опытные пробы готовили из бесклеточного супернатанта бифидобактерий, смешивая с 0,9 и 0,1 мл раствора лизоцима, в контрольных пробах вместо бесклеточного супернатанта использовали питательный бульон. Пробы инкубировали 120 мин при 37±1 °С. Далее проводили определение уровня ЛР культур по степени лизиса суспензии тест-штамма согласно формуле (1):
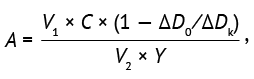 (1)
(1)
где A — лизоцимрезистентность, выраженная в микрограммах инактивированного лизоцима в 1 мл супернатанта, мкг/мл×ОП450; V1 — объем раствора лизоцима исходной концентрации 20 мкг/мл (0,1 мл); V2 — объем бесклеточного супернатанта бульонной культуры исследуемого штамма (0,9 мл); С — исходная концентрация лизоцима (20 мкг/мл); Y — ОП бульонной культуры исследуемого штамма, ед. ОП; ∆D0 — изменение ОП суспензии тест-штамма в опытном образце в временном интервале между 30 и 150 с; ∆Dk — изменение ОП суспензии тест-штамма в контрольном образце между 30 и 150 с.
Содержание уксусной кислоты. Пробы для определения количества уксусной кислоты, продуцируемой штаммами бифидобактерий в монокультуре и композиции, получали при добавлении 1 мл бактериальной суспензии (10⁸ КОЕ/мл) в 9 мл бульона Шадлера (общий объем 10 мл) и помещали в СО2-инкубатор при температуре 37±1 °C в течение 24–72 ч. Проводили измерение содержания уксусной кислоты в начальной временной точке внесения культур (0 ч), через 24, 48 и 72 ч.
Содержание уксусной кислоты при культивировании штаммов бифидобактерий определяли методом газожидкостной хроматографии9 с использованием хроматографа GC-2010 Plus (Shimadzu, Япония); детекцию проводили на пламенно-ионизационном детекторе с капиллярной колонкой HP-FFAP (Agilent Technologies, США), 0,32 мм, 50 м. Условия хроматографирования — температурный режим: испаритель — 240 °С; детектор — 260 °С; программа для капиллярной колонки: 0 мин — 70 °С; 10 мин — 160 °С; 5 мин — 180 °С; 25 мин — 240 °С. В качестве газа-носителя использовали гелий, скорость потока 21 см/сек, давление в колонке 74 кПа. Для определения количества компонента в пробе применяли метод абсолютной градуировки с предварительным построением калибровочного графика уксусной кислоты (Sigma-Aldrich, США). Концентрацию рассчитывали по площадям пиков с помощью программы GCsolution (Shimadzu, Япония).
Статистическую обработку данных проводили с использованием программы Statistica 10.0 (StatSoft, США) и Microsoft Office Excel 2010. Результаты представляли в виде среднего и стандартного отклонения.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предварительный отбор штаммов бифидобактерий и анализ их генома
Предварительно проводили отбор индигенных штаммов бифидобактерий кишечника человека из коллекции лаборатории инфекционной симбиологии (ИКВС УрО РАН, Оренбург). Были отобраны культуры B. bifidum ICIS-310 и B. longum ICIS-505, обладающие выраженными адаптивными свойствами индигенных штаммов по способности выживать в кишечнике человека [3][17], имеющие высокие показатели микробной обсемененности в кишечнике (9,1 и 10,0 lg КОЕ/г соответственно), лизоцимрезистентности (1,62±0,2 и 1,8±0,2 мкг/мл×ОП450 соответственно) и биопленкообразования (0,40±0,03 и 0,50±0,05 ед. ОП630 соответственно).
Анализ генома штаммов бифидобактерий показал, что суммарная длина геномной последовательности B. bifidum ICIS-310 составила 2,21 млн п.н., B. longum ICIS-505 — 2,44 млн п.н. По объему генома штаммы можно оценить как находящиеся на уровне верхней границы размеров геномов известных представителей рода Bifidobacterium spp. (1,8–2,3 млн п.н.). Число белок-кодирующих генов у B. bifidum ICIS-310 составило 1718, у B. longum ICIS-505 — 2003.
При аннотации генома B. bifidum ICIS-310 выявлено, что самые большие группы генов относились к следующим подсистемным категориям: метаболизм белков (207 генов), аминокислоты и их производные (198 генов) и углеводы (143 гена). Другие значительные категории генома включали: кофакторы, витамины, простетические группы, пигменты (73 гена), компоненты клеточной стенки (70 генов), системы метаболизма ДНК (65 генов) и РНК (62 гена), метаболизма фосфора (35 генов), жирных кислот, липидов и изопреноидов (28 генов), гены деления клеток и клеточного цикла (26 генов).
В аннотированном геноме штамма B. longum ICIS-505 самые большие группы генов относились к категориям: аминокислоты и их производные (207 генов), системы метаболизма белков (204 гена) и углеводов (189 генов), кофакторы, витамины, пигменты (96 генов), система метаболизма РНК (70 генов), компоненты клеточной стенки (63 гена).
В геноме обоих штаммов B. bifidum ICIS-310 и B. longum ICIS-505 выявлен ген vanZ, кодирующий белок устойчивости к тейкопланину (гликопептидный антибиотик).
Проведенный анализ генома изучаемых штаммов бифидобактерий показал, что они не имеют генов патогенности и могут быть перспективны для дальнейшего исследования с целью создания пробиотических препаратов.
Исследование пробиотических свойств штаммов B. bifidum ICIS-310 и B. longum ICIS-505
Исследование устойчивости штаммов к действию антибиотиков. При определении устойчивости к действию антибиотиков выявлено, что оба штамма бифидобактерий обладают антибиотикорезистентностью к пенициллинам, гентамицину и эритромицину (табл. S1, опубликована на сайте журнала10). Культура B. bifidum ICIS-310 была также устойчива к сульфаниламидам, ванкомицину и фузидину, а штамм B. longum ICIS-505 — к фторхинолонам.
Определение уровня экспрессии генов устойчивости к антибиотикам и возможности их передачи от пробиотических штаммов комменсальной микробиоте in vivo — важные аспекты при оценке безопасности бактерий для выбора штаммов. Это исключает риск передачи генов резистентности кишечной микробиоте [23]. Долгое время устойчивость молочнокислых бактерий к антимикробным препаратам оценивалась как допустимое свойство [24], и такие штаммы бактерий считались пригодными для использования в производстве пробиотиков и кисломолочных продуктов [25]. Однако недавние исследования показали, что молочнокислые бактерии, являющиеся носителями генов устойчивости к антибиотикам, могут передавать эти гены другим микроорганизмам [26]. Следует отметить, что благодаря генетической удаленности класса актинобактерий, включая бифидобактерии, от большинства патогенных и условно-патогенных бактерий толстого кишечника, передача детерминант устойчивости к антибиотикам путем горизонтального переноса генов в их случае ограничена [27]. Кроме того, совместное применение пробиотиков и противомикробных препаратов может способствовать эффективному восстановлению микробиоценоза толстого кишечника человека на этапе лечения.
В дальнейшем для исключения риска горизонтального переноса генов антибиотикорезистентности между изучаемыми штаммами и патогенной микрофлорой планируется провести анализ на наличие мобильных генетических элементов и плазмид, связанных с устойчивостью к антибиотикам, а также предполагается проведение исследований in vivo.
Оценка выживаемости B. bifidum ICIS-310 и B. longum ICIS-505 в желудочном соке и желчи. При отборе перспективных штаммов необходимым параметром оценки является изучение устойчивости бифидобактерий к биологическим секретам человека. Поскольку при прохождении пробиотических бактерий через желудочно-кишечный тракт они подвергаются воздействию желудочного сока и желчи [28], была проведена оценка влияния этих факторов на выживаемость культур бифидобактерий.
Изучение выживаемости штаммов бифидобактерий в желудочном соке и желчи в условиях in vitro показало, что количество жизнеспособных клеток в контрольных образцах как в монокультуре, так и в композиции без добавления желудочного сока и желчи составляло не менее 10⁸ КОЕ/мл. После инкубации в желудочном соке в течение 30 мин отмечено уменьшение количества клеток обоих штаммов на 3 порядка — до 1×10⁵ КОЕ/мл. Полученные данные свидетельствуют об устойчивости штаммов к данному стрессовому фактору. Следует отметить, что в модельных исследованиях при изучении воздействия желудочного сока в отношении современных пробиотических штаммов показано снижение выживаемости клеток на 5–6 порядков [29].
В условиях инкубирования культур бифидобактерий с желчью в течение 2 ч было выявлено уменьшение количества клеток B. bifidum ICIS-310 и B. longum ICIS-505 на 3–4 порядка — до 1,1×10⁴ и 1×10⁵ КОЕ/мл соответственно.
Определение количества жизнеспособных бактерий B. bifidum ICIS-310 и B. longum ICIS-505 в монокультуре и композиции. Анализ количества жизнеспособных клеток B. bifidum ICIS-310 и B. longum ICIS-505 в монокультуре и композиции (табл. 1) показал, что при раздельном культивировании количество жизнеспособных бифидобактерий увеличивалось к 48 ч (р≤0,05). В композиции культур штаммов через 48 ч количество микробных клеток было выше, чем в монокультурах (р≤0,05). Через 72 ч культивирования количество живых клеток снижалось как в монокультуре, так и в композиции. При рассеве композиции бифидобактерий выявлялись оба штамма. Полученные данные свидетельствуют о том, что исследуемые штаммы не подавляют рост друг друга при совместном культивировании.
Таблица 1. Динамика изменения количества жизнеспособных клеток в монокультуре бифидобактерий B. bifidum ICIS-310 и B. longum ICIS-505 и их композиции
Table 1. Changes in the number of viable cells in mono- and co-cultures of B. bifidum ICIS-310 and B. longum ICIS-505 with time
Время культивирования, ч Culture time, h | Количество жизнеспособных клеток, КОЕ/мл Number of viable cells, CFU/mL | ||||
Монокультура Monoculture | Композиция Co-culture | ||||
B. bifidum ICIS-310 | B. longum ICIS-505 | B. bifidum ICIS-310 | B. longum ICIS-505 | ICIS-310 + ICIS-505 | |
0 | 1,0×10⁸ | 1,0×10⁸ | 3×10⁷ | 7×10⁷ | 1,0×10⁸ |
24 | 2,7×10⁹ | 3,1×10⁸ | 2,0×10⁸ | 1,3×10⁸ | 3,3×10⁸ |
48 | 9,9×10⁹ | 10,3×10⁹ | 5,1×10⁹ | 5,6×10⁹ | 10,7×10⁹ |
72 | 8,4×10⁸ | 9,5×10⁸ | 4,2×10⁸ | 5,6×10⁸ | 9,8×10⁸ |
Таблица составлена авторами по собственным данным /The table is prepared by the authors using their own data
При совместном культивировании B. bifidum ICIS-310 и B. longum ICIS-505 проявляли синергетический эффект, усиливая некоторые характеристики друг друга (табл. 2). Для оценки были выбраны показатели БПО и ЛР, которые хотя и не являются обязательными критериями анализа пробиотических культур, но авторы полагают, что их определение имеет важное значение для выявления адаптивного потенциала пробиотиков в организме человека. Было показано, что значения показателей БПО и ЛР в композиции штаммов повышались до 0,89±0,20 ед. ОП630 и 2,2±0,30 мкг/мл×ОП450 (р<0,05). Представленные данные свидетельствуют о биосовместимости штаммов изучаемых пробиотических культур [18].
Таблица 2. Показатели биопленкообразования и лизоцимрезистентности монокультур B. bifidum ICIS-310 и B. longum ICIS-505 и их композиции
Table 2. Biofilm formation and lysozyme resistance of B. bifidum ICIS-310 and B. longum ICIS-505 in mono- and co-cultures
Показатель Parameter | Монокультура Monoculture | Композиция штаммов Co-culture | |
B. bifidum ICIS-310 | B. longum ICIS-505 | ||
БПО, ед. ОП630 BFF, OD630 units | 0,40±0,03 | 0,50±0,05 | 0,89±0,20* |
ЛР, мкг/мл×ОП450 LR, μg/mL×OD450 | 1,62±0,20 | 1,80±0,20 | 2,20±0,30* |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. БПО — биопленкообразование; ЛР — лизоцимрезистентность; * — достоверные отличия значений относительно монокультур (р<0,05).
Note. BFF, biofilm formation; LR, lysozyme resistance; *, significant differences from monocultures (р<0.05).
Определение антагонистической активности B. bifidum ICIS-310 и B. longum ICIS-505 в монокультуре и композиции. При оценке пробиотического потенциала бифидокультур важным параметром является антагонистическая активность, отражающая способность к колонизации биотопа кишечника [30]. Для определения показателя проводили сравнительный анализ антимикробного действия штаммов бифидобактерий в монокультуре и композиции против тест-штаммов условно-патогенных и патогенных культур (табл. 3). Установлено, что оба штамма бифидобактерий обладали антагонистической активностью в отношении кишечной палочки, клебсиеллы и стафилококка, а культура B. longum ICIS-505 дополнительно подавляла рост тест-штаммов дрожжевых грибов, протея и шигеллы. При этом композиция штаммов обладала более выраженной антагонистической активностью (зоны угнетения роста тест-культур 30–36 мм).
Таблица 3. Антагонистическая активность монокультур B. bifidum ICIS-310 и B. longum ICIS-505 и их композиции
Table 3. Antagonistic activity of mono- and co-cultures of B. bifidum ICIS-310 and B. longum ICIS-505
Штаммы Strains | Зоны задержки роста тест-штаммов, мм Zones of test strain growth inhibition, mm | |||||
C. albicans | P. mirabilis | S. aureus | E. coli | S. flexneri | K. pneumoniae | |
B. bifidum ICIS-310 | 18,0±1,0 | 18,0±1,0 | 20,0±1,0 | 20,0±2,0 | 19,0±2,0 | 20,0±1,0 |
B. longum ICIS-505 | 21,0±2,0 | 22,0±3,0 | 21,0±2,0 | 22,0±2,0 | 20,0±2,0 | 24,0±1,0 |
B. bifidum ICIS-310 + | 36,0±2,0* | 30,0±2,0* | 30,0±1,0* | 30,0±2,0* | 32,0±3,0* | 34,0±3,0* |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. * достоверные отличия значений относительно монокультур (р<0,05).
Note. * significant differences from monocultures (p<0.05).
Оценка уровня продукции уксусной кислоты штаммами бифидобактерий. Возможным объяснением эффекта потенцирования антагонистической активности бифидобактерий в композиции может являться синергетическое действие штаммов на метаболическую активность друг друга. Проведена оценка уровня продукции бифидокультурами ацетата по определению содержания уксусной кислоты в бульоне Шадлера при культивировании монокультур бифидобактерий и их композиции (рис. 1). Показано, что повышение содержания уксусной кислоты в среде (в период от 0 до 72 ч) при культивировании композиции B. bifidum ICIS-310 и B. longum ICIS-505 происходило более интенсивно, чем в случае монокультур (р≤0,05), достигая уровня 33,2 мМ/л.
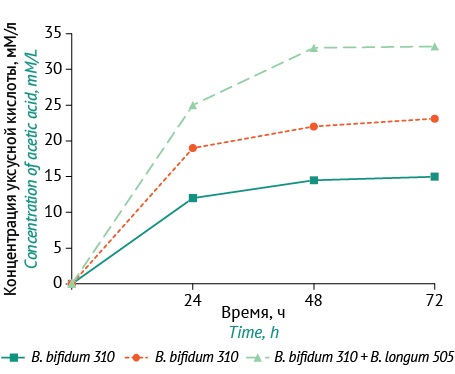
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Динамика изменения содержания уксусной кислоты в среде при культивировании монокультур B. bifidum ICIS-310 и B. longum ICIS-505 и их композиции. На графике представлены средние значения (M) показателя.
Fig. 1. Changes in the acetic acid concentration in mono- and co-cultures of B. bifidum ICIS-310 and B. longum ICIS-505 with time. The plot shows mean concentrations (M).
Выявленное усиление продукции ацетата в композиции бифидокультур имеет важное значение при создании препаратов пробиотиков. Известно, что уксусная кислота обладает антимикробным действием в отношении широкого спектра микроорганизмов, а кроме того, оказывает влияние на продукцию муцина, что, в свою очередь, может способствовать лучшему прикреплению пробиотических бактерий к клеткам эпителия кишечника и образованию биопленок [31].
ВЫВОДЫ
- Проведен предварительный отбор штаммов B. bifidum ICIS-310 и B. longum ICIS-505 с учетом критериев микробной обсемененности в кишечнике человека, лизоцимрезистентности и биопленкообразования. Анализ генома штаммов показал, что они не имеют генов патогенности.
- Определение устойчивости исследуемых культур к действию антибиотиков выявило, что оба штамма бифидобактерий обладают антибиотикорезистентностью к пенициллинам, гентамицину и эритромицину. Показана устойчивость штаммов к воздействию желудочного сока и желчи.
- Анализ жизнеспособности B. bifidum ICIS-310 и B. longum ICIS-505 показал, что исследуемые штаммы не подавляют рост друг друга при совместном культивировании.
- При совместном культивировании B. bifidum ICIS-310 и B. longum ICIS-505 выявлен синергетический эффект в отношении усиления показателей лизоцимрезистентности и биопленкообразования, что свидетельствует об адаптивном потенциале штаммов в организме человека.
- Оценка лизоцимрезистентности и биопленкообразования может быть рекомендована в качестве показателей адаптации и персистенции микробиоты в условиях биотопа при отборе и тестировании пробиотических штаммов.
- Установлено, что оба исследуемых штамма бифидобактерий проявляли антагонистическую активность в отношении тест-штаммов условно-патогенных и патогенных культур. При этом композиция обладала более выраженной антагонистической активностью, а также более высокой способностью к продукции уксусной кислоты, что свидетельствует об их синергетическом действии.
- Штаммы B. bifidum ICIS-310 и B. longum ICIS-505 и их композиция перспективны с целью создания новых пробиотических препаратов.
- Актуальным направлением дальнейших исследований является проведение сравнительного анализа эффективности разработанной композиции штаммов бифидобактерий с коммерчески доступными пробиотическими препаратами.
Дополнительная информация. На сайте журнала «БИОпрепараты. Профилактика, диагностика, лечение» размещена таблица S1.
https://doi.org/10.30895/2221-996X-2025-565-table-s1
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Н.Б. Перунова — дизайн исследования, анализ и интерпретация результатов исследования, критическое обсуждение текста рукописи; О.В. Бухарин — разработка концепции исследования; Е.В. Иванова — дизайн исследования, анализ полногеномного секвенирования исследуемых штаммов, сбор и анализ результатов исследования; А.В. Бекпергенова — идентификация выделенных микроорганизмов генетическим методом, биоинформатическая обработка данных, определение антибиотикорезистентности и устойчивости к желудочному соку и желчи, написание текста рукописи; Т.А. Бондаренко — исследование антагонистической активности, жизнеспособности, биопленкообразования и антилизоцимной активности бифидобактерий.
Благодарности. Авторы выражают признательность сотрудниками Центра коллективного пользования «Персистенция микроорганизмов» ИКВС УрО РАН (заведующий, канд. мед. наук, доц. А.О. Плотников) за представленные результаты полногеномного секвенирования штаммов бифидобактерий. Авторы благодарны канд. мед. наук, вед. науч. сотр. лаборатории инфекционной симбиологии ИКВС УрО РАН С.В. Андрющенко за работу по размещению секвенированных геномов бифидобактерий в базах данных NCBI GenBank.
Additional information. Table S1 is published on the website of Biological Products. Prevention, Diagnosis, Treatment.
https://doi.org/10.30895/2221-996X-2025-565-table-s1
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. N.B. Perunova designed the study, analysed and interpreted the study results, and critically discussed the manuscript. O.V. Bukharin conceptualised the study. E.V. Ivanova designed the study, analysed the full-genome sequencing of the strains under study, collected and analysed the study results. A.V. Bekpergenova identified isolated microorganisms using the genetic method; performed bioinformatics processing of data; measured resistance to antimicrobials, gastric acid, and bile; and drafted the manuscript. T.A. Bondarenko studied the antagonistic activity, viability, biofilm formation, and antilysozyme activity of bifidobacteria.
Acknowledgements. The authors express their gratitude to the team of the Center for Collective Use “Persistence of Microorganisms” of the Institute for Cellular and Intracellular Symbiosis, Ural Branch of the Russian Academy of Sciences (and A.O. Plotnikov, Cand. Sci. (Med.), Associate Professor, Head of the Center for Collective Use) for providing the results of whole-genome sequencing of bifidobacteria strains. The authors also thank S.V. Andryushchenko, Cand. Sci. (Med.), Senior Research Scientist at the Laboratory of Infectious Symbiology of the Institute for Cellular and Intracellular Symbiosis, Ural Branch of the Russian Academy of Sciences, for his work in depositing sequenced bifidobacterial genomes into the NCBI GenBank database.
1. https://www.ncbi.nlm.nih.gov/nuccore/NBYL00000000
2. https://www.ncbi.nlm.nih.gov/nuccore/RJZF00000000
3. https://www.ncbi.nlm.nih.gov/nuccore/NCVU00000000
4. https://rast.nmpdr.org/
5. https://https.ncbi.nlm.nih.gov/refseq/annotation_prok/
6. МУ 2.3.2.2789-10 «Методические указания по санитарно-эпидемиологической оценке безопасности и функционального потенциала пробиотических микроорганизмов, используемых для производства пищевых продуктов» (утв. Роспотребнадзором 06.12.2010).
7. ОФС.1.7.2.0009.15 Определение специфической активности пробиотиков. Государственная фармакопея Российской Федерации. XIV изд. Т. 2; 2018.
8. ОФС.1.7.2.0012.15 Производственные пробиотические штаммы и штаммы для контроля пробиотиков. Государственная фармакопея Российской Федерации. XIV изд. Т. 2; 2018.
9. МУ 2.3.2.2789-10 «Методические указания по санитарно-эпидемиологической оценке безопасности и функционального потенциала пробиотических микроорганизмов, используемых для производства пищевых продуктов» (утв. Роспотребнадзором 06.12.2010).
10. https://doi.org/10.30895/2221-996X-2025-565-table-s1
Список литературы
1. Бухарин ОВ, Перунова НБ, Иванова ЕВ. Бифидофлора при ассоциативном симбиозе человека. Екатеринбург: УрО РАН; 2014.
2. Шендеров БА. Медицинская микробная экология и функциональное питание. М.: ГРАНТЪ; 1998.
3. Бухарин ОВ, Иванова ЕВ, Перунова НБ. Коренные штаммы бифидобактерий кишечника человека: индигенность через призму персистенции. Вестник Российской Академии Наук. 2023;93(11):1071–80. https://doi.org/10.31857/S0869587323110026
4. Alessandri G, Ossiprandi MC, MacSharry J, van Sinderen D, Ventura M. Bifidobacterial dialogue with its human host and consequent modulation of the immune system. Front Immunol. 2019;10:2348. https://doi.org/10.3389/fimmu.2019.02348
5. Aw W, Fukuda S. Protective effects of bifidobacteria against enteropathogens. Microb Biotechnol. 2019;12(6):1097–100. https://doi.org/10.1111/1751-7915.13460
6. Bottacini F, van Sinderen D, Ventura M. Omics of bifidobacteria: Research and insights into their health-promoting activities. Biochem J. 2017;474(24):4137–52. https://doi.org/10.1042/BCJ20160756
7. Bozkurt HS, Quigley EM. The probiotic Biffdobacterium in the management of Coronavirus: A theoretical basis. Int J Immunopathol Pharmacol. 2020;34:2058738420961304. https://doi.org/10.1177/2058738420961304
8. He BL, Xiong Y, Hu TG, Zong MH, Wu H. Biffdobacterium spp. as functional foods: A review of current status, challenges, and strategies. Crit Rev Food Sci Nutr. 2022;63(26):8048–65. https://doi.org/10.1080/10408398.2022.2054934
9. McFarland LV, Evans CT, Goldstein EJC. Strain-specificity and disease-specificity of probiotic efficacy: A systematic review and meta-analysis. Front Med (Lausanne). 2018;5:124. https://doi.org/10.3389/fmed.2018.00124
10. Żółkiewicz J, Marzec A, Ruszczyński M, Feleszko W. Postbiotics — a step beyond pre- and probiotics. Nutrients. 2020;12(8):2189. https://doi.org/10.3390/nu12082189
11. Merenstein D, Pot B, Leyer G, Ouwehand AC, Preidis GA, Elkins CA, et al. Emerging issues in probiotic safety: 2023 perspectives. Gut Microbes. 2023;15(1):2185034. https://doi.org/10.1080/19490976.2023.2185034
12. Амерханова АМ, Алешкин АВ, Жиленкова ОГ. Консорциум бифидобактерий и лактобацилл, используемый для приготовления бактерийных препаратов и биологически активных добавок, предназначенных для коррекции микрофлоры людей старше 14 лет, способ его получения, биологически активная добавка к пище для коррекции микрофлоры желудочно-кишечного тракта людей старше 14 лет и бактериальный препарат для лечения дисбиотических состояний желудочно-кишечного тракта людей старше 14 лет. Патент Российской Федерации № 2491336; 2013. EDN: GRJUWE
13. Глушанова НА, Вербицкая НБ, Петров ЛИ, Блинов АИ, Шендеров БА. Исследование ауто-, изо- и гомоантагонизма пробиотических штаммов лактобацилл. Бюллетень ВСНЦ СО РАМН. 2005;(6):138–42. EDN: LGKXGN
14. Бухарин ОВ. Персистенция патогенных бактерий. М.: Медицина; 1999.
15. Zielke RA, Le Van A, Baarda BI, Herrera MF, Acosta CJ, Jerse AE, Sikora AE. SliC is a surface-displayed lipoprotein that is required for the anti-lysozyme strategy during Neisseria gonorrhoeae infection. PLoS Pathog. 2018;5;14(7):e1007081. https://doi.org/10.1371/journal.ppat.1007081
16. Ножевникова АН, Бочкова ЕА, Плакунов ВК. Мультивидовые биопленки в экологии, медицине и биотехнологии. Микробиология. 2017;84(6):623–44. https://doi.org/10.7868/S0026365615060117
17. Бухарин ОВ, Иванова ЕВ, Перунова НБ. Способ отбора индигенных штаммов бифидобактерий кишечника человека для их включения в состав пробиотических препаратов. Патент Российской Федерации № 2806579; 2023. EDN: DSDIIC
18. Бухарин ОВ, Перунова НБ, Иванова ЕВ. Способ определения уровня биосовместимости штаммов бифидобактерий и/или лактобактерий. Патент Российской Федерации № 2676910; 2019. EDN: SCYHTI
19. Kwoji ID, Aiyegoro OA, Okpeku M, Adeleke MA. Multi-strain probiotics: Synergy among isolates enhances biological activities. Biology (Basel). 2021;10(4):322. https://doi.org/10.3390/biology10040322
20. Бухарин ОВ, Перунова НБ, Иванова ЕВ, Бекпергенова АВ. Штамм бактерий Biffdobacterium biffdum ICIS-310 — продуцент ингибитора провоспалительного цитокина ИФН-γ. Патент Российской Федерации № 2670054; 2018. EDN: WAICBT
21. Бухарин ОВ, Иванова ЕВ, Перунова НБ, Андрющенко СВ. Штамм бактерий Biffdobacterium longum ICIS-505 — продуцент биологически активных веществ, обладающих антиперсистентной активностью в отношении условно-патогенных и патогенных бактерий и дрожжевых грибов. Патент Российской Федерации № 2704423; 2018. EDN: IYKBDB
22. Merritt JH, Kadouri DE, O’Toole GA. Growing and analyzing static biofilms. Curr Protoc Microbiol. 2005; Chapter 1:Unit-1B.1. https://doi.org/10.1002/9780471729259.mc01b01s00
23. Mater DD, Langella P, Corthier G, Flores MJ. A probiotic Lactobacillus strain can acquire vancomycin resistance during digestive transit in mice. J Mol Microbiol Biotechnol. 2008;14(1–3):123–7. https://doi.org/10.1159/000106091
24. Pino A, Bartolo E, Caggia C, Cianci A, Randazzo CL. Detection of vaginal lactobacilli as probiotic candidates. Sci Rep. 2019; 9(1):3355. https://doi.org/10.1038/s41598-019-40304-3
25. Toomey N, Bolton D, Fanning S. Characterisation and transferability of antibiotic resistance genes from lactic acid bacteria isolated from Irish pork and beef abattoirs. Res Microbiol. 2010;161(2):127–35. https://doi.org/10.1016/j.resmic.2009.12.010
26. Li B, Chen D, Lin F, Wu C, Cao L, Chen H, et al. Genomic island-mediated horizontal transfer of the erythromycin resistance gene erm(X) among Biffdobacteria. Appl Environ Microbiol. 2022;88(10):e0041022. https://doi.org/10.1128/aem.00410-22
27. Андрющенко СВ, Иванова ЕВ, Перунова НБ, Бухарин ОВ. Генетическая характеристика адаптивного потенциала бифидобактерий биотопа дистального отдела кишечника человека. Журнал микробиологии, эпидемиологии и иммунобиологии. 2018;(4):4–11. https://doi.org/10.36233/0372-9311-2018-4-4-11
28. Mallick S, Das S. Acid-tolerant bacteria and prospects in industrial and environmental applications. Appl Microbiol Biotechnol. 2023;107(11):3355–74. https://doi.org/10.1007/s00253-023-12529-w
29. Несчисляев ВА, Мокин ПА, Орлова ЕВ, Маслов ЮН, Савина АС. Кислотообразование и кислотоустойчивость пробиотиков. Медико-фармацевтический журнал «Пульс». 2020;22(6):34–8. EDN: XMXXIN
30. Meghrous J, Euloge P, Junelles AM, Ballongue J, Petitdemange H. Screening of Biffdobacterium strains for bacteriocins production. Biotechnol Lett. 1990;12:575–80. https://doi.org/10.1007/BF01030755
31. Bilotta AJ, Cong Y. Gut microbiota metabolite regulation of host defenses at mucosal surfaces: Implication in precision medicine. Precis Clin Med. 2019;2(2):110–9. https://doi.org/10.1093/pcmedi/pbz008
Об авторах
Н. Б. ПеруноваРоссия
Перунова Наталья Борисовна, д-р мед. наук, доц., проф. РАН
ул. Пионерская, д. 11, Оренбург, 460000;
ул. Одесская, д. 54, Тюмень, 625023
О. В. Бухарин
Россия
Бухарин Олег Валерьевич, д-р мед. наук, проф., акад. РАН
ул. Пионерская, д. 11, Оренбург, 460000
Е. В. Иванова
Россия
Иванова Елена Валерьевна, д-р мед. наук, доц.
ул. Пионерская, д. 11, Оренбург, 460000
А. В. Бекпергенова
Россия
Бекпергенова Анастасия Владимировна, канд. биол. наук
ул. Пионерская, д. 11, Оренбург, 460000
Т. А. Бондаренко
Россия
Бондаренко Таисия Александровна, канд. биол. наук
ул. Пионерская, д. 11, Оренбург, 460000
Дополнительные файлы

|
1. Таблица S1. Чувствительность B. bifidum ICIS-310 и B. longum ICIS-505 к антимикробным препаратам | |
| Тема | ||
| Тип | Прочее | |
Скачать
(726KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Перунова Н.Б., Бухарин О.В., Иванова Е.В., Бекпергенова А.В., Бондаренко Т.А. Пробиотические свойства композиции индигенных штаммов Bifidobacterium bifidum ICIS-310 и Bifidobacterium longum ICIS-505 в условиях in vitro. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):203-213. https://doi.org/10.30895/2221-996X-2025-565
For citation:
Perunova N.B., Bukharin O.V., Ivanova E.V., Bekpergenova A.V., Bondarenko T.A. Probiotic properties of an indigenous strain composition of Bifidobacterium bifidum ICIS-310 and Bifidobacterium longum ICIS-505 in vitro. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):203-213. (In Russ.) https://doi.org/10.30895/2221-996X-2025-565
JATS XML



































