Перейти к:
Вакцины против ветряной оспы и опоясывающего герпеса: от живых аттенуированных вакцин к генно-инженерным препаратам
https://doi.org/10.30895/2221-996X-2025-645
Резюме
ВВЕДЕНИЕ. Вирус ветряной оспы (ВВО) остается серьезной угрозой для здоровья населения и представляет собой значительное бремя для системы здравоохранения, связанное с затратами на лечение. Охват населения вакцинацией против ветряной оспы (ВО) и опоясывающего герпеса (ОГ) остается низким по ряду причин, включая отсутствие достаточного количества вакцин. Совершенствование качества существующих и создание новых генно-инженерных, эффективных препаратов с высоким профилем безопасности, а также усовершенствование протоколов их оценки с включением в алгоритмы параметров клеточного иммунного ответа являются необходимым условием развития вакцинопрофилактики заболеваний, вызываемых ВВО. Систематизация данных о текущем статусе вакцин против ВО и ОГ поможет разработчикам в планировании дизайна доклинических и клинических исследований.
ЦЕЛЬ. Анализ опыта разработки и внедрения в клиническую практику современных вакцин для профилактики заболеваний, вызываемых вирусом ветряной оспы, а также оценка путей дальнейших разработок профилактических вакцин.
ОБСУЖДЕНИЕ. Для профилактики ВО и ОГ рекомендуют применять живые вакцины, поскольку они имитируют естественный иммунный ответ организма на контакт с вирусным агентом и активируют как гуморальный, так и клеточный иммунитет. В настоящее время в мире зарегистрировано семь живых вакцин для профилактики ВО и две живые вакцины для профилактики ОГ. Однако при сниженном иммунитете ввиду различных состояний живые вакцины не рекомендованы из-за возможного развития вакциноассоциированных заболеваний. Рекомбинантная вакцина на основе вирусного гликопротеина Е c системой адъювантов показана для профилактики ОГ для лиц старше 50 лет с возможностью назначения иммунокомпрометированным пациентам.
ЗАКЛЮЧЕНИЕ. Наиболее перспективными являются исследования в области разработок вакцин на основе рекомбинантных, РНК-, ДНК-технологий. Поскольку безопасность данных вакцин по ряду параметров превосходит живые вакцины, применение их возможно у лиц с ослабленным иммунитетом. В России также ведется работа по созданию вакцин против ВВО-ассоциированных заболеваний.
Ключевые слова
Для цитирования:
Зотова А.В., Свитич О.А. Вакцины против ветряной оспы и опоясывающего герпеса: от живых аттенуированных вакцин к генно-инженерным препаратам. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(4):461-474. https://doi.org/10.30895/2221-996X-2025-645
For citation:
Zotova A.V., Svitich O.A. Varicella and Herpes zoster vaccines: from live attenuated vaccines to genetically engineered products. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(4):461-474. (In Russ.) https://doi.org/10.30895/2221-996X-2025-645
ВВЕДЕНИЕ
Вирус ветряной оспы (ВВО) — антропонозный высококонтагиозный нейротропный α-герпесвирус. Большинство людей первично инфицируются в детском возрасте, что приводит к развитию заболевания ветряной оспой (ВО). Вирус остается латентным в чувствительных нервных ганглиях и впоследствии из-за ослабления клеточного иммунитета или иммунодепрессивных состояний может реактивироваться, вызывая опоясывающий герпес (ОГ). Согласно оценкам Всемирной организации здравоохранения (ВОЗ) ежегодно регистрируется порядка 4200 смертельных случаев по причине осложненного течения ВО; до 4,2 млн случаев тяжелых форм ВО ежегодно приводит к госпитализации. В структуре возрастной заболеваемости наиболее высокий уровень ВО среди детей 3–6 лет, несколько реже у детей 1–2 и 7–14 лет, а наименьшие показатели заболеваемости отмечаются среди детей младше 1 года1. На территории Российской Федерации в 2023 г. заболевание ВО заняло 3-е место по величине экономического ущерба от инфекционной патологии, который составил более 36,7 млрд рублей2. По данным фармакоэкономического исследования, проведенного ФГБУ «Детский научно-клинический центр инфекционных болезней ФМБА», «средние затраты одного случая заболевания ВО в Российской Федерации составили 43 139 руб./пациента, из которых 8,5% — прямые медицинские затраты» [1].
Вирус ВО распространяется аэрозольным путем, проникает в организм через слизистые оболочки верхних дыхательных путей и проходит первую фазу репликации в региональных лимфатических узлах. Во время первичной клеточно-ассоциированной виремии вирус заражает мононуклеарные клетки периферической крови, во время вторичной виремии вирус распространяется в эпителиальные клетки кожи, что проявляется в типичной клинической картине заболевания: лихорадке, респираторных симптомах, везикулярной сыпи, которая является высококонтагиозной [2]. Осложнения заболевания наблюдаются не часто. Однако для лиц с ослабленным иммунным статусом ВО представляет особый риск. Наиболее распространенными являются неврологические и гематологические осложнения, а также вторичные бактериальные инфекции. Во время беременности заболевание ВО связано с высоким риском материнской пневмонии и трансплацентарной передачей вируса, ведущей к тяжелым последствиям для плода [3]. Пневмония на фоне ВО считается наиболее серьезным осложнением у беременных женщин. При трансплацентарной передаче вируса в течение первых двух триместров заболевание ВО матери может вызвать синдром врожденной ВО. Инфицирование матери также связано со значительным риском неонатальной ВО [4].
У взрослых лиц ВВО является причиной ОГ, который проявляется в виде везикулярной сыпи с типичным дерматомным распределением, сопровождающейся интенсивной болью и зудом. Риск развития ОГ в течение жизни оценивается примерно в 20–30% [5], при этом частота и тяжесть заболевания увеличиваются с возрастом; приблизительно 50% лиц в возрасте ≥85 лет могут иметь эпизод ОГ3. Самым распространенным осложнением ОГ является постгерпетическая невралгия (ПГН), которая развивается у 2,6–67,3% пациентов [6]. Риск возникновения ПГН существенно увеличивается в зависимости от возраста, а также тяжести продромальных симптомов, боли и сыпи в острой фазе [7]. ПГН связана со сниженной физической активностью, высокой утомляемостью, анорексией, потерей веса, нарушением сна. Лечение ПГН и болевого синдрома представляет собой сложную задачу из-за особенности формирования боли, которая недостаточно купируется обезболивающими средствами [8–10]. Офтальмологические проявления ВВО регистрируются в 10–15% случаев, возникают при реактивации вируса в офтальмологическом отделе тройничного нерва [11]. Примерно у 50% пациентов с офтальмологическим проявлением ВВО развиваются хроническое воспаление глаз, потеря зрения, сопровождающиеся изнурительными постоянными болями [12].
Реактивация вируса может иметь отдаленные побочные эффекты и играть роль в развитии сердечно-сосудистых заболеваний, включая инсульт и ишемическую болезнь сердца. В исследовании S.D. Curhan с соавт. было обнаружено, что вирус присутствует в крупных и мелких кровеносных сосудах, приводя со временем к воспалению, а также хроническим сосудистым изменениям [13]. В других работах исследователи также пришли к выводу, что инфекция ВВО является основным фактором риска развития ишемического инсульта, особенно у молодых лиц при отсутствии основного диагноза [14][15].
Поскольку ВВО является внутриклеточной персистирующей инфекцией с вероятностью периодической реактивации, а этиотропное лечение не всегда приводит к ожидаемому эффекту в связи с усиливающейся устойчивостью вируса к стандартным методам терапии, вакцинопрофилактика является предпочтительным вариантом борьбы с вирусом и последствиями его влияния на организм человека (снижение риска сердечно-сосудистых осложнений, ПГН), а также позволяет снизить расходы на лечение пациентов [16]. В Российской Федерации существует проблема недостаточного охвата вакцинацией против ВО детей раннего возраста из-за дефицита вакцин, а также ряд трудностей, которые ограничивают использование живых вакцин: случаи диссеминированной инфекции ВО, вызванной вакцинным штаммом у пациентов с ослабленным иммунитетом, случаи реактивирования вируса у здоровых вакцинированных детей [17]. В очень редких случаях вакцинный штамм вируса может передаваться и вызывать инвазивное заболевание у взрослых лиц [18][19]. В настоящее время для профилактики ОГ в Российской Федерации зарегистрирована одна зарубежная вакцина, но перспективы ее применения пока невысокие из-за ограничения поставок препарата.
Таким образом, особенности жизненного цикла ВВО и существующие проблемы профилактики и этиотропного лечения направляют исследователей к разработке как живых вакцин, так и вакцин на основе различных платформ и систем доставок для профилактики ВО или ОГ, которые могли бы успешно применяться среди различных категорий населения, в том числе у лиц с ослабленным иммунитетом. В отсутствие отечественных зарегистрированных вакцин в Российской Федерации вопросы их разработки находятся в приоритете, ведется активная работа в данном направлении.
Цель работы — анализ опыта разработки и внедрения в клиническую практику современных вакцин для профилактики заболеваний, вызываемых вирусом ветряной оспы, а также оценка путей дальнейших разработок профилактических вакцин.
Поиск публикаций по доклиническим разработкам, клиническим исследованиям (КИ) и применению препаратов для профилактики заболеваний, вызванных ВВО, был выполнен в базах данных PubMed, eLIBRARY.RU, ClinicalTrials.gov за 2011–2025 гг.
ОСНОВНАЯ ЧАСТЬ
Вакцинация против ветряной оспы и опоясывающего герпеса
Вакцина против ВО была впервые одобрена для плановой вакцинации детей в США в 1995 г. и впоследствии включена в программы иммунизации детей во многих странах [20]. ВОЗ рекомендует включить вакцинацию против ВО в плановые программы иммунизации в странах, где ВО представляет значительную проблему для общественного здравоохранения, а охват вакцинацией должен поддерживаться на уровне >80%. К таким выводам эксперты ВОЗ пришли на основе анализа данных из США, Германии, Канады, Австралии, Тайваня и других стран, в которых произошло значительное снижение количества случаев заболевания после внедрения вакцинации против ВО в Национальные календари профилактических прививок6 (НКПП).
По данным ВОЗ, по состоянию на 2024 г. 47 стран включили в свои НКПП вакцинацию против ВО, при этом количество стран увеличивалось с каждым годом (рис. 1). В рамках иммунизации режимы введения вакцин могут различаться. Так, в Германии с 2003 г. внедрена двукратная вакцинация, Южная Корея внедрила вакцинацию против ВО с 2005 г., в рамках которой детям в возрасте 12–15 мес. вводят одну дозу вакцины [21].
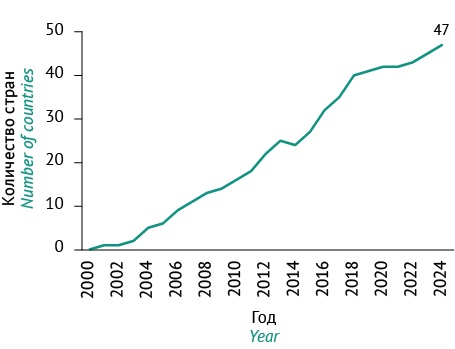
Рисунок подготовлен авторами по данным WHO Immunization Data portal4 / The figure was prepared by the authors according to the WHO Immunization Data portal5
Рис. 1. Динамика внедрения вакцины против ветряной оспы в Национальные календари профилактических прививок.
Fig. 1. Dynamics of introducing chickenpox vaccine into National vaccination schedules.
В Российской Федерации вакцинация детей против ВО не включена в НКПП и проводится выборочно в рамках региональных программ. Стратегия ВОЗ по включению вакцинации детей первых лет жизни против ВО в НКПП разных стран мира полностью отражается в Стратегии развития здравоохранения Российской Федерации7, в которой включение вакцинации детей против ВО в НКПП стоит в приоритете наряду с такими инфекциями, как менингококковая и ротавирусная. Установлено, что «вакцинация 100 000 детей позволит за 10 лет предотвратить 38 551 случай заболевания ВО, причем экономия составит 10,1 тыс. руб. в расчете на одного вакцинированного» [1]. Живая вакцина против ОГ Zostavax® (США) зарегистрирована в более чем в 60 странах. Рекомбинантная вакцина Shingrix® (Европейский союз, ЕС) в настоящее время зарегистрирована в более чем в 30 странах мира [22].
Зарегистрированные вакцины против ветряной оспы и опоясывающего герпеса
Первой вакциной против ВО, зарегистрированной для применения, была живая аттенуированная вакцина на основе штамма Oka/Biken (Япония). Эффективный иммунный ответ против ВВО, который предотвращает заражение при встрече с вирусом, сохраняется в течение нескольких десятилетий. У взрослых лиц защита может быть восстановлена путем усиления клеточно-опосредованного иммунного ответа с помощью двух доз адъювантной рекомбинантной вакцины на основе гликопротеина Е (gpЕ) и направлена на профилактику ОГ [2] (табл. 1).
Таблица 1. Зарегистрированные в мире вакцины против ветряной оспы и опоясывающего герпеса
Table 1. Varicella and herpes zoster vaccines registered worldwide
|
Тип вакцины Vaccine type |
Название препарата, страна-производитель Drug name, manufacturing countries |
Регистрация в Российской Федерацииa Registered in the Russian Federationa |
Преквалификация ВОЗb WHO pre-qualificationb |
|
Вакцины против ветряной оспы / Chickenpox vaccines |
|||
|
Живая аттенуированная Live attenuated vaccine |
OKAVAX, Япония / Japan |
Нет / No |
Нет / No |
|
Varivax, США / USA |
Нет / No |
Да / Yes |
|
|
Varilrix, EC / EU |
Да / Yes |
Нет / No |
|
|
SKYVaricella, Южная Корея South Korea |
Нет / No |
Да / Yes |
|
|
Barycela, Южная Корея South Korea |
Нет / No |
Да / Yes |
|
|
Живая аттенуированная вакцина, Китай Varicella Vaccine Live, China |
Нет / No |
Да / Yes |
|
|
VARI-L, Китай / China |
Нет / No |
Нет / No |
|
|
Вакцины против опоясывающего герпеса / Herpes zoster vaccines |
|||
|
Рекомбинантная Recombinant vaccine |
Shingrix, ЕС / ЕU |
Да / Yes |
Нет / No |
|
Живая аттенуированная Live attenuated vaccine |
SKYZoster, Южная Корея South Korea |
Нет / No |
Нет / No |
|
Zostavax, США / USA |
Нет / No |
Нет / No |
|
Таблица составлена авторами / The table was prepared by the authors
Примечание.
a согласно данным Государственного реестра лекарственных средств (ГРЛС, https://grls.minzdrav.gov.ru/).
b согласно данным Всемирной Организации Здравоохранения (ВОЗ)8.
Note.
a according to GRLS, State Register of Medicines (https://grls.minzdrav.gov.ru/);
b according to the World Health Organization (WHO) data9.
Живая аттенуированная вакцина Varilrix® содержит живой аттенуированный вирус Varicella zoster (штамм Oka/GSK, США) в дозе ≥1995 БОЕ (бляшкообразующие единицы). Вакцина Varivax® содержит живой аттенуированный вирус Varicella zoster (штамм Oka/Merck) в дозе ≥1350 БОЕ. Как правило, вакцины хорошо переносятся; на месте введения могут возникать болевые ощущения, отек, иногда могут развиться папулезные или везикулярные поражения. Корейские живые аттенуированные вакцины против ВО — Barycela® (содержит штамм MAV/06 вируса >3800 БОЕ, аттенуированный компанией GC Biopharma) и SKYVaricella® (содержит вакцинный штамм Oka/SK >2400 БОЕ) в КИ доказали и сопоставимую эффективность с референтной вакциной Varivax, получившей преквалификацию ВОЗ, и безопасность. Обе вакцины получили статус преквалификации ВОЗ [21][23]. Китайская вакцина Varicella Vaccine Live, содержащая штамм Oka в количестве >1995 БОЕ, прошла преквалификацию ВОЗ и поставляется во многие страны, в отличие от вакцины VARI-L, которая содержит >2000 БОЕ и зарегистрирована только в Китае [24].
Различия вариантов штамма ВВО, входящего в состав вакцин, обусловлены генетическим полиморфизмом вируса, особенно наличием однонуклеотидных замен в генах, экспрессирующихся на ранних стадиях репликации. Этот фактор влияет на эффективность вакцин, выработку антител, риск поствакцинальных осложнений, стандартизацию препарата. D.P. Depledge с соавт. провели сравнительный молекулярно-генетический анализ последовательностей нескольких партий вакцин и показали, что >100 однонуклеотидных полиморфизмов (ОНП) сохраняются во всех партиях вакцин. Поскольку шесть ОНП практически фиксированы, это позволило предположить, что именно они ответственны за аттенуацию. Был идентифицирован вариантный аллель гена гликопротеина В (gB), который способствует ослаблению вакцинного штамма vOka [25]. В другой работе исследовали полиморфизм гена гликопротеина С (gC), поскольку ранее было выявлено, что при поражениях кожи содержание gC увеличивается. Различия в содержании gC, приобретенные путем пассажей тканевой культуры, могут способствовать ослаблению вакцины против ВО. Эти результаты подтверждаются работами с рекомбинантным вирусом ВО, в котором «отключали» экспрессию гена ORF14 [2]. Таким образом, сравнение геномов функционально аннотированных штаммов (на основе базы данных «Генная онтология», gene ontology) и вакцинных штаммов может быть эффективным подходом для определения фенотипов последних. Оценка ослабления действия вируса при наработке вакцинных штаммов важна для нивелирования опасений, связанных с введением живых аттенуированных вакцин [26].
На фоне введения живой вакцины описаны случаи горизонтальной трансмиссии вируса штамма Oka, выделяемого из сыпи после вакцинации, особенно если у вакцинированного пациента отмечалась выраженная сыпь. Поскольку данные случаи были характерны только для пациентов с иммуносупрессивным состоянием и не отмечены у здоровых лиц, в инструкции по применению препаратов указывается, что по возможности следует избегать тесного контакта с восприимчивыми к вирусу людьми из группы риска в течение 6 нед. после вакцинации10. Целесообразно в целях предупреждения заражения аэрозольным путем не вводить вакцину против ВО, если в помещении, где проводится вакцинация, находится человек с ослабленным иммунитетом, беременная женщина или новорожденный [27].
Первая вакцина против ОГ, которая изначально разрабатывалась для профилактики ВО, была на основе живого аттенуированного вакцинного штамма Oka вируса ВО (vOka). Однако после изучения механизмов реактивации ВВО с учетом гипотезы Хоуп–Симпсона вакцину испытали для оценки профилактической эффективности против ОГ и его осложнений, в частности ПГН. Количество vOka в вакцине против ОГ было увеличено в ≥14 раз по сравнению с вакциной против ВО, поскольку у взрослых лиц есть определенное количество антител [28]. В 2006 г. после успешных испытаний вакцина Zostavax® была зарегистрирована в США и рекомендована для применения у лиц возраста 50 лет и старше [29].
Живая аттенуированная вакцина против ОГ NBP608 (SKYZoster®) разработана компанией SK Bioscience (Южная Корея) и производится из штамма вируса Oka с использованием клеточной линии MRC-5. Вакцина была одобрена для применения в Южной Корее в октябре 2017 г. Результаты КИ фазы III показали, что NBP608 безопасна и иммуногенна и не уступает по своим характеристикам вакцине Zostavax® при применении у здоровых людей в возрасте 50 лет и старше [30].
Эффективность живой вакцины против ОГ снижается с течением времени. В обсервационных исследованиях оценивалась продолжительность защитного действия вакцины в течение 11 лет после вакцинации. Установлено, что эффективность живой вакцины против ОГ в профилактике заболеваемости ПГН и ОГ снизилась с 66,5 до 35,4% и с 51,3 до 21,1% соответственно. Защитное действие сохранялось в течение 10 лет (распространенность ОГ и заболеваемость ПГН) и 8 лет (заболеваемость ОГ). Кроме того, были отмечены случаи диссеминации vOka на фоне вакцинации, развитие устойчивых штаммов Herpes zoster и развитие ПГН у вакцинированных [31].
В 2017 г. была одобрена первая рекомбинантная субъединичная вакцина Shingrix®, содержащая рекомбинантный gE ВВО и адъювантную систему AS01B. В настоящее время вакцина одобрена для применения у взрослых лиц ≥50 лет, а также у взрослых лиц ≥18 лет, которые подвергаются или будут подвержены повышенному риску заболевания ОГ. Выбор gE в качестве иммуногена обусловлен тем, что он является наиболее распространенным гликопротеином в вирионах ВВО и инфицированных клетках; необходим для репликации вируса и распространения от клетки к клетке, а также является основной мишенью для специфических CD4+ Т-клеток. В вакцинном варианте для получения растворимого секретируемого белка использовалась транкированная форма gE длиной 546 аминокислотных остатков. Адъювантная система AS01B разработана на основе липосом и содержит два иммуностимулятора. Монофосфорил липид A, агонист Toll-подобного рецептора 4 (TLR4), индуцирует экспрессию NF-κB, продукцию цитокинов и активирует антигенпрезентирующие клетки. QS-21, природный сапонин, индуцирует CD4+ T-клеточные ответы. Эффективность рекомбинантной вакцины в профилактике заболеваемости ОГ составила 97,2 и 89,8% у взрослых лиц ≥50 и ≥70 лет соответственно; эффективность вакцинации в отношении предотвращения заболеваемости ПГН составила 88,8% [16][31].
Иммунизация рекомбинантной вакциной стимулировала более выраженные ВВО-специфические и gE-специфические клеточные и гуморальные ответы по сравнению с введением живой аттенуированной вакцины. Концентрации антител к gE и содержание CD4+ T-клеток, экспрессирующих, по крайней мере, 2 из 4 маркеров активации — интерферон-γ (IFN-γ) / интерлейкин-2 (IL-2) / фактор некроза опухоли-альфа (TNF-α) / лиганд CD40 — сохранялись в течение 6 и 9 лет после вакцинации соответственно по данным обсервационных исследований. Поскольку Т-клеточные иммунные ответы были неустойчивыми у четверти вакцинированных лиц старшего возраста, разработаны рекомендации по ревакцинации, особенно для пожилых людей. Введение одной бустерной дозы рекомбинантной вакцины достаточно для поддержания иммунного ответа [2]. Рекомбинантная вакцина рекомендована ВИЧ-инфицированным лицам ≥50 лет (CD4+ Т-лимфоциты ≥200 клеток/мкл) при двукратном режиме введения [32].
Для пациентов с аутоиммунными заболеваниями общей рекомендацией является вакцинация перед началом иммуносупрессивной терапии. При введении рекомбинантной вакцины пациентам с аутоиммунными заболеваниями существует теоретический риск того, что адъюванты, такие как AS01B (а именно компонент QS21), могут спровоцировать или усугубить аутоиммунные заболевания. Поэтому вакцинацию предпочтительно проводить в период ремиссии [29][33].
Опыт вакцинации против ОГ выявил ряд недостатков существующих вакцин. Так, эффективность живых аттенуированных вакцин для профилактики ОГ обычно ниже по сравнению с рекомбинантной и снижается с течением времени. Живую аттенуированную вакцину нельзя использовать у пациентов с иммунодефицитным состоянием. Рекомбинантная вакцина требует двукратного введения с интервалом 2–6 мес., а адъювант AS01B способствует ее большей реактогенности. Описаны случаи синдрома Гийена — Барре (СГБ), связанные с введением вакцины Shingrix®. В связи с этим Управление по контролю за качеством продуктов питания и лекарственных средств (FDA) потребовало включить предупреждение о СГБ в инструкцию по применению препарата11.
Вакцины против ветряной оспы и опоясывающего герпеса на стадии разработки
Несмотря на длительный период исследований ВВО и коммерческую доступность семи живых аттенуированных вакцин против ВО, двух живых и рекомбинантной вакцин против ОГ, остается неудовлетворенной потребность в эффективных и безопасных вакцинах, а также в их бесперебойных поставках для массовой вакцинации в рамках НКПП и планируемого расширения охвата вакцинацией в рамках реализации стратегии ВОЗ. Основная парадигма разработки профилактических вакцинных препаратов состоит в использовании наиболее иммуногенных частей вируса, а именно гликопротеинов оболочки. Рекомбинантные вакцины на основе вирусных гликопротеинов востребованы, безопасны и могут использоваться для иммунизации иммунокомпрометированных лиц. Живые аттенуированные вакцины также находятся на разных стадиях разработки, поскольку для профилактики ВО они наиболее эффективны и показаны к применению у детей. Разработки сплит-вакцин и мРНК-вакцин против ВО и ОГ представляют собой новые направления, поэтому необходимо изучить эффективность и безопасность применения этих препаратов среди детей и взрослых. Страной-лидером в разработке вакцин против ВО и ОГ является Китай (табл. 2). Российские вакцины против ВО и ОГ находятся на ранних стадиях разработки.
Таблица 2. Вакцины против ветряной оспы и опоясывающего герпеса в клинических исследованиях
Table 2. Varicella and herpes zoster vaccines in clinical trials
|
Тип вакцины Vaccine type |
Название вакцины, страна-разработчик Vaccine name, country of origin |
Фаза Phase |
Механизм действия Mechanism of action |
Преимущества и недостатки Advantages and disadvantages |
ClinicalTrial.gov ID |
|
Вакцины против опоясывающего герпеса / Herpes zoster vaccines |
|||||
|
Рекомбинантная субъединичная Recombinant subunit vaccine |
BV211, Китай / China |
I |
Выработка нейтрализующих антител, блокада уклонения вируса от иммунной системыa Production of neutralising antibodies, blocking the virus evasion from the immune systema |
Преимущества: безопасность, отсутствие риска заражения. Недостатки: сниженный иммунный ответ по сравнению с живой аттенуированной вакциной, необходимость ревакцинации Advantages: safety, no risk of infection. Disadvantages: reduced immune response compared to live attenuated vaccine, need for revaccination |
NCT05718037 |
|
LZ901, Китай / China |
III |
NCT06088745 |
|||
|
Рекомбинантная вакцина против опоясывающего герпеса, Китай Recombinant herpes zoster vaccine, China |
II |
NCT05856084 |
|||
|
Z-1018 (gE с адъювантом-CpG 1018), США / gE-based vaccine with adjuvant-CpG 1018, USA |
I |
NCT05245838 |
|||
|
REC610, Китай China |
I |
NCT05769049 |
|||
|
CVI-VZV-001 рекомбинантная с gE, Южная Корея / gE-based recombinant vaccine, South Korea |
I |
NCT06137755 |
|||
|
Рекомбинантная векторная Recombinant vector vaccine |
ChAdOx1-VZV (аденовирусный вектор), Китай / Adenovirus vector, China |
I |
Доставка антигенов в составе вектора и индукция иммунных реакций к соответствующему антигену Delivery of antigens in the vector and induced immune reactions to the corresponding antigen |
Преимущества: высокая иммуногенность благодаря природным MAMPs переносчикам, индукция клеточно-опосредованного и гуморального иммунного ответа. Недостатки: риск контаминации окружающей среды генетически модифицированными организмами, риск интеграции в геном хозяина, высокая или стойкая репликация Advantages: high immunogenicity due to natural carrier MAMPs, induction of cell-mediated and humoral immune response. Disadvantages: risk of environmental contamination by genetically modified organisms, risk of integration into the host genome, high or persistent replication |
NCT05991427 |
|
РНК-вакцины RNA vaccines |
VZV modRNA, США USA |
II |
Выработка нейтрализующих антител, повышение активности естественных клеток-киллеров и спленоцитов Production of neutralising antibodies; increased activity of natural killer cells and splenocytes |
Преимущества: отсутствие риска заражения, специфический иммунный ответ, стабильность препарата, хорошая переносимость, легко изменяемый состав. Недостатки: нет данных по длительному наблюдению применения у людей, эффективность зависит от системы доставки, высокая стоимость производства Advantages: no infection risk, specific immune response, drug stability, good tolerability, easily changeable composition. Disadvantages: no data on long-term monitoring of human use; effectiveness depends on the delivery system; high production cost |
NCT05703607 |
|
mRNA-1468, США USA |
II |
NCT05701800 |
|||
|
JCXH-105, Китай China |
I |
NCT05871541 |
|||
|
Вакцины против ветряной оспы и опоясывающего герпеса / Varicella and herpes zoster vaccines |
|||||
|
Рекомбинантная векторная Recombinant vector vaccine |
CRV-101, США / USA |
II |
Индукция гуморальных и клеточно-опосредованных адаптивных иммунных реакций и врожденного иммунитета, ослабление репликации вируса Induction of humoral and cell-mediated adaptive immune responses and innate immunity, attenuation of viral replication |
Преимущества: более длительный иммунный ответ, профилактическая и терапевтическая эффективность. Недостатки: опасения по поводу безопасности вакцины, нейротропности, передачи или реактивации вируса Advantages: longer immune response, preventive and therapeutic effectiveness. Disadvantages: concerns about safety, neurotropicity, transmission or reactivation |
NCT05304351 |
|
Живая аттенуированная Live attenuated vaccine |
Живая аттенуированная вакцина, Китай / Live attenuated zoster vaccine, China |
III |
NCT05669625 |
||
|
Живая аттенуированная, Китай Live attenuated vaccine, China |
III |
NCT04334577 |
|||
|
Живая аттенуированная, Китай Live attenuated vaccine, China |
III |
NCT03314103 |
|||
Таблица составлена авторами / The table was prepared by the authors
Примечание. CpG — мотивы (синтетические олигонуклеотиды, содержащие иммуностимулирующие CpG-последовательности); MAMPs — молекулярные паттерны, ассоциированные с микроорганизмами.
a За счет влияния на формирование Т-клеточного иммунитета к белкам, участвующим в уклонении от иммунной системы.
Note. CpG, motif (synthetic oligonucleotides containing immunostimulating CpG sequences); MAMPs, microbe-associated molecular patterns.
a Due to effect on formation of T-cell immunity to proteins evading immune system.
Живая вакцина против ВО не предназначена для применения у лиц со сниженным иммунитетом. Для решения данной проблемы были разработаны вакцинные препараты на основе штамма Oka, инактивированного при термической обработке или гамма-излучением. Препараты содержат более низкий начальный титр по сравнению с живой аттенуированной вакциной. Исследования вакцины на реципиентах с трансплантацией гемопоэтических клеток продемонстрировали иммуногенность и эффективность режима введения первой дозы перед трансплантацией и трех последующих доз ежемесячно. Эта инактивированная вакцина также была иммуногенной у пациентов с солидными опухолями и онкогематологическими заболеваниями, получающих химиотерапевтические препараты, и у ВИЧ-инфицированных пациентов (CD4+ Т-лимфоциты <200 клеток/мкл), но не у реципиентов аллогенной трансплантации стволовых клеток [34]. КИ фазы III в сопоставимой группе пациентов с ослабленным иммунитетом, которым вводили инактивированный при помощи гамма-излучения штамм ВВО, продемонстрировало эффективность в профилактике заболеваемости ОГ 63,8% (95% ДИ 48,4–74,6); профилактике осложнений ОГ — 73,5% (95% ДИ 49,8–86,0) и профилактике ПГН — 83,7% (95% ДИ 44,6–95,2). Однако нет данных о длительности этого эффекта. Вакцина не содержит адъюванта, хорошо переносится и может быть показана в качестве первой дозы для усиления других вакцин, которые применяются у пациентов с ослабленным иммунитетом [35].
Китайские ученые разрабатывают аттенуированную вакцину (v7D) против ВО на основе штамма Oka, у которого удален ген ORF7. Поскольку белок ORF7 участвует в процессе слияния клеток и образовании синцитиев во время инфицирования, что имеет решающее значение для репликации ВВО в эпителиальных и нервных тканях, нарушение распространения вируса может быть связано с уменьшением риска его реактивации и развития ОГ и ПГН [36][37].
Большинство разрабатываемых вакцин — рекомбинантные вакцины, содержащие gЕ в качестве антигена. Так, адъювантная субъединичная вакцина CRV-101 (Amezosvatein®) компании Curevo vaccine (США) успешно прошла КИ фазы II, и в 2024 г. запланировано начало КИ фазы III. В состав Amezosvatein®, по аналогии с Shingrix®, включен адъювант, нацеленный на сигнальный путь с участием TLR4 для усиления иммунного ответа на антиген gE12. В 2023 г. компания Luzhu Biotechnology (Китай) анонсировала успешные результаты КИ фазы II и запустила КИ фазы III рекомбинантной вакцины против ОГ. Вакцину испытывают в Китае, США и планируют регистрацию FDA13. Вакцина EG-HZ против ОГ на основе рекомбинантного gE и липосомального адъюванта CIA05 (агонист TLR4) в форме одного шприца успешно прошла КИ фазы I в Австралии; КИ фазы II будут проводиться в Южной Корее14. Компания BravoVax15 (Китай) изучает рекомбинантную вакцину против ОГ в КИ фазы I наряду с компанией Recbio16 (Китай), которая завершила набор пациентов в КИ фазы I в марте 2024 г. Вакцина REC610 содержит новый адъювант BFA01, который способствует выработке высоких уровней gE-специфических антител и CD4+ T-клеток. Компания Dynavax (США) начала набор пациентов в КИ фазы I/II для испытания кандидатной вакцины, преимущества которой, по заявлению разработчиков, заключаются в установленном профиле безопасности и переносимости адъюванта CpG 1018 в ее составе в сочетании со способностью последнего вызывать сильные реакции CD4+ Т-клеток17.
Наряду с рекомбинантными вакцинами против ОГ, используя опыт разработок вакцин против SARS-CoV-2, исследуются вакцины на основе аденовирусных векторов. В 2023 г. компании Vaccitech (ЕС) и CanSino Biologics (Китай) анонсировали КИ фазы I препарата ChAdOx1-VZVgE (CSB-016; VTP-400), представляющего собой ChAdOx1 (рекомбинантный аденовирус шимпанзе (ChAd) серотипа Y25 с заменой нативных генов E4 ORF4, ORF6 и ORF6/7 на гены аденовируса человека HAdV-C5) с включением гена ORF68, который кодирует белок gE ВВО [38]. Британские ученые разработали кандидатную двухвалентную вакцину против герпеса и респираторно-синцитиального вируса на основе аденовирусной платформы ChAdOx2 — родственный аденовирусный вектор на основе аденовируса Chimpanzee 68 (ChAd68), также известного как SAdV-25 и Pan 9 [39]. Предполагается, что вакцина будет не только иммуногенна и безопасна, но и коммерчески доступна и термостабильна. На стадии доклинических исследований (ДКИ) находится кандидатный препарат, который содержит рекомбинантные аденовирусы rChAd63/gE, экспрессирующие gE ВВО. Вакцина на основе аденовируса шимпанзе серотипа 63 (ChAd63) при исследовании на мышах C57BL/6 показала сопоставимые реакции CD4+ и CD8+ T-клеток по сравнению с вакциной Shingrix® [40].
Новым направлением, получившим стремительное развитие в период пандемии COVID-19, стало внедрение мРНК-технологий для создания вакцин. Компании Pfizer, Moderna и Immorna Biotherapeutics разрабатывают препараты на основе самореплицирующихся РНК (срРНК), инкапсулированных в липидные наночастицы. В отличие от нереплицирующихся мРНК-вакцин при репликации срРНК в трансфицированных клетках генерируются промежуточные двухцепочечные РНК. Данный процесс стимулирует сильный врожденный иммунный ответ, который затем усиливает адаптивный иммунный ответ для проявления эффекторных функций, в том числе опосредованных Т-клетками, — основной механизм иммунной защиты от ОГ. Так, в исследованиях18 показано, что после внутримышечного введения кандидатной вакцины JCXH-105 in vivo экспрессируется целевой антиген ВВО в течение более длительного периода времени, по сравнению с нереплицирующейся мРНК-вакциной. Это способствует формированию более стойкого иммунного ответа для профилактики ОГ. Вакцина JCXH-105 может быть эффективна в значительно более низкой дозе по сравнению с нереплицирующейся мРНК-вакциной.
На стадии ДКИ находятся продукты компании GreenLight Biosciences Inc (США): кандидатные мРНК-вакцины, инкапсулированные в липопротеин (ЛПН) на основе липида NOF или SM102, нацеленные на усиление иммунного ответа на поверхностный gE. У мышей, получивших разные варианты мРНК-ЛПН вакцин, наблюдалась значительно более высокая продукция антигенспецифических цитокинов Т-клетками по сравнению с мышами, получившими вакцину Shingrix®. На основе обнаружения персистирующих gE-специфических долгоживущих плазматических клеток (LLPC) и Т-клеток памяти через четыре месяца после последней иммунизации вакцинами мРНК-ЛНП был сделан вывод о долговременном ответе клеточной памяти [41].
H. Cao с соавт. изучили прототипы мРНК-вакцин, которые кодировали полноразмерный gE, внеклеточный домен gE и gE с несколькими мутациями C-концевого домена, инкапсулированных в липопротеиновую оболочку. Вакцина на основе gE с несколькими мутациями C-концевого домена продемонстрировала стабильные преимущества по всем показателям, включая высокие титры gE-специфических IgG и реакции Т-клеток, и предложена в качестве кандидатного вакцинного препарата против ОГ [42].
На стадии ДКИ находятся ДНК-вакцины. В качестве ДНК-вакцины использовали эукариотическую экспрессионную плазмиду (pcDNA-gE) с вставкой гена, кодирующего gE ВВО, которая индуцировала специфические гуморальные и клеточные иммунные реакции после иммунизации [43]. В свою очередь, компания GeneOne Life Science (Южная Корея), ведущая разработки препаратов на основе нуклеиновых кислот, включая ДНК- и РНК-вакцины, представила ДНК-вакцину GLS-5100 против ВВО, кодирующую антиген, вовлеченный в латентность вируса19.
Используя технологию получения вирусоподобных частиц и систему экспрессии рекомбинантных белков на основе клеток Spodoptera frugiperda (Sf9) и бакуловируса, компания CPL Biologicals (Индия) разрабатывает вакцину против ОГ, которая переходит на стадию ДКИ20.
Наряду с белком gE, белок IE63 (immediate-еarly 63), экспрессирующийся во время латентности ВВО, может быть потенциальным антигеном. Так, разработаны и испытаны на иммуногенность ДНК-вакцины против ОГ, кодирующие белки gE, IE63, IE63-2A-gE или IE63-линкер-gE с саморасщепляющейся «2А» или линкерной последовательностью соответственно. Титры нейтрализующих антител, образующихся в ответ на введение ДНК-вакцин на основе IE63-2A-gE и gE или живой аттенуированной вакцины, были сопоставимыми. Введение ДНК-вакцин IE63-2A-gE, gE или IE63 приводило к значительному увеличению секреции IFN-γ (IE63) и IL-2 (gE) по сравнению с живой аттенуированной вакциной, что указывает на иммунный ответ по Th1-типу. Кроме того, применение вакцин на основе IE63-2A-gE и gE индуцировало цитотоксическую активность CD8+ T-клеток [44].
Исследования в области разработки отечественной вакцины против ВВО и ОГ ведутся в ФГБНУ «НИИ вакцин и сывороток им. И.И. Мечникова». Были получены холодоадаптированные штаммы ВВО vFiraVax и vZelVax, депонированные в Государственную коллекцию вирусов НИИ вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» [45][46]. Проводится научная работа по изучению влияния полученных штаммов на гуморальный и клеточный иммунные ответы по параметрам экспрессии Toll-подобных рецепторов, TNF-α и др., что важно для дополнения протоколов рутинной оценки эффективности вакцинации; планируется создание прототипов живой и рекомбинантной вакцин для профилактики заболеваний, ассоциированных с ВВО.
ЗАКЛЮЧЕНИЕ
Вакцины против ветряной оспы (ВО) на основе штамма Oka обладают низкой вирулентностью, индуцируют выраженный и стойкий иммунный ответ, обеспечивая защиту от ВО и ее осложнений, и широко применяются в разных странах мира. Актуальна разработка безопасных вакцин следующего поколения с низким патогенным потенциалом или без такового для обеспечения массовой иммунизации и внедрения программы ВОЗ по установлению всемирного коллективного иммунитета против ВО. У лиц со сниженным иммунитетом существует потенциальный риск возникновения побочных эффектов на фоне вакцинации. Тропизм штамма vOka к коже может привести к появлению сыпи после иммунизации, похожей на ВО, поэтому вакцина на основе vOka не рекомендована для применения у лиц из группы риска. Высокий приоритет имеют разработки генно-инженерных вакцинных препаратов, которые не только предотвращают заболевание опоясывающим герпесом (ОГ) и связанные с ним осложнения, но и являются безопасными для лиц пожилого возраста и иммунокомпрометированных пациентов.
Востребованными остаются не только модифицированные варианты живых вакцин, но и рекомбинантные, векторные, а также РНК-, ДНК-вакцины. В целом эффективные вакцины должны индуцировать гуморальный и CD4+ Т-клеточный ответы, а также CD8+ Т-клеточный ответ. Необходимым условием совершенствования оценки эффективности генно-инженерных вакцин является внедрение в протоколы исследований анализа параметров не только антительного ответа, но и клеточного — по уровням экспрессии маркерных генов или белков IFN-γ, TNF-α, IL-2 и др. Протоколы оценки антительного ответа можно дополнить определением авидности IgG к очищенному гликопротеину E.
Ожидаемые на фармацевтическом рынке вакцины должны соответствовать следующим критериям: безопасности, что позволит проводить вакцинацию лиц из группы риска; эффективности, которая должна быть выше по сравнению с существующими вакцинами; широкой доступности для населения.
Стратегия обеспечения населения вакцинами против ВО и ОГ включает в себя разработку российской вакцины, внедрение в практику и масштабирование ее производства или локализацию в России производства импортной вакцины. По последнему пути решили идти несколько российских компаний в надежде локализовать вакцины в самом ближайшем будущем. Более сложный путь — разработка собственной российской вакцины в рамках импортозамещения. Такая программа реализуется в настоящее время в ФГБНУ «НИИ вакцин и сывороток имени И.И. Мечникова», где на этапе научно-исследовательской разработки находится живая вакцина против ВО с собственным запатентованным штаммом ВВО в основе, и рекомбинантная вакцина против ОГ. При успешных результатах дальнейших доклинических и клинических исследований вакцины на основе российских штаммов ВВО будут способствовать увеличению охвата населения вакцинацией.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.В. Зотова — концепция работы, работа с источниками литературы, написание текста рукописи, формулировка выводов; О.А. Свитич — участие в формулировке выводов, утверждение окончательной версии статьи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.V. Zotova conceptualised the study, worked with literature sources, drafted the manuscript, and formulated the conclusions. O.A. Svitich participated in formulating the conclusions and approved the final version for publication.
1. Varicella and herpes zoster vaccines. WHO position paper, June 2014. Wkly Epidemiol Rec. 2014;89(25):265–87.
2. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2023 году: Государственный доклад. М.: Роспотребнадзор; 2024.
3. Varicella and herpes zoster vaccines. WHO position paper, June 2014. Wkly Epidemiol Rec. 2014;89(25):265–87.
4. https://immunizationdata.who.int/global/wiise-detail-page/introduction-of-varicella-vaccine?ISO_3_CODE=&YEAR
5. Там же.
6. Varicella and herpes zoster vaccines. WHO position paper, June 2014. Wkly Epidemiol Rec. 2014;89(25):265–87.
7. Указ Президента Российской Федерации от 06.06.2019 № 254 (ред. от 27.03.2023) «О Стратегии развития здравоохранения в Российской Федерации на период до 2025 года».
8. https://extranet.who.int/prequal/vaccines/prequalified-vaccines
9. Там же.
10. https://www.cdc.gov/pinkbook/hcp/table-of-contents/chapter-22-varicella.html
11. https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/fda-requires-warning-about-guillain-barre-syndrome-gbs-be-included-prescribing-information-shingrix
12. https://curevovaccine.com/amezosvatein-for-shingles/
13. http://www.luzhubiotech.com/techAndProduct/productInResearch
14. https://eyegene.co.kr/kor/
15. https://www.bravovax.com/?products/1169.html
16. https://www.recbio.cn/en/media/press-release/20240820/
17. https://www.dynavax.com/
18. https://clinicaltrials.gov/study/NCT05871541
19. https://genels.com/en/sub/technology/vaccine.asp
20. https://cplbio.com/technology/
Список литературы
1. Рудакова АВ, Харит СМ, Бабаченко ИВ и др. Эффективность затрат на вакцинацию детей против ветряной оспы в Российской Федерации. Журнал инфектологии. 2021;13(3):114–9. https://doi.org/10.22625/2072-6732-2021-13-3-114-119
2. Arvin АМ, Moffat JF, Abendroth A, Oliver SL. Varicella-zoster virus. Genetics, pathogenesis and immunity. Springer Cham; 2023. https://doi.org/10.1007/978-3-031-15305-1
3. Sauerbrei A, Wutzler P. Herpes simplex and varicella-zoster virus infections during pregnancy: current concepts of prevention, diagnosis and therapy. Part 2: Varicella-zoster virus infections. Med Microbiol Immunol. 2007;196(2):95–102. https://doi.org/10.1007/s00430-006-0032-z
4. Schmidt-Chanasit J, Sauerbrei A. Evolution and world-wide distribution of varicella-zoster virus clades. Infect Genet Evol. 2011;11(1):1–10. https://doi.org/10.1016/j.meegid.2010.08.014
5. Johnson RW, Wasner G, Saddier P, Baron R. Herpes zoster and postherpetic neuralgia: optimizing management in the elderly patient. Drugs Aging. 2008;25(12): 991–1006. https://doi.org/10.2165/0002512-200825120-00002
6. Forbes HJ, Thomas SL, Smeeth L, et al. A systematic review and meta-analysis of risk factors for postherpetic neuralgia. Pain. 2016;157(1):30–54. https://doi.org/10.1097/j.pain.0000000000000307
7. Johnson RW, Rice AS. Clinical practice. Postherpetic neuralgia. N Engl J Med. 2014;371(16):1526–33. https://doi.org/10.1056/NEJMcp1403062
8. Huerta MÁ, Garcia MM, García-Parra B, et al. Investigational drugs for the treatment of postherpetic neuralgia: Systematic review of randomized controlled trials. Int J Mol Sci. 2023;24(16):12987. https://doi.org/10.3390/ijms241612987
9. Приходченко НГ. Инфекция, вызванная вирусом ветряной оспы: особенности течения, клинические проявления, осложнения и возможности профилактики. Терапевтический архив. 2021;93(11):1401–6. https://doi.org/10.26442/00403660.2021.11.201192
10. Исагулян ЭД, Семенов ДЭ, Томский АА. Нейрохирургическое лечение постгерпетической невралгии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2024;124(2):154–7. https://doi.org/10.17116/jnevro2024124021154
11. Davis AR, Sheppard J. Herpes zoster ophthalmicus review and prevention. Eye Contact Lens. 2019;45(5):286–91. https://doi.org/10.1097/ICL.0000000000000591
12. Kedar S, Jayagopal LN, Berger JR. Neurological and ophthalmological manifestations of varicella zoster virus. J Neuroophthalmol. 2019;39(2):220–31. https://doi.org/10.1097/WNO.0000000000000721
13. Curhan SG, Kawai K, Yawn B, et al. Herpes zoster and long-term risk of cardiovascular disease. J Am Heart Assoc. 2022;11(23):e027451. https://doi.org/10.1161/JAHA.122.027451
14. Bakradze E, Esenwa CC, Schmid DS, et al. Cross-sectional retrospective study to identify clinical and radiographic features associated with VZV reactivation in cryptogenic stroke patients with CSF testing. Neurohospitalist. 2022;12(3):437–43. https://doi.org/10.1177/19418744221075123
15. Wu H, Li J, Wang R, et al. A case of ischemic stroke secondary to varicella-zoster virus meningoencephalitis. J Neurovirol. 2022;28(2):319–21. https://doi.org/10.1007/s13365-022-01050-x
16. Lecrenier N, Beukelaers P, Colindres R, et al. Development of adjuvanted recombinant zoster vaccine and its implications for shingles prevention. Expert Rev Vaccines. 2018;17(7):619–34. https://doi.org/10.1080/14760584.2018.1495565
17. Chaves SS, Haber P, Walton K, et al. Safety of varicella vaccine after licensure in the United States: Experience from reports to the vaccine adverse event reporting system, 1995–2005. J Infect Dis. 2008;197(Suppl 2):S170–7. Erratum in: J Infect Dis. 2014;210(12):2021. https://doi.org/10.1086/522161
18. Davidson N, Broom J. Vaccine strain varicella zoster virus transmitted within a family from a child with shingles results in varicella meningitis in an immunocompetent adult. Intern Med J. 2019;49(1):132–3. https://doi.org/10.1111/imj.14178
19. Tseng HF, Schmid DS, Harpaz R, et al. Herpes zoster caused by vaccine-strain varicella zoster virus in an immunocompetent recipient of zoster vaccine. Clin Infect Dis. 2014;58(8):1125–8. https://doi.org/10.1093/cid/ciu058
20. Quinlivan M, Breuer J. Clinical and molecular aspects of the live attenuated Oka varicella vaccine. Rev Med Virol. 2014;24(4):254–73. https://doi.org/10.1002/rmv.1789
21. Choi UY, Kim KH, Lee J, et al. Immunogenicity and safety profiles of a new MAV/06 strain varicella vaccine in healthy children: A multinational, multicenter, randomized, double-blinded, active-controlled phase III study. Vaccine. 2021;39(12):1758–64. https://doi.org/10.1016/j.vaccine.2021.02.013
22. Pan CX, Lee MS, Nambudiri VE. Global herpes zoster incidence, burden of disease, and vaccine availability: A narrative review. Ther Adv Vaccines Immunother. 2022;10:25151355221084535. https://doi.org/10.1177/25151355221084535
23. Choi UY, Kim KH, Cho HK, et al. Immunogenicity and safety of a newly developed live attenuated varicella vaccine in healthy children: A multi-national, randomized, double-blinded, active-controlled, phase 3 study. Vaccines (Basel). 2023;11(9):1416. https://doi.org/10.3390/vaccines11091416
24. Lee YH, YJ Choe, Lee J, et al. Global varicella vaccination programs. Clin Exp Pediatr. 2022;65(12):555–62. https://doi.org/10.3345/cep.2021.01564
25. Depledge DP, Yamanishi K, Gomi Y, et al. Deep sequencing of distinct preparations of the live attenuated varicella-zoster virus vaccine reveals a conserved core of attenuating single-nucleotide polymorphisms. J Virol. 2016;90(19):8698–704. https://doi.org/10.1128/JVI.00998-16
26. Moon JY, Seo J, Lee J, Park D. Assessment of attenuation of varicella-zoster virus vaccines based on genomic comparison. J Med Virol. 2023;95(3):e28590. https://doi.org/10.1002/jmv.28590
27. Marin M, Leung J, Gershon AA. Transmission of vaccine-strain varicella-zoster virus: A systematic review. Pediatrics. 2019;144(3):e20191305. https://doi.org/10.1542/peds.2019-1305
28. Oxman MN, Levin MJ, Johnson GR, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med. 2005;352(22):2271–84. https://doi.org/10.1056/NEJMoa051016
29. Harbecke R, Cohen JI, Oxman MN. Herpes zoster vaccines. J Infect Dis. 2021;224(12 Suppl 2):S429–42. https://doi.org/10.1093/infdis/jiab387
30. Choi WS, Choi JH, Jung DS, et al. Immunogenicity and safety of a new live attenuated herpes zoster vaccine (NBP608) compared to Zostavax® in healthy adults aged 50 years and older. Vaccine. 2019;37(27):3605–10. https://doi.org/10.1016/j.vaccine.2019.04.046
31. Cunningham AL, Levin MJ. Herpes zoster vaccines. J Infect Dis. 2018;218(Suppl 2):S127–33. https://doi.org/10.1093/infdis/jiy382
32. Thompson MA, Horberg MA, Agwu AL, et al. Primary care guidance for persons with human immunodeficiency virus: 2020 update by the HIV medicine association of the infectious diseases society of America. Clin Infect Dis. 2021;73(11):e3572–605. https://doi.org/10.1093/cid/ciaa1391 Erratum in: Clin Infect Dis. 2022;74(10):1893–98. https://doi.org/10.1093/cid/ciab801 Erratum in: Clin Infect Dis. 2022;75(11):2052. https://doi.org/10.1093/cid/ciac474
33. Furer V, Rondaan C, Heijstek MW, et al. 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis. 2020;79(1):39–52. https://doi.org/10.1136/annrheumdis-2019-215882
34. Mullane KM, Winston DJ, Wertheim MS, et al. Safety and immunogenicity of heat-treated zoster vaccine (ZVHT) in immunocompromised adults. J Infect Dis. 2013;208(9):1375–85. https://doi.org/10.1093/infdis/jit344
35. Winston DJ, Mullane KM, Cornely OA, et al. V212 protocol 001 trial team. Inactivated varicella zoster vaccine in autologous haemopoietic stem-cell transplant recipients: an international, multicentre, randomised, double-blind, placebo-controlled trial. Lancet. 2018;391(10135):2116–27. https://doi.org/10.1016/S0140-6736(18)30631-7
36. Wang W, Pan D, Fu W, et al. Development of a skin- and neuro-attenuated live vaccine for varicella. Nat Commun. 2022;13(1):824. https://doi.org/10.1038/s41467-022-28329-1
37. Selariu A, Cheng T, Tang Q, et al. ORF7 of varicella-zoster virus is a neurotropic factor. J Virol. 2012;86(16):8614–24. https://doi.org/10.1128/JVI.00128-12
38. Ulaszewska M, Merelie S, Sebastian S, Lambe T. Preclinical immunogenicity of an adenovirus-vectored vaccine for herpes zoster. Hum Vaccin Immunother. 2023;19(1):2175558. https://doi.org/10.1080/21645515.2023.2175558
39. Petherbridge L, Davis C, Robinson A, et al. Pre-clinical development of an adenovirus vector based RSV and shingles vaccine candidate. Vaccines (Basel). 2023;11(11):1679. https://doi.org/10.3390/vaccines11111679
40. Zheng Y, Huang L, Ding H, et al. Immunogenicity in mice immunized with recombinant adenoviruses expressing varicella-zoster virus envelope glycoprotein E. Viruses. 2023;15(12):2288. https://doi.org/10.3390/v15122288
41. Bhattacharya A, Jan L, Burlak O, et al. Potent and long-lasting humoral and cellular immunity against varicella zoster virus induced by mRNA-LNP vaccine. NPJ Vaccines. 2024;9(1):72. https://doi.org/10.1038/s41541-024-00865-5
42. Cao H, Wang Y, Luan N, Lin K, Liu C. Effects of varicella-zoster virus glycoprotein E carboxyl-terminal mutation on mRNA vaccine efficacy. Vaccines (Basel). 2021;9(12);1440. https://doi.org/10.3390/vaccines9121440
43. Bao L, Wei G, Gan H, et al. Immunogenicity of varicella zoster virus glycoprotein E DNA vaccine. Exp Ther Med. 2016;11(5):1788–94. https://doi.org/10.3892/etm.2016.3086
44. Liu J, Lin J, Cai L, et al. Immunogenicity of varicella zoster virus DNA vaccines encoding glycoprotein E and immediate early protein 63 in mice. Viruses. 2022;14(6):1214. https://doi.org/10.3390/v14061214
45. Зверев ВВ, Нагиева ФГ, Баркова ЕП, Осокина ОВ. Штамм «vFiraVax» для получения аттенуированной живой культуральной вакцины для профилактики ветряной оспы. Патент Российской Федерации № 2693440; 2019. EDN: JWECLO
46. Зверев ВВ, Нагиева ФГ, Баркова ЕП и др. Вирусный штамм для получения аттенуированной живой культуральной вакцины для профилактики и лечения опоясывающего герпеса для взрослого населения. Патент Российской Федерации № 2750818; 2020. EDN: ACINJQ
Об авторах
А. В. ЗотоваРоссия
Зотова Анна Вячеславовна, канд. фарм. наук
Малый Казенный пер., д. 5а, стр. 2, Москва, 105064
О. А. Свитич
Россия
Свитич Оксана Анатольевна, д-р мед. наук, проф., академик РАН
Малый Казенный пер., д. 5а, стр. 2, Москва, 105064; Трубецкая улица, д. 8, стр. 2, Москва, 119991
Дополнительные файлы
Рецензия
Для цитирования:
Зотова А.В., Свитич О.А. Вакцины против ветряной оспы и опоясывающего герпеса: от живых аттенуированных вакцин к генно-инженерным препаратам. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(4):461-474. https://doi.org/10.30895/2221-996X-2025-645
For citation:
Zotova A.V., Svitich O.A. Varicella and Herpes zoster vaccines: from live attenuated vaccines to genetically engineered products. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(4):461-474. (In Russ.) https://doi.org/10.30895/2221-996X-2025-645
JATS XML