Перейти к:
Валидация методики на основе биослойной интерферометрии для определения связывающих (общих) антител к ромиплостиму в сыворотке крови человека
https://doi.org/10.30895/2221-996X-2025-639
Резюме
ВВЕДЕНИЕ. В ряде случаев лечение ромиплостимом пациентов с идиопатической тромбоцитопенической пурпурой сопряжено с образованием антилекарственных антител (АЛА), что часто приводит к развитию серьезных неблагоприятных явлений. Для определения связывающих (общих) АЛА (оАЛА) к ромиплостиму в сыворотке крови человека предлагается методика, основанная на биослойной интерферометрии. С технической точки зрения использующие данный принцип приборы имеют некоторые преимущества (высокая пропускная способность, увеличенные межсервисные интервалы, низкий уровень контаминации оборудования при анализе биообразцов) перед приборами на основе поверхностного плазмонного резонанса, которые применяются для мониторинга оАЛА при проведении клинических исследований оригинального препарата. Для обеспечения воспроизводимости измерений и стандартизации лабораторного этапа клинических исследований иммуногенности биоаналогичного препарата необходима валидация методики.
ЦЕЛЬ. Установить ключевые валидационные характеристики методики, основанной на биослойной интерферометрии, для определения общих антилекарственных антител к ромиплостиму в сыворотке крови человека.
МАТЕРИАЛЫ И МЕТОДЫ. Принцип метода заключается в детектировании специфического взаимодействия связывающих антител, содержащихся в исследуемых образцах, с иммобилизованным на поверхности стрептавидиновых биосенсоров биотинилированным ромиплостимом. Методика состоит из этапа скрининг-теста, в котором определяется наличие или отсутствие оАЛА в образцах; подтверждающего теста для проверки специфичности связывания оАЛА с ромиплостимом; этапа определения титра антител, то есть предельного разведения, при котором оАЛА могут быть обнаружены в образцах. В работе использовались положительные контрольные образцы, содержащие различные концентрации поликлональных кроличьих антител к ромиплостиму. Детектирование белкового комплексообразования проводилось в режиме реального времени с использованием интерферометра Octet® QKe.
РЕЗУЛЬТАТЫ. Значения фактора биологической вариабельности и предельного значения незначимого ингибирования составили 1,481 и 34,2% соответственно. Подтверждены прецизионность и специфичность методики. Нижний предел детекции оАЛА в отсутствие ромиплостима составил 622 нг/мл. При оценке эффекта матрицы в скрининг-тесте аналитический сигнал 8 из 10 образцов сыворотки крови после добавления оАЛА увеличился более чем в 1,481 раза; в подтверждающем тесте значение показателя «процент ингибирования» превышало 34,2% при анализе 8 из 10 образцов с добавлением оАЛА. Эффект высокой дозы оАЛА в концентрации от 0,8 до 50 мкг/мл отсутствовал. Результаты определения оАЛА в скрининг-тесте были устойчивы к присутствию 1 нг/мл ромиплостима в образцах. Стрептавидиновые биосенсоры с иммобилизованным ромиплостимом сохраняли стабильность после 14 сут хранения при температуре 5±3 °С и не менее 20 циклов регенерации.
ВЫВОДЫ. Анализ полученных результатов валидации подтвердил пригодность методики на основе биослойной интерферометрии для достоверного и воспроизводимого определения связывающих (общих) антител к ромиплостиму в сыворотке крови человека.
Ключевые слова
Для цитирования:
Агафонова А.А., Жиляева М.В., Лягоскин И.В., Казаров А.А., Лисова А.Е., Шукуров Р.Р. Валидация методики на основе биослойной интерферометрии для определения связывающих (общих) антител к ромиплостиму в сыворотке крови человека. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(3):271-283. https://doi.org/10.30895/2221-996X-2025-639
For citation:
Agafonova A.A., Zhilyaeva M.V., Lyagoskin I.V., Kazarov A.A., Lisova A.E., Shukurov R.R. Validation of a biolayer interferometry-based method for the determination of binding (total) antibodies to romiplostim in human serum. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(3):271-283. (In Russ.) https://doi.org/10.30895/2221-996X-2025-639
ВВЕДЕНИЕ
Идиопатическая тромбоцитопеническая пурпура (ИТП) — редкое аутоиммунное заболевание, характеризующееся низким количеством тромбоцитов. Использование препаратов агонистов тромбопоэтинового рецептора, в число которых входит ромиплостим, увеличивает продолжительность и улучшает качество жизни пациентов с ИТП [1][2]. Вывод на фармацевтический рынок препарата ромиплостима российского производства способствует большей доступности терапии нуждающимся в ней пациентам.
Ромиплостим представляет собой гибридный белок, состоящий из Fc-фрагмента человеческого IgG1, С-конец каждой цепи которого ковалентно связан с пептидом, содержащим два фрагмента, которые взаимодействуют с тромбопоэтиновым рецептором. В клинических исследованиях оригинального препарата ромиплостима выявление общих антилекарственных антител (оАЛА) проводили с использованием метода поверхностного плазмонного резонанса (surface plasmon resonance, SPR). Вероятность развития клинически значимого иммунного ответа на данный препарат является низкой [3]. Однако образование АЛА может приводить к развитию серьезных неблагоприятных явлений [4]. Поэтому при разработке биоаналогичного препарата необходимо изучить его иммуногенность с помощью надежной и устойчивой методики.
Международными регуляторными органами рекомендовано использование многоуровневого подхода к оценке оАЛА1, который состоит из последовательных этапов: скрининг-теста, подтверждающего теста и оценки титра. Мониторинг изменения титра оАЛА помогает интерпретировать данные фармакокинетики, фармакодинамики и клинических наблюдений [5][6].
Для обнаружения оАЛА используются различные методы, включая иммуноферментный анализ (enzyme-linked immunosorbent assay, ELISA), электрохемилюминесцентный иммуноанализ (electrochemiluminescence immunoassay, ECLIA), SPR и биослойную интерферометрию (bio-layer interferometry, BLI) [7]. По сравнению с ELISA и ECLIA, метод BLI имеет более низкую чувствительность, но потенциально более устойчив к присутствию лекарственного препарата в анализируемых образцах [8] и позволяет обнаруживать низкоаффинные антитела, характерные для раннего иммунного ответа2 [7][9][10].
В данной работе впервые в клинических исследованиях ромиплостима предлагается использовать BLI для определения оАЛА. С помощью метода BLI так же, как и SPR, можно детектировать образование белковых комплексов в режиме реального времени. Для измерительных приборов на основе SPR характерна проблема загрязнения сывороткой крови каналов, служащих для доставки образца на поверхность биосенсорного чипа. В BLI используется подход «dip-and-read», при котором биосенсоры погружаются в лунки планшета, содержащие образцы, что исключает описанную выше проблему [7][9].
Цель работы — установить ключевые валидационные характеристики методики, основанной на биослойной интерферометрии, для определения общих антилекарственных антител к ромиплостиму в сыворотке крови человека.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Исследование было одобрено на заседании Межвузовского комитета по этике (Протокол № 2 от 20.02.2020) при АНО «Организационно-техническое обеспечение «МКЭ». Пробы периферической венозной крови забирали в пробирки Vacuette с активатором свертывания крови (кат. № 455059, Greiner Bio-One GmbH, Австрия) от здоровых добровольцев мужского пола в возрасте от 18 до 50 лет, не получавших лечение ромиплостимом. Для выделения сыворотки крови пробирки оставляли на 20–30 мин при комнатной температуре, после чего центрифугировали при 1800 g и 4 °С в течение 10 мин. Образцы сыворотки крови аликвотировали и хранили при температуре минус 80 °С до проведения анализа.
В качестве негативного контрольного образца (negative control, NC), заведомо не содержащего антилекарственных антител, использовали пулированную сыворотку крови человека «Normal human serum» (кат. № S1-100 ML, Merck Millipore, США).
Для приготовления положительных контрольных образцов (positive control, PC) в NC добавляли поликлональные кроличьи антитела, специфичные к ромиплостиму (получены в АО «ГЕНЕРИУМ»), до финальной концентрации 50 мкг/мл (очень высокий положительный контроль, VHPC), 10 мкг/мл (высокий положительный контроль, HPC), 2 мкг/мл (средний положительный контроль, MPC) и 0,8 мкг/мл (низкий положительный контроль, LPC).
Для приготовления контрольных образцов, содержащих неспецифические антитела, в NC добавляли моноклональные человеческие антитела к омализумабу (кат. № HCA235, Bio-Rad, США) до финальной концентрации 10 мкг/мл или человеческие антитела класса G (кат. № ab98981, Abcam, Великобритания) — до 20 мкг/мл.
Для конъюгирования ромиплостима с биотином использовали биоаналогичный препарат Стимплейт (серия MW00120, АО «ГЕНЕРИУМ», Россия) или оригинальный препарат Энплейт (серия 1100215A, Amgen Europe B.V., Нидерланды) и набор для биотинилирования «Biotin (Type A) Fast Conjugation Kit» (кат. № ab201795, Abcam, Великобритания).
Для оценки специфичности подтверждающего теста использовали лекарственный препарат Луцентис® (серия SH275, Novartis Pharma Stein AG, Швейцария), содержащий ранибизумаб в качестве действующего вещества.
Для приготовления буферных растворов использовали следующие реактивы: фосфатно-солевой буфер, pH 7,4, таблетки (кат. № B-60201, НПЦ «Эко-Сервис», Россия); Твин 20 (кат. № P7949, Sigma-Aldrich, США); натрия азид (кат. № A1430.0100, Panreac Applichem, Испания); глицин (кат. № 1.00590.1000, Merck, Германия). В работе использовали буферный раствор PBS-T (10 мМ фосфатно-солевой буферный раствор; 0,05% Твин 20, pH 7,2–7,6); 5% раствор NC для блокирования биосенсоров (PBS-T; 0,05% натрия азид; 5% NC); буферный раствор для разведения образцов и хранения биосенсоров (PBS-T; 0,05% натрия азид); буферный раствор для регенерации биосенсоров (20 мМ глицин-HCl, pH 2,0).
При валидации методики использовали 96-луночные несорбирующие планшеты черного цвета (кат. № 655209, Greiner Bio-One GmbH, Австрия); стрептавидиновые биосенсоры для интерферометра Octet «High Precision Streptavidin (SAX)» (кат. № 18-5117, Fortebio, США).
Метод биослойной интерферометрии
Подготовка биосенсоров. Биотинилированный ромиплостим в концентрации 10 мкг/мл сорбировали на стрептавидиновых биосенсорах при комнатной температуре в течение 2 ч. Свободные сайты связывания биосенсоров блокировали 5% NC и далее проводили 3 цикла регенерации биосенсоров раствором 20 мМ глицин-HCl.
Пробоподготовка образцов. Искажающее воздействие компонентов сыворотки крови, отличающихся от оАЛА (например, ревматоидный фактор и растворимые мишени лекарственных препаратов), которое способно приводить к получению ложных результатов, называется «эффект матрицы». Для снижения этого эффекта исследуемые и контрольные образцы в 20-кратных разведениях (минимальное необходимое разведение, МНР), приготовленных в PBS-T с добавлением 0,05% натрия азида, инкубировали при 65 °С в течение 20 мин, что, как было установлено в предварительных экспериментах, не влияло на чувствительность метода.
Для определения титра оАЛА из образцов в МНР готовили серии последовательных разведений в 5% NC.
Выполнение скрининг-теста. В лунки 96-луночного несорбирующего планшета черного цвета вносили 240 мкл образцов в МНР после пробоподготовки не менее чем в двух повторах.
Выполнение подтверждающего теста. В лунки планшета вносили 240 мкл образцов в МНР после пробоподготовки не менее чем в четырех повторах. В половину лунок, содержащих каждый анализируемый образец, добавляли ромиплостим до концентрации 20 мкг/мл.
Оценка титра оАЛА. Образцы в объеме 240 мкл (серии последовательных разведений) добавляли в лунки планшета не менее чем в двух повторах.
Детектирование белкового комплексообразования. Образование комплексов ромиплостима и антител к нему регистрировали в режиме реального времени с использованием интерферометра Octet® QKe (Pall Corporation, ForteBio, США). Рабочую температуру поддерживали на уровне 30 °С при скорости перемешивания планшета 1000 rpm. Аналитический сигнал каждого образца представлял собой сдвиг длины волны, измеренный в нм, в конце этапа ассоциации оАЛА с биотинилированным ромиплостимом в течение 17 мин. После каждого этапа ассоциации проводили два цикла регенерации биосенсоров 20 мМ глицин-HCl в течение 5 с каждый и последующее уравновешивание в 5% NC в течение 50 с.
Статистическая обработка результатов
Основные валидационные характеристики методики определяли в соответствии с рекомендациями G. Shankar с соавт. [5] и D. Jani с соавт. [11].
Оценка нормальности распределения данных в выборках при определении фактора биологической вариабельности (CPfскр) и предельного значения незначимого ингибирования (CPпт) осуществлялась с использованием статистического теста Д’Агостино — Пирсона в программе GraphPad Prism 8. Остальные расчеты проводились в программе Microsoft Excel 2016.
Обнаружение выбросов в исследуемых данных проводилось с помощью межквартильного интервала. Коэффициент вариации (%CV) рассчитывался как отношение стандартного отклонения (SD) к среднему значению рассматриваемой величины и выражался в процентах.
Расчет валидационных параметров
Фактор биологической вариабельности для расчета предельного значения скрининг-теста (CPfскр) и определения титра оАЛА вычисляли по формуле (1):
 (1)
(1)
где 95th percentile (logA) — 95%-й перцентиль десятичного логарифма аналитического сигнала индивидуальных образцов исследуемой выборки; Amean — среднее значение аналитического сигнала индивидуальных образцов исследуемой выборки.
Предельное значение скрининг-теста (CPскр) рассчитывали по формуле (2):
CPскр = ANC × CPfскр, (2)
где ANC — среднее значение аналитического сигнала негативного контрольного образца; CPfскр — фактор биологической вариабельности для скрининг-теста и определения титра.
Образцы, значения аналитических сигналов которых превышали предельное значение скрининг-теста, считали условно положительными.
При проведении подтверждающего теста рассчитывали показатель «процент ингибирования» (%I) сигнала каждого образца в МНР с добавлением ромиплостима относительно образца в МНР без добавления ромиплостима по формуле (3):
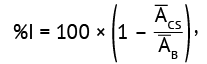 (3)
(3)
где ACS — среднее значение аналитического сигнала образца с добавлением ромиплостима; AB — среднее значение аналитического сигнала образца без добавления ромиплостима.
Предельное значение незначимого ингибирования (CPпт) рассчитывали по формуле (4):
CPПТ = %I + 3,09 × SD%I, (4)
где %I — среднее значение показателя «процент ингибирования» индивидуальных образцов исследуемой выборки; «3,09» — 0,999 квантиль стандартного нормального распределения; SD%I — стандартное отклонение показателя «процент ингибирования» образцов исследуемой выборки.
Для снижения вероятности получения ложноположительных результатов взамен рекомендуемого 0,99 квантиля [11] в расчетах использовали 0,999 квантиль стандартного нормального распределения.
Образцы, значение показателя %I которых превышало CPпт, считали положительными по наличию оАЛА.
Разведение, при котором аналитический сигнал образца соответствует значению CPскр, принимали в качестве титра оАЛА в положительных контрольных образцах.
Оценка прецизионности методики для определения антител к ромиплостиму включала в себя доказательство воспроизводимости и повторяемости результатов.
Прецизионность результатов скрининг-теста оценивали по нормированным коэффициентам (K). Для оценки воспроизводимости нормированные коэффициенты (Kвоспр) рассчитывали по формуле (5):
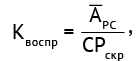 (5)
(5)
где APC — среднее значение аналитического сигнала положительного контрольного образца (PC) в опыте; CPскр — предельное значение скрининг-теста.
Аналогичным образом рассчитывали нормированные коэффициенты для оценки повторяемости, но используя значение аналитического сигнала PC отдельного повтора вместо среднего значения сигнала.
Для оценки воспроизводимости и повторяемости подтверждающего теста рассчитывали значения показателя %I по формуле (3), используя средние значения аналитических сигналов и значения аналитических сигналов в отдельных повторах соответственно.
Воспроизводимость результатов определения титра оАЛА оценивали, рассчитывая медиану полученных значений титра оАЛА каждого PC. Максимальное и минимальное допустимые значения титра определяли путем умножения и деления медианного значения на 2,5 (максимальный коэффициент кратности серии разведений для расчета титра).
Нижний предел детекции (НПД) опыта вычисляли по формуле (6):
 (6)
(6)
где С — концентрация оАЛА в PC, нг/мл; Титр — рассчитанный в опыте титр оАЛА в PC; «20» — минимальное необходимое разведение.
НПД методики рассчитывали как сумму среднего значения НПД по всем опытам и значения трех стандартных отклонений.
Устойчивость методики к присутствию в образцах лекарственного препарата характеризовали по коэффициенту выявления (%R), который рассчитывали по формуле (7):
 (7)
(7)
где Aс внесением — среднее значение аналитического сигнала контрольного образца с внесением препарата; Aбез внесения — среднее значение аналитического сигнала контрольного образца без внесения препарата.
Стабильность биосенсоров с иммобилизованным ромиплостимом для каждого исследуемого PC оценивали по значениям %R, которые рассчитывали по отношению значений аналитических сигналов, полученных при использовании биосенсоров после хранения и до закладки на хранение.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Перечень оцененных валидационных характеристик и критерии приемлемости представлены с учетом текущих требований нормативной документации3.
Определение фактора биологической вариабельности для расчета предельного значения скрининг-теста и определения титра оАЛА
Для определения фактора биологической вариабельности (CPfскр) были проанализированы 48 образцов сыворотки крови человека. Образцы анализировали два исследователя, каждый из которых провел три независимых опыта в разные дни. Один опыт включал в себя скрининг-тест всех исследуемых образцов.
Результаты статистического теста Д’Агостино–Пирсона показали, что распределение значений аналитического сигнала образцов исследуемой выборки не соответствует нормальному. Значения аналитических сигналов были преобразованы в соответствующие значения десятичного логарифма, при этом два образца были исключены из расчета CPfскр как выбросы. Среднее значение CPfскр составило 1,481.
Определение предельного значения незначимого ингибирования для подтверждающего теста
Вычисленное значение незначимого ингибирования аналитического сигнала, выраженное в процентах, разделяющее исследуемые образцы на подтвержденные или неподтвержденные по наличию оАЛА, называют предельным значением незначимого ингибирования для подтверждающего теста (CPпт) [12].
Оценка CPпт проводилась на той же выборке и при тех же условиях, что и оценка CPfскр. Значения показателя %I аналитического сигнала образцов исследуемой выборки характеризовались нормальным распределением; выбросы не были выявлены. Значение CPпт подтверждающего теста составило 34,2%.
Оценка прецизионности результатов методики
Для оценки воспроизводимости методики были проанализированы образцы PC и NC двумя исследователями в разные дни (табл. S1, опубликована на сайте журнала4). Для оценки повторяемости каждый контрольный образец был проанализирован в 6 повторах одним исследователем в одном опыте (табл. S2, опубликована на сайте журнала5).
При оценке результатов руководствовались следующими критериями приемлемости:
- коэффициент вариации между значениями нормированного коэффициента (K) при проведении скрининг-теста или между значениями показателя %I при проведении подтверждающего теста должен составлять ≤20% при оценке повторяемости и ≤25% при оценке воспроизводимости;
- значения титра оАЛА не должны отклоняться от рассчитанного медианного значения более чем в 2,5 раза.
На рисунке 1 приведен пример сенсограммы, полученной при определении титра оАЛА в образце VHPC.
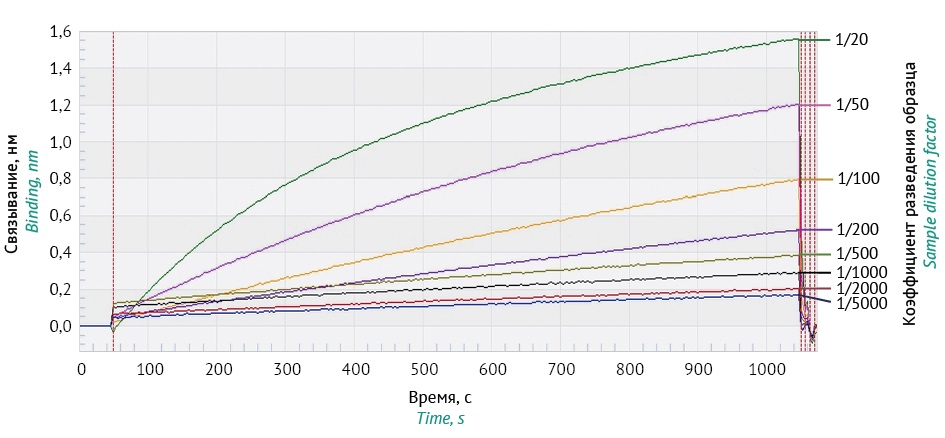
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Типовая сенсограмма взаимодействия поликлональных кроличьих антител к ромиплостиму в разных разведениях исходного образца (50 мкг/мл) с иммобилизованным на стрептавидиновых биосенсорах ромиплостимом.
Fig. 1. A typical sensogram of the interaction of polyclonal rabbit antibodies to romiplostim in different dilutions of the initial sample (50 μg/mL), with romiplostim immobilised on the streptavidin-coated biosensors.
При оценке воспроизводимости и повторяемости коэффициент вариации значений показателя K не превышал 6,7 и 10,5%, а показателя %I — 3,0 и 7,8% соответственно. Полученные значения титра оАЛА при оценке воспроизводимости отличались от медианного значения не более чем в 2,1 раза (табл. S1, табл. S2).
Результаты оценки прецизионности удовлетворяли установленным критериям приемлемости.
Оценка нижнего предела детекции скрининг-теста
Значение НПД оАЛА к ромиплостиму определяли по данным 6 независимых опытов, выполненных двумя исследователями в разные дни. Образцы HPC анализировали в серии разведений от 1/20 до 1/2000. Несмотря на то, что поликлональные кроличьи антитела не могут полностью отражать свойства человеческих антител, образующихся в ответ на введение ромиплостима, их использование на этапе разработки позволило оптимизировать условия анализа, повысив его чувствительность [13][14]. Значение НПД методики по обнаружению поликлональных кроличьих антител к ромиплостиму составило 622 нг/мл.
Оценка эффекта высокой дозы при проведении скрининг-теста и подтверждающего теста
Эффект высокой дозы — распространенное явление, при котором из-за ограниченного количества иммобилизованного препарата и чрезвычайно высоких концентраций антител в образце происходит снижение образования комплексов антиген/антитело. Эффект высокой дозы способен приводить к получению ложноотрицательных результатов [15].
Для определения эффекта высокой дозы в скрининг-тесте и подтверждающем тесте использовали образцы VHPC и HPC. Предельное значение скрининг-теста в проведенном опыте составило 0,1552. Более высокой концентрации антител соответствовал более высокий уровень аналитического сигнала в скрининг-тесте и большее значение показателя %I (табл. S3, опубликована на сайте журнала6). Эффект высокой дозы при анализе образцов VHPC и HPC отсутствовал.
Вероятность возникновения эффекта высокой дозы крайне мала при анализе образцов, содержащих нативные человеческие антитела к ромиплостиму, которые характеризуются более низкой аффинностью по сравнению с антителами, используемыми в положительных контрольных образцах [13]. Для снижения вероятности получения ложноотрицательных результатов использовали дополнительные разведения образцов, аналитический сигнал которых соответствовал VHPC, при этом сохранялось 5%-ное содержание сыворотки в разведениях образцов.
Эффект матрицы при проведении скрининг-теста и подтверждающего теста
Для оценки эффекта матрицы в индивидуальные образцы сыворотки крови здоровых добровольцев, не получавших ранее лечение ромиплостимом, добавляли поликлональные кроличьи антитела к ромиплостиму до финальной концентрации 800 нг/мл. В качестве образцов сравнения служили образцы сыворотки крови без добавления антител.
По данным скрининг-теста, аналитические сигналы 9 из 10 образцов без добавления антител были ниже предельного значения скрининг-теста (0,158); один образец IS31 показал ложноположительный результат (табл. 1). Аналитические сигналы всех образцов, содержащих антитела к ромиплостиму, включая IS31, были охарактеризованы как условно положительные. При этом аналитические сигналы 8 из 10 образцов, содержавших оАЛА, превышали таковые образцов сравнения более чем в 1,481 раза (табл. 1).
Таблица 1. Оценка эффекта матрицы при проведении скрининг-теста
Table 1. Assessment of the matrix effect during the screening test
|
Номер образца Sample ID |
Без добавления оАЛА Without the addition of binding ADA |
С добавлением оАЛА With the addition of binding ADA |
|||||
|
AИО, нм AИО , nm |
%CV |
AИО ≤ CPскр |
ALPC, нм ALPC , nm |
%CV |
|
|
|
|
IS06 |
0,1463 |
0,4 |
Да / Yes |
0,2067 |
0,4 |
1,413 |
Нет / No |
|
IS11 |
0,0933 |
3,5 |
Да / Yes |
0,1493 |
0,9 |
1,600 |
Да / Yes |
|
IS17 |
0,0777 |
2,0 |
Да / Yes |
0,1326 |
7,6 |
1,706 |
Да / Yes |
|
IS28 |
0,0605 |
0,2 |
Да / Yes |
0,1251 |
0,6 |
2,067 |
Да / Yes |
|
IS29 |
0,0877 |
4,3 |
Да / Yes |
0,1443 |
0,3 |
1,646 |
Да / Yes |
|
IS31 |
0,1826 |
0,6 |
Нет / No |
0,2232 |
0,3 |
1,222 |
Нет / No |
|
IS37 |
0,0681 |
6,3 |
Да / Yes |
0,1398 |
2,4 |
2,054 |
Да / Yes |
|
IS44 |
0,0529 |
0,4 |
Да / Yes |
0,1167 |
1,0 |
2,208 |
Да / Yes |
|
IS47 |
0,0954 |
13,7 |
Да / Yes |
0,1719 |
1,3 |
1,803 |
Да / Yes |
|
IS48 |
0,1254 |
4,1 |
Да / Yes |
0,1871 |
1,2 |
1,492 |
Да / Yes |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. оАЛА — общее антилекарственное антитело; %CV — коэффициент вариации; CPскр — предельное значение скрининг-теста (0,158); CPfскр — фактор биологической вариабельности; AИО — усредненное значение сигнала исследуемого образца без добавления оАЛА; ALPC — усредненное значение сигнала исследуемого образца с добавлением оАЛА до 800 нг/мл.
Note. ADA, anti-drug antibodies; %CV, coefficient of variation; CPскр, cutoff value of the screening test (0.158); CPfскр, biological variability factor; AИО, mean value of the signal of the test sample without addition of ADA; ALPC, mean value of the signal of the test sample with addition of ADA up to 800 ng/mL.
Результаты оценки эффекта матрицы при проведении подтверждающего теста приведены в таблице 2. Для 8 из 10 проанализированных образцов значения показателя %I превышали значения CPпт.
Таблица 2. Оценка эффекта матрицы при проведении подтверждающего теста образцов сыворотки крови с добавлением оАЛА
Table 2. Assessment of the matrix effect in confirmatory test while analysing blood serum samples with the addition of binding ADA
|
Номер образца Sample ID |
AB, нм AB , nm |
%CV |
ACS, нм ACS , nm |
%CV |
%I |
%I > CPПТ |
|
IS04 |
0,1978 |
5,2 |
0,0969 |
9,7 |
51,0 |
Да / Yes |
|
IS05 |
0,2545 |
7,3 |
0,1317 |
10,8 |
48,3 |
Да / Yes |
|
IS06 |
0,2067 |
0,4 |
0,1425 |
4,1 |
31,1 |
Нет / No |
|
IS11 |
0,1493 |
0,9 |
0,0800 |
0,4 |
46,4 |
Да / Yes |
|
IS17 |
0,1326 |
7,6 |
0,0708 |
0,1 |
46,6 |
Да / Yes |
|
IS28 |
0,1251 |
0,6 |
0,0596 |
4,6 |
52,4 |
Да / Yes |
|
IS29 |
0,1443 |
0,3 |
0,0774 |
1,6 |
46,4 |
Да / Yes |
|
IS31 |
0,2232 |
0,3 |
0,1581 |
8,3 |
29,2 |
Нет / No |
|
IS37 |
0,1398 |
2,4 |
0,0801 |
5,1 |
42,7 |
Да / Yes |
|
IS44 |
0,1167 |
1,0 |
0,0643 |
13,1 |
44,9 |
Да / Yes |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. оАЛА — общее антилекарственное антитело; AB — среднее значение аналитического сигнала индивидуального образца сыворотки крови без добавления ромиплостима; ACS — среднее значение аналитического сигнала индивидуального образца сыворотки крови с добавлением ромиплостима; %CV — коэффициент вариации; %I — показатель «процент ингибирования» сигнала образца с добавлением ромиплостима; CPпт — предельное значение незначимого ингибирования.
Note. ADA, anti-drug antibodies; AB, mean value of the analytical signal of an individual blood serum sample without addition of romiplostim; ACS, mean value of the analytical signal of an individual blood serum sample with addition of romiplostim; %CV, coefficient of variation; %I, percentage of signal inhibition of a sample with addition of romiplostim; CPпт, cutoff value of not significant inhibition.
Аналитический сигнал образцов IS06 и IS31 после добавления в них антител к ромиплостиму вырос менее чем в 1,481 раза. С одной стороны, в скрининг-тесте было установлено, что аналитические сигналы данных образцов без добавления антител были несколько повышены относительно среднего значения сигнала по выборке (табл. 1). С другой стороны, значения показателя %I образцов IS06 и IS31 были ниже значения CPпт (табл. 2). Эти наблюдения могут быть обусловлены неспецифическим связыванием с биосенсором компонентов сыворотки крови, препятствующих связыванию антител. Предположительно, при более высоких (>800 нг/мл) концентрациях антител к ромиплостиму в образцах вероятность получения ложноположительных результатов в подтверждающем тесте будет минимальна.
Оценка специфичности методики при проведении скрининг-теста и подтверждающего теста
При проведении скрининг-теста усредненные значения аналитических сигналов контрольных образцов, содержащих 10 мкг/мл антител к омализумабу или 20 мкг/мл человеческих антител класса G, составили 0,1070 и 0,1029 соответственно и были ниже предельного значения скрининг-теста (0,166). Ложноположительных результатов не наблюдалось.
При проведении подтверждающего теста добавление в образцы ромиплостима в качестве антигена должно приводить к ингибированию сигнала связывания специфических антител, не оказывая влияния на антитела иной специфичности7. В таблице S4 (опубликована на сайте журнала8) показаны результаты анализа контрольных образцов, содержащих разные концентрации антител к ромиплостиму, а также ромиплостим или ранибизумаб. В качестве сравнения анализировали образцы, не содержавшие антигенов.
В отличие от ромиплостима, добавление ранибизумаба в качестве неспецифического антигена значимо не ингибировало связывание антител с ромиплостимом. Таким образом, неспецифическое ингибирование аналитического сигнала при проведении подтверждающего теста отсутствовало.
Оценка устойчивости методики к присутствию в образцах лекарственного препарата и его мишени
Мишенью ромиплостима является рецептор тромбопоэтина — трансмембранного белка, расположенного на поверхности тромбоцитов и мегакариоцитов [16]. За исключением случаев контаминации образцов клетками крови при ненадлежащей пробоподготовке, присутствие рецептора тромбопоэтина в образцах сыворотки крови не предполагается. Следовательно, вероятность возникновения ложноположительных результатов крайне низкая и оценивать влияние белка-мишени на результаты анализа не требуется.
Лекарственный препарат в свободной форме или в форме иммунных комплексов с оАЛА может присутствовать в исследуемых образцах. Поэтому важно оценить устойчивость методики определения оАЛА к ромиплостиму к присутствию последнего, для чего анализировали контрольные образцы, содержавшие 0,8, 2, 10 мкг/мл специфических антител и 1 нг/мл ромиплостима (табл. S5, опубликована на сайте журнала9).
По данным J. Qi с соавт. [17], при еженедельном введении ромиплостима в течение 2 нед. максимальная концентрация препарата в сыворотке крови пациентов с ИТП составила 52 и 105 пг/мл при применении препарата в дозе 1 мкг/кг и 3 мкг/кг ромиплостима соответственно [17]. Следовательно, концентрация 1 нг/мл в целом превышает предполагаемый диапазон концентраций ромиплостима в образцах сыворотки крови пациентов, получающих лечение ромиплостимом, и соответствует требованиям к устойчивости методики определения оАЛА в присутствии лекарственного препарата в образцах10.
Исследования показали, что при анализе образцов, содержащих 1 нг/мл ромиплостима, снижение регистрируемого сигнала отсутствовало.
Оценка устойчивости результатов скрининг-теста и подтверждающего теста к замене компонентов аналитической системы
Для оценки устойчивости результатов скрининг-теста и подтверждающего теста к замене компонентов аналитической системы образцы PC анализировали с использованием биосенсоров, сорбированных биотинилированным ромиплостимом, приготовленным из оригинального или биоаналогичного препарата. В подтверждающем тесте в исследуемые образцы добавляли оригинальный препарат ромиплостима в качестве специфичного антигена. Результаты данного анализа сравнивали с результатами анализа образцов, содержащих биоаналогичный препарат.
Экспериментально подтверждена сопоставимость уровней аналитического сигнала независимо от вида используемого препарата, что свидетельствует о возможности применения методики для оценки клинических образцов, содержащих оАЛА, выработанные в ответ на введение как оригинального, так и биоаналогичного препаратов (табл. S6, опубликована на сайте журнала11).
Оценка стабильности иммобилизованного на биосенсорах ромиплостима после хранения и регенераций
Стабильность биосенсоров с иммобилизованным биотинилированным ромиплостимом после длительного хранения и регенерации оценивали путем определения оАЛА в образцах с использованием биосенсоров, которые хранили в течение 2 нед. при температуре 5±3 °C и подвергали не менее 20 циклам регенерации.Результаты оценки стабильности приведены в таблице 3.
Таблица 3. Оценка стабильности иммобилизованного на биосенсорах ромиплостима после хранения и регенераций
Table 3. Stability assessment of romiplostim immobilised on the biosensors after storage and regenerations
|
Образец Sample |
A1, нм A1, nm |
A2, нм A2, nm |
A, нм A, nm |
SD |
%CV |
%R |
|
Биосенсоры до хранения / Biosensors before storage |
||||||
|
HPC |
0,8098 |
0,7033 |
0,757 |
0,0753 |
10,0 |
– |
|
MPC |
0,2662 |
0,2623 |
0,264 |
0,0028 |
1,0 |
– |
|
LPC |
0,1655 |
0,1861 |
0,176 |
0,0146 |
8,3 |
– |
|
Биосенсоры после храненияa / Biosensors after storagea |
||||||
|
HPC |
0,6379 |
0,6610 |
0,6495 |
0,0163 |
2,5 |
86 |
|
MPC |
0,2683 |
0,2674 |
0,2679 |
0,0006 |
0,2 |
101 |
|
LPC |
0,1742 |
0,1777 |
0,1760 |
0,0025 |
1,4 |
100 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. A1 и A2 — значения аналитического сигнала в двух повторах; A — среднее значение сигнала образца; SD — стандартное отклонение; %CV — коэффициент вариации; %R — коэффициент выявления; HPC, MPC, LPC — высокий, средний и низкий положительный контрольный образец соответственно; «–» — не применимо.
a Биосенсоры после хранения в течение 2 нед. при 5±3 °C и не менее 20 циклов регенераций.
Note. A1 and A2, analytical signal values of two replicates; A, mean value of the analytical signal; SD, standard deviation; %CV, coefficient of variation; %R, detection coefficient; HPC, MPC, and LPC, high, medium and low positive control sample, respectively; –, not applicable.
a Biosensors after storage for 2 weeks at 5±3 °C and at least 20 regeneration cycles.
В качестве критерия приемлемости использовался диапазон значений коэффициента выявления %R — от 80 до 120%. Согласно полученным данным, иммобилизованный на биосенсорах биотинилированный ромиплостим был стабилен после хранения в течение 2 нед. при температуре 5±3 °C и не менее 20 циклов регенерации.
ВЫВОДЫ
- Результаты проведенной валидации подтверждают пригодность разработанной методики для получения достоверных и воспроизводимых результатов при определении оАЛА к ромиплостиму в образцах сыворотки крови человека.
- Доказана применимость методики для оценки связывающих антител к ромиплостиму в образцах сыворотки крови человека, образующихся в ответ на введение как оригинального, так и биоаналогичного препаратов.
- Метод биослойной интерферометрии может применяться для определения оАЛА, в том случае, если компоненты сыворотки крови оказывают значительное влияние на результаты анализа.
- Преимущество разработанной методики заключается в возможности определения оАЛА в образцах, содержащих 1 нг/мл ромиплостима.
- Анализ 96-луночного планшета занимает 4 ч, включая этап пробоподготовки образцов.
- Регенерация биосенсоров позволяет выполнить не менее 20 независимых измерений связывания оАЛА с ромиплостимом без потери качества данных.
Дополнительная информация. На сайте журнала «БИОпрепараты. Профилактика, диагностика, лечение» опубликованы таблицы S1–S6.
https://doi.org/10.30895/2221-996X-2025-639-table-s1
https://doi.org/10.30895/2221-996X-2025-639-table-s2
https://doi.org/10.30895/2221-996X-2025-639-table-s3
https://doi.org/10.30895/2221-996X-2025-639-table-s4
https://doi.org/10.30895/2221-996X-2025-639-table-s5
https://doi.org/10.30895/2221-996X-2025-639-table-s6
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.А. Агафонова — написание текста рукописи, формулирование выводов, работа с источниками литературы; М.В. Жиляева — планирование исследования, выполнение экспериментальных работ, интерпретация результатов исследования; И.В. Лягоскин — постановка цели, руководство исследованием, работа с текстом и критический пересмотр его содержания; А.А. Казаров — статистическая обработка данных на всех этапах валидации методики; А.Е. Лисова — доработка текста рукописи; Р.Р. Шукуров — критическая оценка содержания текста, утверждение окончательной версии рукописи для публикации.
Соответствие принципам этики. Исследование было одобрено на заседании Межвузовского комитета по этике (Протокол № 2 от 20.02.2020) при АНО «Организационно-техническое обеспечение «МКЭ».
Благодарности. Авторы выражают благодарность В.М. Симонову за ценные консультации по проводимой работе, а также всему коллективу АО «ГЕНЕРИУМ» за предоставление оборудования, материалов и содействие при проведении исследования.
Additional information. Tables S1–S6 are published on the website of Biological Products. Prevention, Diagnosis, Treatment.
https://doi.org/10.30895/2221-996X-2025-639-table-s1
https://doi.org/10.30895/2221-996X-2025-639-table-s2
https://doi.org/10.30895/2221-996X-2025-639-table-s3
https://doi.org/10.30895/2221-996X-2025-639-table-s4
https://doi.org/10.30895/2221-996X-2025-639-table-s5
https://doi.org/10.30895/2221-996X-2025-639-table-s6
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.A. Agafonova wrote the manuscript, formulated conclusions, and worked with literature sources. M.V. Zhilyaeva developed the study plan, performed experimental work, and interpreted the results of the study. I.V. Lyagoskin formulated the goal, supervised the study, worked with the text and critically revised its content. A.A. Kazarov performed statistical processing of data at all stages of method validation. A.E. Lisova finalised the manuscript. R.R. Shukurov critically evaluated the content of the text, and approved the final version of the manuscript for publication.
Ethics approval. The study was approved at a meeting of the Interuniversity Ethics Committee (Protocol No. 2 of 20 February 2020) at the ANO Organisational and Technical Support of the IEC.
Acknowledgements. The authors express their gratitude to V.M. Simonov for valuable consultations on the work carried out, as well as to the entire staff of GENERIUM JSC for providing equipment and materials as well as assistance in conducting the research.
1. Immunogenicity testing of therapeutic protein products — developing and validating assays for anti-drug antibody detection. Guidance for industry. Center for Biologics Evaluation and Research, FDA; 2019.
EMEA/CHMP/BMWP/14327/2006 Rev 1. Guideline on immunogenicity assessment of therapeutic proteins. EMA; 2017.
2. Immunogenicity assessment of therapeutic protein on the Octet® BLI System. Technical note. Sartorius. https://www.sartorius.com/resource/blob/1523320/b9e4c06d9543d580afc4b401cfec69ed/immunogenicity-assessment-bli-octet-technical-note-en-sartorius-pdf-260224--data.pdf
3. Immunogenicity testing of therapeutic protein products — developing and validating assays for anti-drug antibody detection. Guidance for industry. Center for Biologics Evaluation and Research, FDA; 2019.
ОФС.1.1.0012 Валидация аналитических методик. Государственная фармакопея Российской Федерации. XV изд.; 2023.
4. https://doi.org/10.30895/2221-996X-2025-639-table-s1
5. https://doi.org/10.30895/2221-996X-2025-639-table-s2
6. https://doi.org/10.30895/2221-996X-2025-639-table-s3
7. Immunogenicity testing of therapeutic protein products — developing and validating assays for anti-drug antibody detection. Guidance for industry. Center for Biologics Evaluation and Research. FDA; 2019.
8. https://doi.org/10.30895/2221-996X-2025-639-table-s4
9. https://doi.org/10.30895/2221-996X-2025-639-table-s5
10. Immunogenicity testing of therapeutic protein products — developing and validating assays for anti-drug antibody detection. Guidance for industry. Center for Biologics Evaluation and Research, FDA; 2019.
11. https://doi.org/10.30895/2221-996X-2025-639-table-s6
Список литературы
1. Меликян АЛ, Егорова ЕК, Пустовая ЕИ, Колошейнова ТИ, Володичева ЕМ, Капорская ТС и др. Промежуточные результаты эпидемиологического исследования идиопатической тромбоцитопенической пурпуры у взрослых в Российской Федерации. Гематология и трансфузиология. 2019;64(4):436–46. https://doi.org/10.35754/0234-5730-2019-64-4-436-446
2. Neunert C, Terrell DR, Arnold DM, Buchanan G, Cines DB, Cooper N, et al. American Society of Hematology 2019 guidelines for immune thrombocytopenia. Blood Adv. 2019;3(23):3829–66. https://doi.org/10.1182/bloodadvances.2019000966
3. Barger TE, Boshier A, Jawa V, Kim J, Mytych DT, Park J, et al. Assessment of romiplostim immunogenicity in adult patients in clinical trials and in a global registry. Blood. 2018;132 (Supplement 1):2427. https://doi.org/10.1182/blood-2018-99-113484
4. Swanson SJ. What are clinically significant anti-drug antibodies and why is it important to identify them. Front Immunol. 2024;15:1401178. https://doi.org/10.3389/fimmu.2024.1401178
5. Shankar G, Devanarayan V, Amaravadi L, Barrett YC, Bowsher R, Finco-Kent D, et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. J Pharm Biomed Anal. 2008;48(5):1267–81. https://doi.org/10.1016/j.jpba.2008.09.020
6. Hagman C, Chasseigne G, Nelson R, Anlauff F, Kagan M, Goldfine AB, et al. Immunogenicity assessment strategy for a chemically modified therapeutic protein in clinical development. Front Immunol. 2024;15:1438251. https://doi.org/10.3389/fimmu.2024.1438251
7. Shibata H, Nishimura K, Miyama C, Tada M, Suzuki T, Saito Y, et al. Comparison of different immunoassay methods to detect human anti-drug antibody using the WHO erythropoietin antibody reference panel for analytes. J Immunol Methods. 2018;452:73–7. https://doi.org/10.1016/j.jim.2017.09.009
8. Li J, Schantz A, Schwegler M, Shankar G. Detection of low-affinity anti-drug antibodies and improved drug tolerance in immunogenicity testing by Octet® biolayer interferometry. J Pharm Biomed Anal. 2011;54(2):286–94. https://doi.org/10.1016/j.jpba.2010.08.022
9. Jug A, Bratkovič T, Ilaš J. Biolayer interferometry and its applications in drug discovery and development. Trends Anal Chem. 2024;176:117741. https://doi.org/10.1016/j.trac.2024.117741
10. Wadhwa M, Knezevic I, Kang H-N, Thorpe R. Immunogenicity assessment of biotherapeutic products: An overview of assays and their utility. Biologicals. 2015;43(5):298–306. https://doi.org/10.1016/j.biologicals.2015.06.004
11. Jani D, Marsden R, Mikulskis A, Gleason C, Klem T, Fiorotti CK, et al. Recommendations for the development and validation of confirmatory anti-drug antibody assays. Bioanalysis. 2015;7(13):1619–31. https://doi.org/10.4155/bio.15.96
12. Smith HW, Moxness M, Marsden R. Summary of confirmation cut point discussions. AAPS J. 2011;13(2):227–9. https://doi.org/10.1208/s12248-011-9263-z
13. Gunn GR, Sealey DC, Jamali F, Meibohm B, Ghosh S, Shankar G. From the bench to clinical practice: understanding the challenges and uncertainties in immuno-genicity testing for biopharmaceuticals. Clin Exp Immunol. 2016;184(2):137–46. https://doi.org/10.1111/cei.12742
14. Tada M, Suzuki T, Ishii-Watabe A. Development and characterization of an anti-rituximab monoclonal antibody panel. MAbs. 2018;10(3):370–9. https://doi.org/10.1080/19420862.2018.1424610
15. Namburi RP, Kancherla V, Ponnala AR. High-dose hook effect. J Dr NTR Univ Health Sci. 2014;3(1):5–7. https://doi.org/10.4103/2277-8632.128412
16. Varghese LN, Defour J-P, Pecquet C, Constantinescu SN. The Thrombopoietin receptor: structural basis of traffic and activation by ligand, mutations, agonists, and mutated calreticulin. Front Endocrinol (Lausanne). 2017;8:59. https://doi.org/10.3389/fendo.2017.00059
17. Qi J, Zheng L, Hu B, Zhou H, He Q, Liu H, et al. Pharmacokinetics, safety, and pharmacodynamics of romiplostim in chinese subjects with immune thrombocytopenia: a phase I/II trial. Clin Pharmacol Drug Dev. 2022;11(3):379–87. https://doi.org/10.1002/cpdd.1059
Об авторах
А. А. АгафоноваРоссия
Агафонова Алена Алексеевна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
М. В. Жиляева
Россия
Жиляева Мария Владимировна
ул. Маршала Рыбалко, д. 2, корпус 6, вн. тер. г. муниципальный округ Щукино, Москва, 123060
И. В. Лягоскин
Россия
Лягоскин Иван Владимирович, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
А. А. Казаров
Россия
Казаров Александр Александрович
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
А. Е. Лисова
Россия
Лисова Алена Евгеньевна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Р. Р. Шукуров
Россия
Шукуров Рахим Рахманкулыевич, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Дополнительные файлы

|
1. Таблица S1. Результаты оценки воспроизводимости результатов определения связывающих антилекарственных антител | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(120KB)
|
Метаданные ▾ | |

|
2. Таблица S2. Результаты оценки воспроизводимости результатов определения связывающих антилекарственных антител | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(113KB)
|
Метаданные ▾ | |

|
3. Таблица S3. Результаты оценки эффекта высокой дозы при определении связывающих антилекарственных антител к ромиплостиму | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(108KB)
|
Метаданные ▾ | |

|
4. Таблица S4. Результаты оценки специфичности методики при проведении подтверждающего теста | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(123KB)
|
Метаданные ▾ | |

|
5. Таблица S5. Результаты оценки влияния ромипластима, присутствующего в образцах при проведении скрининг-теста | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(118KB)
|
Метаданные ▾ | |

|
6. Таблица S6. Результаты оценки устойчивости результатов скрининг-теста и подтверждающего теста к замене компонентов аналитической системы | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(126KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Агафонова А.А., Жиляева М.В., Лягоскин И.В., Казаров А.А., Лисова А.Е., Шукуров Р.Р. Валидация методики на основе биослойной интерферометрии для определения связывающих (общих) антител к ромиплостиму в сыворотке крови человека. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(3):271-283. https://doi.org/10.30895/2221-996X-2025-639
For citation:
Agafonova A.A., Zhilyaeva M.V., Lyagoskin I.V., Kazarov A.A., Lisova A.E., Shukurov R.R. Validation of a biolayer interferometry-based method for the determination of binding (total) antibodies to romiplostim in human serum. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(3):271-283. (In Russ.) https://doi.org/10.30895/2221-996X-2025-639


































