Перейти к:
Лиофилизация стандартизированных по количеству жизнеспособных клеток микроорганизмов в низкой концентрации: разработка режима высушивания
https://doi.org/10.30895/2221-996X-2025-25-2-193-202
Резюме
ВВЕДЕНИЕ. Современные подходы к микробиологическим испытаниям в фармацевтической промышленности требуют использования стандартизированных по количеству жизнеспособных клеток тест-штаммов микроорганизмов. Наиболее удобной формой для их хранения и транспортировки является лиофилизированное состояние, обеспечивающее длительное сохранение жизнеспособности микроорганизмов. В научной литературе хорошо описаны различные режимы высушивания микроорганизмов в высокой концентрации (10⁷–10¹² КОЕ/мл). Однако такие режимы нельзя напрямую применять при работе со стандартизированными по количеству жизнеспособными клетками в низкой концентрации (10³ КОЕ/мл). Определение оптимального режима лиофилизации позволит решить проблему сохранения жизнеспособности клеток микроорганизмов в низкой концентрации.
ЦЕЛЬ. Разработка режима высушивания с использованием аппарата камерного типа, обеспечивающего выживаемость тест-штаммов микроорганизмов, стандартизированных по количеству жизнеспособных клеток в концентрации 10³ КОЕ/мл.
МАТЕРИАЛЫ И МЕТОДЫ. В работе использовали тест-штаммы микроорганизмов Salmonella enterica subsp. enterica serovar Abony NCTC 6017, Staphylococcus aureus АТСС 6538 и 6538P, Alcaligenes faecalis 415, Pseudomonas aeruginosa ATCC 9027, Yersinia enterocolitica ATCC 9610, Escherichia coli ATCC 25922, Micrococcus luteus ATCC 10240. Тест-штаммы лиофилизировали в сахарозо-желатиновой защитной среде, используя лиофильный аппарат камерного типа Martin Christ Epsilon 2-4 LSCplus.
РЕЗУЛЬТАТЫ. В экспериментах были установлены оптимальные параметры лиофильного высушивания микроорганизмов в концентрации 10³ КОЕ/мл в аппарате камерного типа: замораживание до минус 25 °С; первичное высушивание при температуре полки минус 35 °С и вакууме 0,4 мбар в течение 8 ч; досушивание при температуре 30 °С в течение 4 ч и остаточном давлении 0,001 мбар. Выживаемость тест-штаммов в низкой концентрации составляла от 22 до 100% в зависимости от вида микроорганизма. Качество полученных образцов тест-штаммов соответствовало показателю «Потеря в массе при высушивании», значения которого варьировались от 0,8 до 2,1%.
ВЫВОДЫ. Разработанный режим высушивания позволяет сохранять количество жизнеспособных клеток микроорганизмов, стандартизированных в низкой концентрации, используя лиофильный аппарат камерного типа. Замораживание ниже температуры эвтектики может снижать выживаемость микробных клеток после высушивания, как это показано для A. faecalis 415. Оценка выживаемости группы из восьми микроорганизмов в низкой концентрации после лиофилизации проведена впервые в России.
Ключевые слова
Для цитирования:
Воропаев А.А., Крысанова Ю.И., Фадейкина О.В., Валюхова Р.М., Давыдов Д.С. Лиофилизация стандартизированных по количеству жизнеспособных клеток микроорганизмов в низкой концентрации: разработка режима высушивания. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):193-202. https://doi.org/10.30895/2221-996X-2025-25-2-193-202
For citation:
Voropaev A.A., Krysanova Yu.I., Fadeikina O.V., Valyukhova R.M., Davydov D.S. Lyophilization of microorganisms standardized by the number of viable cells in low concentration: Development of a drying mode. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):193-202. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-2-193-202
ВВЕДЕНИЕ
Одной из важных задач Государственной коллекции микроорганизмов является пополнение, поддержание и обеспечение заинтересованных учреждений, в том числе производителей лекарственных препаратов, типовыми и референсными тест-штаммами микроорганизмов [1]. Последние широко используются при проверке ростовых свойств питательных сред, оценке работы оборудования, валидации методик, при проведении микробиологических испытаний, а также при контроле качества работы лаборатории и подтверждении компетентности лабораторий на соответствие ГОСТ ISO/IEC 17025-2019 [2].
Лиофилизированные образцы тест-штаммов микроорганизмов являются лучшим выбором как для долгосрочного хранения, так и для транспортирования, что позволяет сохранить микроорганизмы в жизнеспособном состоянии. Для упрощения работы микробиологических лабораторий и увеличения точности проведения испытаний целесообразно использовать образцы лиофилизированных тест-штаммов микроорганизмов, готовых к использованию сразу после растворения и исключающих проведение дополнительных манипуляций по культивированию и приготовлению серийных разведений. Готовые к использованию образцы тест-штаммов должны содержать стандартизированное количество живых микробных клеток в концентрации 10³ КОЕ/мл.
Существует немало работ, посвященных выбору оптимальных условий высушивания и культивирования микроорганизмов перед высушиванием [3–6] или выбору оптимальных лиопротекторов [7–10], но все они касаются высушивания микроорганизмов в высоких концентрациях (10⁷–10¹² КОЕ/мл). Известно, что высокая концентрация клеток способствует лучшей выживаемости микроорганизмов при высушивании [11][12]. Таким образом, условия высушивания микроорганизмов в концентрации 10⁷–10¹² КОЕ/мл нельзя напрямую экстраполировать на подготовку лиофилизатов микроорганизмов в низкой концентрации.
Ранее нами были определены параметры лиофильного высушивания с применением аппарата коллекторного типа и по результатам проведенной работы разработаны несколько режимов высушивания коллекционных штаммов в ампулах [13]. При использовании аппарата данного типа можно контролировать только время высушивания. Современное лиофильное оборудование камерного типа позволяет контролировать практически все параметры процесса: температуру замораживания и нагревания образцов, время каждого этапа и глубину вакуума в камере. Таким образом, при оптимизации режима высушивания можно улучшить качество готового лиофилизированного продукта.
Обычно в режиме лиофильного высушивания выделяют три этапа: замораживание, первичное высушивание и досушивание [14].
Замораживание — первый и важнейший этап лиофилизации для всего цикла высушивания [15]. Замораживание сложных растворов, содержащих лиопротекторы (сахароза), проходит по механизму стеклования. При замораживании растворов, содержащих воду и растворенные в ней вещества, происходит их эвтектическое разделение. Оно заключается в том, что замерзает чистая вода (кристаллизация), а вещества концентрируются в незамерзающей части до тех пор, пока раствор не достигнет эвтектической концентрации. Температура, при которой достигается максимальная концентрация данного вещества и происходит замораживание всего раствора, называется эвтектической точкой.
При замерзании чистой воды снижается средняя кинетическая энергия молекул, то есть происходит выделение тепла. На графике кристаллизация обозначается моментом резкого нагревания образцов на несколько градусов. Данное значение температуры указывает на начало эвтектической зоны. При этом между кристаллами воды остается жидкая вода, в которой концентрируются растворенные вещества. Присутствие жидкой воды способствует электропроводности, выраженной в низком электрическом сопротивлении [16]. Таким образом, устанавливая температуру замораживания образцов и анализируя показатели электрического сопротивления, можно контролировать качество конечного лиофилизированного продукта.
Температура замораживания влияет на проницаемость клеточной мембраны, снижая жизнеспособность микроорганизмов [3][17]. Если температура замораживания будет недостаточно низкой и образцы не полностью замерзнут, то при сублимации такой образец вспенится, что приведет к потере качества конечного продукта. Напротив, слишком низкая температура замораживания существенно увеличивает время высушивания и потребления энергии, а также может привести к снижению выживаемости микроорганизмов при дальнейшем хранении [4].
На втором этапе (первичное высушивание), происходит сублимация воды из лиофилизуемого образца в условиях вакуума. К образцам подводят дополнительную энергию, необходимую для сублимации влаги путем нагревания полки, на которой расположены образцы. Образцы также получают энергию теплового излучения окружающей среды (рис. 1). Крайние флаконы получают больше энергии и их содержимое высыхает быстрее остальных («эффект краевого флакона»).
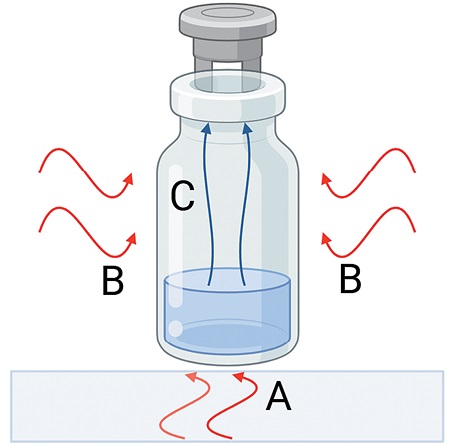
Рисунок подготовлен авторами с использованием графического редактора BioRender / The figure is prepared by the authors using the BioRender graphical editor.
Рис. 1. Тепловая энергия, получаемая лиофилизированными образцами: A — от нагревания полки лиофильного аппарата, B — от окружающей среды, С — испарение влаги.
Fig. 1. Thermal energy received by lyophilized samples from heating the shelf of the lyophilizer and the environment, A and B, respectively; С, evaporation of moisture.
Третий этап (досушивание или вторичное высушивание) является критическим для лиофилизации, поскольку определяет остаточную влажность образцов. На данном этапе связанная вода, оставшаяся адсорбированной в образцах после сублимации, удаляется путем десорбции. Для ее удаления необходимо подвести дополнительную энергию к образцам, что достигается нагреванием полки и максимальным снижением давления в камере. При досушивании необходимо достигнуть остаточной влажности 1–3% для предотвращения химической деградации и физического разрушения структуры лиофилизата.
Суммируя вышесказанное: для получения образцов тест-штаммов, содержащих низкую концентрацию клеток, важно разработать специальный режим высушивания, который будет способствовать сохранению жизнеспособности максимального исходного количества клеток микроорганизмов.
Цель работы — разработка режима высушивания с использованием аппарата камерного типа, обеспечивающего выживаемость тест-штаммов микроорганизмов, стандартизированных по количеству жизнеспособных клеток в концентрации 10³ КОЕ/мл.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
В работе применяли тест-штаммы микроорганизмов, рекомендованные к проведению микробиологических испытаний Государственной фармакопеей Российской Федерации XV изд.: Salmonella enterica subsp. enterica serovar Abony NCTC 6017; Staphylococcus aureus АТСС 6538 и 6538P; Alcaligenes faecalis 415; Pseudomonas aeruginosa ATCC 9027; Yersinia enterocolitica ATCC 9610; Escherichia coli ATCC 25922. Все штаммы получены из основного фонда Государственной коллекции патогенных микроорганизмов ФГБУ «НЦЭСМП» Минздрава России.
Питательная среда ГРМ-агар (серия О1-К-755) получена от ФБУН «ГНЦ ПМБ» Роспотребнадзора. В качестве лиопротектора использовали сахарозо-желатиновую среду, которая содержала по массе 10% сахарозы (кат. № 1.07653, серия K48546153, Merck, Франция) и 1,5% желатина (кат. № 1.04070, серия VM918570, Merck, Франция). В работе также использовали фармакопейный стандартный образец (ФСО) Государственной фармакопеи Российской Федерации мутности бактериальных взвесей 10 МЕ ФСО 3.1.00084 (ОСО 42-28-84, серия S-2/8-010122, ФГБУ «НЦЭСМП» Минздрава России) (далее — ФСО мутности бактериальных взвесей). Подготовленную бактериальную суспензию разливали во флаконы для лиофилизации объемом 2,0 мл из боросиликатного стекла стандарта 2R (артикул 1637441, серия 6106541118, Shott, Германия).
Оборудование
В работе использовали следующее оборудование: сушку лиофильную Epsilon 2-4 LSCplus с датчиками измерения температуры и электрического сопротивления LioRx (Martin Christ, Германия); весы специальные класса 1 ML204T/A00 (Mettler Toledo, Швейцария); генератор плазмы PG 1200 (Fergutec, Нидерланды); вакуумно-сушильный шкаф VD 23 (Binder, Германия); термостат MIR254 (Panasonic Healthcare Co., Ltd, Япония); шкаф ламинарный БАВ п-01-1,2, класс защиты II (ЗАО «Ламинарные системы», Россия).
Методы
Температуру замораживания образцов, помещенных в лиофильный аппарат, определяли посредством измерения электрического сопротивления с помощью датчика LioRx и температурного датчика, входящих в комплект лиофильной сушки Epsilon 2-4 LSCplus. В момент замораживания температура образца снижается, а электрическое сопротивление резко возрастает из-за снижения подвижности ионов в момент перехода из жидкого в твердое состояние. Анализируя график замораживания флаконов в лиофильной сушке, за точку замерзания можно принять пересечение кривых электрического сопротивления и температуры.
Оценку выживаемости микробных клеток после замораживания и лиофилизации проводили путем культивирования тест-штаммов при 37±2 °С на поверхности агаризованной среды в чашках Петри. Для лиофильного высушивания использовали суточную культуру микроорганизмов. Колонии отбирали бактериологической петлей и готовили в стерильной воде суспензию, соответствующую 10 МЕ ФСО мутности бактериальных взвесей. Полученную суспензию путем последовательных десятикратных разведений в сахарозо-желатиновой среде доводили до концентрации 10³ КОЕ/мл микробных клеток и вносили по 0,5 мл во флаконы. Для определения концентрации микробных клеток проводили посев суспензии в объеме 0,1 мл на поверхности агаризованной среды в чашках Петри.
Флаконы с суспензией (флаконы) помещали в лиофильную сушку и замораживали в течение 2 ч при температуре полки минус 35, 45 и 55 °С. По окончании замораживания, непосредственно перед первичным высушиванием, отбирали по 3 образца каждого штамма и размораживали в термостате при температуре 37 °С в течение 30 мин, а затем проводили посев. Оставшиеся флаконы высушивали при температуре полки минус 20 °С и вакууме 0,4 мбар в течение 10 ч. Затем флаконы досушивали при температуре 30 °С и вакууме 0,006 мбар в течение 4 ч. По окончании лиофилизации определяли количество жизнеспособных клеток и рассчитывали показатель выживаемости, выраженный как отношение количества жизнеспособных клеток после высушивания к исходному количеству клеток.
Определение условий первичного высушивания весовым методом. Критерием первичного высушивания служило изменение массы образцов вследствие удаления воды при сублимации. Массу образца в каждом флаконе рассчитывали по разнице между массой флакона с образцом и массой пустого флакона. Для оценки влияния глубины вакуума проводили три цикла сублимации при давлении 0,4, 0,04 и 0,004 мбар. Высушивание завершали через 5 ч, после чего взвешивали флаконы и рассчитывали массу сублимированной влаги и скорость сублимации образцов.
Определение времени досушивания. Образцы замораживали и проводили сублимацию, как указано выше. Затем в камере создавали минимальное возможное давление, а температуру полки повышали до 30 °С. После нагрева полки образцы отбирали каждый час (6 временных точек) и определяли остаточную влажность образцов по потере в массе при высушивании.
Определение потери в массе при высушивании проводили согласно ОФС.1.2.1.0010.15 Государственной фармакопеи Российской Федерации1. Для определения потери в массе при высушивании использовали 20 флаконов, из содержимого которых формировали три навески. Высушивание проводили при температуре 60 °С и давлении менее 7 гПа.
Статистическая обработка результатов включала в себя расчет среднего значения измеряемого параметра, стандартного отклонения от среднего значения и относительного стандартного отклонения с помощью программы Microsoft Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Определение температуры замораживания
На графике замораживания сахарозо-желатиновой среды (рис. 2) можно выделить несколько стадий. На первой стадии защитная среда охлаждается и температура постепенно снижается до точки замерзания воды и начала образования первых кристаллов льда. Лиопротекторы (сахароза и желатин) понижают точку замерзания ниже 0 °С. Как следует из графика (рис. 2), данная среда замерзает при температуре минус 9,9 °С. Процесс кристаллизации является экзотермическим, поэтому происходит нагрев образца до минус 1,6 °С. При кристаллизации электрическое сопротивление резко повышается, но не достигает 100%, так как проходит процесс стеклования раствора (постепенный переход в твердую фазу без кристаллизации). Начинается вторая стадия — стеклование образца, когда он становится более вязким, пока не затвердеет полностью. По достижении температуры образца ниже минус 25 °С электрическое сопротивление достигает 100% (табл. 1). Таким образом, при лиофилизации замораживание необходимо проводить до температуры образца ниже минус 25 °С. Разница температуры полки и лиофилизированного продукта составляет 10 °С. Поэтому для замораживания образцов температура полки должна составлять минус 35 °С.
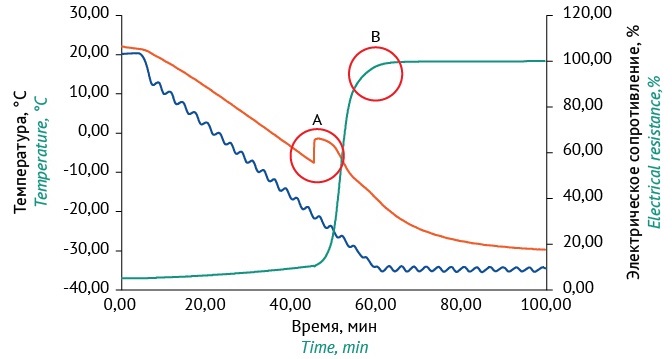
Рисунок подготовлен авторами по собственным данным с использованием программного обеспечения LioLog к оборудованию Epsilon 2-4 LSCplus / The figure is prepared by the authors using their own data and software LioLog to the Epsilon 2-4 LSCplus equipment
Рис. 2. График замораживания сахарозо-желатиновой защитной среды: красная линия — температура образцов; зеленая линия — электрическое сопротивление LioRx, синяя линия — температура полки. Красными кругами на рисунке выделены: A — момент кристаллизации образцов; B — момент достижения 100% электрического сопротивления LioRx.
Fig. 2. A graph of sucrose-gelatin protective medium freezing: red line, sample temperature; green line, electrical resistance LioRx; blue line, shelf temperature. Red circles highlight points of crystallization of samples and reaching 100% electrical resistance LioRx, A and B, respectively.
Таблица 1. Характеристики замораживания сахарозо-желатиновой среды при определении зоны эвтектики
Table 1. Characteristics of sucrose-gelatin medium freezing while determining the eutectic zone
Температура полки, °С Shelf temperature, °C | Температура образца, °С Sample temperature, °C | Электрическое сопротивление LioRx, % Electrical resistance LioRx, % |
Минус 20 / -20 | Минус 10 / -10 | 84,00±1,00 |
Минус 30 / -30 | Минус 20 / -20 | 99,50±0,10 |
Минус 30 / -30 | От минус 23 до минус 25 From -23 to -25 | 99,99±0,01 |
Минус 35 / -35 | От минус 25 до минус 26 From -25 to -26 | 100,00±0,01 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Влияние температуры замораживания на выживаемость тест-штаммов микроорганизмов
Результаты оценки влияния температуры замораживания на жизнеспособность тест-штаммов микроорганизмов после замораживания и лиофилизации представлены в таблице 2. При температуре ниже минус 40 °С количество жизнеспособных клеток штамма A. faecalis 415 уменьшается, хотя для двух других штаммов, S. Abony NCTC 6017 и S. aureus АТСС 6538, различия незначительны. Это объясняется тем, что микроорганизмы, содержащие жгутики и не ферментирующие трегалозу, такие как A. faecalis, имеют более низкую выживаемость после лиофилизации [18]. Поэтому для лиофилизации образцов выбрана температура минус 25 °С при температуре полки лиофильного аппарата минус 35 °С.
Таблица 2. Влияние температуры замораживания на выживаемость тест-штаммов микроорганизмов
Table 2. Effect of freezing temperature on the survival rate of test strains of microorganisms
Тест-штамм Test strain | Выживаемость, % / Survival rate, % | |||
Условия Conditions | Температура образца, °C / Sample temperature, °C | |||
Минус 25 -25 | Минус 35 -35 | Минус 45 -45 | ||
S. Abony NCTC 6017 | Замораживание / Freezing | 96±6a | 100±6 | 95±1 |
Лиофилизация/ Lyophilization | 83±8 | 62±6 | 69±7 | |
S. aureus АТСС 6538 | Замораживание / Freezing | 100±7 | 94±8 | 100±1 |
Лиофилизация / Lyophilization | 68±18 | 68±15 | 58±17 | |
A. faecalis 415 | Замораживание / Freezing | 100±14 | 92±11 | 96±8 |
Лиофилизация / Lyophilization | 54±9 | 50±10 | 15±5 | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. X — среднеарифметическое значение, S — стандартное отклонение; n — число испытаний.
a данные представлены как X±S (n=9).
Note. X, arithmetic mean, S, standard deviation; n, a number of tests.
a data represented as X±S (n=9).
Определение условий первичного высушивания
При температуре полки минус 20 °С отсутствует плавление защитной среды. Небольшое плавление наблюдается при температурах минус 15 и минус 10 °С. Скорость сублимации при температурах полки минус 15 и минус 20 °С одинаковая. Поэтому оптимально проводить высушивание при температуре полки минус 20 °С, так как отсутствует вероятность плавления образцов.
После определения температуры нагрева полки оценили влияние глубины вакуума на скорость сублимации. При понижении давления скорость высушивания снижается, увеличивая общее время сублимации. Результаты эксперимента приведены в таблицах 3 и 4. Таким образом, оптимально было использовать остаточное давление в камере на уровне 0,4 гПа.
Таблица 3. Характеристика первичного высушивания образцов при разной температуре полок
Table 3. Characteristics of the primary drying of samples at different shelf temperatures
Температура полки, °С Shelf temperature,°C | Электрическое сопротивление LioRx, % Electrical resistance LioRx, % | Температура образца, °С Sample temperature, °C | Скорость сублимации, мг/ч Sublimation rate, mg/h | Время, необходимое для высушивания 0,5 мл, ч Time required for drying of 0.5 mL, h |
Минус 10 -10 | 99,88–99,99 | Минус 23,8 — минус 26,6 From -23.8 to -26.6 | 65 | 11,5 |
Минус 15 -15 | 99,93–99,99 | Минус 21,3 — минус 24,4 From -21.3 to -24.4 | 34 | 13,5 |
Минус 20 -20 | 100 | Минус 24,5 — минус 25,9 From -24.5 to -25.9 | 34 | 13,5 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Таблица 4. Масса сублимированной влаги при разном давлении
Table 4. The mass of sublimated moisture at different pressures
Остаточное давление в камере лиофильной сушки, гПа Residual pressure in the freeze-drying chamber, gPa | Потеря в массе при сублимации, мг Weight loss during sublimation, mg | Остаточная масса лиофилизата, % Residual weight of lyophilizate, % |
0,4 | 455±18a | 9 |
0,04 | 307±18 | 39 |
0,004 | 240±9 | 52 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. X — среднеарифметическое значение; S — стандартное отклонение; n — число испытаний.
a данные представлены как X±S (n=10).
Note. X, arithmetic mean; S, standard deviation; n, a number of tests.
a data represented as X±S (n=10).
После определения условий первичного высушивания рассчитали скорость высушивания образцов в зависимости от расположения в камере лиофильного аппарата при его полной загрузке (рис. 3). Процесс сублимации протекает линейно, происходит постепенное углубление зоны высушенного образца [1]. Из рисунка 3 следует, что процесс продолжался в течение 8 ч, после чего останавливался. Затем переходили к следующему этапу — досушиванию.
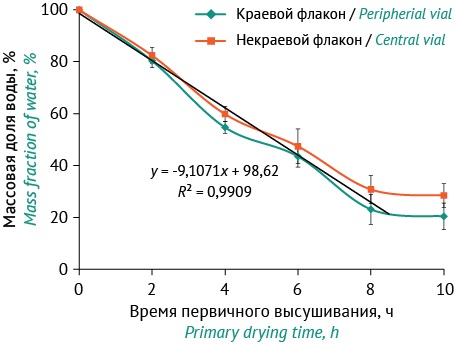
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 3. График скорости высушивания в зависимости от расположения флаконов в лиофильном аппарате: линия зеленого цвета (ромбы) — флаконы, расположенные по краям; линия красного цвета (квадраты) — флаконы, расположенные в центре аппарата; линия черного цвета — кривая аппроксимации.
Fig. 3. A graph of drying speed depending on the location of the vials in the freeze dryer: vials located at the peripheral and in the central parts of the device are shown in green and red colors, respectively; an approximation curve is shown in black color.
Определение времени досушивания
В предыдущих исследованиях нами было определено, что продолжительность досушивания не оказывает влияния на выживаемость S. Abony, S. aureus и A. faecalis после лиофилизации и последующем хранении [13]. При определении потери в массе при высушивании остаточная влажность нормируется в диапазоне от 0 до 3%. В качестве критерия окончания времени досушивания была выбрана середина диапазона (1,5%), но не менее 0,5%, так как слишком низкая остаточная влажность может привести к снижению выживаемости клеток микроорганизмов за счет удаления связанной воды и денатурации белковых структур. Такая остаточная влажность достигается за 4 ч досушивания при 30 °С (рис. 4).
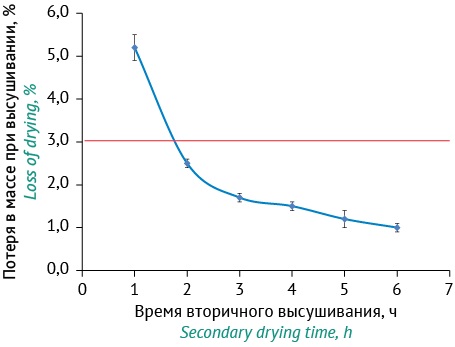
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 4. Изменение остаточной влажности образцов в зависимости от времени досушивания. Красным цветом обозначено критическое значение остаточной влажности.
Fig. 4. Dynamics of residual moisture content of the samples depending on the drying time. The critical value of residual moisture content is shown in red color.
Таким образом, по результатам проведенных исследований можно предложить режим высушивания тест-штаммов микроорганизмов в аппарате камерного типа с параметрами, указанными в таблице 5.
Таблица 5. Параметры разработанного режима высушивания для флаконов 2R, заполненных суспензией микробных клеток в объеме 0,5 мл
Table 5. Parameters of developed drying mode for 2R vials filled with 0.5 mL microbial cell suspension
Стадия лиофилизации Lyophilization stage | Продолжительность экспозиции, ч Exposition duration, h | Температура полок, °C Shelf temperature, °C | Вакуум в камере, мбар Vacuum in the freeze-drying chamber, mbar |
Загрузка Loading | 0 | 20 | – |
Замораживание Freezing | 1 | Минус 35 / -35 | – |
1 | Минус 35 / -35 | – | |
Первичная сушка First drying | 10 | Минус 20 / -20 | 0,4 |
1 | 30 | 0,4 | |
Досушивание Final drying | 4 | 30 | 0,001 |
Общее время The total time | 17 | Не применимо / Not applicable | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Подобранный режим высушивания верифицировали на нескольких сериях образцов разных тест-штаммов микроорганизмов в концентрации 10³ КОЕ/мл (табл. 6). В каждой серии отмечалось высокое качество лиофилизата: ровная белая таблетка, растворяющаяся в течение 30 с в 0,5 мл стерильной воды очищенной. При культивировании каждого тест-штамма наблюдались типичные колонии, соответствующие морфологическим свойствам данного штамма.
Таблица 6. Оценка качества лиофилизатов, полученных по разработанному режиму высушивания
Table 6. Evaluation of the quality of lyophilisates obtained according to the developed drying mode
Тест-штамм Test strain | Выживаемость после высушивания, % Survival after drying, % | Потеря в массе при высушивании, % Loss of drying, % |
A. faecalis 415 | 40 | 0,8 |
S. aureus АТСС 6538 | 96 | 1,5 |
S. Abony NCTC 6017 | 83 | 1,5 |
S. aureus ATCC 6538P | 89 | 2,1 |
P. aeruginosa ATCC 9027 | 40 | 1,0 |
Y. enterocolitica ATCC 9610 | 22 | 1,5 |
E. coli ATCC 25922 | 41 | 1,2 |
M. luteus ATCC 10240 | 100 | 1,9 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Выживаемость грамположительных бактерий после лиофилизации оказалась выше, чем грамотрицательных, что, возможно, связано со строением клеточной стенки. Результаты оценки выживаемости совпадают с результатами исследований патентованных микроорганизмов в депозитариях Японии [19] и ФКУН РосНИПЧИ «Микроб» Роспотребнадзора [18], однако описанное в этих работах высушивание проводили в условиях высокой концентрации клеток. Установленное нами сходство данных оценки выживаемости клеток микроорганизмов, взятых для высушивания в высоких и низких концентрациях, указывает на то, что выживаемость является видоспецифическим признаком, а разработанный режим высушивания может быть использован для лиофилизации стандартизированных по количеству жизнеспособных клеток микроорганизмов.
Проведенное исследование подчеркивает важность оптимизации условий лиофилизации, поскольку выбор параметров процесса влияет на выживаемость микроорганизмов. Замораживание ниже температуры стеклования приводит к снижению жизнеспособности некоторых штаммов. Увеличение глубины вакуума не ускоряет процесс высушивания, а продлевает время сублимации. Таким образом, описанный подход к определению параметров лиофильного высушивания может быть использован для оптимизации цикла лиофилизации при создании и поддержании коллекций микроорганизмов.
ВЫВОДЫ
- Разработан режим лиофильного высушивания тест-штаммов микроорганизмов в низкой концентрации (10³ КОЕ/мл), включающий замораживание до температуры не выше минус 25 °C, первичное высушивание при температуре полки минус 35 °C и вакууме 0,4 мбар, а также досушивание при 30 °C и остаточном давлении 0,001 мбар.
- Выживаемость тест-штаммов микроорганизмов зависит от температурного режима замораживания: температура замораживания ниже эвтектической точки может снижать жизнеспособность микроорганизмов, особенно A. faecalis.
- Полученные результаты исследования могут быть положены в основу стандартизации процесса лиофилизации тест-штаммов микроорганизмов в рамках фармакопейных требований и микробиологического контроля.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.А. Воропаев — концепция работы, проведение экспериментальной работы, написание текста рукописи, формулировка выводов; Ю.И. Крысанова — проведение экспериментальной работы; О.В. Фадейкина — участие в формулировке выводов, утверждение окончательной версии рукописи для публикации; Р.М. Валюхова — проведение экспериментальной работы, написание текста рукописи; Д.С. Давыдов — концепция работы, утверждение окончательной версии рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.A. Voropaev conceptualized the work, conducted the experiments, drafted the manuscript, and compiled the conclusions. Yu.I. Krysanova conducted the experiments. O.V. Fadeikina compiled the conclusions and approved the final version of the manuscript for publication. R.M. Valyukhova conducted the experimental work and drafted the manuscript. D.S. Davydov conceptualized the work and approved the final version of the manuscript for publication.
1. ОФС 1.2.1.0010.15 Потеря в массе при высушивании. Государственная фармакопея Российской Федерации. XIV изд.; 2018.
Список литературы
1. Díaz-Rodríguez AM, Salcedo Gastelum LA, Félix Pablos CM, Parra-Cota FI, Santoyo G, Puente ML, et al. The current and future role of microbial culture collections in food security worldwide. Front Sustain Food Syst. 2020;4:614739. https://doi.org/10.3389/fsufs.2020.614739
2. Han-Min O. Selection of bacterial strains in a testing microbiology laboratory for quality assurance purposes: ISO/IEC 17025: 2017 standard point of view. Accred Qual Assur. 2025; 30:95–101. https://doi.org/10.1007/s00769-024-01615-9
3. Rockinger U, Funk M, Winter G. Current approaches of preservation of cells during (freeze-) drying. J Pharm Sci. 2021; 110(8):2873–93. https://doi.org/10.1016/j.xphs.2021.04.018
4. Polo L, Mañes Lázaro R, Olmeda I, Cruz Pio LE, Medina A, Ferrer S, Pardo I. Influence of freezing temperatures prior to freeze drying on viability of yeasts and lactic acid bacteria isolated from wine. J Appl Microbiol. 2017;122(6):1603–14. https://doi.org/10.1111/jam.13465
5. de Almeida KV, Zanetti VC, Camelo-Silva C, Alexandre LA, da Silva AC, Verruck S, Teixeira LJQ. Powdered water kefir: Effect of spray drying and lyophilization on physical, physicochemical, and microbiological properties. Food Chem Adv. 2024;5:100759. https://doi.org/10.1016/j.focha.2024.100759
6. Dimitrellou D, Kandylis P, Kourkoutas Y. Effect of cooling rate, freeze-drying, and storage on survival of free and immobilized Lactobacillus casei ATCC 393. LWT — Food Sci Technol. 2016;69:468–73. https://doi.org/10.1016/j.lwt.2016.01.063
7. Verlhac P, Vessot-Crastes S, Degobert G, Cogné C, Andrieu J, Beney L, et al. Experimental study and optimization of freezedrying cycles of a model Casei type probiotic bacteria. Dry Technol. 2020;38(16):2120–33. https://doi.org/10.1080/07373937.2019.1683859
8. Guowei S, Yang X, Li C, Huang D, Lei Z, He C. Comprehensive optimization of composite cryoprotectant for Saccharomyces boulardii during freeze-drying and evaluation of its storage stability. Prep Biochem Biotechnol. 2019;49(9):846–57. https://doi.org/10.1080/10826068.2019.1630649
9. Bellali S, Bou Khalil J, Fontanini A, Raoult D, Lagier JC. A new protectant medium preserving bacterial viability after freeze drying. Microbiol Res. 2020;236:126454. https://doi.org/10.1016/j.micres.2020.126454
10. Явников НВ. Влияние различных криопротекторных компонентов на выживаемость пробиотических микроорганизмов после лиофильной сушки. Международный вестник ветеринарии. 2022;(1):69–73. https://doi.org/10.52419/issn2072-2419.2022.1.69
11. Manohar P, Ramesh N. Improved lyophilization conditions for long-term storage of bacteriophages. Sci Rep. 2019; 9(1):15242. https://doi.org/10.1038/s41598-019-51742-4
12. Schoug A, Olsson J, Carlfors J. Schnürer J, Håkansson S. Freeze-drying of Lactobacillus coryniformis Si3-effects of sucrose concentration, cell density, and freezing rate on cell survival and thermophysical properties. Cryobiology. 2006; 53(1);119–27. https://doi.org/10.1016/j.cryobiol.2006.04.003
13. Воропаев АА, Фадейкина ОВ, Ермолаева ТН, Давыдов ДС. Лиофилизация бактериальных тест-штаммов в аппарате коллекторного типа: влияние параметров замораживания и высушивания, объема заполнения ампул и плотности ватного фильтра. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(3):348–60. https://doi.org/10.30895/2221-996X-2023-23-3-348-360
14. Ward KR, Matejtschuk P. The principles of freeze-drying and application of analytical technologies. In: Wolkers WF, Oldenhof H, eds. Cryopreservation and freeze-drying protocols. Methods in Molecular Biology. Vol. 2180. New York: Humana; 2021. https://doi.org/10.1007/978-1-0716-0783-1_3
15. Assegehegn G, Brito-de la Fuente E, M. Franco J, Gallegos C. The importance of understanding the freezing step and its impact on freeze-drying process performance. J Pharm Sci. 2019;108(4):1378–95. https://doi.org/10.1016/j.xphs.2018.11.039
16. Sohail Arshad М, Smith G, Polygalov E, Ermolina I. Throughvial impedance spectroscopy of critical events during the freezing stage of the lyophilization cycle: The example of the impact of sucrose on the crystallization of mannitol. Eur J Pharm Biopharm. 2014;87(3):598–605. https://doi.org/10.1016/j.ejpb.2014.05.005
17. Wang G-Q, Pu J, Yu X-.Q, Xia Y-J, Ai L-Z. Influence of freezing temperature before freeze-drying on the viability of various Lactobacillus plantarum strains. J Dairy Sci. 2020; 103(4):3066–75. https://doi.org/10.3168/jds.2019-17685
18. Осин АВ, Червякова НС, Валова ТВ. Лиофилизация штаммов патогенных микроорганизмов на сублимационных установках разного типа и оценка качества полученных препаратов. Проблемы особо опасных инфекций. 2016;(3):66–70. https://doi.org/10.21055/0370-1069-2016-3-66-70
19. Miyamoto-Shinohara Y, Sukenobe J, Imaizumi T, Nakahara T. Survival of freeze-dried bacteria. J Gen Appl Microbiol. 2008;54(1):9–24. https://doi.org/10.2323/jgam.54.9
Об авторах
А. А. ВоропаевРоссия
Воропаев Андрей Андреевич
Петровский б-р, д. 8, стр. 2, Москва, 127051
Ю. И. Крысанова
Россия
Крысанова Юлия Игоревна
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. В. Фадейкина
Россия
Фадейкина Ольга Васильевна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Р. М. Валюхова
Россия
Валюхова Рузиля Маратовна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Д. С. Давыдов
Россия
Давыдов Дмитрий Сергеевич, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Воропаев А.А., Крысанова Ю.И., Фадейкина О.В., Валюхова Р.М., Давыдов Д.С. Лиофилизация стандартизированных по количеству жизнеспособных клеток микроорганизмов в низкой концентрации: разработка режима высушивания. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):193-202. https://doi.org/10.30895/2221-996X-2025-25-2-193-202
For citation:
Voropaev A.A., Krysanova Yu.I., Fadeikina O.V., Valyukhova R.M., Davydov D.S. Lyophilization of microorganisms standardized by the number of viable cells in low concentration: Development of a drying mode. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):193-202. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-2-193-202


































