Перейти к:
Определение антилекарственных антител к афлиберцепту методом иммуноферментного анализа: разработка и валидация методики
https://doi.org/10.30895/2221-996X-2025-631
Резюме
ВВЕДЕНИЕ. Афлиберцепт применяется для лечения неоваскулярной возрастной макулярной дегенерации, приводящей к потере зрения. К числу существенных побочных эффектов афлиберцепта относится его иммуногенность, проявляющаяся в виде выработки антилекарственных антител (АЛА). В рамках оценки иммуногенности препарата актуальной представляется разработка методики определения АЛА к афлиберцепту.
ЦЕЛЬ. Разработка и валидация аналитической методики для иммуноферментного обнаружения и поэтапной характеристики общих антилекарственных антител к афлиберцепту в сыворотке крови человека.
МАТЕРИАЛЫ И МЕТОДЫ. Разработку методики проводили с применением метода твердофазного иммуноферментного анализа (ИФА). Использовали афлиберцепт (GNR-098, АО «ГЕНЕРИУМ», Россия) и конъюгат GNR-098 с пероксидазой хрена. Поликлональные антитела к GNR-098 получали путем иммунизации крыс, последующего отбора сыворотки крови и выделения из нее антител при помощи метода аффинной хроматографии. Обнаружение АЛА осуществляли с использованием меченого GNR-098 при постановке мостикового ИФА. Модельные образцы готовили, используя пулированные сыворотки здоровых доноров с добавлением крысиных поликлональных антител. Валидацию методики проводили по следующим параметрам: пределы исключения методик; прецизионность; предел обнаружения; устойчивость к присутствию в образцах растворимой мишени терапевтического белка; специфичность; эффект матрицы; минимальное необходимое разведение; стабильность; устойчивость к замене ключевого компонента; эффект сверхдозы (хук-эффект).
РЕЗУЛЬТАТЫ. Аналитическая методика включала скрининг-тест для определения возможного наличия АЛА, подтверждающий тест — для установления специфичности обнаруженных АЛА, тест для определения титра АЛА и их принадлежности к классу IgE. Пределы исключения методик для скрининг-теста и для теста определения АЛА класса IgE составили 1,3 и 1,2 соответственно; для подтверждающего теста — 15,2%. Предел обнаружения скрининг-теста составил 185 нг/мл. Продемонстрирована устойчивость методики к присутствию в образцах до 2000 пг/мл растворимой мишени терапевтического белка (hrVEGF165). Отсутствие эффекта матрицы установлено в скрининг-тесте и подтверждающем тесте 13 испытуемых образцов, содержащих АЛА в концентрации 280 нг/мл. Эффект сверхдозы не был установлен в скрининг-тесте и подтверждающем тесте образцов, содержащих АЛА в концентрации, пятикратно превышающей высокоположительный образец.
ВЫВОДЫ. Разработана комплексная аналитическая методика для иммуноферментного обнаружения и поэтапной характеристики общих антилекарственных антител к афлиберцепту (препарат GNR-098) в сыворотке крови человека. Пригодность методики к применению подтверждена в ходе валидации. Разработанная аналитическая система позволит провести оценку иммуногенности афлиберцепта.
Ключевые слова
Для цитирования:
Шевченко И.В., Лисова А.Е., Агафонова А.А., Смолова К.А., Алаева И.М., Жуков И.Ю., Казаров А.А., Лягоскин И.В. Определение антилекарственных антител к афлиберцепту методом иммуноферментного анализа: разработка и валидация методики. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(3):284-295. https://doi.org/10.30895/2221-996X-2025-631
For citation:
Shevchenko I.V., Lisova A.E., Agafonova A.A., Smolova K.A., Alaeva I.M., Zhukov I.Yu., Kazarov A.A., Lyagoskin I.V. Detection of anti-drug antibodies to aflibercept by enzyme-linked immunosorbent assay: Development and validation of the method. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(3):284-295. (In Russ.) https://doi.org/10.30895/2221-996X-2025-631
ВВЕДЕНИЕ
Афлиберцепт широко применяется для те-рапии влажной формы возрастной макулярной дегенерации (ВМД) [1–4], которая проявляется избыточным ростом сосудов и приводит к потере зрения. В мире зарегистрировано до 200 млн человек с ВМД, и их численность увеличивается [5]. Согласно данным компании Regeneron Pharmaceuticals, доходы от продаж афлиберцепта в США в 2023 г. составили 5,9 млрд долларов1.
Афлиберцепт представляет собой рекомбинантный гибридный белок, состоящий из фрагментов рецептора фактора роста эндотелия сосудов (vascular endothelial growth factor, VEGF) и Fc-домена иммуноглобулина G (IgG) человека [2].
Одним из существенных побочных эффектов афлиберцепта является его потенциальная иммуногенность, проявляющаяся в выработке антилекарственных антител (АЛА) в ответ на введение препарата. В соответствии с требованиями Европейского агентства по лекарственным средствам (European Medicines Agency, EMA)2, Управления по контролю за качеством продуктов питания и лекарственных средств США (Food and Drug Administration, FDA)3 и Министерства здравоохранения Российской Федерации4 для каждого биологического лекарственного препарата необходима оценка безопасности, в том числе изучение нежелательной иммуногенности [6–9]. Следует отметить, что производитель оригинального препарата афлиберцепта (Эйлеа) не предоставляет полную информацию о методах обнаружения и характеризации АЛА, в связи с чем производителям биоаналогов требуется разработка и валидация собственных аналитических методик для обеспечения контроля качества и безопасности терапии.
В Российской Федерации выпускается биоаналог афлиберцепта (GNR-098, АО «ГЕНЕРИУМ»), при разработке которого в рамках концепции «качество через дизайн» (Quality by Design, QbD)5 были определены ключевые риски и факторы вариабельности, контроль над которыми обеспечивает получение стабильных результатов. Важнейшим аспектом в оценке иммуногенности является индивидуальная реакция пациента, выражающаяся в уникальных характеристиках продуцируемых антител: клональности, количестве, авидности, изотипическом составе и нейтрализующей активности. Эти особенности не позволяют провести точное количественное определение уровня АЛА в образцах путем сравнения с сигналом калиброванного положительного контроля6 [10]. Кроме того, сыворотка крови, используемая для анализа, содержит примеси — различные белки7, липиды и ионы, — которые могут влиять на точность измерений.
Источником дополнительной вариабельности служат различия между партиями используемых реагентов, особенности оборудования и работа аналитиков. Эти факторы можно контролировать при строгом соответствии принципам надлежащей клинической лабораторной практики (Good Clinical Laboratory Practice, GCLP)8. Также важно учитывать сочетанное влияние множества факторов на конечный результат, что требует одновременной оптимизации нескольких параметров при разработке методики.
Цель работы — разработка и валидация аналитической методики для иммуноферментного обнаружения и поэтапной характеристики общих антилекарственных антител к афлиберцепту в сыворотке крови человека.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Реагенты. В работе использовали афлиберцепт GNR-098 (АО «ГЕНЕРИУМ», Россия); афлиберцепт Эйлеа, оригинальный препарат (Байер АГ, Германия); поликлональные крысиные антитела к GNR-098 (АО «ГЕНЕРИУМ», Россия); нативные человеческие иммуноглобулины (кат. № ab91102, ab91117, ab152001), наборы для биотинилирования (кат. № ab201796) и стрептавидин, меченный пероксидазой хрена (ПХ) (кат. № ab7403, Abcam, Великобритания); наборы для конъюгирования с ПХ (кат. № LNK004P) и антитела к человеческим IgE (кат. № STAR147P, BioRad, США); рекомбинантный фактор роста эндотелия сосудов человека, VEGF (кат. № GF315, Sigma, США; АО «ГЕНЕРИУМ», Россия); субстратный раствор на основе 3,3’,5,5’-тетраметилбензидина (кат. № 01016-1, НПО «Био ТестСистемы», Россия). Для приготовления буферных растворов применяли: глицин (Merck, Германия); бычий сывороточный альбумин (БСА) (Sequens, Франция); трис основной (Scharlab, Испания); 0,01 М фосфатно-солевой буфер (ФСБ) pH 7,2–7,6 (НПЦ «Эко-Сервис», Россия); серная кислота, хч (ООО «МиниМед», Россия); натрия карбонат, натрия бикарбонат BioXtra (Sigma-Aldrich, США).
Модельные образцы. Готовили модельные образцы (МО), которые имитировали образцы сыворотки крови от пациентов. Для учета влияния индивидуальной вариабельности пациентов в качестве негативного МО (НМО) использовали пулированную сыворотку крови, полученную от 50 здоровых доноров (материал предоставлен ГБУЗ ВО «Областная станция переливания крови», г. Владимир). Положительные МО (ПМО) готовили путем внесения в НМО антилекарственных антител — поликлональных крысиных антител к GNR-098 в концентрациях 20, 5 и 0,5 мкг/мл для получения высокоположительного (ВПО), среднеположительного (СПО) и низкоположительного (НПО) модельных образцов соответственно.
Буферные растворы для разведения и блокирования. Для разведения испытуемых образцов (МО и сыворотки крови здоровых доноров), а также для блокирования свободных участков связывания в лунках полистироловых планшетов использовали растворы, приготовленные в ФСБ. Эффективность буферных растворов оценивали по их способности снижать фоновую оптическую плотность (ОП) в испытуемых образцах сыворотки.
Методы
Получение поликлональных антител. Поликлональные антитела к GNR-098 получали путем парентеральной иммунизации препаратом GNR-098 самцов взрослых крыс (10 особей) линии Sprague Dawley (предоставлены виварием АО «ГЕНЕРИУМ»). Через 14 сут после иммунизации проводили эвтаназию животных, отбирали кровь и получали сыворотку. Исследование проводили в соответствии с требованиями Европейской Конвенции по защите позвоночных животных, используемых в экспериментальных и иных научных целях9.
Антитела выделяли из сыворотки крови с помощью метода аффинной хроматографии с использованием колонок с носителем Protein G (Cytiva, США) в соответствии с протоколом производителя.
Условия сорбирования антигена и инкубации. В качестве буфера для сорбирования антигена (GNR-098) в лунках иммунологических планшетов (Nunc, Германия) был использован карбонатно-бикарбонатный буфер pH 9,2–9,6 в объеме 100 мкл на лунку. Было отработано два протокола сорбирования GNR-098: быстрый — в течение 1 ч при 25 °С и перемешивании при скорости 250 об/мин с использованием термошейкера (Biosan, Латвия), и ночной — в течение 12 ч при 4 °C.
Для блокирования свободных участков связывания в лунках полистироловых планшетов использовали 300 мкл ФСБ с добавлением полисорбата 20.
Получение конъюгата GNR-098. Использовали две схемы конъюгации GNR-098 с ПХ: 1) прямая конъюгация непосредственно с ПХ; 2) биотинилирование GNR-098 для последующего обнаружения с использованием конъюгата стрептавидин-ПХ. Конъюгацию проводили с применением коммерческих наборов в соответствии с инструкциями производителя.
Кислотная диссоциация комплекса АЛА-антиген. Для диссоциации комплекса АЛА-антиген проводили его обработку раствором 2М глицина гидрохлорида (pH 2,0) и инкубировали в течение 5 мин при комнатной температуре. Затем переносили АЛА в лунки нового планшета и нейтрализовали кислоту добавлением раствора 2М трис-буфера.
Учет результатов. Учет результатов проводили на спектрофотометре xMark (BioRad, США) при длине волны 450 нм.
Дизайн исследования
Обнаружение АЛА осуществляли путем многостадийного анализа, включавшего последовательное уточнение данных на каждом этапе. На стадии скрининга выполняли качественное определение общих АЛА (оАЛА) в образце, затем подтверждали специфичность обнаруженных АЛА и проводили характеризацию АЛА с установлением их титра, класса и нейтрализующей активности10 [6]. При разработке аналитических методик для обнаружения АЛА необходимо использовать положительные и отрицательные МО, а также учитывать возможное присутствие в исследуемых образцах терапевтического белка и/или его растворимой мишени, что может привести к возникновению ложноположительных результатов [8][9][11].
Скрининг-тест. Для обнаружения АЛА к GNR-098 применяли метод ИФА, использованный производителем оригинального препарата Эйлеа. АЛА из образцов сыворотки крови иммобилизовали путем связывания с антигеном (GNR-098), сорбированным на твердой фазе. Иммобилизованные АЛА детектировали с использованием меченого антигена. Антивидовые антитела к иммуноглобулинам человека на данном этапе не применялись, поскольку это потребовало бы использования положительных контрольных образцов (сыворотки крови человека с подтвержденным наличием АЛА).
Рассматривали два варианта постановки ИФА: сэндвич-вариант и мостиковый вариант. В сэндвич-варианте ИФА меченый антиген сорбировали третьим слоем поверх иммобилизованных АЛА. В мостиковом варианте комплексы АЛА-антиген предварительно диссоциировали с последующей сорбцией АЛА на новой подложке. Для проведения дальнейших исследований был выбран мостиковый вариант ИФА, поскольку в нем была продемонстрирована более высокая чувствительность. Это можно объяснить тем, что в сэндвич-варианте ИФА часть эпитопов АЛА участвует в связывании с антигеном нижнего слоя, а оставшиеся свободные эпитопы экранируются, что снижает эффективность обнаружения.
Подтверждающий тест. Подтверждающий тест включал дополнительный этап инкубации образцов с избытком антигена с целью истощения специфичных АЛА в образце. Это приводило к снижению аналитического сигнала в подтверждающем тесте по сравнению со скрининг-тестом. Добавление антигена в концентрации 200 мкг/мл позволило уменьшить аналитический сигнал ВПО на 95%.
Определение титра общих АЛА. Титрование выполнялось с сохранением постоянной доли биологической матрицы в буферном растворе для разведения испытуемых образцов сыворотки. Для обеспечения точности вычисления титра интервалы титрования подбирались так, чтобы коэффициенты кратности разведений в предполагаемом диапазоне титров не превышали 2,5.
Определение классов общих АЛА. Методика определения изотипа общих АЛА основана на скрининг-тесте и отличается используемым конъюгатом, а также внесением ПМО после кислотной диссоциации. Основная трудность при определении изотипа антител заключается в отсутствии положительных контрольных образцов человеческой сыворотки. Так как коммерческие иммуноглобулины к определенным классам антител не являются АЛА к терапевтическому белку, при выявлении классов общих АЛА возможен только качественный результат. Методы изотипирования общих АЛА обладают меньшей чувствительностью по сравнению со скрининговыми методами, поскольку выявляют лишь часть антител из общего пула.
Валидация методики
Параметры валидации. Цель валидации — подтвердить, что методика позволяет надежно и воспроизводимо определять общие АЛА к GNR-098 в биологической матрице (сыворотка крови). Согласно принципу «соответствия назначению» (fit for purpose) был определен перечень валидируемых параметров методики: пределы исключения методик (ПИМ, cut-point); прецизионность (повторяемость и воспроизводимость); предел обнаружения (ПО); устойчивость к присутствию в образцах растворимой мишени терапевтического белка; специфичность; эффект матрицы; минимальное необходимое разведение (МНР); стабильность; устойчивость к замене ключевого компонента; эффект сверхдозы (хук-эффект).
Статистическую обработку экспериментальных данных проводили при помощи программы GraphPad Prism 9 (GraphPad Software Inc., США) и Microsoft Office Excel 2016. Для каждого тестируемого образца значение ОП в повторностях усредняли и рассчитывали коэффициент вариации (coefficient of variation, CV, %).
Пределы исключения методик. ПИМ служат для разделения образцов на отрицательные и положительные. Для расчета ПИМ оценивали нормальность распределения значений ОП с учетом требований риск-ориентированного подхода. ПИМ устанавливали на уровне, допускающем получение до 5% ложноположительных результатов, что гарантирует обнаружение истинно положительных образцов с низкой концентрацией. Графическое представление алгоритма расчета представлено на рисунке S1 (опубликован на сайте журнала11).
Для оценки вариабельности значений аналитического сигнала исследовали образцы сыворотки от 60 здоровых доноров (для методики определения классов иммуноглобулинов использовали сыворотки от 45 доноров) в двух повторностях в шести независимых опытах с участием двух аналитиков. Образцы со значением CV более 20% признавали статистическими выбросами и исключали из расчетов. Дополнительно определение статистических выбросов проводили с использованием межквартильного интервала. Оценку нормальности данных проверяли с помощью теста Д’Агостино — Пирсона12.
При оценке вариабельности скрининг-теста, подтверждающего теста и определения АЛА класса IgE было установлено, что распределение данных является ненормальным и не поддается нормализации при помощи логарифмирования и удаления статистических выбросов. Поэтому ПИМ для скрининг-теста и определения АЛА класса IgE рассчитывали по формуле (1):
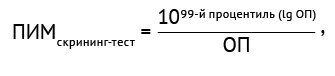 (1)
(1)
где ОП — среднее значение ОП.
Пробы, ОП которых превышала ПИМ, считали условно-положительными, поскольку специфичность обнаруженных АЛА необходимо подтвердить.
Для подтверждающего теста предельный уровень (%) незначимого ингибирования образца определяли по формуле (2):
ПИМподтверждающий тест = 100 – 10 1-й процентиль (lg И), (2)
где И — уровень ингибирования (%), определяемый по снижению отношения средней ОП образца в подтверждающем тесте по отношению к средней ОП того же образца в скрининг-тесте.
Пробы, условно-положительные в скрининг-тесте и одновременно имеющие уровень ингибирования, превышающий ПИМ подтверждающего теста, считали положительными.
Прецизионность. Оценивали степень близости друг к другу независимых результатов измерений, полученных в установленных условиях. Для скрининг-теста, подтверждающего теста и определения титров оценивали прецизионность внутри аналитических циклов (повторяемость) и между ними (воспроизводимость). Повторяемость методик скрининг-теста и подтверждающего теста оценивали при исследовании шести МНР для каждого из трех ПМО в одном опыте одним аналитиком. Повторяемость определения титра оАЛА оценивали при исследовании 9 повторностей (серий разведений) для каждого ПМО. Воспроизводимость исследовалась двумя аналитиками в шести независимых опытах с оценкой трех ПМО в двух повторностях.
Нормированные коэффициенты (K) для каждого ПМО в скрининг-тесте рассчитывали по формуле (3):
 (3)
(3)
где ПИМскрининг-тест — предел исключения методики скрининг-теста; ОППМО — среднее значение ОП для ПМО. Критерий приемлемости результатов — CV менее 20% для каждого ПМО при оценке повторяемости и воспроизводимости.
Для оценки воспроизводимости подтверждающего теста расчет уровня ингибирования (И, %) каждого ПМО проводили по формуле (4):
 (4)
(4)
где ОППТ — среднее значение ОП для ПМО в подтверждающем тесте; ОПСКР — среднее значение ОП для ПМО в скрининг-тесте.
Критерий приемлемости результатов — CV менее 20% для каждого ПМО при оценке повторяемости и воспроизводимости.
Для оценки прецизионности при определении титра АЛА расчет проводили по формуле (5):
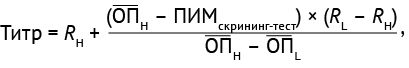 (5)
(5)
где титр — максимальное разведение образца, при котором его ОП превышает значение ПИМскрининг-тест; ОПН — среднее значение ОП для НМО; ПИМскрининг-тест — предел исключения методики скрининг-теста; RН — максимальный коэффициент разведения ПМО, средняя ОП которого выше предельного значения; RL — минимальный коэффициент разведения ПМО, средняя ОП которого ниже предельного значения; ОDН — среднее значение ОП для ПМО в максимальном разведении, превышающее предельное значение скрининг-теста; ОDL — среднее значение ОП для ПМО в минимальном разведении, ниже предельного значения скрининг-теста.
При оценке повторяемости рассчитывали медиану титра каждого ПМО. Критерием приемлемости результатов являлось различие максимального и минимального титров каждого ПМО не более чем в 3 раза от рассчитанной медианы.
Предел обнаружения. При оценке ПО (нг/мл) для методики обнаружения оАЛА расчет проводили по формуле (6):
ПО = ПОопыт + 3 × SD, (6)
где ПОопыт — усредненное значение ПО в шести независимых опытах, нг/мл; SD — стандартное отклонение. ПОопыт определяли по формуле (7):
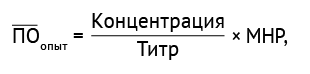 (7)
(7)
где МНР — минимальное необходимое разведение; концентрация — концентрация ПМО, нг/мл.
Устойчивость к присутствию в образцах сыворотки растворимой мишени терапевтического белка. Присутствие в исследуемых образцах сыворотки GNR-098 (в несвязанной форме) и/или его растворимой мишени (VEGF) может снижать чувствительность методики. Риск влияния присутствия GNR-098 был признан незначительным, поскольку препарат вводится интравитреально. VEGF, постоянно присутствующий в системном кровотоке, способен связывать свободный GNR-098. Для оценки влияния VEGF на чувствительность проводили анализ образцов с добавлением препаратов рекомбинантного человеческого VEGF (hrVEGF165) от двух производителей в скрининг-тесте. Для образцов, содержащих VEGF, рассчитывали коэффициент выявления (R, %). Критерием приемлемости результатов служило попадание величины R в диапазон значений от 75 до 125%.
Эффект матрицы. Устойчивость к матричным эффектам (неспецифическое ингибирование связывания АЛА с антигеном) оценивали в скрининг-тесте и подтверждающем тесте на 13 образцах, содержащих АЛА в концентрации 280 нг/мл. Критерием приемлемости результатов считалось получение условно положительного результата в скрининг-тесте и в подтверждающем тесте (ОП и уровень ингибирования выше соответствующих ПИМ) не менее чем для 80% испытуемых МО.
Минимальное необходимое разведение. Разведение испытуемых образцов сыворотки в буферном растворе применяется с целью снижения неспецифического влияния матрицы и экономии материала.
Специфичность. Для оценки специфичности методик обнаружения оАЛА и определения титра антител исследовали МО, содержащие неспецифические к GNR-098 АЛА (специфические к двум другим препаратам). Один из МО содержал АЛА к моноклональному антителу, направленному на ту же биологическую мишень, что и GNR-098. Специфичность подтверждающего теста оценивали путем внесения в ПМО непосредственно этих двух препаратов. Специфичность теста на определения АЛА класса IgE оценивали с использованием МО, содержащих антитела классов IgG и IgM человека.
Стабильность. Для подтверждения стабильности значений ОП образцов при хранении, транспортировке и проведении анализа исследовали МО в различных условиях хранения:
- в холодильной камере в течение 16 ч: замораживание при температуре не выше минус 70 °С, размораживание, инкубация в течение 16 ч в холодильной камере при температуре 5±3 °C;
- при комнатной температуре в течение 16 ч: замораживание при температуре не выше минус 70 °С, размораживание, инкубация в течение 16 ч при комнатной температуре;
- после нескольких циклов замораживания/размораживания: замораживание при температуре не выше минус 70 °С, размораживание при комнатной температуре и повторное замораживание (3 цикла).
В отдельном эксперименте анализировали МО после длительного хранения: замораживание на 14 сут при температуре не выше минус 20 °С и хранение в течение 3,5 мес. при температуре не выше минус 70 °C.
Все анализируемые МО сравнивали со свежеприготовленными МО. Для каждого МО после хранения рассчитывали коэффициент выявления (R, %) относительно свежеприготовленных образцов по формуле (8):
 (8)
(8)
где ОП — среднее значение оптической плотности образцов до и после хранения. Критерием приемлемости результатов служило попадание величины R в диапазон значений от 80 до 120%.
Устойчивость к замене ключевого компонента. Сравнивали работоспособность методики определения титра ПМО при использовании GNR-098 и оригинального препарата. Критерием приемлемости результатов являлось попадание установленных значений титра ПМО в диапазон, рассчитанный при оценке воспроизводимости определения титров.
Эффект сверхдозы (хук-эффект). Высокие концентрации аналита в пробе могут приводить к получению ложноотрицательного результата (ОП образца ниже ПИМ). Наличие хук-эффекта проверяли в скрининг-тесте и подтверждающем тесте с использованием МО, содержащих АЛА в концентрации, пятикратно превышающей уровень ВПО.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Разработка методики определения антилекарственных антител к биоаналогу афлиберцепта
На первом этапе разработки методики проводили подбор разведения сывороток, оптимального состава буферных растворов и выбор схемы проведения ИФА. Минимальное необходимое разведение составило 1:5. Выбран мостиковый вариант ИФА как показавший более высокую чувствительность.
Эффективность буферных растворов в снижении фоновой ОП негативных модельных образцов (фоновый сигнал) оценивали, сравнивая результаты измерения отношений ОП индивидуальных образцов сыворотки здоровых доноров к оптической плотности НМО (табл. S1, опубликована на сайте журнала13).
Использование ФСБ, содержащего полисорбат 20 и 1% БСА, позволило снизить среднее отношение ОП индивидуальных образцов сыворотки здоровых доноров к оптической плотности НМО на 33,2%, поэтому для разведения образцов был выбран этот буферный раствор.
При обнаружении АЛА использовали два варианта подготовки меченого антигена GNR-098. Проводили прямое конъюгирование антигена с ПХ и биотинилирование с последующей детекцией при помощи конъюгата стрептавидина с ПХ. Было показано, что биотинилирование повысило чувствительность методики: отношение аналитического сигнала низкоположительных МО к сигналу НМО было на 22–44% выше по сравнению с конъюгатом GNR-098 с ПХ.
Далее проводили подбор параметров инкубации ИФА. Полученные результаты при использовании быстрого и ночного протокола сорбирования антигена GNR-098 оказались сопоставимы, а оптимальный диапазон его концентрации составил 5–10 мкг/мл. Длительность инкубации АЛА с избытком антигена в подтверждающем тесте удалось сократить до 30 мин благодаря высокой концентрации взаимодействующего антигена и проведению реакции в гомогенной фазе. Для блокирования неспецифического связывания в лунках полистироловых планшетов оказалось достаточно инкубации в течение 30 мин.
Валидация методики определения антилекарственных антител к афлиберцепту
Определение предела исключения методики. Значения ПИМ, рассчитанные на основании ОП образцов (табл. S2–S4, опубликованы на сайте журнала в Приложении 114) для скрининг-теста и определения АЛА класса IgE составили 1,3 и 1,2 соответственно, значение ПИМ для подтверждающего теста составило 15,2%.
Оценка прецизионности. Прецизионность скрининг-теста и подтверждающего теста рассчитывали на основании определения нормированного коэффициента и коэффициента вариации модельных образцов (табл. 1, 2). Прецизионность при определении титров рассчитывали на основании данных отклонения максимального и минимального титров каждого ПМО от рассчитанного медианного значения (табл. 3).
Таблица 1. Оценка прецизионности методики (скрининг-тест)
Table 1. Assessment of precision of the method (screening assay)
|
Параметр Parameter |
Образец / Sample |
||
|
ВПО / HPS |
СПО / MPS |
НПО / LPS |
|
|
Воспроизводимость / Intermediate precision |
|||
|
Kсреднее / Kmean |
29,1 |
10,2 |
1,6 |
|
CV, % |
9,4 |
8,3 |
8,1 |
|
Повторяемость / Repeatability |
|||
|
Kсреднее / Kmean |
33,0 |
10,8 |
1,6 |
|
CV, % |
4,0 |
11,0 |
9,5 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Kсреднее — среднее значение нормированного коэффициента К; CV — коэффициент вариации. Варианты модельных образцов: ВПО — высокоположительный; СПО — среднеположительный; НПО — низкоположительный.
Note. Kmean, average value of the normalized coefficient K; CV, coefficient of variation. Model sample types: HPS, highly positive sample; MPS, medium positive sample; LPS, low positive sample.
Таблица 2. Оценка прецизионности методики (подтверждающий тест)
Table 2. Assessment of precision of the method (confirmatory assay)
|
Параметр Parameter |
Образец / Sample |
||
|
ВПО / HPS |
СПО / MPS |
НПО / LPS |
|
|
Воспроизводимость / Intermediate precision |
|||
|
Исреднее, % / Imean, % |
94,0 |
90,4 |
53,5 |
|
CV, % |
0,5 |
0,8 |
8,8 |
|
Повторяемость / Repeatability |
|||
|
Исреднее, % / Imean, % |
94,5 |
90,9 |
51,8 |
|
CV, % |
0,2 |
0,9 |
5,8 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Исреднее — среднее значение уровня ингибирования (%) для соответствующего образца; CV — коэффициент вариации. Варианты модельных образцов: ВПО — высокоположительный; СПО — среднеположительный; НПО — низкоположительный.
Note. Imean, mean inhibition rate (%) for the respective sample; CV, coefficient of variation. Model sample types: HPS, highly positive sample; MPS, medium positive sample; LPS, low positive sample.
Таблица 3. Оценка прецизионности методики (определение титра* общих антилекарственных антител с использованием модельных образцов)
Table 3. Assessment of precision of the method (total anti-drug antibodies titer* determination using the model samples)
|
Параметр Parameter |
Образец / Sample |
||
|
ВПО / HPS |
СПО / MPS |
НПО / LPS |
|
|
Воспроизводимость / Intermediate precision |
|||
|
Минимальный титр Minimal titre |
1427 |
351 |
34 |
|
Максимальный титр Maximal titre |
2291 |
506 |
45 |
|
Референсный интервал титра Reference titre range |
725–4534 |
166–1039 |
15–92 |
|
Повторяемость / Repeatability |
|||
|
Минимальный титр Minimal titre |
1841 |
391 |
35 |
|
Максимальный титр Maximal titre |
2544 |
538 |
42 |
|
Референсный интервал титра Reference titre range |
970–3880 |
227–909 |
19–769 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Варианты модельных образцов: ВПО — высокоположительный; СПО — среднеположительный; НПО — низкоположительный. *, титр — максимальное разведение образца, при котором его оптическая плотность превышает предел исключения методики.
Note. Model sample types: HPS, highly positive sample; MPS, medium positive sample; LPS, low positive sample. *, titre is the maximal dilution of a sample, at which its optical density exceeds the cut-point.
Значения коэффициентов вариации при оценке прецизионности скрининг-теста и подтверждающего теста не превышали 11%. Максимальные и минимальные титры для каждого ПМО вошли в рассчитанные референсные интервалы (табл. 3). Таким образом, прецизионность разработанной методики была подтверждена.
Оценка предела обнаружения. Рассчитанный ПО скрининг-теста для определения общих АЛА составил 185 нг/мл.
Оценку устойчивости к присутствию в образцах растворимой мишени терапевтического белка проводили путем анализа образцов с внесением к исходно присутствующему в сыворотке крови нативному VEGF экзогенного hrVEGF165 до финальной концентрации 2000 пг/мл. Для всех испытанных МО значения коэффициента выявления R удовлетворяли установленным критериям приемлемости: для образцов, содержащих 2000 пг/мл hrVEGF165, значения R находились в диапазоне от 91,5 до 104,2%.
Оценка специфичности. В скрининг-тесте и при определении АЛА класса IgE для всех МО, содержащих неспецифические АЛА, были получены отрицательные результаты (значения ОП образцов были ниже значений соответствующих ПИМ). В подтверждающем тесте для всех МО, содержащих неспецифические антигены, были получены отрицательные результаты (уровень ингибирования ниже ПИМ).
Оценка эффекта матрицы. При анализе 13 модельных образцов, содержащих АЛА в концентрации 280 нг/мл, был зарегистрирован положительный результат в скрининг-тесте и подтверждающем тесте (значения ОП и уровень ингибирования выше соответствующих ПИМ). Таким образом, эффект матрицы отсутствовал.
Оценка стабильности. Для подтверждения стабильности МО проводили сравнительный анализ результатов измерения ОП свежеприготовленных ПМО и НМО и после их хранения (табл. 4).
Таблица 4. Оценка стабильности модельных образцов при разных условиях хранения
Table 4. Assessment of stability of model samples on different storage conditions
|
Эксперимент Experiment |
Параметр Parameter |
Образцы / Samples |
|||
|
ВПО / HPS |
СПО / MPS |
НПО / LPS |
НМО / NMS |
||
|
Стабильность при краткосрочном хранении Short-term stability |
Свежеприготовленные образцы / Freshly prepared samples |
||||
|
OП / OD |
1,737 |
0,562 |
0,107 |
0,056 |
|
|
R, % |
– |
– |
– |
– |
|
|
Хранение в холодильной камере в течение 16 ч при 5±3 °C / Refrigerated for 16 hours at 5±3 °C |
|||||
|
OП / OD |
1,732 |
0,564 |
0,100 |
0,054 |
|
|
R, % |
100 |
101 |
93 |
96 |
|
|
Хранение при комнатной температуре в течение 16 ч / Storage at room temperature for 16 hours |
|||||
|
OП / OD |
1,908 |
0,598 |
0,104 |
0,055 |
|
|
R, % |
110 |
107 |
97 |
98 |
|
|
После замораживания/размораживания / After freeze-thaw |
|||||
|
OП / OD |
1,795 |
0,548 |
0,104 |
0,055 |
|
|
R, % |
103 |
98 |
98 |
98 |
|
|
Стабильность при долгосрочном хранении Long-term stability |
Свежеприготовленные образцы / Freshly prepared samples |
||||
|
OП / OD |
2,165 |
0,730 |
0,114 |
0,057 |
|
|
R, % |
– |
– |
– |
– |
|
|
После долгосрочного хранения / After long-term storage |
|||||
|
OП / OD |
2,165 |
0,624 |
0,096 |
0,056 |
|
|
R, % |
83 |
86 |
83 |
97 |
|
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. OП — среднее значение оптической плотности; R — коэффициент выявления; «–» — не применимо. Варианты модельных образцов: ВПО — высокоположительный образец; СПО — среднеположительный образец; НПО — низкоположительный образец; НМО — негативный модельный образец.
Note. OD, mean optical density; R, detection coefficient; –, not applicable. Model sample variants: HPS, highly positive sample; MPS, medium positive sample; LPS, low positive sample; NMS, negative model sample.
Значения коэффициента выявления R при оценке стабильности МО составляли от 83 до 103%. Таким образом, поскольку полученные значения R удовлетворяли установленным критериям приемлемости, стабильность МО при заданных условиях хранения была подтверждена.
Оценка устойчивости к замене ключевого компонента. Показано, что установленные значения титров ПМО, полученные при использовании GNR-098 и оригинального препарата, входили в допустимый диапазон, рассчитанный при оценке воспроизводимости определения титров. Устойчивость разработанной методики к замене ключевого компонента была подтверждена для всех исследованных МО.
Оценка эффекта сверхдозы. При анализе образцов, содержащих АЛА в пятикратно превышающей ВПК концентрации, не было получено ложноотрицательных результатов в скрининг-тесте и подтверждающем тесте. Таким образом, эффект сверхдозы не был обнаружен.
Сравнение разработанной методики определения антилекарственных антител с коммерческими наборами
В коммерческих ИФА тест-системах, предназначенных для выявления антител к афлиберцепту (например, производства Bio-Rad, Abcam и др.), используются в качестве ПМО моноклональные антитела с одинаковой для всех клонов специфичностью и авидностью. Однако МО с добавленными в них моноклональными антителами не являются релевантной моделью для воспроизведения полученных от пациентов положительных по наличию антител к афлиберцепту образцов, поскольку последние содержат уникальные и различные по клональности, авидности, изотипическому составу и нейтрализующей активности комбинации антител.
Предлагаемая авторами комплексная аналитическая методика позволяет решить данную проблему за счет использования поликлональных антител и включает четыре теста для обнаружения и поэтапной характеристики оАЛА: скрининг-тест, подтверждающий тест, определение титра оАЛА и принадлежности их к классу IgE. Разработанная методика позволит провести оценку иммуногенности афлиберцепта.
Важным аспектом оценки иммуногенности представляется определение содержания фракции нейтрализующих антител в составе оАЛА, поэтому в дальнейшем предполагается разработать дополнительную аналитическую методику для их детекции.
ВЫВОДЫ
- Разработана комплексная аналитическая методика для иммуноферментного обнаружения и поэтапной характеристики общих антилекарственных антител к афлиберцепту (препарат GNR-098) в образцах сыворотки крови человека, включающая скрининг-тест, подтверждающий тест, а также тест для определения титра АЛА и их принадлежности к классу IgE.
- Установленные валидационные характеристики удовлетворяли критериям приемлемости. Пределы исключения методик для скрининг-теста и теста определения АЛА класса IgE составили 1,3 и 1,2 соответственно; для подтверждающего теста — 15,2%. Значения коэффициентов вариации при оценке прецизионности не превышали 11%. Предел обнаружения скрининг-теста составил 185 нг/мл. Минимально необходимое разведение для испытуемых образцов — 1:5. Значения коэффициента выявления Rпри оценке устойчивости к присутствию 2000 пг/мл hrVEGF165 находились в диапазоне от 91,5 до 104,2%. При оценке специфичности методики в ходе анализа модельных образцов, содержащих неспецифические АЛА, были получены отрицательные результаты. Продемонстрировано отсутствие эффекта матрицы для всех модельных образцов, содержащих АЛА в концентрации 280 нг/мл. Значения коэффициента выявления R при оценке стабильности модельных образцов были в диапазоне от 83 до 103%. Значения титров положительных модельных образцов, полученные при использовании GNR-098 и оригинального препарата, входили в диапазон, рассчитанный при оценке воспроизводимости определения титров, что свидетельствует об устойчивости разработанной методики к замене ключевого компонента. Эффект сверхдозы не был обнаружен.
- Разработанная аналитическая система позволит провести оценку иммуногенности афлиберцепта (препарат GNR-098).
Дополнительная информация. На сайте журнала «БИОпрепараты. Профилактика, диагностика, лечение» размещены рисунок S1, таблица S1 и Приложение 1.
https://doi.org/10.30895/2221-996X-2025-631-fig-s1
https://doi.org/10.30895/2221-996X-2025-631-table-s1
https://doi.org/10.30895/2221-996X-2025-631-annex
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: И.В. Шевченко — концепция работы, проведение экспериментальных исследований, написание текста рукописи; А.Е. Лисова — критическое обсуждение текста рукописи; А.А. Агафонова, И.М. Алаева — проведение экспериментальных исследований; К.А. Смолова — выделение и очистка антител; И.Ю. Жуков — анализ данных литературы, редактирование текста рукописи; А.А. Казаров — статистическая обработка данных; И.В. Лягоскин — утверждение окончательной версии статьи для публикации.
Additional information. Figures S1, Table S1 and Supplement 1 are published on the website of Biological Products. Prevention, Diagnosis, Treatment.
https://doi.org/10.30895/2221-996X-2025-631-fig-s1
https://doi.org/10.30895/2221-996X-2025-631-table-s1
https://doi.org/10.30895/2221-996X-2025-631-annex
Authors’ contribution. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows: I.V. Shevchenko conceptualised the study, performed the experiments, drafted the manuscript. A.E. Lisova critically discussed the manuscript. A.A. Agafonova and I.M. Alaeva performed the experiments. K.A. Smolova extracted and purified antibodies. I.Yu. Zhukov analysed literature data and edited the manuscript. A.A. Kazarov performed statistical data processing. I.V. Lyagoskin approved the final version of the manuscript for publication.
1. https://investor.regeneron.com/news-releases/news-release-details/regeneron-reports-fourth-quarter-and-full-year-2023-financial/
2. https://www.ema.europa.eu/en/immunogenicity-assessment-biotechnology-derived-therapeutic-proteins-scientific-guideline
3. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/immunogenicity-testing-therapeutic-protein-products-developing-and-validating-assays-anti-drug
4. Методические рекомендации «Оценка иммуногенности биотерапевтических препаратов в странах ЕАЭС». ФГБУ «НЦЭСМП» Минздрава России; 2021.
5. https://www.ema.europa.eu/en/human-regulatory-overview/research-development/quality-design
6. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/immunogenicity-testing-therapeutic-protein-products-developing-and-validating-assays-anti-drug
7. https://www.proteinatlas.org/humanproteome/blood/proteins+detected+in+ms
8. https://iris.who.int/bitstream/handle/10665/44092/9789241597852_eng.pdf
9. European Convention for the protection of vertebrate animals used for experimental and other scientific purposes. ETS No.123. Strasbourg; 1986. https://norecopa.no/media/2iydns5h/ets-123-original.pdf
10. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/immunogenicity-testing-therapeutic-protein-products-developing-and-validating-assays-anti-drug
11. https://doi.org/10.30895/2221-996X-2025-631-fig-s1
12. https://www.graphpad.com/guides/prism/latest/statistics/stat_choosing_a_normality_test.htm
13. https://doi.org/10.30895/2221-996X-2025-631-table-s1
14. https://doi.org/10.30895/2221-996X-2025-631-annex
Список литературы
1. Veritti D, Sarao V, Gorni G, Lanzetta P. Anti-VEGF drugs dynamics: Relevance for clinical practice. Pharmaceutics. 2022;14(2):265. https://doi.org/10.3390/pharmaceutics14020265
2. Anguita R, Tasiopoulou A, Shahid S, Roth J, Sim SY, Patel PJ. A review of aflibercept treatment for macular disease. Ophthalmol Ther. 2021;10(3):413–28. https://doi.org/10.1007/s40123-021-00354-1
3. Sharma A, Kumar N, Parachuri N, Bandello F, Kuppermann BD. Immunogenicity: Clouding the future of intravitreal therapy. Ocul Immunol Inflamm. 2022;31(9):1746–9. https://doi.org10.1080/09273948.2022.2139273
4. Gyenes A, Istvan L, Benyo F, Papp A, Resch M, Sandor N, et al. Intraocular neutralizing antibodies against aflibercept in patients with age related macular degeneration. BMC Ophthalmol. 2023;23(1):14. https://doi.org/10.1186/s12886-022-02761-9
5. Fleckenstein M, Schmitz-Valckenberg S, Chakravarthy U. Age-related macular degeneration: A review. JAMA. 2024;331(2):147–47. https://doi.org/10.1001/jama.2023.26074
6. Harris C.T, Cohen, S. Reducing immunogenicity by design: Approaches to minimize immunogenicity of monoclonal antibodies. BioDrugs. 2024;38(3):205–26. https://doi.org/10.1007/s40259-023-00641-2
7. Koren E, Smith HW, Shores E, Shankar G, Finco-Kent D, Rup B, et al. Recommendations on risk-based strategies for detection and characterization of antibodies against biotechnology products. J Immunol Methods. 2008;333(1–2):1–9. https://doi.org/10.1016/j.jim.2008.01.001
8. Иванов Р, Секарева Г, Кравцова О, Кудлай Д, Лукьянов С, Тихонова И и др. Правила проведения исследований биоаналоговых лекарственных средств (биоаналогов). Фармакокинетика и фармакодинамика. 2014;(1):21–36. EDN: SYTXJB
9. Pineda C, Castaneda Hernandez G, Jacobs IA, Alvarez DF, Carini C. Assessing the immunogenicity of biopharmaceuticals. BioDrugs. 2016;30(3):195–206. https://doi.org/10.1007/s40259-016-0174-5
10. Shankar G, Devanarayan V, Amaravadi L, Barrett YC, Bowsher R, Finco-Kent D, et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. J Pharm Biomed Anal. 2008;48(5):1267–81. https://doi.org/10.1016/j.jpba.2008.09.020
11. Carter PJ, Rajpal A. Designing antibodies as therapeutics. Cell. 2022;185(15):2789–805. https://doi.org/10.1016/j.cell.2022.05.029
Об авторах
И. В. ШевченкоРоссия
Шевченко Иван Вячеславович, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
А. Е. Лисова
Россия
Лисова Алена Евгеньевна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
А. А. Агафонова
Россия
Агафонова Алена Алексеевна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
К. А. Смолова
Россия
Смолова Ксения Александровна, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
И. М. Алаева
Россия
Алаева Ирина Михайловна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
И. Ю. Жуков
Россия
Жуков Иван Юрьевич, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
А. А. Казаров
Россия
Казаров Александр Александрович
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
И. В. Лягоскин
Россия
Лягоскин Иван Владимирович, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Дополнительные файлы

|
1. Рис. S1. Оценка нормальности распределения аналитических данных для расчета пределов исключения методик. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(362KB)
|
Метаданные ▾ | |

|
2. Таблица S1. Оценка буферных растворов с определением отношения сигналов (ОП) испытуемых и негативных модельных образцов (НМО) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(115KB)
|
Метаданные ▾ | |

|
3. Приложение 1 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(159KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Шевченко И.В., Лисова А.Е., Агафонова А.А., Смолова К.А., Алаева И.М., Жуков И.Ю., Казаров А.А., Лягоскин И.В. Определение антилекарственных антител к афлиберцепту методом иммуноферментного анализа: разработка и валидация методики. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(3):284-295. https://doi.org/10.30895/2221-996X-2025-631
For citation:
Shevchenko I.V., Lisova A.E., Agafonova A.A., Smolova K.A., Alaeva I.M., Zhukov I.Yu., Kazarov A.A., Lyagoskin I.V. Detection of anti-drug antibodies to aflibercept by enzyme-linked immunosorbent assay: Development and validation of the method. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(3):284-295. (In Russ.) https://doi.org/10.30895/2221-996X-2025-631
JATS XML



































