Перейти к:
Применение принципов 3Rs для оценки качества АКДС-вакцины: преимущества и недостатки
https://doi.org/10.30895/2221-996X-2025-25-2-156-169
Резюме
ВВЕДЕНИЕ. Для определения специфической активности дифтерийного и столбнячного анатоксинов в составе АКДС-вакцин крупные мировые производители, следуя принципам 3Rs (замена, уменьшение, усовершенствование), активно применяют современные альтернативные методы in vivo и in vitro. На сегодняшний день некоторые альтернативные методы полностью заменили методы in vivo. В Российской Федерации принципы 3Rs для оценки качества АКДС-вакцины практически не применяются. Процесс гармонизации Государственной фармакопеи Российской Федерации с требованиями региональной фармакопеи Евразийского экономического союза (ЕАЭС) обусловливает необходимость проведения анализа современных методов контроля качества АКДС-вакцин.
ЦЕЛЬ. Провести сравнительный анализ современных методов определения специфической активности компонентов АКДС-вакцины, оценить их преимущества и недостатки, выявить проблемные вопросы гармонизации методов в рамках ЕАЭС.
ОБСУЖДЕНИЕ. В Европейском союзе принципы 3Rs являются неотъемлемой частью законодательства. Благодаря исследованиям под эгидой ВОЗ и Европейского директората по качеству лекарственных средств и здравоохранения (EDQM) в некоторых тестах удалось полностью отказаться от использования лабораторных животных или заменить их на более гуманные, облегчающие страдания животных. Альтернативные серологические методы для контроля качества АКДС-вакцины считают щадящими, но они не исключают использование животных, которых иммунизируют для последующего получения образцов крови. Для постановки альтернативных методов определения специфической активности дифтерийного и столбнячного анатоксинов требуются дополнительные материалы, реактивы, стандартные образцы, специальное оборудование и статистическое программное обеспечение. Методы многоэтапны, требуют вовлечения большего числа специалистов. Альтернативный серологический метод на основе ИФА обладает определенным преимуществом перед методом летального заражения. В нем исключено использование токсинов и доступно определение содержания сразу двух видов защитных антител в образцах сыворотки крови, полученных от одного животного.
ЗАКЛЮЧЕНИЕ. Несмотря на активное развитие и внедрение методов контроля качества вакцин in vitro, для дифтерийного и столбнячного компонентов АКДС-вакцины методы летального заражения более экономичны, просты в исполнении и позволяют оценить прямое протективное действие вакцины. Из альтернативных методов для контроля качества АКДС-вакцины наиболее перспективным является метод на основе иммуноферментного анализа.
Ключевые слова
Для цитирования:
Комаровская Е.И., Проскурина О.В. Применение принципов 3Rs для оценки качества АКДС-вакцины: преимущества и недостатки. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):156-169. https://doi.org/10.30895/2221-996X-2025-25-2-156-169
For citation:
Komarovskaya E.I., Proskurina O.V. Application of 3Rs principles to assess the quality of DPT vaccine: Advantages and disadvantages. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):156-169. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-2-156-169
ВВЕДЕНИЕ
АКДС-вакцина является одной из важнейших вакцин национальных календарей всех стран мира. Применение АКДС-вакцины позволило значительно снизить заболеваемость и связанную с ней смертность при реализации программ плановой иммунизации. Специфическая активность и безопасность — одни из основных показателей качества вакцины, и для их контроля требуется использование лабораторных животных на каждой стадии производства вакцины.
На момент разработки и регистрации АКДС-вакцины методы исследования на животных (далее — методы in vivo) были самыми передовыми. С 1959 г., когда впервые были выдвинуты принципы 3Rs (replacement, reduction and refinement of animal assays — замена, уменьшение, усовершенствование), ученые начали поиски новых методов контроля качества вакцин с целью замены и уменьшения количества лабораторных животных, используемых в различных испытаниях. Методы in vivo применяли на всех стадиях производства вакцины, и их замена альтернативными методами оказалась сложной задачей [1–4]. Производители вакцин в 1970-х годах, следуя принципам 3Rs, начали поиск методов in vitro, которые могли бы стать надежной альтернативой традиционным методам in vivo для оценки безопасности и специфической активности компонентов АКДС-вакцины.
С начала 90-х годов прошлого столетия в практику контроля показателей качества иммунобиологических препаратов начали постепенно внедрять альтернативные серологические методы. Однако не все производители вакцин и регуляторные органы оказались готовы к переходу от методов in vivo к методам in vitro. В июле 2021 г. Национальный центр Великобритании1 по замене, усовершенствованию и сокращению использования животных в исследованиях (NC3Rs) по поручению Всемирной организации здравоохранения (ВОЗ) провел опрос производителей с целью проанализировать, в какой степени методы in vivo описаны в руководствах и рекомендациях по производству и контролю качества вакцин и биотерапевтических препаратов. Большинство участников (66%) ответили, что на производстве применяют только методы in vivo, поскольку результаты этих исследований принимают все региональные регуляторные органы [5].
Основными препятствиями были и остаются различия нормативных требований в разных странах, а также большая осторожность производителей вакцин и регуляторных органов в отношении изменения методов оценки качества иммунобиологических препаратов и вакцин [6]. Проблемы, связанные с разработкой и внедрением альтернативных методов, обусловлены необходимостью продемонстрировать сопоставимость результатов нового и утвержденного (in vivo) методов и валидировать альтернативный метод в соответствии с требованиями Международного совета по гармонизации ICH Q2(R1)2.
В Европейском союзе (ЕС) следование принципам 3Rs является юридическим требованием. В отношении АКДС-вакцины внесен ряд изменений, которые отражены в Европейской фармакопее (ЕФ), включая возможность совмещения тестов на реверсию токсичности и специфическую безопасность на культуре клеток Vero при оценке качества дифтерийного анатоксина (ДА). Для столбнячного анатоксина (СА) исключены испытания на реверсию токсичности, теста на аномальную токсичность и специфическую безопасность в готовой форме препарата. Для оценки специфической активности вакцин разрешены альтернативные серологические методы3.
Отсутствие всемирно гармонизированных нормативных требований с альтернативными методами является одной из основных причин, по которой вакцинная промышленность не смогла полностью внедрить описанные в ЕФ альтернативные испытания [7].
Российская Федерация в последние годы участвует в работе по созданию единых подходов к оценке качества вакцинных препаратов в странах — членах Евразийского экономического союза (ЕАЭС). Одним из основных условий данной работы является гармонизация нормативных требований ЕАЭС с рекомендациями ЕФ.
Цель работы — провести сравнительный анализ современных методов определения специфической активности компонентов АКДС-вакцины, оценить их преимущества и недостатки, выявить проблемные вопросы гармонизации методов в рамках ЕАЭС.
ОСНОВНАЯ ЧАСТЬ
Общие сведения о принципах 3Rs
Принципы 3Rs впервые определены У. Расселом и Р. Берчем в книге «Принципы гуманной экспериментальной техники» более 50 лет назад [2][3]. Принципы были представлены в качестве основы для будущих разработок, и авторы сформулировали ее как «The 3Rs» (3Rs): replacement (замена), reduction (уменьшение), refinement (усовершенствование).
Принципы 3Rs были выдвинуты не только для того, чтобы помочь исследователям в поиске и использовании доступных методов, но и для поощрения разработки новых. Идеи Рассела и Берча вызвали огромный интерес в научном сообществе и стимулировали ученых и производителей к поиску новых методов оценки качества лекарственных препаратов. Термины «замена», «уменьшение» и «усовершенствование» впоследствии стали известны как «альтернативы» или «альтернативные методы» для сведения к минимуму боли и стресса у животных при проведении биомедицинских исследований [2][3]. Рассел и Берч употребляли также термин «дистресс». Современное понятие «дистресс» имеет много определений. Большинство из них характеризуют дистресс как аверсивное состояние, при котором животное не способно полностью адаптироваться к стрессорам и демонстрирует неадаптивное поведение4.
Сформулированные Расселом и Берчем 3Rs лежат в основе современных правил5 использования животных и помогают найти ученым альтернативные методы исследования, основные принципы которых направлены на:
- замену — подразумевает полное или частичное исключение или замену животных в исследовательских целях. Полная замена исключает использование любых животных; частичная замена подразумевает использование некоторых видов животных, которые, основываясь на современном научном мышлении, не считаются способными испытывать страдания;
- сокращение — относится к методам, которые минимизируют количество животных, используемых в эксперименте, в соответствии с научными целями;
- усовершенствование — относится к методам, которые сводят к минимуму боль, страдания или длительный вред, причиняемый исследуемым животным, и которые улучшают их благополучие.
В настоящее время принципы 3Rs являются неотъемлемой частью законодательства во многих странах мира.
Реализация принципов 3Rs для иммунобиологических препаратов в Европейской фармакопее
В ЕС принципы 3Rs сформулированы в Директиве ЕС 2010/63/EU, что делает их реализацию юридическим требованием6. Во многих странах ЕС принципы 3Rs включены в национальное законодательство и положения об использовании животных в научных процедурах, а также в политику организаций, которые финансируют или проводят исследования на животных. Следует отметить, что некоторые крупнейшие производители вакцин ставят своей целью на ближайшее десятилетие полностью отказаться от тестов на животных7.
Европейский директорат по качеству лекарственных средств и здравоохранения (European Directorate for the Quality of Medicines, EDQM) осуществляет работу по координации коллаборативных исследований, направленных на реализацию концепции 3Rs: совместная работа по Программе биологической стандартизации, совместная деятельность Совета Европы и Комиссии Европейского союза8.
Эксперты ЕФ применяют одну из стратегий по реализации принципов 3Rs в разработке и внедрении фармакопейных монографий в отношении усовершенствования методов, которая заключается в использовании «гуманных конечных точек» (ГКТ) в испытаниях вакцинных препаратов. Подход к определению ГКТ основан на прекращении боли, при этом страдание экспериментального животного сведено к минимуму или уменьшено с помощью гуманной эвтаназии, прекращения болезненной процедуры или лечения для облегчения боли и/или дистресса9.
Чтобы установить ГКТ при тестировании эффективности вакцины, необходимо определить параметры, по которым можно предсказать смертельные исходы или тяжелые клинические проявления, связанные с выполнением теста. Как правило, используются два типа ГКТ, которые основаны на клинических проявлениях теста и патофизиологических параметрах (маркеры процесса), таких как масса и температура тела [8][9]. В частности, при определении специфической активности вакцины против столбняка в качестве ГКТ служит такая степень столбнячной интоксикации, при которой животное еще активное, но следующая стадия принесет сильные страдания и смерть (табл. 1). По международной классификации это стадия Т3 — паралич конечности, которая уже не может функционировать. Для стадии Т3 характерны тяжелые клинические проявления столбняка, поэтому гуманная эвтаназия на этом этапе уменьшит боль и страдания животного без ущерба для результатов испытания.
Таблица 1. Клинические проявления столбнячной интоксикации у лабораторных животных (мыши и морские свинки)
Table 1. Clinical signs of tetanus intoxication of laboratory animals (mice and guinea pigs)
Стадия Stage | Клинические проявления Clinical signs |
Т1 | Небольшая ригидность конечности, которую трудно заметить Slight stiffness of one limb, which is difficult observable |
Т2 | Парез конечности, которая еще может функционировать Paresis of one limb, which can still function |
Т3 | Паралич одной конечности. Животное двигается неохотно, тело из-за сколиоза часто имеет слегка бананообразную форму Paralysis of one limb. An animal moves reluctantly, the body is often slightly banana-shaped owing to scoliosis |
Т4 | Конечность полностью ригидна, пальцы неподвижны. Мышечное сокращение конечности очень выражено, и обычно наблюдается сколиоз The limb is completely stiff and the toes are immovable. The muscular contraction of the forelimb is very pronounced and usually scoliosis is observable |
Т5 | Столбнячные судороги, продолжительный тонический спазм мышц Tetanus seizures, continuous tonic spasm of muscles |
+ | Смерть / Death |
Таблица составлена авторами по данным монографии 2.7.8. версия 01/2008:20708 Европейской фармакопеи12 / The table is prepared by the authors using general chapter 2.7.8 version 01/2008:20708 European Pharmacopoeia
В качестве примера полного отказа от использования животных в экспериментальных целях можно привести метод определения специфической активности препаратов ботулинического токсина типа А для медицинского применения на культуре клеток. Традиционно это тестирование проводилось на мышах при помощи метода количественного определения показателя LD50 (количество препарата, вызывающее гибель 50% мышей при внутрибрюшинном введении), который принят в качестве «золотого стандарта». Учеными из Национального института биологических стандартов и контроля (The National Institute for Biological Standards and Control, NIBSC)10 был разработан метод определения специфической активности на культуре клеток (сell based potency assay, CBPA). Метод CBPA полностью заменил использование животных для оценки качества специфической активности препаратов ботулинического токсина типа А для медицинского применения в странах ЕС и США. В CBPA используется клеточная культура, которая высоко чувствительна к воздействию малых доз ботулинического нейротоксина (4–9 нг/флакон). Зачастую каждая компания-производитель самостоятельно подбирает и/или выращивает клеточную культуру под свой продукт. Это значимо увеличивает стоимость анализа и ограничивает воспроизводимость метода. В настоящее время, несмотря на активное внедрение в производственную практику методов in vitro, замены метода количественного определения показателя LD50 на мышах пока не произошло. Метод «золотого стандарта» не исключен из ЕФ11, и любой альтернативный метод in vitro должен быть валидирован относительно него.
Следующим образцом отказа от использования животных в экспериментальных целях служит тест на аномальную токсичность, который был признан широким кругом исследователей устаревшим и неспецифичным методом в отношении некоторых препаратов (вакцины, иммунные сыворотки, биотерапевтические средства, аллергены и др.). Экспертный комитет ВОЗ по биологической стандартизации (Expert Committee on Biological Standardisation, ECBS) и ЕФ, Управление по контролю за качеством продуктов питания и лекарственных средств США (Food and Drug Administration, FDA) и многие другие регуляторные органы исключили данный тест из своих требований в 2018 г.13 [10]. Однако, несмотря на это, результаты теста на аномальную токсичность по-прежнему запрашиваются регуляторными органами многих стран и/или тест используется производителями. Согласно проведенному опросу 80% респондентов осведомлены, что ВОЗ отменила требование проводить тест на аномальную токсичность, вместе с тем 57% от общего числа опрошенных по-прежнему проводят его. По мнению специалистов ВОЗ и NC3Rs такая ситуация связана с тем, что многие производители реализуют свою продукцию в нескольких регионах, где необходимо проведение данного теста в соответствии с требованиями национального законодательства [5].
Применение принципов 3Rs для оценки качества вакцины от полиомиелита является еще одним успешным примером. В течение многих лет в испытаниях вакцины на нейровирулентность использовали макак и мартышек как единственных животных, которые восприимчивы к вирусу полиомиелита. В 90-х годах прошлого столетия была выведена трансгенная мышь, чувствительная к этому вирусу14 [11][12]. Специалистами NIBSC, ВОЗ и другими регуляторными лабораториями были проведены испытания, подтвердившие, что этот тип мышей может быть использован для тестирования вакцин от полиомиелита. Эти исследования в конечном итоге привели к утверждению нового метода испытания вакцины на нейровирулентность на мышах15 [13–15].
Замена методов оценки специфической активности ДА и СА в тестах на животных серологическими методами является продолжением концепции 3Rs, чему уделяется большое внимание во всем мире16. Например, в Институте сывороток Индии (Serum Institute of India) для оценки специфической активности АКДС-вакцины традиционный метод летального заражения на морских свинках/мышах был заменен методами оценки специфической активности ДА на культуре клеток Vero и СА — методом иммуноферментного анализа (ИФА), которые были разработаны в течение трех лет. Это позволило сократить количество используемых в лабораторных исследованиях морских свинок на 85% (с 232 до 30)17 [4].
Эксперты ECBS, ЕФ, FDA поддерживают замену теста по определению пирогенности на кроликах на ЛАЛ-тест (реакция лизата амебоцитов с эндотоксином)18 для идентификации бактериального эндотоксина.
EDQM активно развивает программы19 по замене и усовершенствованию методов in vivo [16]. В период с 2016 по 2022 гг. был организован проект VAC2VAC (Vaccine batch to vaccine batch comparison by consistency testing)20. Целью проекта являлась разработка методов in vitro для исследования вакцин, создание процедур и нормативной базы для взаимного принятия вакцин, оценка и оптимизация методов оценки качества вакцин для рутинного контроля. Одно из направлений проекта VAC2VAC было посвящено разработке клеточного метода определения пирогенов — тест активации моноцитов (МАТ), который заменяет не только тест на кроликах, но и ЛАЛ-тест. Метод МАТ позволяет определять все виды пирогенных примесей и обладает высокой чувствительностью (0,004 ЕЭ/мл, ЕЭ — единица эндотоксина) [17]. Эта работа убедила Комиссию ЕФ (The European Pharmacopoeia Commission, EPC) принять решение об исключении метода определения пирогенности на кроликах из монографий ЕФ. С 1 июля 2025 г. метод будет исключен из 57 монографий21.
Таким образом, EDQM поощряет применение методов, не связанных с использованием животных. Международное сотрудничество является ключевым элементом для внедрения принципов 3Rs в практику. Для успешного освоения новых методов необходимы не только взаимодействие между производителями и регуляторными органами, но также обмен стандартными процедурами и участие в многоцентровых валидационных исследованиях.
Применение принципов 3Rs в контексте оценки качества АКДС-вакцины
Дифтерийный и столбнячный анатоксины, а также вакцина от коклюша являются компонентами ряда вакцин календаря прививок. АКДС-вакцину производят с 1948 г. [18], а методы производства и контроля качества вакцины эволюционировали вместе с развитием науки и технологий. В настоящее время для контроля качества АКДС-вакцины в мире используются традиционные методы in vivo и альтернативные in vitro, которые применяются на разных стадиях производственного цикла при условии, что доказана чувствительность метода in vitro относительно метода in vivo для частного препарата. Альтернативный метод должен быть одобрен регуляторным органом.
В таблице 2 представлены результаты сравнительного анализа количества лабораторных животных, требуемых для контроля качества вакцины традиционными и современными альтернативными методами на различных стадиях производства.
Таблица 2. Показатели использования животных для контроля качества АКДС-вакцины традиционными и альтернативными методами на разных стадиях производственного цикла
Table 2. Animal utilization benchmarks for DTP vaccine quality control by traditional and alternative tests across different stages of manufacturing process
Показатель Specification | Количество животных / Number of animals | |
Традиционные методы in vivoа Traditional tests in vivoа | Альтернативные методыb Alternative tests | |
Инактивация токсинов (ДА и СА) и коклюшных микробных клеток Detoxification and purification of toxin (DT and TT), and Bordetella pertussis cells | ||
Специфическая безопасность (токсичность) ДА и СА Specific toxicity of DT and TT | ДА: 5 МС / DT: 5 GP СА: 5 МС / TT: 5GP | ДА: тест исключен; cовмещен с тестом на реверсию токсичности на клетках Vero / DT: test is excluded; it is combined with toxicity reversion Vero cell-based assay СА: 5 МС / TT: 5 GP |
Реверсия токсичности ДА и СА Absence of toxin and irreversibility of toxoid DT and TT | ДА: 1–2 МС или 1 кролик DT: 1–2 GP or 1 rabbit СА: 5 МС / TT: 5 GP | ДА: на клетках Vero (совмещен с тестом на специфическую безопасность) / DT: Vero cell-based assay (it is combined with specific toxicity test) СА: тест исключен / TT: test is excluded |
Специфическая безопасность Коклwс, аc Specific toxicity of pertussis vaccinewс, аc | Тест на увеличение массы тела: 20 мышейwс; или тест на термолабильный токсин (дермонекротический токсин)wс, аc: 3 мыши-сосунки или 2 кролика; гистамин-сенсибилизирующий факторwс (20 мышей) Mouse weight-gain test: 20 mice; or heat-labile toxin (dermonecrotic toxin)wс, аc: 3 suckling mice or 2 rabbits; histamine sensitizing activitywс (20 mice) | Кокл* / Pertussis vaccine* Определение активности коклюшного токсина на клетках CHOаc Determination of active pertussis toxin by utilizing CHO cell clustering assayаc |
Суммарное количество используемых животных Total number of animals used | 16–18 МС, 1–3 кролика, 43 мыши 16–18 GP, 1–3 rabbits, 43 mice | 5 МС / 5 GP |
Получение адсорбированных компонентов вакцины (до розлива) / Control of final bulk (before filling) | ||
Специфическая безопасность (ДА, СА, Коклwс, аc) Specific toxicity (DT, TT, Pvwс, аc) | ДА: 5 МС / DT: 5 GP; СА: 5 МС / TT: 5 GP Кокл: тест на увеличение массы тела: 20 мышейwс; тест на термолабильный токсин (дермонекротический токсин)wс, аc: 3 мыши-сосунки или 2 кролика, или гистамин-сенсибилизирующий факторwс (20 мышей) Pv: mouse weight-gain testwс (20 mice); heat-labile toxinwс, аc (dermonecrotic toxin): 3 suckling mice or 2 rabbits;or histamine sensitizing activitywс (20 mice) | ДА: тест исключен / DT: test is excluded СА: тест исключен / TT: test is excluded Кокл* / Pv* |
Специфическая активность (ДА, СА, Коклwс, аc) Potency (DT, TT, P wс, аc) | ДА: 64–75 МС / DT: 64–75 GP СА: 64–112 мышей или 76 МС TT: 64–112 mice or 76 GP Кокл wс: 210–260 мышей (метод Кендрик) Pv wс: 210–260 mice (Kendrick test) | ДА: 64–75 МС / DT: 64–75 GP СА: 64–112 мышей или 76 МС TT: 64–112 mice or 76 GP Кокл*, 30–100 мышей аc (ИФА) Pv*, 30–100 miceаc (ELISA) |
Суммарное количество используемых животных Total number of animals used | 150–161 МС, 317–415 мышей, 2 кролика (опционально) 150–161 GP, 317–415 mice, 2 rabbits (optional) | 64–151 МС, 94–212 мышей 64–151 GP, 94–212 mice |
Контрольные испытания готового продукта (после розлива) / Control of final product (after filling) | ||
Специфическая безопасность (ДА, СА, Кокл wс) Specific toxicity (DT, TT, Pv wс) Аномальная токсичность (ДА, СА) Abnormal toxicity (DT, TT) | ДА, СА: 5 МС, Коклwс: 20 мышей DT, TT: 5 GP, Pv wс: 20 mice ДА, СА: 2 МС, 5 мышей / DT, TT: 2 GP, 5 mice | Кокл* / Pv* Тесты исключены для всех компонентов вакцины Tests are excluded for all components of vaccine |
Специфическая активность (ДА, СА, Кокл) Potency (DT, TT, Pv) | ДА: 64–75 МС / DT: 64–75 GP СА: 64–112 мышей или 76 МС TT: 64–112 mice or 76 GP Кокл wс: 200–250 мышей Pv wс: 200–250 mice | ДА: 20–75 МС, СА: 64–112 мышей или 20–116 МС, Кокл*, 30–100 мышейаc (ИФА) DT: 20–75 GP, TT: 64–112 mice or 20–116 GP, Pv*: 30–100 miceаc (ELISA) |
Суммарное количество используемых животных Total number of animals used | 71–158 МС, 299–397 мышей 71–158 GP, 299–397 mice | 40–191 МС, 94–212 мышей 40–191 GP, 91–112 mice |
Суммарное количество используемых животных (включая все стадии производства вакцины) Total number of animals used (included all manufacturing stages) | 237–337 МС, 659–855 мышей, 3 кролика 237–337 GP, 659–855 mice, 3 rabbits | 104–324 МС, 188–424 мышей 104–324 GP, 188–424 mice |
Таблица составлена авторами с использованием источниковa, b / The table is prepared by the authors using data from the sourcesa, b
Примечание. ДА — дифтерийный анатоксин; СА — столбнячный анатоксин; Кокл — коклюшный компонент; ЕФ — Европейская фармакопея; МС — морские свинки; ИФА — иммуноферментный анализ, * — не применимо для цельноклеточной коклюшной вакцины; Коклwc — для цельноклеточной коклюшной вакцины; Коклаc — для бесклеточной (ацеллюлярной) коклюшной вакцины.
Note. DT, diphtheria toxoid; TT, tetanus toxoid; Pv, pertussis vaccine; EF, European Pharmacopoeia; GP, guinea pig; ELISA, enzyme-linked immunosorbent assay; *, not applicable for whole cell pertussis vaccine; Pvwc, for whole cell pertussis vaccine; Pvac, for acellular pertussis vaccine.
а WHO Expert Committee on Biological Standardization. Technical Report Series. 17th report: WHO TRS No. 800. WHO; 1990.
b Manual for Quality Control of Diphtheria, Tetanus and Pertussis Vaccines, Diphtheria and Tetanus vaccine (adsorbed), version 01/2021:0444. Ph. Eur. 11th ed. Strasbourg, France: Council of Europe; 2013.
Традиционными методами оценки специфической безопасности и реверсии токсичности (полнота инактивации токсина) ДА являются кожные тесты. Основанием для замены теста на специфическую безопасность послужили результаты исследования, которые доказали, что чувствительность культуры клеток Vero к дифтерийному токсину выше, чем у животных. Пределы обнаружения токсина in vitro зависят от применяемой методики и находятся в диапазоне от 10 до 100 пг/мл, что на порядок выше предела обнаружения метода in vivo [19]. Поскольку для определения реверсии токсичности должны применяться высокочувствительные методы, позволяющие обнаруживать очень малые количества токсина, то оба теста объединили.
Тест на реверсию токсичности СА был исключен. Это решение было основано на данных о стабильности СА. За долгую мировую практику производства ни разу не было зафиксировано реверсии токсичных свойств.
После сорбции ДА и СА на адъювант (гель алюминия) испытания на специфическую безопасность считаются избыточными, поэтому они были исключены как на данной стадии производства, так и в готовом продукте.
Эксперты EDQM инициировали исследования по оценке альтернативного серологического испытания цельноклеточного коклюшного компонента с целью замены метода определения специфической активности in vivo. Используемый метод основан на интрацеребральном введении летальных доз тест-штамма Bordetella pertussis (метод Кендрик). Исследования были прекращены22, так как анализ полученных результатов не продемонстрировал достаточной точности и воспроизводимости.
Для контроля качества бесклеточных коклюшных вакцин23 на стадии получения антигенов и их сорбции на адъювант применяются в основном иммунохимические методы (ракетный электрофорез, радиальная иммунодиффузия), ЛАЛ-тест и высокоэффективная жидкостная хроматография. Для оценки остаточных количеств коклюшного токсина и реверсии токсичности коклюшного анатоксина (в таблице 2 обозначен как тест на специфическую безопасность) был применен тест на гистамин-сенсибилизирующий фактор. С 2020 г. он был заменен24 на тест in vitro с использованием культуры клеток СНО25 (CHO cell clustering assay). В готовой вакцине контроль специфической безопасности не предусмотрен.
Специфическую активность каждого компонента вакцины контролируют на нескольких стадиях производственного цикла: до розлива, на стадии готового продукта после розлива, а также при лицензировании/выпуске серии вакцины. Комитетом экспертов ВОЗ по стандартизации биологических препаратов установлены требования к показателю специфической активности этих анатоксинов в прививочной дозе (0,5 мл): ≥30 МЕ для ДА, ≥40 МЕ (в тесте на мышах 60 МЕ) для СА26 и 4 МЕ — для цельноклеточного коклюшного компонента27. Для бесклеточных коклюшных компонентов международных норм не установлено, специфическую активность оценивают методом ИФА.
Большее количество животных (табл. 2) требуется для испытаний традиционными методами in vivo. Для оценки безопасности и токсичности компонентов вакцины внедрение альтернативных методов позволило практически полностью сократить количество животных в эксперименте. Для определения специфической активности ДА и СА количество животных не стало меньше: от 64 до 75 морских свинок (ДА) и 64–112 мышей или 76 морских свинок (СА). Количество и вид животных зависят от методики оценки, принятой в стране-производителе вакцины. Несмотря на активное внедрение альтернативных методов для определения специфической активности в практику производителей, значительного сокращения количества животных в эксперименте не достигнуто. Поскольку основным принципом применения концепции 3Rs является снижение страданий животных, а именно использование ГКТ, некоторые производители сократили количество используемых животных на стадии готового продукта путем применения метода однодозовых разведений для оценки специфической активности ДА и СА. Существенно сократить количество экспериментальных животных удалось в случае производства вакцины, содержащей бесклеточный коклюшный компонент: при помощи метода ИФА в образцах сыворотки крови мышей определяют титр антител к каждому антигену, присутствующему в вакцине.
Таким образом, большее количество животных необходимо для оценки специфической активности. Поэтому практический интерес для исследователей представляет анализ основных различий между альтернативными методами и традиционными методами «золотого стандарта». Далее будут проанализированы методы оценки специфической активности дифтерийного и столбнячного анатоксинов в АКДС-вакцине.
Оценка специфической активности дифтерийного и столбнячного анатоксинов
Специфическую активность ДА и СА в вакцинах определяют путем сравнения с соответствующей референс-вакциной, откалиброванной по международному стандарту. Методы, которые применяют для контроля качества вакцины, можно разделить на две группы28: методы с введением токсинов животным и серологические методы с определением титра специфических антител (рис. 1).
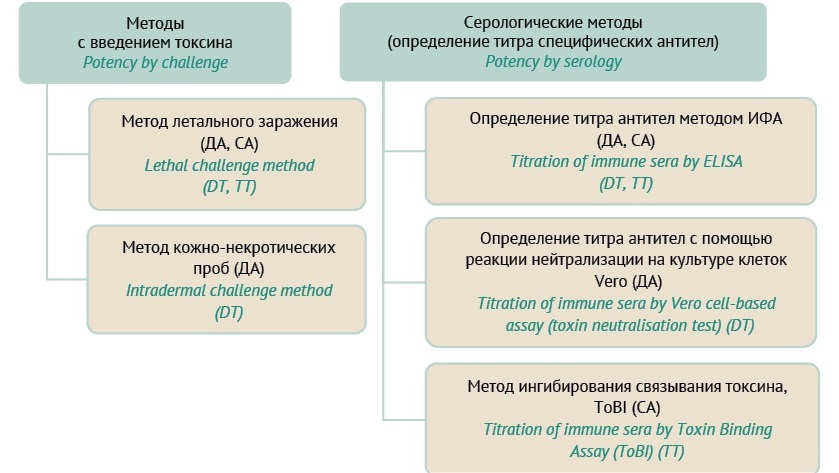
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Методы определения специфической активности дифтерийного и столбнячного анатоксинов.
Fig 1. Tests for diphtheria and tetanus toxoids (adsorbed) potency assessment.
Примечание. ДА — дифтерийный анатоксин; СА — столбнячный анатоксин; ИФА — иммуноферментный анализ; ToBI — метод ингибирования связывания токсина.
Note. DT, diphtheria toxoid; TT, tetanus toxoid; ELISA, enzyme linked immunosorbent assay; ToBI, toxin binding assay.
Каждый метод включает в себя два этапа: иммунизация, затем либо введение провокационных доз токсина, либо забор крови у животного для последующего определения уровня антител. Поскольку методы летального заражения являются «золотым стандартом» то все альтернативные методы должны быть валидированы относительно них29. Для подтверждения корреляции показателей иммунного ответа (специфическая активность), определяемых по выживаемости при летальном заражении животных, и результатами серологических методов требуется параллельное изучение иммунного ответа двумя способами. При этом необходимо отметить, что требования к количественному значению показателя иммунного ответа, определяемого серологическим методом, не установлены.
Методами летального заражения специфическую активность СА и ДА определяют по их способности защищать иммунизированных животных от заражения соответствующим токсином и выражают в количестве Международных единиц (МЕ) активности, содержащихся в 1 мл или в прививочной дозе (0,5 мл).
Метод кожно-некротических проб, несмотря на введение токсина морским свинкам, считается соответствующим принципам 3Rs, поскольку животные не гибнут от дифтерийной интоксикации. В данном методе появление эритемы или некроза после внутрикожного введения токсина служит в качестве ГКТ, что минимизирует страдания животных. В ФГБУ «НЦЭСМП» Минздрава России проводили работы по валидации метода кожно-некротических проб и было установлено, что его использование в рутинной практике сопряжено с рисками получения недостоверных результатов в сравнении с методом летального заражения [20].
Методы определения специфической активности применяют главным образом в двух вариантах: а) испытание с тремя разведениями позволяет определить количество единиц активности в прививочной дозе препарата; б) испытание с одним разведением позволяет провести сравнительную оценку активности прививочной дозы и референс-вакцины. Активность испытуемой вакцины считается удовлетворительной, если ее введение в организм вызывает значительно более высокий уровень ответа, чем референс-вакцина (точный критерий Фишера односторонний, р≤0,05). Из всех описанных выше методов только метод кожно-некротических проб не может быть выполнен с одним разведением.
Многие сторонники альтернативных серологических методов [4][21–23] отмечают, что факторами, побуждающими отказаться от традиционных методов с введением токсинов, являются длительность и сложность их постановки, потребность в большом количестве животных разных видов, вариабельность результатов из-за нестандартности животных, необходимость работы с патогенным материалом при заражении животных, а также тщательного соблюдения норм биоэтики при работе с лабораторными животными. В связи с этим задача максимального сокращения использования животных для оценки биологических препаратов важна не только по этическим соображениям, но научно и практически обоснована: животные дорогостоящи и не могут быть стандартизованы.
Ниже изложены результаты сравнительной оценки альтернативных методов и методов летального заражения для определения специфической активности ДА и СА по количеству животных, материальным и временным затратам и затратам прочих ресурсов (табл. 3 и табл. S1, опубликована на сайте журнала30). Все рассматриваемые методы являются фармакопейными31.
Таблица 3. Сравнение метода летального заражения с серологическими методами определения специфической активности дифтерийного и столбнячного анатоксинов
Table 3. Comparison of the lethal challenge test with serological tests for potency assessment for diphtheria and tetanus toxoids
Ресурсыa Resourcesa | Метод летального заражения Lethal challenge method | Серологические методы / Serological tests | ||
ИФА ELISA | На культуре клеток Vero Vero cell-based assay | ToBI | ||
Количество животных: Number of animals: Дифтерийный анатоксин Diphtheria toxoid | 75–87 / 25b МС 75–87 / 25b GP | 70 / 25–30b МС 75–87 / 25–30b GP | 70 / 25–30b МС 75–87 / 25–30b GP | Не применимо Not applicable |
Столбнячный анатоксин Tetanus toxoid | 75–87 / 25b МС или 112 / 48b мышей 75–87 / 25b GP or 112 / 48b mice | Не применимо Not applicable | 70 / 25–30b МС 75–87 / 25–30b GP | |
Количество этапов Number of stages | 2 | 4 | 4 | 4 |
Длительность испытания Duration of the test | 32–35 сут 32–35 days | 40–50 сут 40–50 days | 40–50 сут 40–50 days | 40–50 сут 40–50 days |
Расчет специфической активности Calculation of potency values | Не требует дополнительной обработки первичных данных Additional processing of raw data is required | Требуется дополнительная обработка первичных данных Additional processing of raw data is not required | ||
Лабораторные отходы Laboratory waste | Обеззараживание и утилизация: / Disinfection and utilization: | |||
Наконечники для дозаторов, шприцы, иглы Tips, syringes, needles | Наконечники для дозаторов, шприцы, иглы, пробирки для крови и сыворотки крови, микропланшеты и другой лабораторный пластик; утилизация растворов Tips, syringes, needles, blood and serum test tubes, microplates and other laboratory plastics; disposal of liquid wastes | |||
Утилизация животных / Disposal of animal carcasses | ||||
Таблица подготовлена авторами с использованием источников согласно сноскеc, указанной в примечании / The table is prepared by the authors using data from the sources specified in the footnotcc shown in the notes
Примечание. МС — морские свинки; ИФА — иммуноферментный анализ; ToBI — метод ингибирования связывания токсина.
a Подробная информация о содержании этапов исследований, критических реактивах и стандартах, вспомогательных реактивах, дополнительных материалах, оборудовании, особых навыках персонала, расчете показателей специфической активности размещена в таблице S1 на сайте журнала.
b Метод с тремя разведениями / метод с одним разведением препарата.
с Руководство по контролю качества вакцин против дифтерии, столбняка, коклюша. ВОЗ; 2013.
Notes. GP, guinea pig; ELISA, enzyme-linked immunosorbent assay; ToBI, toxin binding assay.
a Detailed information about the stages of tests, critical reagents and standards, other reagents, additional materials, equipment, special skills of personal, calculation of potency values are shown in table S1 deposited on the journal website.
b Three-dilution test / one-dilution test of a preparation.
с Manual for Quality Control of Diphtheria, Tetanus and Pertussis Vaccines. WHO; 2013.
ОБСУЖДЕНИЕ
В российской практике внедрение принципов 3Rs осуществлено введением в 2010 г. в метод летального заражения методики с одним разведением в соответствии с требованиями ЕФ и ВОЗ. Это позволило значительно сократить количество животных, используемых в тестах специфической активности ДА и СА, — с 75 до 25 морских свинок и с 108 до 48 мышей соответственно.
Зарубежные авторы, обсуждая альтернативные методы тестирования специфической активности АКДС-вакцины, отмечают их значительные преимущества перед традиционными методами: высокую точность, экономичность и, самое важное, — сокращение количества используемых животных [21–23].
Основываясь на результатах анализа данных, представленных в таблицах 3 и S1, можно рассмотреть, насколько принципы 3Rs реализованы в альтернативных методах оценки специфической активности ДА и СА.
Замена: сравнительная оценка методов определения специфической активности дифтерийного и столбнячного компонентов АКДС-вакцины показывает, что основными методами контроля остаются методы in vivo. Постановка альтернативных методов требует использования животных, что, в свою очередь, не дает дополнительных преимуществ с точки зрения сокращения продолжительности испытаний и количества животных в испытании.
Сокращение: для вакцин, содержащих ДА и СА, принцип реализуется в испытаниях с одним разведением.
Усовершенствование: использование гуманных конечных точек. В серологических методах — это неклиническая конечная точка, в которой производят забор крови под инъекционным наркозом для определения титра защитных антител, после чего гуманно умерщвляют животное. Таким образом, исключается стадия заражения токсином, который провоцирует клиническую картину дифтерии или столбняка, где конечной точкой является смерть или тяжелые клинические проявления в виде паралича вследствие столбнячной интоксикации.
Проведенный анализ демонстрирует, что все альтернативные серологические методы требуют большего количества дорогостоящих стандартных образцов, дополнительных реактивов, специального дорогостоящего оборудования, особенно для теста с использованием клеточной культуры, и программного обеспечения по сравнению с методом «золотого стандарта». Необходимо также учитывать, что постановка технически сложных методов требует наличия персонала, обладающего определенными навыками и компетенциями для забора крови из сердца (или vena saphena), пробоподготовки образцов крови, постановки ИФА и МТТ-теста, работы с клеточной культурой и навыками статистической обработки данных. Многоэтапность альтернативных методов может повлечь за собой появление множественных ошибок. Например, выполнение теста на клеточной культуре связано не только с дополнительными финансовыми затратами, но и серьезными рисками: во-первых, все манипуляции необходимо проводить в асептических условиях; во-вторых, непосредственно перед каждым испытанием необходимо определять цитопатическую дозу дифтерийного токсина, потому что клеточная культура от серии к серии обладает значительной вариативной чувствительностью к токсину; в-третьих, для работы с клеточными культурами сотрудники должны обладать специальными навыками.
Таким образом, тезисы зарубежных авторов [21–23] о том, что испытания на животных являются более дорогими, трудоемкими и изменчивыми по сравнению с альтернативными, не подтверждаются. Ни один из рассмотренных альтернативных методов не уступает методу «золотого стандарта» по количеству животных, длительности испытания и экономичности. Только в методе ИФА исключена работа с токсинами и оптимизировано количество животных в эксперименте. ИФА позволяет одновременно оценить иммунный ответ к столбнячному и дифтерийному антигенам в образце сыворотки крови, взятого от одного животного.
Принципы 3Rs распространяются на все сферы жизнедеятельности современного человека, в том числе и на защиту окружающей среды от загрязнений. В последнее время научное сообщество активно обсуждает вопрос о необходимости снижения объема отходов лабораторного пластика. Среди основных предлагаемых стратегий — замена пластиковых лабораторных материалов (посуда, пипетки и др.) на металлические или стеклянные, вторичное использование после обработки (дезинфекция, мойка) и сокращение применения одноразового пластика в том случае, если не применимы первые две стратегии. Если исследования не позволяют отказаться от одноразовых пластиковых материалов, их следует сортировать и сдавать для переработки. Исследователи отмечают, что, хотя переработка и/или утилизация и создает загрязнение окружающей среды, это предпочтительнее, чем после дезинфекционной обработки утилизировать пластиковые материалы как отходы32.
Анализ методов с точки зрения количества получаемых лабораторных отходов показал, что несомненными преимуществами обладают методы летального заражения: минимальное количество лабораторного пластика (шприцы, наконечники для дозаторов), возможность использовать стеклянные флаконы и серологические стеклянные пипетки для приготовления разведений, а животные утилизируются с органическим остатком. Для альтернативных методов применение стратегий снижения лабораторных отходов представляется затруднительным ввиду необходимости использования микропланшетов для ИФА, культуральных планшетов и других одноразовых материалов. Эти методы, особенно метод с использованием культуры клеток, предполагают применение некоторого количества токсичных растворов, на обеззараживание и утилизацию которых необходимы дополнительные ресурсы.
Из приведенного выше анализа современных альтернативных методов определения специфической активности дифтерийного и столбнячного анатоксинов в АКДС-вакцине выявлены преимущества и недостатки. Так, метод ИФА имеет несомненные преимущества: позволяет сократить количество животных в эксперименте благодаря возможному определению антител к двум антигенам в образцах крови, взятых от одного животного; не используются токсины; не требуются особые лабораторные условия для выполнения анализа; дешевле относительно других альтернативных методов.
Методы с использованием клеточной культуры Vero и метод ингибирования связывания токсина (ToBI) имеют ряд существенных недостатков по сравнению с ИФА: длительность и сложность постановки, необходимость работы с токсинами.
Из недостатков трех рассмотренных альтернативных методов можно выделить следующие: необходимость приобретения значительного количества критических реагентов и стандартных образцов, специального оборудования и программного обеспечения; наличие персонала, обладающего специальными навыками и компетенциями; утилизация большого объема лабораторных отходов классов Б и Г.
Проведенный анализ современных методов определения специфической активности компонентов АКДС-вакцины позволяет заключить, что с помощью метода летального заражения («золотой стандарт») можно быстрее и с меньшей трудоемкостью оценить протективные свойства вакцины по сравнению с альтернативными методами. Таким образом, серологические методы для определения специфической активности компонентов АКДС-вакцины можно рассматривать как более трудоемкие, длительные по времени и требующие вовлечения большего числа специалистов.
В то же время нельзя не отметить преимущества альтернативных методов, применяющихся в процессе производственного цикла, для оценки реверсии токсичности и безопасности АКДС-вакцины. Замена контроля на более чувствительные к дифтерийному токсину культуры клеток Vero и отказ от тестирования СА значительно упрощают процедуры и ведут к сокращению количества лабораторных животных в исследованиях.
Для внедрения в российскую производственную и лабораторную практику новых методов необходимо проведение их валидации при активном сотрудничестве исследовательских лабораторий, производителей и государственных регуляторных органов. В настоящее время продолжаются исследования по использованию ИФА для контроля качества АКДС-вакцины [24].
ЗАКЛЮЧЕНИЕ
По сравнению с альтернативными методами определения специфической активности дифтерийного и столбнячного анатоксинов в АКДС-вакцине методы летального заражения являются самыми быстрыми и простыми в исполнении, не требуют дополнительного оборудования, программного обеспечения, критических стандартных образцов, реактивов и материалов, а также особых навыков персонала лаборатории.
При выборе альтернативных методов, ИФА — наиболее предпочтителен вследствие его экономичности, наименьшей сложности в исполнении и отсутствия необходимости использовать токсины в анализе. ИФА оптимален при изучении влияния антигенного состава комбинированных вакцин на специфическую активность отдельных антигенов, поскольку в образцах крови иммунизированного животного можно одновременно определять титры антител различной специфичности. Несомненно, подобное объединение процедур контроля специфической активности комбинированных вакцин на основе АКДС в одном серологическом тесте приведет к значительному сокращению количества животных в экспериментах.
Дополнительная информация. На сайте журнала «БИОпрепараты. Профилактика, диагностика, лечение» размещена таблица S1.
https://doi.org/10.30895/2221-996X-2025-25-2-156-169-table-s1
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.И. Комаровская — идея исследования, обработка и анализ данных литературы, написание текста рукописи, формулировка выводов исследования; О.В. Проскурина — оформление таблиц, работа с источниками литературы.
Additional information. Table S1 is published on the website of Biological Products. Prevention, Diagnosis, Treatment.
https://doi.org/10.30895/2221-996X-2025-25-2-156-169-table-s1
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. E.I. Komarovskaya conceived the study idea, drafted the manuscript, and formulated the conclusions; O.V. Proskurina designed the tables, collected and analysed literature data.
1. https://nc3rs.org.uk/
2. ICH Harmonized Tripartite Guideline Q2(R1). Validation of analytical procedures text and methodology. ICH; 2005.
https://database.ich.org/sites/default/files/Q2(R1)%20Guideline.pdf
3. Manual for quality control of diphtheria, tetanus and pertussis vaccines. WHO; 2013.
Diphtheria and tetanus vaccine (adsorbed), version 01/2021:0444. European Pharmacopoeia. 11th ed. Strasbourg: EDQM; 2024. www.pheur.edqm.eu/home
4. National Research Council (US). Committee on Pain and Distress in Laboratory Animals. Recognition and alleviation of pain and distress in laboratory animals. Washington (DC): National Academies Press; 1992.
5. https://nc3rs.org.uk
6. https://sdgs.un.org/partnerships/mainstreaming-3rs-and-resource-efficiency-overall-policy-development-local-and
https://www.meti.go.jp/english/policy/energy_environment/3r/index.html
7. https://www.gsk.com/en-gb/responsibility/ethical-standards/use-of-animals/
https://www.fda.gov/science-research/about-science-research-fda/advancing-alternative-methods-fda
8. https://ntp.niehs.nih.gov/whatwestudy/niceatm/accept-methods/apps
https://nibsc.org/about_us/our_use_of_animals/3rs.aspx
https://nc3rs.org.uk/who-we-are/3rs
9. CCAC guidelines on choosing an appropriate endpoint in experiments using animals for research, teaching and testing. CCAC; 1998.
10. https://nibsc.org/about_us/our_use_of_animals/3rs.aspx
11. Botulinum toxin type A for injection, version 07/2022:2113. European Pharmacopoeia. 11th ed. Strasbourg: EDQM; 2024.
www.pheur.edqm.eu/home
12. General chapter 2.7.8 Assay of tetanus vaccine (adsorbed), version 01/2008:20708. European Pharmacopoeia. 11th ed. Strasbourg: EDQM; 2024. www.pheur.edqm.eu/home
13. Diphtheria and tetanus vaccine (adsorbed), version 01/2021:0444. European Pharmacopoeia. 11th ed. Strasbourg: EDQM; 2024. https://ntp.niehs.nih.gov/whatwestudy/niceatm/accept-methods
WHO Expert Committee on Biological Standardization: sixty-ninth report. WHO Technical Report Series No. 1016. WHO; 2018.
14. https://nibsc.org/about_us/our_use_of_animals/3rs.aspx
15. Там же.
Standard operating procedure. Neurovirulence test of types 1, 2 or 3 live attenuated poliomyelitis vaccines (oral) in transgenic mice susceptible to poliovir, version 7. WHO; 2015.
16. https://www.afsacollaboration.org/sciencex_event/global-workshop-transitioning-dtwp-containing-vaccines-to-animal-free-batch-release-testing-strategy-strategies-for-implementation/
17. Там же.
18. https://www.pei.de/EN/newsroom/hp-news/2024/240718-rabbit-pyrogentest.html
19. https://www.edqm.eu/en/bsp-programme-for-3rs#{%221886723%22:[]}
20. https://www.euvaccine.eu/cross-cutting-activities/vac2vac
https://www.ihi.europa.eu/projects-results/project-factsheets/vac2vac
21. https://www.ema.europa.eu/en/documents/scientific-guideline/draft-reflection-paper-current-regulatory-testing-requirements-medicinal-products-human-use-opportunities-implementation-3rs-revision-1_en.pdf
22. https://www.edqm.eu/en/-/update-on-bsp-study-on-the-evaluation-of-a-replacement-method-for-the-potency-control-of-whole-cell-pertussis-vaccines
23. WHO Expert Committee on Biological Standardization. Technical Report Series No. 979. WHO; 2013.
24. https://www.edqm.eu/en/-/ph.-eur.-to-replace-histamine-sensitisation-test-hist-for-residual-pertussis-toxin-testing
25. CHO, Chinese hamster ovary cells (клетки яичника китайского хомячка).
26. WHO Expert Committee on Biological Standardization. Technical Report Series. 17th report: TRS No. 800. WHO; 1990.
27. Там же.
28. Chapters 2.7.6 and 2.7.8. European Pharmacopoeia. 11th ed. Vol. 1. Strasbourg: EDQM; 2024.
29. Manual for quality control of diphtheria, tetanus and pertussis vaccines. WHO; 2013.
30. https://doi.org/10.30895/2221-996X-2025-25-2-156-169-table-s1
31. Chapters 2.7.6 and 2.7.8. European Pharmacopoeia. 11th ed. Vol. 1. Strasbourg: EDQM; 2024.
ФС.3.3.1.0010.15 Вакцина коклюшно-дифтерийно-cтолбнячная адсорбированная (АКДС-вакцина). Государственная фармакопея Российской Федерации. XIII изд; 2016.
32. https://hellobio.com/blog/ten-ways-to-reduce-plastic-waste-in-the-lab.html
https://lms.mrc.ac.uk/top-tips-to-make-your-lab-more-sustainable/
https://www.sustainable.pitt.edu/reducing-lab-plastics/
Список литературы
1. Stickings P, Rigsby P, Coombes L, Hockley J, Tierney R, Sesardic D. Animal refinement and reduction: alternative approaches for potency testing of diphtheria and tetanus vaccines. Procedia Vaccinol. 2011;(5):200–12. https://doi.org/10.1016/j.provac.2011.10.020
2. Tannenbaum J, Taylor Bennett B. Russell and Burch’s 3Rs then and now: The need for clarity in definition and purpose. J Am Assoc Lab Anim Sci. 2015;54(2):120–32. PMCID: PMC4382615
3. Hubrecht RC, Carter E. The 3Rs and humane experimental technique: Implementing change. Animals. 2019;9(10):754. https://doi.org/10.3390/ani9100754
4. Akkermans A, Chapsal JM, Coccia EM, Depraetere H, Dierick JF, Duangkhae P, et al. Animal testing for vaccines. Implementing replacement, reduction and refinement: challenges and priorities. Biologicals. 2020;68:92–107. https://doi.org/10.1016/j.biologicals.2020.07.010
5. Lilley E, Coppens E, Das P, Galaway F, Isbrucker R, Sheridan S, et al. Integrating 3Rs approaches in WHO guidelines for the batch release testing of biologicals: Responses from a survey of vaccines and biological therapeutics manufacturers. Biologicals. 2023;81:101660. https://doi.org/10.1016/j.biologicals.2022.11.002
6. Hendriksen C, Arciniega JL, Bruckner L, Chevalier M, Coppens E, Descamps J, et al. The consistency approach for the quality control of vaccines. Biologicals. 2008;36:73–7. https://doi.org/10.1016/j.biologicals.2007.05.002
7. Uhlrich S, Coppens E, Moysan F, Nelson S, Nougarede N. 3Rs in quality control of human vaccines: opportunities and barriers. In: Kojima H, Seidle T, Spielmann H, eds. Alternatives to animal testing. Springer Singapore; 2019. https://doi.org/10.1007/978-981-13-2447-5_10
8. Hendriksen CFM, Steen B. Refinement of vaccine potency testing with the use of humane endpoints. ILAR J. 2000;41(2):105–13. https://doi.org/:10.1093/ilar.41.2.105
9. Stokes WS. Humane endpoints for laboratory animals used in regulatory testing. ILAR J. 2002;43 Suppl:S31–8. PMID: 12388849
10. Неугодова НП, Степанюк ЕО, Сапожникова ГА, Саканян ЕИ, Рябцева МС. Современные подходы к введению показателя «Аномальная токсичность». Ведомости Научного центра экспертизы средств медицинского применения. 2020;10(2):82–8. https://doi.org/10.30895/1991-2919-2020-10-2-82-88
11. Nomoto A. Molecular aspects of poliovirus pathogenesis. Proc Jpn Acad Ser B Phys Biol Sci. 2007;83(8):266–75. https://doi.org/10.2183/pjab/83.266
12. Racaniello VR. One hundred years of poliovirus pathogenesis. Virology. 2006;344(1):9–16. https://doi.org/10.1016/j.virol.2005.09.015
13. Koike S, Nagata N. A transgenic mouse model of poliomyelitis. Methods Mol Biol. 2016;1387:129–44. https://doi.org/10.1007/978-1-4939-3292-4_7
14. Fulton MC, Bailey WJ. Live viral vaccine neurovirulence screening: Current and future models. Vaccines (Basel). 2021;9(7):710. https://doi.org/10.3390/vaccines9070710
15. Rubin SA. Toward replacement of the monkey neurovirulence test in vaccine safety testing. Procedia Vaccinol. 2011;5:261–5. https://doi.org/10.1016/j.provac.2011.10.027
16. Zhang X, Wu X, He Q, Wang J, Mao Q, Liang Z, Xu M. Research progress on substitution of in vivo method(s) by in vitro method(s) for human vaccine potency assays. Expert Rev Vaccines. 2023;22(1):270–7. https://doi.org/10.1080/14760584.2023.2178421
17. Solati S, Zhang T, Timman S. The monocyte activation test detects potentiated cytokine release resulting from the synergistic effect of endotoxin and non-endotoxin pyrogens. Innate Immun. 2022;28(3–4):130–7. https://doi.org/10.1177/17534259221097948
18. Decker MD, Edwards KM, Howe BJ. Combination vaccines. In: Plotkin SA, Orenstein WA, Offit PA, Edwards KM, eds. Plotkin’s Vaccines. 7th ed. Philadelphia PA: Elsevier; 2018. P. 198–227.
19. Prygiel M, Mosiej E, Polak M, Krysztopa-Grzybowska K, Wdowiak K, Formińska K, Zasada AA. Challenges of diphtheria toxin detection. Toxins (Basel). 2024;16(6):245. https://doi.org/10.3390/toxins16060245
20. Комаровская ЕИ, Перелыгина ОВ. Определение специфической активности дифтерийного анатоксина в комбинированных вакцинах методом кожно-некротических проб. Эпидемиология и вакцинопрофилактика. 2023;22(4):12–23. https://doi.org/10.31631/2073-3046-2023-22-4-12-23
21. Gupta RK, Anderson R, Cecchini D, Rost B, Xu J, Gendreau K, et al. Evaluation of a guinea pig model to assess interference in the immunogenicity of different components of a combination vaccine comprising diphtheria, tetanus and acellular pertussis (DTaP) vaccine and haemophilus influenzae type B capsular polysaccharide conjugate vaccine. Biologicals. 1999;27(2):167–76. https://doi.org/10.1006/biol.1999.0204
22. Stalpers CAL, Retmana IA, Pennings JLA, Vandebriel RJ, Hendriksen CFM, Akkermans AM, et al. Variability of in vivo potency tests of diphtheria, tetanus and acellular pertussis (DTaP) vaccines. Vaccine. 2021;39(18):2506–16. https://doi.org/10.1016/j.vaccine.2021.03.078
23. Szeto J, Beharry A, Chen T, Zholumbetov E, Daigneault E, Ming M, et al. Development of an in vitro test method to replace an animal-based potency test for pertactin antigen in multivalent vaccines. Vaccines. 2023;11(2):275. https://doi.org/10.3390/vaccines11020275
24. Комаровская ЕИ, Солдатов АА. Изучение иммунного ответа к дифтерийному и столбнячному анатоксинам серологическим методом. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(3):321–32. https://doi.org/10.30895/2221-996X-2023-23-3-321-332
Об авторах
Е. И. КомаровскаяРоссия
Комаровская Елена Игоревна
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. В. Проскурина
Россия
Проскурина Ольга Владимировна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы

|
1. Таблица S1. Сравнение метода летального заражения с серологическими методами определения специфической активности дифтерийного и столбнячного анатоксинов | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(361KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Комаровская Е.И., Проскурина О.В. Применение принципов 3Rs для оценки качества АКДС-вакцины: преимущества и недостатки. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):156-169. https://doi.org/10.30895/2221-996X-2025-25-2-156-169
For citation:
Komarovskaya E.I., Proskurina O.V. Application of 3Rs principles to assess the quality of DPT vaccine: Advantages and disadvantages. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):156-169. (In Russ.) https://doi.org/10.30895/2221-996X-2025-25-2-156-169


































