Перейти к:
Оценка жизнеспособности тест-штамма Salmonella enterica subsp. enterica serovar Abony NCTC 6017 в ампулах и флаконах методом ускоренного хранения
https://doi.org/10.30895/2221-996X-2024-24-4-467-475
Резюме
ВВЕДЕНИЕ. Важными задачами ведения коллекций микроорганизмов являются обеспечение стабильности свойств и поддержание жизнеспособности микробиологических культур во время хранения и при транспортировке. При использовании коллекционных штаммов микроорганизмов в качестве контрольных образцов в ряде случаев необходимы точные данные о количестве живых микробных клеток в каждом образце, в связи с чем актуальна разработка и применение методики прогнозирования гарантийных сроков хранения тест-штаммов.
ЦЕЛЬ. Оценить изменение жизнеспособности тест-штаммов для прогнозирования гарантийных сроков их хранения в различной первичной упаковке на примере штамма Salmonella enterica subsp. enterica serovar Abony NCTC 6017 методом ускоренного хранения.
МАТЕРИАЛЫ И МЕТОДЫ. В работе использовали лиофилизированные образцы культуры штамма Salmonella enterica subsp. enterica serovar Abony NCTC 6017, депонированного в Государственной коллекции патогенных микроорганизмов ФГБУ «НЦЭСМП» Минздрава России. В качестве первичной упаковки применены ампулы боросиликатные вакуумного наполнения и флаконы для лиофилизации стандарта 2R. Проведена оценка образцов по ряду показателей качества (потеря в массе при высушивании, количество жизнеспособных клеток, выживаемость клеток, морфология колоний, биохимическая идентификация) и смоделировано ускоренное хранение при повышенных температурах (35–65 °С).
РЕЗУЛЬТАТЫ. Существенных различий качества лиофилизированных образцов в зависимости от типа первичной упаковки не выявлено. Экспериментально определены константы дезактивации жизнеспособности микробиологических культур при хранении образцов при повышенных температурах. Рассчитаны константы дезактивации для температур транспортировки и хранения в различной первичной упаковке. Прогнозируемое время снижения жизнеспособности клеток до 10% составляет 19 лет при хранении во флаконах и 25 лет — в ампулах. Прогнозируемое время снижения жизнеспособности клеток до 50% составляет 5,8 и 7,6 года — для флаконов и ампул соответственно.
ВЫВОДЫ. Анализ результатов исследования подтвердил возможность использования различных типов первичной упаковки (ампулы и флаконы) для лиофильного высушивания и хранения тест-штаммов микроорганизмов. Полученные данные могут быть использованы для дальнейших исследований и разработки рекомендаций по хранению лиофилизированных штаммов в различных типах упаковки.
Ключевые слова
Для цитирования:
Воропаев А.А., Цыдыпова О.Ц., Фадейкина О.В., Давыдов Д.С. Оценка жизнеспособности тест-штамма Salmonella enterica subsp. enterica serovar Abony NCTC 6017 в ампулах и флаконах методом ускоренного хранения. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(4):467-475. https://doi.org/10.30895/2221-996X-2024-24-4-467-475
For citation:
Voropaev A.A., Cidipova O.T., Fadeikina O.V., Davydov D.S. Viability assessment of Salmonella enterica subsp. enterica serovar Abony NCTC 6017 in ampoules and vials by the accelerated shelf-life testing method. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(4):467-475. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-4-467-475
ВВЕДЕНИЕ
Задачами ведения коллекций микроорганизмов, особенно государственных коллекций, являются обеспечение сохранения свойств и жизнеспособности микроорганизмов, а также коллекционного фонда и обеспечение лабораторий образцами штаммов микроорганизмов (в том числе тест-штаммы) надлежащего качества для проведения научно-исследовательских и производственных работ, микробиологического контроля, оценки качества лекарственных средств и медицинских изделий [1].
Для решения данных задач применяют различные методы консервации микроорганизмов, среди которых лиофилизация является основным методом для высушивания из замороженного состояния в вакууме. Лиофилизированные образцы тест-штаммов возможно транспортировать в пределах Российской Федерации при температуре окружающей среды. Долгосрочное хранение штаммов осуществляют при температуре плюс 2–8 °С. В герметично запаянных под вакуумом ампулах коллекционные штаммы могут храниться практически неограниченное время, и это основное применение подобного типа емкости. Однако для конечного потребителя предпочтительнее использовать штаммы, расфасованные во флаконы, укупоренные резиновой пробкой и завальцованные. Такую упаковку легче вскрыть, нет опасности перегревания культуры во время вскрытия в пламени горелки или повреждения кожных покровов острыми осколками и, следовательно, отсутствует риск нарушения режима биологической безопасности в лабораторных условиях [2][3].
Технология изготовления лиофилизатов в ампулах и флаконах также различается: при высушивании в ампулах используют ватные фильтры, создающие барьер для испарения удаляемой влаги; ампулы запаивают вне камеры лиофильного аппарата, что может сказаться на величине остаточной влажности (значение показателя «Потеря в массе при высушивании», важного для последующей сохранности качества лиофилизата и жизнеспособности культуры) [4][5]. Недостатком использования ампул является трудоемкость процедуры запаивания ампул, для выполнения которой требуются специальные навыки. Недостаток использования флаконов связан с возможной частичной усушкой пробки при длительном хранении, превышающем срок годности пробки, вследствие чего может быть нарушение герметичности упаковки. Запаянные ампулы являются лучшим выбором для долгосрочного хранения, а флаконы с резиновыми пробками — для снабжения тест-штаммами микробиологических лабораторий.
Поскольку требуется гарантировать сохранение жизнеспособности тест-штаммов независимо от цели их использования, то важно спрогнозировать гарантийное время их хранения как при долгосрочном хранении, так и при транспортировке к конечному потребителю, которая, как правило, осуществляется при температуре окружающей среды. Для такого прогнозирования можно использовать метод ASLT (Accelerated Shelf-Life Testing, метод ускоренного тестирования срока хранения или метод ускоренного хранения), который успешно используется для определения сроков годности биологических препаратов, образцов бактериофагов и микроорганизмов, а также лиофилизированных лекарственных средств [6–9].
Основой метода является выдерживание образцов при нескольких повышенных температурах с последующим расчетом констант дезактивации для различных температур [10]. Исходя из уравнения Аррениуса, логарифмы констант дезактивации линейно зависят от температуры (1):
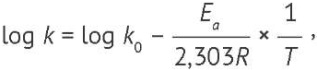 (1)
(1)
где k0 — экспериментально рассчитанная константа дезактивации, T — абсолютная температура в Кельвинах, R — газовая постоянная, Ea — энергия активации, log — логарифм с основанием 10.
Таким образом, зная константы дезактивации при повышенных температурах, методом экстраполяции можно определить константу для целевой температуры хранения и прогнозировать гарантийное время хранения штаммов.
Цель работы — оценить изменение жизнеспособности тест-штаммов для прогнозирования гарантийных сроков их хранения в различной первичной упаковке на примере штамма Salmonella enterica subsp. enterica serovar Abony NCTC 6017 методом ускоренного хранения.
Для достижения указанной цели были сформулированы следующие задачи: приготовить лиофилизированные образцы тест-штамма в ампулах и флаконах; оценить образцы по показателям качества лиофилизатов; провести хранение образцов при различных повышенных температурах; экспериментально определить константы дезактивации при повышенных температурах и рассчитать константы дезактивации при температурах хранения и транспортировки; определить гарантированное время хранения лиофилизированного тест-штамма S. enterica subsp. enterica serovar Abony NCTC 6017 в разной первичной упаковке при температурах хранения и транспортировки.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
В работе применяли следующие материалы: тест-штамм микроорганизмов, рекомендованный для проведения испытаний в ОФС.1.2.4.0002.151 Salmonella enterica subsp. enterica serovar Abony NCTC 6017; питательная среда ГРМ-агар (серия О1-К-683, ФБУН «ГНЦ ПМБ» Роспотребнадзора); сахарозо-желатиновая среда (защитная среда), содержащая 20% сахарозы (кат. № 1.07653, серия K48546153, Merck, США) и 2% желатина (кат. № 1.04070, серия VM918570, Merck, США); фармакопейный стандартный образец (ФСО) ГФ РФ мутности бактериальных взвесей 20 МЕ ФСО 3.1.00084 (ОСО 42-28-84), серия S-2/8-010122, ФГБУ «НЦЭСМП» Минздрава России); ампулы с внутренним диаметром 8 мм, изготовленные из боросиликатной стеклотрубки (Simax®, Чехия); флаконы для лиофилизации стандарта 2R (кат. № 1637441, серия 6106541118, Schott Pharma, Германия).
Оборудование
В работе использовали измерительное и испытательное оборудование, прошедшее поверку (квалификацию, аттестацию): сушка лиофильная Epsilon 2-4 LSCplus (Martin Christ, Германия); весы специальные класса 1 ML204T/A00 (Mettler Toledo, Швейцария); морозильник MDF-193AT (Panasonic Healthcare, Япония); лиофильный аппарат Usifroid M.S.R. 18 (Usifroid, Франция); генератор плазмы PG 1200 (Fergutec, Нидерланды); вакуумно-сушильный шкаф VD 23 (Binder, Германия); термостат ТС-1/80 СПУ (АО «Смоленское СКТБ СПУ», Россия); шкаф ламинарный БАВ п-01-1,2, класс защиты II (ЗАО «Ламинарные системы», Россия);
Методы
Подготовка тест-штаммов к высушиванию. Культивирование тест-штаммов проводили при температуре 37±2 °С на поверхности агаризованной среды в чашках Петри в течение 20–24 ч. Для лиофильного высушивания использовали 20-часовую культуру. Бактериологической петлей отбирали колонии и готовили суспензию, соответствующую 20 МЕ ФСО мутности бактериальных взвесей. Полученную суспензию объединяли в равном объеме с сахарозо-желатиновой защитной средой и вносили по 0,2 мл в ампулы и по 0,5 мл во флаконы. Для определения концентрации жизнеспособных клеток до высушивания суспензию десятикратно разводили и проводили посев на поверхности агаризованной среды в чашках Петри.
Лиофилизация. Замораживание и высушивание проводили в рамках одного цикла лиофилизации. Образцы замораживали до температуры минус 40 °С в течение 4 ч, первичное высушивание проводили под вакуумом 0,1 мбар в течение 12 ч, плавно повышая температуру полки от минус 20 до 0 °С. Досушивание проводили в течение 7 ч при температуре 30 °С. Флаконы укупоривали под вакуумом в камере лиофильной сушки, ампулы доставали из лиофильного аппарата и запаивали под вакуумом на специальном устройстве для запаивания ампул.
Определение вакуума/герметизации проводили согласно ОФС.1.8.1.0002.152.
Определение времени растворения проводили согласно ОФС.1.4.1.0031.183.
Определение потери в массе при высушивании в испытании по способу 1 из ОФС.1.2.1.0010.154 использовали 10 ампул и 4 флакона.
Определение количества жизнеспособных микробных клеток проводили по методике, описанной в работе А.А. Воропаева с соавт. [5]. Лиофилизат ресуспендировали стерильной водой, внося 0,2 мл в ампулы и 0,5 мл во флаконы. При определении количества жизнеспособных микробных клеток для оценки каждого исследуемого параметра (температура и время хранения) использовали по три образца (ампулы или флаконы). Содержимое каждого образца разводили десятикратно, после чего из разведений высевали по 0,1 мл в три чашки с питательной средой и инкубировали в течение 24 ч при температуре 37±2 °С. Для каждой температуры и времени хранения получали результаты (n=9) по определению количества жизнеспособных микробных клеток [5].
Тест ускоренного хранения. Флаконы и ампулы помещали в вакуумный сушильный шкаф, нагретый до необходимой температуры (35, 45, 55 или 65 °С). Через определенные промежутки времени образцы вынимали и определяли концентрацию жизнеспособных микроорганизмов. Константу дезактивации k рассчитывали по формуле (2):
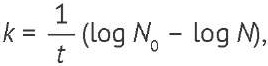 (2)
(2)
где N0 — начальная концентрация микроорганизма, N — концентрация микроорганизма после хранения при повышенной температуре, log — логарифм с основанием 10, t — время хранения при повышенной температуре (ч) [11].
Статистическая обработка результатов. Среднее значение, стандартное отклонение, относительное стандартное отклонение и коэффициент корреляции Пирсона рассчитывали с помощью программы Microsoft Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Подготовка лиофилизированных образцов
Подготовленные образцы штамма S. enterica subsp. enterica serovar Abony NCTC 6017 после лиофильного высушивания оценивали по параметрам качества, представленным в таблице 1: описание (внешний вид); потеря в массе при высушивании; вакуум/герметизация; время растворения лиофилизата. Восстановленную из лиофильного состояния культуру оценивали по количеству жизнеспособных клеток, выживаемости, морфологии колоний и биохимической активности. Концентрация микробных клеток в исходной суспензии до высушивания составила (4,16±0,40)×10⁸ КОЕ/мл. После высушивания результаты оценки качества лиофилизированных образцов во флаконах и ампулах оказались сопоставимы. Единственное различие наблюдали для показателя «Потеря в массе при высушивании»: 2,0% — для ампул, 1,3% — для флаконов (табл. 1). Вероятно, это связано с наличием ватного фильтра и особенностями процедуры запаивания ампул.
Таблица 1. Влияние первичной упаковки (флаконы/ампулы) на качество лиофилизированных образцов
Table 1. Influence of primary packaging (vials/ampoules) on the quality of lyophilised samples
Показатели качества лиофилизированных образцов Quality attributes of lyophilised samples | Ампулы Ampoules | Флаконы для лиофилизации Lyophilisation vials |
Описание Appearance | Сухая пористая масса в виде таблетки, цельная Dry, porous, and uniform cake | Сухая пористая масса в виде таблетки, цельная Dry, porous, and uniform cake |
Потеря в массе при высушивании, % Loss on drying, % | 2,0±0,2 | 1,3±0,1 |
Вакуум/герметизация Vacuum/sealing | Вакуум не более 10 гПа Vacuum of ≤10 hPa | Вакуум не более 10 гПа Vacuum of ≤10 hPa |
Время растворения лиофилизата, с Reconstitution time, s | <10 | <10 |
Количество жизнеспособных клеток, КОЕ/мл Viable cell count, CFU/mL | (3,06±0,02)×10⁸ | (3,06±0,04)×10⁸ |
Выживаемость, % Viability, % | 73 | 73 |
Морфология колоний Colony morphology | Гладкие круглые колонии Smooth round colonies | Гладкие круглые колонии Smooth round colonies |
Биохимическая идентификация Biochemical identification | 95,5% (Salmonella еnterica) | 95,5% (Salmonella еnterica) |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Проведение теста ускоренного хранения
Испытания проводили при четырех разных повышенных температурах с шагом в 10 °С (35, 45, 55 и 65 °С). Время отбора проб подбирали экспериментально для каждой температуры таким образом, чтобы снижение количества жизнеспособных клеток было статистически значимым. Результаты проведения теста представлены в таблице 2.
Таблица 2. Результаты теста ускоренного хранения образцов штамма S. enterica subsp. enterica serovar Abony NCTC 6017 в разных первичных упаковках
Table 2. Results of accelerated shelf-life testing of Salmonella enterica subsp. enterica serovar Abony NCTC 6017 samples in different primary packaging
Tемпература хранения, °С Storage temperature, °С | Время, ч Time, h | Количество жизнеспособных микробных клеток, КОЕ/мл Viable cell count, CFU/mL | |||||
Ампулы Ampoules | Флаконы Vials | ||||||
X±S (n=9) | RSD, % | log10X | X±S (n=9) | RSD, % | log10X | ||
35 | 696 | (6,6±2,2)×10⁷ | 33 | 7,82 | (4,6±0,1)×10⁷ | 2 | 7,66 |
960 | (1,9±0,2)×10⁷ | 11 | 7,28 | (7,2±2,4)×10⁷ | 33 | 7,86 | |
1680 | (6,6±0,2)×10⁵ | 7 | 5,82 | (3,9±0,2)×10⁵ | 7 | 5,82 | |
2496 | (1,1±0,3)×10⁵ | 10 | 4,52 | (1,6±0,3)×10⁵ | 10 | 5,52 | |
3000 | (3,3±0,3)×10⁴ | 27 | 5,04 | (2,1±0,3)×10⁴ | 27 | 5,04 | |
45 | 48 | (1,6±0,3)×10⁸ | 19 | 8,20 | (2,1±0,1)×10⁸ | 5 | 8,32 |
168 | (2,7±0,2)×10⁷ | 9 | 7,43 | (2,6±0,1)×10⁷ | 5 | 7,41 | |
672 | (2,8±1,2)×10⁵ | 43 | 5,45 | (1,1±0,5)×10⁶ | 44 | 5,04 | |
840 | (5,6±1,5)×10⁴ | 26 | 4,75 | (3,9±0,4)×10⁴ | 10 | 4,59 | |
1008 | (1,1±0,2)×10⁴ | 15 | 4,04 | (2,3±0,4)×10⁴ | 17 | 4,36 | |
55 | 6 | (1,4±0,3)×10⁸ | 21 | 8,15 | (2,4±0,2)×10⁸ | 6 | 8,38 |
24 | (8,8±0,2)×10⁷ | 19 | 7,94 | (8,5±1,1,)×10⁷ | 12 | 7,93 | |
48 | (2,7±0,5)×10⁷ | 20 | 7,43 | (6,0±0,7)×10⁷ | 12 | 7,78 | |
96 | (1,3±0,4)×10⁶ | 32 | 6,11 | (4,3±1,2)×10⁵ | 28 | 5,63 | |
144 | (4,5±1,1)×10⁴ | 25 | 4,65 | (2,6±0,9)×10⁴ | 33 | 4,41 | |
65 | 3 | (7,0±5,7)×10⁷ | 82 | 7,85 | (9,4±2,4)×10⁷ | 26 | 7,97 |
16 | (6,7±4,6)×10⁶ | 68 | 6,83 | (1,6±0,3)×10⁷ | 45 | 7,20 | |
24 | (8,0±3,1)×10⁵ | 39 | 5,90 | (1,0±0,5)×10⁷ | 45 | 7,00 | |
48 | (2,8±3,3)×10⁴ | 118 | 4,45 | (6,5±3,1)×10⁴ | 48 | 4,81 | |
72 | (5,0±2,1)×10² | 42 | 2,70 | (4,6±4,4)×10³ | 94 | 3,66 | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. X±S — среднеарифметическое значение ± стандартное отклонение; n — количество результатов испытаний; RSD — относительное стандартное отклонение.
Note. X±S, arithmetic mean ± standard deviation; n, number of test results; RSD, relative standard deviation.
Снижения количества жизнеспособных клеток в зависимости от типа первичной упаковки не наблюдалось. В среднем разница между количеством жизнеспособных клеток в ампулах и флаконах составила от 0,01 до 1,1 log10 КОЕ/мл.
На основании полученных данных рассчитаны коэффициенты корреляции и проведен анализ функции снижения количества жизнеспособных клеток в зависимости от типа первичной упаковки, температуры и времени хранения, имеющей линейный вид (табл. 3).
Таблица 3. Характеристики зависимости количества жизнеспособных клеток от времени хранения при повышенных температурах
Table 3. Viable cell counts depending on the time of storage at elevated temperatures
Температура, °С Temperature, °C | Угловой коэффициент уравнения линейной функции Linear function slope | r * | |
Ампулы Ampoules | Флаконы Vials | ||
35 | -0,001 | -0,001 | 0,978 |
45 | -0,004 | -0,004 | 0,988 |
55 | -0,025 | -0,030 | 0,990 |
65 | -0,073 | -0,065 | 0,982 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. * r — коэффициент корреляции Пирсона использовали для анализа взаимосвязи между результатами.
Note. * Pearson’s correlation coefficient, r, was used to analyse the relationship between the results.
Значения угловых коэффициентов функции снижения количества жизнеспособных клеток от времени сопоставимы для ампул и флаконов при всех изученных температурах. Значения коэффициентов корреляции зависимости для ампул и флаконов составили более 0,9.
Значения констант дезактивации, рассчитанные по формуле (2), представлены в таблице 4. Используя полученные значения, строили график зависимости константы дезактивации от абсолютной температуры.
Таблица 4. Результаты расчетов констант дезактивации
Table 4. Calculation results for viability loss rate constants
Температура хранения, °С Storage temperature, °C | Константа дезактивации Viability loss rate constant (k) | r * | ||
Ампулы Ampoules | Флаконы Vials | Ампулы Ampoules | Флаконы Vials | |
65 | 1,18×10-1 | 0,92×10-1 | 0,996 | 0,997 |
55 | 3,06×10-2 | 2,29×10-2 | ||
45 | 5,15×10-3 | 4,77×10-3 | ||
35 | 1,30×10-3 | 1,26×10-3 | ||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. * r — значение коэффициента корреляции Пирсона уравнения зависимости log10k от обратной абсолютной температуры 1/T.
Note. * Pearson’s correlation coefficient, r, for log10k values as a function of the inverse absolute temperature, 1/T.
Используя уравнения прямой (рис. 1), рассчитали константы дезактивации и время снижения количества жизнеспособных клеток при целевых температурах (табл. 5). Целевыми температурами были выбраны 5 и 25 °С: 5 °С — средняя температура хранения лиофилизированных образцов, а 25 °С — вероятная температура транспортировки образцов конечному потребителю.
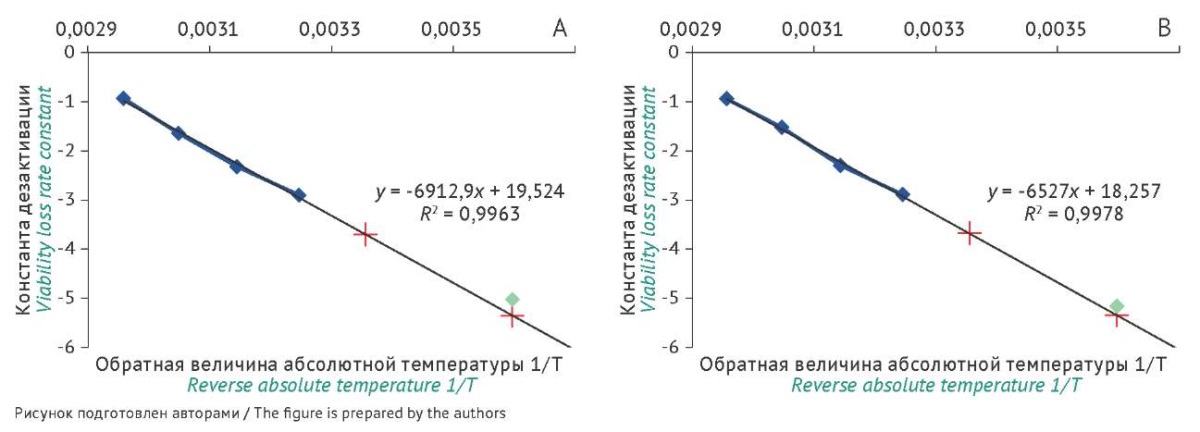
Рис. 1. Зависимость констант дезактивации от обратной абсолютной температуры: A — ампулы, B — флаконы. Синий цвет — экспериментальные данные, полученные при хранении в условиях повышенных температур; красный цвет (значок перекрестия) — рассчитанные константы при 25 и 5 °С; зеленый цвет (значок ромба) — данные, полученные при хранении в режиме реального времени.
Fig. 1. Viability loss rate constants as a function of the inverse absolute temperature: A, ampoules; B, vials. Blue: experimental data obtained in accelerated stability testing at elevated temperatures; red (crosshairs): calculated constants for 25 °C and 5 °C; green (diamonds): data obtained in real-time stability testing.
Таблица 5. Прогнозирование сроков хранения тест-штамма Salmonella enterica subsp. enterica serovar Abony NCTC 6017
Table 5. Predicting the shelf life of the control strain Salmonella enterica subsp. enterica serovar Abony NCTC 6017
Температура хранения, °С Storage temperature, °C | Константа дезактивации Viability loss rate constant | Время снижения количества жизнеспособных клеток до 50%, лет Time to viable cell count reduction to 50%, years | Время снижения количества жизнеспособных клеток до 10%, лет Time to viable cell count reduction to 10%, years | |||
Ампулы Ampoules | Флаконы Vials | Ампулы Ampoules | Флаконы Vials | Ампулы Ampoules | Флаконы Vials | |
25 | 2,12×10-4 | 1,99×10-4 | 0,2 | 0,2 | 0,5 | 0,5 |
5* | 4,54×10-6 | 4,43×10-6 | 7,6 | 5,8 | 25,2 | 19,3 |
5** | 6,90×10-6 | 9,50×10-6 | – | – | – | – |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. * расчетные данные; ** экспериментальные данные; «–» — не применимо.
Note. *, estimated data; **, experimental data; –, not applicable.
В режиме реального времени количество жизнеспособных клеток оценивали через полтора года хранения при температуре 2–8 °С. Концентрация клеток составила (2,3±0,1)×10⁸ КОЕ/мл в ампулах и (2,0±0,3)×10⁸ КОЕ/мл во флаконах.
Данные исследования указывают на принципиальную возможность использования закона Аррениуса для прогнозирования гарантийного срока хранения лиофилизированных бактериальных штаммов. Влияние эффекта температуры имеет линейный вид, а значения коэффициентов аппроксимации (R²) близки к единице. Отсутствие различий в прогнозируемом времени хранения лиофилизированного тест-штамма, укупоренного во флаконы или ампулы, указывает на возможность использования только одного вида первичной упаковки для проведения теста ускоренного хранения при определении гарантийного срока хранения разных штаммов микроорганизмов. Таким образом, результаты изменения жизнеспособности штаммов, хранящихся во флаконах, можно экстраполировать на долгосрочное хранение в ампулах. По результатам исследования были выбраны температуры проведения теста ускоренного хранения (35, 45, 55 и 65 °С) и получены ориентировочные скорости снижения количества жизнеспособных клеток. Полученные данные будут использованы для дальнейших исследований. Прогнозируемое время снижения количества жизнеспособных клеток лиофилизированного штамма S. enterica subsp. enterica serovar Abony NCTC 6017 до 10% составляет 19 лет для флаконов и 25 лет для ампул; до 50% составляет 5,8 года для флаконов и 7,6 года — для ампул.
Данные о сроках хранения штамма S. enterica subsp. enterica serovar Abony NCTC 6017 нецелесообразно экстраполировать для прогнозирования сроков хранения других штаммов, поскольку микроорганизмы могут различаться по степени выживаемости после лиофильного высушивания и скорости снижения жизнеспособности со временем. Мы предварительно показали, что снижение жизнеспособности в условиях повышенных температур существенно выше у S. enterica subsp. enterica serovar Abony NCTC 6017 по сравнению с Staphylococcus aureus NCTC 10788 и Pseudomonas aeruginosa NCTC 12924 [5]. А.В. Осин и соавт. также получили результаты по прогнозируемым срокам хранения при 4 °С; они выше у S. aureus ATCC 6538 (209–P) — 105 лет, а самые низкие — у Vibrio cholerae non-O1 р9741 [12]. Поэтому существует необходимость прогнозирования для каждого рода или штамма в отдельности, что может оказаться крайне затратным.
Для определения сроков хранения различных микроорганизмов мы предлагаем использование следующей схемы: 1) провести стресс-тест при одной повышенной температуре 37 °С различных штаммов микроорганизмов; 2) при стресс-тесте проводить отбор проб через 1 и 3 мес.; 3) рассчитать константы дезактивации при данной температуре по трем точкам; 4) распределить все микроорганизмы на группы: устойчивые, умеренно-устойчивые и неустойчивые; 5) для каждой группы прогнозировать сроки хранения методом ускоренного хранения.
Полученные результаты по снижению количества жизнеспособных клеток на 50% могут быть рекомендованы для установления интервала периодичности проверки жизнеспособности тест-штаммов, хранящихся в ампулах в фондах коллекции, примерно через 7–10 лет.
ЗАКЛЮЧЕНИЕ
Проведенное исследование подтвердило использование разных типов первичной упаковки (флаконы и ампулы) для лиофильного высушивания и хранения тест-штаммов. Выбор первичной упаковки должен быть обусловлен целями использования тест-штаммов — долгосрочное хранение в фондах Государственной коллекции патогенных микроорганизмов или снабжение конечных потребителей.
Полученные данные могут быть использованы для дальнейших исследований и разработки рекомендаций по хранению лиофилизированных бактериальных штаммов в различных типах упаковки.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.А. Воропаев — концепция работы, проведение экспериментальной работы, написание текста рукописи, формулировка выводов; О.Ц. Цыдыпова — концепция работы, проведение экспериментальной работы; О.В. Фадейкина — формулировка выводов, утверждение окончательной версии статьи для публикации; Д.С. Давыдов — концепция работы, утверждение окончательной версии статьи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.A. Voropaev conceptualised the study, conducted the experimental work, drafted the manuscript, and formulated the conclusions. O.T. Cidipova conceptualised the study and conducted the experimental work. O.V. Fadeikina formulated the conclusions and approved the final version of the manuscript for publication. D.S. Davydov conceptualised the study and approved the final version of the manuscript for publication.
1. ОФС 1.2.4.0001.15 Микробиологическая чистота. Государственная фармакопея Российской Федерации. XIV изд.; 2018.
2. ОФС 1.7.1.0018.18 Иммунобиологические лекарственные препараты. Государственная фармакопея Российской Федерации, XIV изд.; 2018.
3. ОФС 1.4.1.0031.18 Лиофилизаты. Государственная фармакопея Российской Федерации. XIV изд.; 2018.
4. ОФС 1.2.1.0010.15 Потеря в массе при высушивании. Государственная фармакопея Российской Федерации. XIV изд.; 2018.
Список литературы
1. Грачева ИВ, Осин АВ, Кутырев ВВ. Принципы формирования коллекционных фондов штаммов микроорганизмов. Проблемы особо опасных инфекций. 2021;(2):16–23. https://doi.org/10.21055/0370-1069-2021-2-16-23
2. Снатенков ЕА, Агеева НП, Ротов КА, Коваленко АА. Анализ аварийных ситуаций при работе с патогенными биологическими агентами в рамках риск-ориентированного подхода. Проблемы особо опасных инфекций. 2022;(2):145–48. https://doi.org/10.21055/0370-1069-2022-2-145-148
3. Carraretto AR, Curi EF, Almeida CED, Abatti REM. Glass ampoules: risks and benefits. Rev Bras Anestesiol. 2011;61(4):513–21. https://doi.org/10.1016/s0034-7094(11)70059-9
4. Peiren J, Hellemans A, De Vos P. Impact of the freeze-drying process on product appearance, residual moisture content, viability, and batch uniformity of freeze-dried bacterial cultures safeguarded at culture collections. Appl Microbiol Biotechnol. 2016;100(14):6239–49. https://doi.org/10.1007/s00253-016-7359-1
5. Воропаев АА, Фадейкина ОВ, Ермолаева ТН, Давыдов ДС. Лиофилизация бактериальных тест-штаммов в аппарате коллекторного типа: влияние параметров замораживания и высушивания, объема заполнения ампул и плотности ватного фильтра. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(3):348–60. https://doi.org/10.30895/2221-996X-2023-23-3-348-360
6. Tsen JH, Lin YP, Huang HY, King VAN. Acceleration storage testing of freeze-dried immobilized Lactobaccilus acidophilus-fermented banana media. J Food Process Preserv. 2007;31(6):688–701. https://doi.org/10.1111/j.1745-4549.2007.00160.x
7. Muntu CM, Avanti C, Hayun H, Surini S. Stability study of spray freeze-dried insulin dry powder formulations used for nose-to-brain delivery. J Appl Pharm Sci. 2023;13(10):225–37. https://doi.org/10.7324/JAPS.2023.148983
8. Zhenhe X, Zihan D, Yuanxing Z, Xiaohong L, Qiyao W, Shuai S, Qin L. Shelf-life prediction and storage stability of Aeromonas bacteriophage vB_AsM_ZHF. Virus Research. 2023;323:198997. https://doi.org/10.1016/j.virusres.2022.198997
9. Shalaev E, Ohtake S, Mousa EM, Searles J, Nail S, Roberts CJ. Accelerated storage for shelf-life prediction of lyophiles: temperature dependence of degradation of amorphous small molecular weight drugs and proteins. J Pharm Sci. 2023;112(6):1509–22. https://doi.org/10.1016/j.xphs.2023.02.008
10. Ebrahim A, DeVore K, Fischer T. Limitations of accelerated stability model based on the Arrhenius equation for shelf life estimation of in vitro diagnostic products. Clin Chem. 2021;67(4):684–8. https://doi.org/10.1093/clinchem/hvaa282
11. Mitic S, Otenhajmer I, Damjanovic V. Predicting the stabilities of freeze-dried suspensions of Lactobacillus acidophilus by the accelerated storage test. Cryobiology. 1974;11(2):116–20. https://doi.org/10.1016/0011-2240(74)90300-9
12. Осин АВ, Червякова НС, Валова ТВ. Лиофилизация штаммов патогенных микроорганизмов на сублимационных установках разного типа и оценка качества полученных препаратов. Проблемы особо опасных инфекций. 2016;(3):66–70. https://doi.org/10.21055/0370-1069-2016-3-66-70
Об авторах
А. А. ВоропаевРоссия
Воропаев Андрей Андреевич
Петровский бульвар, д. 8, стр. 2, Москва, 127051
О. Ц. Цыдыпова
Цыдыпова Ольга Цыренжаповна
Петровский бульвар, д. 8, стр. 2, Москва, 127051
О. В. Фадейкина
Фадейкина Ольга Васильевна, канд. биол. наук
Петровский бульвар, д. 8, стр. 2, Москва, 127051
Д. С. Давыдов
Давыдов Дмитрий Сергеевич, канд. биол. наук
Петровский бульвар, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Воропаев А.А., Цыдыпова О.Ц., Фадейкина О.В., Давыдов Д.С. Оценка жизнеспособности тест-штамма Salmonella enterica subsp. enterica serovar Abony NCTC 6017 в ампулах и флаконах методом ускоренного хранения. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(4):467-475. https://doi.org/10.30895/2221-996X-2024-24-4-467-475
For citation:
Voropaev A.A., Cidipova O.T., Fadeikina O.V., Davydov D.S. Viability assessment of Salmonella enterica subsp. enterica serovar Abony NCTC 6017 in ampoules and vials by the accelerated shelf-life testing method. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(4):467-475. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-4-467-475


































