Перейти к:
Лекарственные препараты иммуноглобулина человека против гепатита В: вопросы стандартизации
https://doi.org/10.30895/2221-996X-2025-621
Резюме
ВВЕДЕНИЕ. Специфический иммуноглобулин человека получают из плазмы крови иммунизированных доноров и применяют для иммунопрофилактики вирусного гепатита В. Основная проблема при контроле качества таких препаратов и оценке их профилактической эффективности связана с отсутствием стандартных образцов, аттестованных по содержанию антител к поверхностному антигену вируса гепатита В. Систематизация и анализ существующего лабораторного и производственного опыта в данной области нужны для выработки новых подходов к стандартизации препаратов иммуноглобулина человека против гепатита В.
ЦЕЛЬ. Охарактеризовать лекарственные препараты иммуноглобулина человека против гепатита В и рассмотреть подходы к их стандартизации.
ОБСУЖДЕНИЕ. Большая часть препаратов иммуноглобулина человека против гепатита В разработана в Германии (27%), Италии (17%) и США (17%). Из всех препаратов 67% выпускается в лекарственной форме для внутримышечного введения, 30% — для внутривенного введения, 3% — для подкожного введения. Специфическая активность указанных лекарственных средств варьирует от 50 до 500 МЕ/мл. В России зарегистрировано три наименования препарата, содержащего специфический иммуноглобулин человека. Количество вводимых в гражданский оборот лекарственных средств не в полной мере покрывает потребности лечебно-профилактических учреждений. Эффективность иммунопрофилактики напрямую зависит от дозы препарата, которую рассчитывают исходя из специфической активности. Для обеспечения точности определения указанного показателя качества следует использовать стандартный образец содержания антител к поверхностному антигену вируса гепатита В, аттестованный в международных единицах. Существующий международный стандарт специфического иммуноглобулина человека ограниченно доступен для приобретения на территории Российской Федерации, а национальный (фармакопейный) стандартный образец отсутствует.
ЗАКЛЮЧЕНИЕ. Анализ данных о выпускаемых препаратах иммуноглобулина человека против гепатита В позволил выявить современные направления развития данной сферы фарминдустрии. Разработка и применение национального (фармакопейного) стандартного образца содержания антител к поверхностному антигену вируса гепатита В будет способствовать повышению качества продукции и эффективности иммунопрофилактики.
Ключевые слова
Для цитирования:
Коновалова Е.A., Калинина Е.Н., Кормщикова Е.С., Росина Е.В., Зиганшина С.E., Воробьев К.А., Парамонов И.В. Лекарственные препараты иммуноглобулина человека против гепатита В: вопросы стандартизации. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):170-181. https://doi.org/10.30895/2221-996X-2025-621
For citation:
Konovalova E.A., Kalinina E.N., Kormshchikova E.S., Rosina E.V., Ziganshina S.E., Vorobiev K.A., Paramonov I.V. Human hepatitis B immunoglobulins: Standardisation issues. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):170-181. (In Russ.) https://doi.org/10.30895/2221-996X-2025-621
ВВЕДЕНИЕ
Вирусный гепатит B (ВГВ) — инфекционное заболевание с преимущественным поражением печени и возможным исходом в цирроз и гепатоцеллюлярную карциному у лиц с хронической формой1. Эта патология является серьезной проблемой для глобального здравоохранения. По оценке Всемирной организации здравоохранения (ВОЗ) в мире насчитывается >250 млн человек с диагнозом хронического ВГВ и ежегодно регистрируется ≈1,2 млн новых случаев инфекции2. В Российской Федерации за последнее десятилетие заболеваемость ВГВ снижается: количество вновь выявленных случаев заражения ВГВ сократилось в 4 раза (с 1,32 до 0,33 на 100 тыс. населения)3. При положительной тенденции к уменьшению распространенности заболевания полная элиминация вируса не достигнута, о чем свидетельствуют летальные исходы, в том числе среди детского населения (1 летальный случай в 2021 г., 2 — в 2022 г.)4.
С целью формирования активного иммунитета, то есть достижения концентрации антител к поверхностному антигену вируса гепатита В (анти-HBsAg) в крови не менее 10 МЕ/л, рекомендуется проведение иммунизации вакцинами на основе очищенного поверхностного антигена вируса гепатита В (HBsAg)5 [1]. Современные вакцины получают с помощью технологий рекомбинантной ДНК. Они содержат в своем составе HBsAg серотипов ayw и adw, которые наиболее распространены на территории нашей страны, поэтому считается, что любая подобная вакцина может обеспечить защиту населения от инфицирования вирусом гепатита В.
В Российской Федерации вакцинация против ВГВ включена в национальный календарь профилактических прививок6, но 100% охват населения не достигнут. Наиболее защищены от инфекции дети (97% вакцинированных) и взрослые в возрасте от 18 до 35 лет (98% вакцинированных). Самый низкий процент иммунизированного населения наблюдается среди лиц старше 60 лет (44% вакцинированных)7.
Поддержание максимально высокого уровня вакцинации населения Российской Федерации является одной из приоритетных задач профилактики ВГВ. Показана роль активно-пассивной иммунизации в иммунопрофилактике ВГВ, предусматривающей одновременное введение иммуноглобулина человека против гепатита В (ИГЧГВ) и вакцины8 [2–5]. Такая схема введения обеспечивает немедленную пассивную защиту от заражения после контакта с инфекцией за счет поступления в кровоток специфического иммуноглобулина и долгосрочную иммунизацию путем выработки собственных анти-HBsAg в ответ на введение вакцины [6].
Эффективность пассивной иммунопрофилактики зависит от специфической активности ИГЧГВ, которая характеризуется концентрацией анти-HBsAg. Ее определяют с использованием стандартных образцов (СО), аттестованных в международных единицах (МЕ), в иммуноферментном анализе9. Это позволяет унифицировать результаты тестирования и повысить точность определения основного показателя качества ИГЧГВ.
Изучение и систематизация информации о производстве, стандартизации и применении лекарственных препаратов ИГЧГВ позволит выявить существующие проблемы в данной сфере и определить пути их решения.
Цель работы — охарактеризовать лекарственные препараты иммуноглобулина человека против гепатита В и рассмотреть подходы к их стандартизации.
Проанализированы данные научных публикаций и нормативных актов в области профилактики ВГВ, производства и стандартизации ИГЧГВ. Информационный поиск проведен в электронных библиотеках PubMed, eLIBRARY и справочно-правовой системе «Консультант плюс».
ОСНОВНАЯ ЧАСТЬ
Механизм действия и показания к применению иммуноглобулина человека против вируса гепатита В
Действующим веществом в составе ИГЧГВ является анти-HBsAg. Терапевтический эффект препарата достигается за счет высокоаффинного связывания специфических антител с HBsAg, который является основным компонентом оболочки вириона. Анти-HBsAg ориентированы преимущественно на связывание с α-детерминантой указанного антигена [7][8], что обеспечивает защиту от вируса гепатита В всех серотипов. Противовирусный иммунитет формируется при нейтрализации вируса в кровотоке посредством блокирования рецепторов, отвечающих за связывание вируса с мембраной клетки-мишени [9]. Известно также, что анти-HBsAg способны экранировать клеточные рецепторы и эндоцитировать в гепатоциты, препятствуя проникновению вирионов в цитоплазму клетки [10].
При внутривенной инфузии ИГЧГВ сразу попадает в системный кровоток. Происходит его перераспределение между плазмой и внесосудистым пространством. Биодоступность такой лекарственной формы составляет 100%, а период полувыведения — в среднем 22 сут. Внутримышечное введение препарата позволяет создать максимальную концентрацию антител в крови только через 24 ч с периодом полувыведения от 4 до 5 нед. Утилизируется иммуноглобулин клетками ретикулоэндотелиальной системы10.
Введение ИГЧГВ показано лицам с недостаточной напряженностью поствакцинального иммунитета, которые нуждаются в постоянной профилактике по причине непрерывного риска инфицирования ВГВ11. Экстренная профилактика заболевания с применением данного препарата рекомендована в случае контакта с инфицированным материалом. Вирус может проникнуть в организм через поврежденные кожные покровы и слизистые оболочки при попадании на них зараженного биоматериала, при незащищенном половом акте, через плаценту от матери к плоду [11–15]. Применение ИГЧГВ показано лицам, контактирующим с носителями HBsAg или больными острым ВГВ; детям, рожденным от инфицированных матерей; медицинскому персоналу, работающему с кровью, ее компонентами и препаратами; не вакцинированным против гепатита В пациентам, регулярно получающим гемотрансфузии и препараты крови. ИГЧГВ применяют с целью иммунопрофилактики в комплексе с вакциной12 [6][16]. ИГЧГВ может быть использован для лечения легких и среднетяжелых форм острого ВГВ13.
Технологии производства иммуноглобулина человека против гепатита В
Лекарственные препараты ИГЧГВ производят из плазмы человека для фракционирования, заготовленной от здоровых вакцинированных доноров. Для вакцинации обычно используют доступные рекомбинантные вакцины против гепатита В: «Вакцина гепатита В рекомбинантная дрожжевая» (ЗАО НПК «Комбиотех», Россия)14 и «Регевак® В вакцина против гепатита В, рекомбинантная дрожжевая жидкая» (АО «Биннофарм», Россия)15. Вакцины производят на основе поверхностных антигенов вируса серотипов ayw и adw, что обеспечивает выработку у доноров высокопротективных специфических антител, активных в отношении наиболее распространенных серотипов вируса. Оценку напряженности иммунитета осуществляют через 30 сут после вакцинации. К донации иммуноспецифической плазмы допускают лиц, в сыворотке крови которых содержатся анти-HBsAg в концентрации не менее 7 МЕ/мл16. Для производства ИГЧГВ используется сырье, соответствующее требованиям Государственной фармакопеи Российской Федерации и не представляющее опасности заражения гемотрансмиссивными инфекциями17.
Иммуноглобулиновые препараты получают путем фракционирования донорской плазмы. В Российской Федерации нашел применение метод холодового этанольного фракционирования по Cohn [17]. Он включает в себя осаждение фибриногена; выделение и очистку фракции β- и γ-глобулинов; осаждение β-глобулинов и липоидов; выделение, концентрирование и очистку γ-глобулинов. Фракцию иммуноглобулинов класса G (IgG) с чистотой более 97% и минимальным содержанием примесей получают при соблюдении всех условий фракционирования. Высокая степень чистоты препаратов ИГЧГВ, а также инактивация и/или удаление патогенов (таких, как ВИЧ, вирусы гепатитов В и С) достигается благодаря включению в технологию производства следующих стадий: сольвент / детергентная обработка; противовирусная фильтрация; хроматографическая очистка; выдерживание при рН 4,0–4,5 и температуре 37 °С в течение 48 ч [18].
В Японии из-за нехватки гипериммунного сырья разрабатывают рекомбинантный противогепатитный иммуноглобулин на основе экспрессирующих анти-HBsAg B-клеток, которые получают от вакцинированных лиц после введения им одной бустерной дозы вакцины против гепатита В. В-клетки получают с использованием гибридомной технологии (мононуклеарные клетки периферической крови, трансформированные вирусом Эпштейна–Барр и гибридизованные с линией клеток миеломы) или сортировкой антигенспецифических В-клеток памяти. Комплементарную ДНК, кодирующую тяжелую и легкую цепи целевого антитела, клонируют в вектор экспрессии IgG1 и трансфицируют в клетки Expi293F (культура клеток, происходящая из клеток эмбриональной почки человека HEK293). Полученные рекомбинантные моноклональные антитела демонстрируют более сильную нейтрализующую активность in vitro, чем используемый в настоящее время ИГЧГВ [19]. Разработка таких препаратов является сложной задачей в связи с ограниченным доступом к техническим и финансовым ресурсам, а вывод на рынок представляется в весьма отдаленной перспективе.
Мировая практика применения иммуноглобулина человека против гепатита В
К настоящему времени показана результативность иммунопрофилактики с применением ИГЧГВ после трансплантации печени. Отмечено, что при введении ИГЧГВ в высоких дозах в течение длительного времени снижается риск рецидива антигенемии HBsAg (циркуляция указанного антигена в крови) [20][21]. Анализ результатов исследований позволил сделать вывод об эффективности применения ИГЧГВ в комбинации с вакциной и противовирусными препаратами. В этих случаях отмечено снижение риска рецидива заболевания до 50% [22–27].
Консультативным комитетом по практике иммунизации США (Advisory Committee on Immunization Practices) рекомендовано новорожденным от HBsAg-позитивных матерей в первые 12 ч жизни одновременное введение одной дозы ИГЧГВ (0,5 мл) внутримышечно и первой дозы вакцины против гепатита В. Совместное применение ИГЧГВ и вакцины требуется пациентам в случае контакта с зараженным биоматериалом, незащищенного полового акта или использования одной иглы с инфицированным лицом [6][28][29]. Рекомендации не изменились при пересмотре в 2018 г. и до сих пор используются для обоснования постконтактной иммунопрофилактики заболевания, предотвращения внутриутробного инфицирования ВГВ и дородовой иммунопрофилактики женщин [30][31]. Считается, что комбинированная профилактика способна предупреждать перинатальную передачу вируса от матери ребенку во время беременности. Пассивная и активная иммунопрофилактика ВГВ при рождении в комбинации с применением противовирусных препаратов лежат в основе ключевой стратегии ВОЗ по глобальной элиминации вируса к 2030 г. [32–35].
Опыт применения ИГЧГВ, накопленный специалистами разных стран, свидетельствует о его значимой роли в иммунопрофилактике заболевания, поэтому в таблице 1 приведены результаты информационного поиска наиболее распространенных в мире препаратов ИГЧГВ.
Таблица 1. Наиболее распространенные в мире препараты иммуноглобулина человека против гепатита В
Table 1. The most common human hepatitis B immunoglobulins in the world
Торговое наименование препаратов Trade name | Специфическая активность (содержание анти-HBsAg, МЕ/мл) Potency (anti-HBsAg content, IU/mL) | Лекарственная форма Dosage form |
Германия / Germany | ||
Гапатитис В Иммуноглобулин P Бейринг Hepatitis B Immunoglobulin P Behring® | 200 МЕ/мл / 200 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Гепатект Hepatect® | 50 МЕ/мл / 50 IU/mL | Раствор для внутривенного введения Solution for intravenous administration |
Наби-ГВ Nabi-HB® | >312 МЕ/мл / >312 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Наби-ГВ НоваПлюс Nabi-HB NovaPlus® | >312 МЕ/мл / >312 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Зутектра Zutectra® | 500 МЕ/мл / 500 IU/mL | Раствор для подкожного введения Solution for subcutaneous administration |
Г-БИГ H-BIG® | 220 МЕ/мл / 220 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Байхеп В Bayhep B® | 217 МЕ/мл / 217 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Неогепатект Neohepateсt® | 50 МЕ/мл / 50 IU/mL | Раствор для внутривенного введения Solution for intravenous administration |
Италия / Italy | ||
Уман Биг UMAN-BIG® | 180 МЕ/мл / 180 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Венбиг VENBIG® | 50 МЕ/мл / 50 IU/mL | Раствор для внутривенного введения Solution for intravenous administration |
Гаймабиг Haimabig® | 180 МЕ/мл / 180 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Гепуман В Hepuman B® | 100 МЕ/мл / 100 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
ИммуноHBs IMMUNOHBs® | 180 МЕ/мл / 180 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
США / USA | ||
ГепаГам B HepaGam B® | >312 МЕ/мл / >312 IU/mL | Раствор для внутривенного введения Solution for intravenous administration |
ГепаГам B НоваПлюс HepaGam B NovaPlus® | >312 МЕ/мл / >312 IU/mL | Раствор для внутримышечного введения (возможно подкожное введение) Solution for intramuscular administration (subcutaneous administration is possible) |
ГиперГЕП B HyperHEP B® | >220 МЕ/мл / >220 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Геп-B-Гаммаджи Hep-B-Gammagee® | 220 МЕ/мл / 220 IU/mL | Раствор для внутривенного введения Solution for intravenous administration |
Игантибе Igantibe® | 200 МЕ/мл / 200 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Российская Федерация / Russian Federation | ||
Антигеп® Antihep® | 100 МЕ/доза / 100 IU/dose | Раствор для внутримышечного введения Solution for intramuscular administration |
Антигеп-Нео® Иммуноглобулин человека против гепатита В хроматографически очищенный Antihep-Neo®, human hepatitis B immunoglobulin, purified by chromatography | 50 МЕ/мл / 50 IU/mL | Раствор для инфузий Solution for infusion |
Великобритания / Great Britain | ||
Иммуногам ImmunoGam® | >312 МЕ/мл / >312 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Гаммаглоб Антигепатитис BP Gammaglob Antihepatitis BP® | >312 МЕ/мл / >312 IU/mL | Раствор для внутривенного введения Solution for intravenous administration |
Австрия / Austria | ||
Аунатив Aunativ® | 200 МЕ/мл / 200 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Индия / India | ||
Эль-геп El-Hep® | 100 МЕ/мл / 100 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
ЮАР / South Africa | ||
ГебаГам ИМ HebaGam IM® | 100 МЕ/мл / 100 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Япония / Japan | ||
Гебсбулин-ИГ Hebsbulin-IH® | 200 МЕ/мл / 200 IU/mL | Раствор для внутривенного введения Solution for intravenous administration |
Малайзия / Malaysia | ||
Гепабиг Hepabig® | 200 МЕ/мл / 200 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Швейцария / Switzerland | ||
Гепуман Берна Hepuman Berna® | 200 МЕ/мл / 200 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Франция / France | ||
Гамма Глоб Антигепа В Gamma Glob Antihepa B® | >312 МЕ/мл / >312 IU/mL | Раствор для внутривенного введения Solution for intravenous administration |
Украина / Ukraine | ||
Гепатоиммун® Hepatoimmun | 50 МЕ/мл / 50 IU/mL | Раствор для внутримышечного введения Solution for intramuscular administration |
Таблица составлена авторами / The table is prepared by the authors
Примечание. МЕ — международная единица.
Note. IU, international unit.
Специфическая активность препаратов ИГЧГВ, представленных на мировом фармацевтическом рынке (табл. 1), варьирует от 50 до 500 МЕ/мл. Из них 67% выпускается в лекарственной форме для внутримышечного введения, 30% — для внутривенного введения, 3% — для подкожного введения. Больше всего препаратов разработано в Германии (27%), Италии (17%) и США (17%). На долю Российской Федерации, Великобритании, Австрии, Индии, ЮАР, Японии, Малайзии, Швейцарии, Франции и Украины суммарно приходится 39% выпускаемого ИГЧГВ (рис. 1).
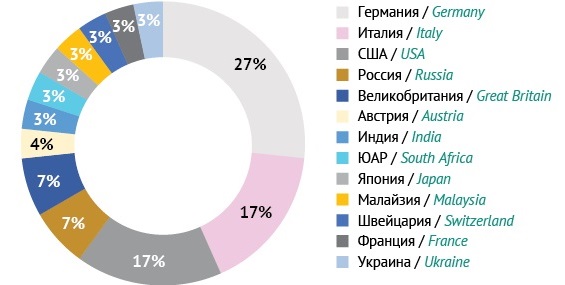
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Доля препаратов иммуноглобулина человека против гепатита В, разработанных в разных странах мира.
Fig. 1. Percentage of human hepatitis B immunoglobulins developed in different countries of the world.
Российская практика применения иммуноглобулина человека против гепатита В
Первым стандартизованным ИГЧГВ в Российской Федерации считается лекарственный препарат для внутримышечного введения Антигеп®, содержащий 100 МЕ/доза анти-HBsAg (по данным метода ИФА). При совместной работе ФГУП «Пермский НПО «Биомед», Пермской государственной медицинской академии им. академика Е.А. Вагнера, ЗАО НПК «Комбиотех» и ряда лечебно-профилактических учреждений Перми проведены клинические исследования безопасности и иммунологической эффективности активно-пассивной иммунопрофилактики новорожденных от HBsAg-позитивных матерей при использовании комбинации данного препарата и вакцины против гепатита В [36–39]. Показано отсутствие различий частоты появления и характера нежелательных явлений у пациентов, получавших препарат и вакцину, и пациентов из группы сравнения (получали только вакцину) по схеме 0–1–2 мес. Вводимые с ИГЧГВ антитела не только не снижали иммунологическую эффективность вакцины, но и создавали защиту в течение периода времени, необходимого для выработки собственных антител.
В 2003 г. был запатентован способ лечения острого вирусного гепатита В, заключающийся во введении разовой дозы препарата Антигеп® в объеме 0,1 мл/кг массы тела один раз в день в течение трех дней [40]. В 2023 г. АО «НПО «Микроген» получило регистрационное удостоверение на первый отечественный ИГЧГВ для внутривенного введения — Антигеп-Нео®, изготавливаемый на основе вирусинактивации и хроматографической очистки с концентрацией специфических антител 50 МЕ/мл18. В настоящее время препарат зарегистрирован по процедуре Евразийского экономического союза.
В Российской Федерации зарегистрировано три препарата ИГЧГВ: Антигеп® (рег. № Р N000073/01 от 25.01.2012) и Антигеп-Нео® (рег. № ЛП-№ (005326)–(РГ–RU) от 26.04.2024) отечественного производства, а также Неогепатект (рег. № Р N015018/01 от 25.11.2008), выпускаемый в Германии19. Препараты представляют собой иммуноглобулины класса G, выделенные из плазмы крови доноров, вакцинированных против ВГВ. Препараты выпускают в форме растворов для внутримышечного (Антигеп®) и внутривенного введения (Антигеп-Нео®, Неогепатект)20. За последние 5 лет в Россию ввезено 15 партий зарубежного препарата, однако это количество полностью не покрывает потребности лечебно-профилактических учреждений21. Препаратов Антигеп® и Антигеп-Нео® в настоящее время нет в гражданском обороте22. Развитие отечественной фарминдустрии лекарственных препаратов ИГЧГВ будет в значительной степени способствовать импортозамещению в области производства лекарственных средств для иммунопрофилактики ВГВ и повышению уровня защиты населения Российской Федерации от инфицирования вирусом гепатита В.
Стандартизация лекарственных препаратов на основе иммуноглобулинов человека против гепатита В
Стандартизация лекарственных препаратов заключается в проведении контроля качества, обеспечении точности и метрологической прослеживаемости результатов тестирования. В Государственной фармакопее Российской Федерации есть рекомендации использовать аттестованные СО в целях стандартизации. К ним относят вещества, посредством сравнения с которыми осуществляют оценку показателей качества лекарственных средств с помощью физико-химических и биологических методов для подтверждения соответствия требованиям нормативной документации23. Применение СО обеспечивает унификацию и точность результатов тестирования, а следовательно, приемлемо низкий риск некорректного заключения о качестве готовой продукции [41]. Стандартизация служит неотъемлемой частью метрологического обеспечения аналитических методик в фармацевтическом производстве и дает возможность оценивать правильность и стабильность работы тест-систем и лабораторного оборудования [42–44].
Эффективность иммунопрофилактики зависит от дозы препарата, которую рассчитывают исходя из его специфической активности. Эта характеристика — основной показатель качества ИГЧГВ, которую оценивают по содержанию действующего вещества (анти-HBsAg). Показатель определяют методом ИФА при чувствительности разрешенных к применению в Российской Федерации тест-систем не ниже 10 МЕ/л24. Фармакологическое действие ИГЧГВ связано с высокой специфической активностью, которая в десятки тысяч раз превышает защитный уровень поствакцинальных антител. Согласно Государственной фармакопее Российской Федерации этот показатель должен быть не менее 100 и 50 МЕ/мл для препаратов, выпускаемых в форме растворов для внутримышечного и внутривенного введения соответственно. Требования к специфической активности импортных препаратов основаны на нормативных документах выпускающих стран.
При проведении тестирования используют СО, аттестованный в международных единицах25. В 2007 г. ВОЗ утвердила второй международный СО, который произведен в США из готовой серии препарата ИГЧГВ с концентрацией белка 50 г/л и до настоящего времени реализуется Национальным институтом биологических стандартов и контроля (NIBSC, Великобритания). Идентификационный номер продукта 07/164. СО представляет собой лиофилизат иммуноглобулина с содержанием анти-HBsAg 100 МЕ/ампула. Специалисты из 22 независимых лабораторий в 12 странах участвовали в работах по его аттестации. Специфическую активность определяли хемилюминесцентным, радиоиммунным и иммуноферментным методами с использованием 19 различных методик анализа [45]26.
Российские фармпроизводители зачастую не имеют возможности приобретения международного СО из-за логистических затруднений. Кроме того, в соответствии с требованиями отечественной нормативной документации в сфере разработки СО необходимо определять статистическую неопределенность аттестованного значения, а данный показатель для международного СО не оценивается [46]. В Российской Федерации на фармацевтическом рынке был представлен отраслевой стандартный образец ОСО-42-2815488, аттестованный по содержанию анти-HBsAg, который производили в Государственном научно-исследовательском институте стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича. В настоящее время его выпуск прекращен.
В Кировском научно-исследовательском институте гематологии и переливания крови ведутся исследования по разработке национального (фармакопейного) СО для определения специфической активности иммуноспецифической плазмы и получаемых из нее препаратов ИГЧГВ. Формируется донорский резерв для заготовки иммуноспецифической плазмы, получены кандидаты в СО в форме лиофилизата и проводятся испытания их стабильности [47–49].
ЗАКЛЮЧЕНИЕ
В настоящем исследовании систематизированы данные о механизме действия и технологии получения препаратов ИГЧГВ, клинической эффективности и показаниях к применению. Охарактеризована номенклатура лекарственных средств, выпускаемых как в Российской Федерации, так и за рубежом. Изложены подходы к стандартизации ИГЧГВ. Представлены сведения о существующих СО для оценки специфической активности препаратов.
Анализ литературы указал на значимость ИГЧГВ в иммунопрофилактике гепатита В и необходимость создания национального (фармакопейного) СО для оценки его специфической активности. Это будет способствовать стандартизации и повышению качества выпускаемых лекарственных средств и более эффективной профилактике вирусного гепатита В.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.А. Коновалова — анализ источников литературы, написание и оформление текста рукописи, формулировка выводов; Е.Н. Калинина, Е.С. Кормщикова — концепция работы, формулировка выводов, редактирование текста рукописи; Е.В. Росина, С.Е. Зиганшина — редактирование текста рукописи; К.А. Воробьев, И.В. Парамонов — участие в формулировке выводов, утверждение окончательной версии рукописи для публикации.
Благодарности. Коллектив авторов благодарит Н.М. Поздеева, Н.А. Зорину, С.В. Самарину, М.А. Логинову и Д.А. Дьяконова за ценные консультации при подготовке рукописи статьи.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. E.A. Konovalova analysed the literature, drafted and designed the manuscript, and formulated the conclusions. E.N. Kalinina and E.S. Kormshchikova conceptualised the study, formulated the conclusions, and edited the manuscript. E.V. Rosina and S.E. Ziganshina edited the manuscript. K.A. Vorobiev and I.V. Paramonov participated in the formulation of the conclusions and approved the final version of the manuscript for publication.
Acknowledgements. The author team thanks N.M. Pozdeev, N.A. Zorina, S.V. Samarina, M.A. Loginova, and D.A. Dyakonov for valuable advice in preparing the manuscript.
1. СанПиН 3.3686-21. Санитарно-эпидемиологические требования по профилактике инфекционных болезней.
2. Hepatitis B Newsletter. WHO; 2024.
3. Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2023 году». Роспотребнадзор; 2024.
4. Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2022 году». Роспотребнадзор; 2023.
5. Technical Report No. 978. Recommendations for the evaluation of animal cell cultures as substrates for the manufacture of biological medicinal products and for the characterization of cell banks. WHO; 2013.
6. Приказ Минздрава России от 06.12.2021 № 1122н «Об утверждении национального календаря профилактических прививок, календаря профилактических прививок по эпидемическим показаниям и порядка проведения профилактических прививок».
7. Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2023 году». Роспотребнадзор; 2024.
8. Клинические рекомендации «Острый гепатит B (ГB) у взрослых». Минздрав России; 2022.
Клинические рекомендации «Острый гепатит B (ОГВ) у детей». Минздрав России; 2021.
9. ФС.3.3.2.00012.18 Иммуноглобулин человека против гепатита В для внутримышечного введения. Государственная фармакопея Российской Федерации. XIV изд.; 2018.
ФС.3.3.2.00011.18 Иммуноглобулин человека против гепатита В для внутривенного введения. Государственная фармакопея Российской Федерации. XIV изд.; 2018.
10. Инструкция к препарату «Антигеп® (Иммуноглобулин человека против гепатита В)».
Инструкция к препарату «Антигеп-Нео® Иммуноглобулин человека против гепатита В хроматографически очищенный».
Инструкция к препарату «Неогепатект (Иммуноглобулин человека против гепатита В)».
11. Инструкция к препарату «Антигеп-Нео® Иммуноглобулин человека против гепатита В хроматографически очищенный».
12. Инструкция к препарату «Антигеп® (Иммуноглобулин человека против гепатита В)».
Инструкция к препарату «Антигеп-Нео® Иммуноглобулин человека против гепатита В хроматографически очищенный».
Инструкция к препарату «Неогепатект (Иммуноглобулин человека против гепатита В)».
13. Инструкция к препарату «Антигеп® (Иммуноглобулин человека против гепатита В)».
14. Инструкция к препарату «Вакцина Гепатита В рекомбинантная дрожжевая суспензия для внутримышечного введения».
15. Инструкция к препарату «Регевак® В (Вакцина против гепатита В, рекомбинантная дрожжевая жидкая)».
16. Приказ Минздрава России от 21.11.2022 № 750н «Об утверждении порядка иммунизации доноров для заготовки иммуноспецифической плазмы».
17. ФС.3.3.2.0001.18 Плазма человека для фракционирования. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
18. Инструкция к препарату «Антигеп-Нео® Иммуноглобулин человека против гепатита В хроматографически очищенный».
19. https://grls.minzdrav.gov.ru/
20. ФС.3.3.2.00012.18 Иммуноглобулин человека против гепатита В для внутримышечного введения. Государственная фармакопея Российской Федерации. XIV изд.; 2018.
ФС.3.3.2.00011.18 Иммуноглобулин человека против гепатита В для внутривенного введения. Государственная фармакопея Российской Федерации. XIV изд.; 2018.
21. https://roszdravnadzor.gov.ru/services/turnover
22. Там же.
23. Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств».
Technical report series № 932. WHO expert committee on biological standardization. WHO; 2006.
ОФС.1.1.0007 Стандартные образцы. Государственная фармакопея Российской Федерации. XV изд. Т. 1; 2024.
24. ФС.3.3.2.00012.18 Иммуноглобулин человека против гепатита В для внутримышечного введения. Государственная фармакопея Российской Федерации. XIV изд.; 2018.
ФС.3.3.2.00011.18 Иммуноглобулин человека против гепатита В для внутривенного введения. Государственная фармакопея Российской Федерации. XIV изд.; 2018.
25. Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств».
Technical report series № 932. WHO expert committee on biological standardization. WHO; 2006.
26. Second International Standart for anti-hepatitis B surface antigen (anti-HBs) immunoglobulin, human NIBSC code: 07/164 Instruction for use. WHO; 2008.
Список литературы
1. Озерецковский НА, Шалунова НВ, Петручук ЕМ, Индикова ИН. Вакцинопрофилактика гепатита В. Эпидемиология и вакцинопрофилактика. 2015;14(2):87–95. https://doi.org/10.31631/2073-3046-2015-14-2-87-95
2. Wei KP, Zhu FC, Liu JX, Yan L, Lu Y, Zhai XJ, et al. The efficacy of two different dosages of hepatitis B immunoglobulin combined with hepatitis B vaccine in preventing mother-to-child transmission of hepatitis B virus: A prospective cohort study. Vaccine. 2018;36(2):256–63. https://doi.org/10.1016/j.vaccine.2017.11.037
3. Zhou M, Li L, Han L, Sun F, Yi N. Breast-feeding is not a risk factor of mother-to-child transmission of hepatitis B virus. Int J Gen Med. 2021;14:1819–27. https://doi.org/10.2147/IJGM.S289804
4. Рулева АА, Харит СМ. Вакцинация детей, рожденных раньше срока. Журнал инфектологии. 2023;15(4):25–34. https://doi.org/10.22625/2072-6732-2023-15-4-25-34
5. Шабунин АВ, Сметанина СВ, Дроздов ПА. Результаты применения мультидисциплинарного подхода в лечении больных циррозом печени в исходе хронических вирусных гепатитов. Эффективная фармакотерапия. 2022;18(22):20–24. https://doi.org/10.33978/2307-3586-2022-18-22-20-24
6. Zuckerman JN. Review: Hepatitis B immune globulin for prevention of hepatitis B infection. J Med Virol. 2007;79(7):919–21. https://doi.org/10.1002/jmv.20816
7. Franco E, Bagnato B, Marino MG, Meleleo C, Serino L, Zaratti L. Hepatitis B: Epidemiology and prevention in developing countries. World J Hepatol. 2012;4(3):74–80. https://doi.org/10.4254/wjh.v4.i3.74
8. Moradi A, Zhand S, Ghaemi A, Javid N, Tabarraei A. Mutations in the S gene region of hepatitis B virus genotype D in Golestan Province–Iran. Virus Genes. 2012;44(3):382–7. https://doi.org/10.1007/s11262-012-0715-z
9. Gao Y, Zhang TY, Yuan Q, Xia NS. Antibody-mediated immunotherapy against chronic hepatitis B virus infection. Hum Vaccin Immunother. 2017;13(8):1768–73. https://doi.org/10.1080/21645515.2017.1319021
10. Schilling R, Ijaz S, Davidoff M, Lee JY, Locarnini S, Williams R, Naoumov NV. Endocytosis of hepatitis B immune globulin into hepatocytes inhibits the secretion of hepatitis B virus surface antigen and virions. J Virol. 2003;77(16):8882–92. https://doi.org/10.1128/jvi.77.16.8882-8892.2003
11. Das S, Ramakrishnan K, Behera SK. Hepatitis B vaccine and immunoglobulin: Key concepts. Clin Transl Hepatol. 2019; 7(2):165–71. https://doi.org/10.14218/JCTH.2018.00037
12. World Health Organisation. Hepatitis B vaccines: WHO position paper, July 2017 — Recommendations. Vaccine. 2019; 37(2):223–5. https://doi.org/10.1016/j.vaccine.2017.07.046
13. Akarsu M, Onem S, Turan I, Adali G, Akdogan M, Akyildiz M, et al. Recommendations for hepatitis B immunoglobulin and antiviral prophylaxis against hepatitis B recurrence after liver transplantation. Turk J Gastroenterol. 2021;32(9):712–9. https://doi.org/10.5152/tjg.2021.21608
14. Lee WC, Chou HS, Wu TH, Cheng CH, Lee CF, Wang YC, et al. Low-dose anti-hepatitis B immunoglobulin regimen as prophylaxis for hepatitis B recurrence after liver transplantation. Transpl Infect Dis. 2019;21(6):e13190. https://doi.org/10.1111/tid.13190
15. Каптильный ВА, Рейштат ДЮ, Беришвили МВ, Жолобова МН. Гепатиты В и С при беременности. Архив акушерства и гинекологии им. В.Ф. Снегирева. 2021;8(3):121–31. https://doi.org/10.17816/2313-8726-2021-8-3-121-131
16. Habib S, Shaikh OS. Hepatitis B immune globulin. Drugs Today (Barc). 2007;43(6):379–94. https://doi.org/10.1358/dot.2007.43.6.1050792
17. Петров ВФ, Николаева АМ, Казьянин АВ, Пархоменко ТГ, Борисова ВН, Мельникова ВА, Буданов МВ. Противовирусный препарат и способ получения иммуноглобулина для профилактики и лечения вирусных заболеваний. Патент Российской Федерации № 2144379; 2000. EDN: PYWECF
18. Кудашева ЭЮ, Борисевич ИВ, Бондарев ВП, Миронов АН. Технологические аспекты обеспечения вирусной безопасности препаратов иммуноглобулинов человека. Медицинская иммунология. 2015;17:270–1. EDN: UQDDVV
19. Furuta RA, Yasui T, Minamitani T, Akiba H, Toyoda C, Tobita R, et al. Development of a recombinant hepatitis B immunoglobulin derived from B cells collected from healthy individuals administered with hepatitis B virus vaccines: A feasibility study. Transfusion. 2023;63(6):1204–14. https://doi.org/10.1111/trf.17382
20. Krüger M. European hepatitis B immunoglobulin trials: Prevention of recurrent hepatitis B after liver transplantation. Clin Transplant. 2000;14(2):14–9. PMID: 10965959
21. Shouval D, Samuel D. Hepatitis B immuneglobulin to prevent hepatitis B virus graft reinfection following liver transplantation: A concise review. Hepatology. 2000;32(6):1189–95. https://doi.org/10.1053/jhep.2000.19789
22. Yan ML, Yan LN, Li B, Zeng Y, Wen TF, Wang WT, et al. Intramuscular hepatitis B immune globulin combined with lamivudine in prevention of hepatitis B recurrence after liver transplantation. Hepatobiliary Pancreat Dis Int. 2006;5(3):360–3. PMID: 16911931
23. Angus PW, Patterson SJ. Liver transplantation for hepatitis B: What is the best hepatitis B immune globulin/antiviral regimen? Liver Transpl. 2008;14(2):S15–22. https://doi.org/10.1002/lt.21614
24. Filipponi F, Franchello A, Carrai P, Romagnoli R, De Simone P, Woodward MK, et al. Efficacy, safety, and pharmacokinetics of intramuscular hepatitis B immune globulin, Igantibe, for the prophylaxis of viral B hepatitis after liver transplantation. Dig Liver Dis. 2010;42(7):509–14. https://doi.org/10.1016/j.dld.2009.09.005
25. Selcuk H, Karakayali H, Haberal M. Liver transplant and chronic hepatitis B virus infection. Exp Clin Transplant. 2011;9(2):94–7. PMID: 21453226
26. De Simone P, Romagnoli R, Tandoi F, Carrai P, Ercolani G, Peri E, et al. Early introduction of subcutaneous hepatitis B immunoglobulin following liver transplantation for hepatitis B virus infection: A prospective, multicenter study. Transplantation. 2016;100(7):1507–12. https://doi.org/10.1097/TP.0000000000001171
27. Park JS, Gayam V, Pan CQ. Review article: Preventing hepatitis B graft infection in hepatitis B patients after liver transplantation: immunoglobulin vs anti-virals. Aliment Pharmacol Ther. 2020;52(6):944–54. https://doi.org/10.1111/apt.15999
28. Mast EE, Margolis HS, Fiore АE, Brink EW, Goldstein ST, Wang SA, et al. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: Recommendation of the Advisory Committee on Immunization Practices (ACIP). Part I: Immunization of infants, children, and adolescents. MMWR Recomm Rep. 2005;54(RR-16):1–31. PMID: 16371945
29. Mast EE, Weinbaum CM, Fiore AE, Alter MJ, Bell BP, Finelli L, et al. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States: Recommendation of the Advisory Committee on Immunization Practices (ACIP). Part II: Immunization of adults. MMWR Recomm Rep. 2006;55(RR-16):1–33. PMID: 17159833
30. Schillie S, Vellozzi C, Reingold A, Harris A, Haber P, Ward JW, Nelson NP. Prevention of hepatitis B Virus infection in the United States: Recommendations of the Advisory Committee on Immunization Practices. MMWR Recomm Rep. 2018;67(1):1–31. https://doi.org/10.15585/mmwr.rr6701a1
31. Garofoli GK. Updated vaccination and screening recommendations for hepatitis B: Implications for pharmacists. J Am Pharm Assoc. 2024;64(5):102150. https://doi.org/10.1016/j.japh.2024.102150
32. Veronese P, Dodi I, Esposito S, Indolfi G. Prevention of vertical transmission of hepatitis B virus infection. World J Gastroenterol. 2021;27(26):4182–93. https://doi.org/10.3748/wjg.v27.i26.4182
33. Wang H, Fang JW, Gu ZW, Song DJ, Chen Y, Chen GD, et al. Application of hepatitis B immunoglobulin in prevention of mother-to-child transmission of chronic hepatitis B in HBsAg- and HBeAg-positive mother. J Obstet Gynaecol. 2022;42(5): 877–82. https://doi.org/10.1080/01443615.2021.1946495
34. Zubkova I, Zhao Y, Cui Q, Kachko A, Gimie Y, Chabot S, et al. Assessing the impact of hepatitis B immune globulin (HBIG) on responses to hepatitis B vaccine during co-administration. Vaccine. 2023;41(4):955–64. https://doi.org/10.1016/j.vaccine.2022.12.055
35. You H, Wang F, Li T, Xu X, Sun Y, Nan Y, et al. Guidelines for the prevention and treatment of chronic hepatitis B (version 2022). J Clin Transl Hepatol. 2023;11(6):1425–42. https://doi.org/10.14218/JCTH.2023.00320
36. Казьянин АВ, Ведерникова НВ, Вязникова ТВ, Пленкина СВ. Изучение фармакодинамики анти-HBs при разных схемах введения препарата АНТИГЕП и вакцины против гепатита B в эксперименте. В кн.: Материалы Всероссийской научной конференции «Актуальные вопросы вакцинно-сывороточного дела в ХХI веке». Пермь; 2003. С. 86–9.
37. Казьянин АВ, Пленкина СВ, Николаева АМ, Борисова ВН, Ведерникова НВ, Вашин АЛ. Оценка реактогенности отечественного специфического иммуноглобулина человека против гепатита В АНТИГЕП и комбинированной вакцины БУБО-М при иммунизации контактных лиц в очагах. В кн.: Материалы Всероссийской научной конференции «Актуальные вопросы вакцинно-сывороточного дела в ХХI веке». Пермь; 2003. С. 122–5.
38. Казьянин АВ, Пленкина СВ, Фельдблюм ИВ, Борисова ВН. Сравнительная оценка различных схем иммунизации против гепатита В детей в закрытых организованных коллективах. Пермский медицинский журнал. 2004;(2):103–7.
39. Воробьева НН, Казьянин АВ, Борисова ВН, Мышкина ОК, Рысинская ТК, Николаева АМ, Дедова ОВ. Эффективность специфического иммуноглобулина (Антигеп) при остром вирусном гепатите В. Эпидемиология и вакцинопрофилактика. 2004;(2):13–6.
40. Борисова ГН, Николавева АМ, Воробьева НН, Казьянин АВ, Рысинская ТН, Мышкина ОК, Дедова ОВ. Способ лечения острого вирусного гепатита В. Патент Российской Федерации № 2240824; 2003. EDN: BQDTLP
41. Леонтьев ДА. Система вторичных стандартных образцов в лабораториях контроля качества лекарственных средств. Ведомости Научного центра экспертизы средств медицинского применения. 2016;(1):50–5. EDN: VSBDNX
42. Меркулов ВА, Саканян ЕИ, Волкова РА, Климов ВИ, Шемерянкина ТБ, Яшкир ВА. Фармакопейные стандартные образцы и практика их применения в отечественной системе стандартизации лекарственных средств. Химико-фармацевтический журнал. 2016;50(4):40–3. https://doi.org/10.30906/0023-1134-2016-50-4-40-43
43. Борисевич ИВ, Кудашева ЭЮ, Перелыгина ОВ, Миронов АН, Меркулов ВА, Бондарев ВП и др. Состояние проблемы стандартизации специфических иммуноглобулинов и антитоксических сывороток. Медицинская иммунология. 2015;17(S):379. EDN: UQDDMF
44. Волкова РА, Фадейкина ОВ, Устинникова ОБ, Саркисян КА, Мовсесянц АА, Меркулов ВА, Косенко ВВ. Требования к материалам раздела по стандартным образцам, представляемым в досье на биологические лекарственные средства. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):7–20. https://doi.org/10.30895/2221-996X-2024-24-1-7-20
45. Ferguson M, Yu MW, Heath A. Calibration of the second International Standard for hepatitis B immunoglobulin in an international collaborative study. Vox Sang. 2010;99(1):77–84. https://doi.org/10.1111/j.1423-0410.2010.01314.x
46. Волкова РА, Фадейкина ОВ, Климов ВИ, Саканян ЕИ, Олефир ЮВ, Меркулов ВА и др. Актуальные вопросы стандартных образцов в сфере обращения биологических лекарственных средств. БИОпрепарты. Профилактика, диагностика, лечение. 2016;16(4):229–36. EDN: XEHMCB
47. Коновалова ЕА, Кормщикова ЕС. Стандартизация лекарственных препаратов иммуноглобулина человека против гепатита В по показателю качества «Специфическая активность» (обзор литературы). В кн.: Материалы XIV Всероссийской научной конференции «Молодая фармация — потенциал будущего». СПб.: СПХФУ; 2024. С. 624–7.
48. Коновалова ЕА, Калинина ЕН, Росина ЕВ, Зиганшина СЕ, Кормщикова ЕС. Поиск потенциальных доноров иммуноспецифической плазмы, содержащей антитела к поверхностному антигену вируса гепатита В. В кн.: Материалы XIV Всероссийской научной конференции «Молодая фармация — потенциал будущего». СПб.: СПХФУ; 2024. С. 47–8.
49. Коновалова ЕА, Росина ЕВ, Калинина ЕН, Зиганшина СЕ, Пивошенко ЯД, Кормщикова ЕС. Получение кандидатов в стандартный образец иммуноглобулина человека против гепатита В. В кн.: Материалы научно-практической конференции молодых ученых и специалистов «Актуальные вопросы трансфузиологии и онкогематологии». Киров; 2024. С. 43–52. EDN: LNORWG
Об авторах
Е. A. КоноваловаРоссия
Коновалова Екатерина Анатольевна
ул. Красноармейская, д. 72, Киров, 610027
Е. Н. Калинина
Россия
Калинина Елена Николаевна
ул. Красноармейская, д. 72, Киров, 610027
Е. С. Кормщикова
Россия
Кормщикова Елена Сергеевна, канд. биол. наук
ул. Красноармейская, д. 72, Киров, 610027
Е. В. Росина
Россия
Росина Елена Владимировна
ул. Красноармейская, д. 72, Киров, 610027
С. E. Зиганшина
Россия
Зиганшина Светлана Евгеньевна
ул. Красноармейская, д. 72, Киров, 610027
К. А. Воробьев
Россия
Воробьев Константин Анатольевич, д-р биол. наук
ул. Красноармейская, д. 72, Киров, 610027
И. В. Парамонов
Россия
Парамонов Игорь Владимирович, д-р мед. наук
ул. Красноармейская, д. 72, Киров, 610027
Дополнительные файлы
Рецензия
Для цитирования:
Коновалова Е.A., Калинина Е.Н., Кормщикова Е.С., Росина Е.В., Зиганшина С.E., Воробьев К.А., Парамонов И.В. Лекарственные препараты иммуноглобулина человека против гепатита В: вопросы стандартизации. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):170-181. https://doi.org/10.30895/2221-996X-2025-621
For citation:
Konovalova E.A., Kalinina E.N., Kormshchikova E.S., Rosina E.V., Ziganshina S.E., Vorobiev K.A., Paramonov I.V. Human hepatitis B immunoglobulins: Standardisation issues. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):170-181. (In Russ.) https://doi.org/10.30895/2221-996X-2025-621


































