Перейти к:
Иммуногенность «ГамЖВК, живой вакцины интраназального применения для профилактики коклюша» у взрослых добровольцев: слепое рандомизированное плацебо-контролируемое исследование по оптимизации метода и схемы введения
https://doi.org/10.30895/2221-996X-2025-610
Резюме
ВВЕДЕНИЕ. Применяемые в настоящее время вакцины, содержащие бесклеточный или цельноклеточный коклюшный компонент, не обеспечивают стерильность иммунитета и его необходимую продолжительность, не предотвращают передачу возбудителя и распространение инфекции. Ранее живая вакцина интраназального применения для профилактики коклюша ГамЖВК прошла необходимые доклинические исследования и клиническое исследование, в котором была определена оптимальная доза для однократной вакцинации.
ЦЕЛЬ. Оптимизация метода и схемы введения ГамЖВК, живой вакцины интраназального применения для профилактики коклюша, по показателям иммуногенности в клиническом исследовании у здоровых взрослых добровольцев от 18 до 40 лет.
МАТЕРИАЛЫ И МЕТОДЫ. В слепом рандомизированном плацебо-контролируемом исследовании приняли участие 50 здоровых взрослых добровольцев, распределенных в 2 группы по методу введения ГамЖВK — капельно и распылением. Проведена оценка эффективности двух схем введения — однократно и двукратно с интервалом 60 сут. Для анализа использовали аспираты из носо- и ротоглотки, образцы сыворотки крови и мононуклеаров периферической крови добровольцев. Уровень специфических IgM-, IgA-, IgG-антител в сыворотке крови и секреторного IgA в аспиратах детектировали методом ИФА, титр агглютинации — в реакции агглютинации (РА). Количественное определение ДНК Bordetella pertussis в аспиратах проводили с помощью ПЦР в реальном времени. Клеточный иммунный ответ оценивали по синтезу цитокинов IFN-γ и IL-17 мононуклеарами периферической крови.
РЕЗУЛЬТАТЫ. Вакцинация добровольцев ГамЖВК сопровождалась продукцией специфических антител класса IgG и IgА в сыворотке крови и секреторных IgА в аспиратах, увеличением титра общих противококлюшных антител в РА после однократного и двукратного введения независимо от способа введения. При повторном введении ГамЖВК наблюдался выраженный бустерный эффект в виде увеличения титра антител всех классов начиная с 14 сут. Повторное введение вакцины приводило к укорочению времени элиминации бактерий B. pertussis в сравнении с первым введением (c 28 до 14 сут). Не выявлено достоверных отличий в динамике и значениях измеренных показателей при использовании распыления и капельного интраназального введения вакцины.
ВЫВОДЫ. Интраназальная иммунизация препаратом ГамЖВК способствует формированию выраженного гуморального и клеточного иммунного ответа, а также мукозального иммунитета в отношении коклюшной инфекции у взрослых добровольцев. Рекомендован капельный метод введения ГамЖВК. Сокращение времени элиминации бактерий после повторного введения свидетельствует о проявлении стерильного иммунитета, индуцированного первой вакцинацией, что в итоге может привести к снижению передачи инфекции в популяции.
Ключевые слова
Для цитирования:
Лиджиева А.А., Медкова А.Ю., Куликов С.В., Синяшина Л.Н., Сюндюкова Р.А., Чернышова И.Н., Гаврилова М.В., Бушкова К.К., Снегирева Н.А., Дьяков И.Н., Каратаев Г.И. Иммуногенность «ГамЖВК, живой вакцины интраназального применения для профилактики коклюша» у взрослых добровольцев: слепое рандомизированное плацебо-контролируемое исследование по оптимизации метода и схемы введения. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(1):22-36. https://doi.org/10.30895/2221-996X-2025-610
For citation:
Lidzhieva A.A., Medkova A.Yu., Kulikov S.V., Sinyashina L.N., Sioundioukova R.A., Chernyshova I.N., Gavrilova M.V., Bushkova K.K., Snegireva N.A., Dyakov I.N., Karataev G.I. Immunogenicity of GamLPV, an intranasal live vaccine for pertussis prevention, in adult volunteers: a blind, randomised, placebo-controlled trial to optimise the method and schedule of administration. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(1):22-36. (In Russ.) https://doi.org/10.30895/2221-996X-2025-610
ВВЕДЕНИЕ
Коклюш продолжает оставаться серьезной проблемой здравоохранения во всем мире, несмотря на проводимую в разных странах с начала 50-х годов прошлого столетия массовую вакцинацию. На фоне гиподиагностики коклюша в мире ежегодно регистрируется 20–40 млн случаев заболевания разной степени тяжести, из которых около 300 тыс. заканчиваются летальным исходом1. В последние годы отмечается значительный рост числа лабораторно подтвержденных случаев коклюша среди подростков и взрослых [1–3], однако истинная картина заболеваемости в этих группах остается скрытой ввиду сложности диагностики и неполной отчетности о заболеваемости2. Опасность коклюша, особенно для лиц пожилого возраста с хроническими соматическими заболеваниями, сильно недооценена. Исследования показывают, что пожилые люди имеют более высокий риск смертности от коклюша, чем дети и подростки, хотя этот риск, вероятно, недооценен [4].
Для профилактики коклюша в настоящее время в мире используют препараты АКДС-вакцины, содержащей корпускулярный (цельноклеточный) коклюшный компонент (АКДС) или бесклеточный коклюшный компонент (АаКДС) в сочетании с инактивированными дифтерийным и столбнячным анатоксинами. Иногда цельноклеточные (ЦКВ) или бесклеточные коклюшные вакцины (БКВ) используют как моновакцины. По данным ВОЗ в настоящее время в 42 странах для профилактики коклюша используют препараты АаКДС-вакцины, а в 143 странах — АКДС. В последние годы АаКДС применяют для ревакцинации подростков и разработаны программы для ревакцинации взрослых [3]. Однако эти программы не получили широкого распространения даже в странах с высоким уровнем доходов. Одна из причин ограниченного использования АаКДС для ревакцинации — ее недостаточная эффективность и неспособность препятствовать размножению и передаче бактерий от человека к человеку. Этот результат представляется логичным, так как БКВ не формирует противобактерийного иммунитета и не защищает животных и людей от экспериментальной коклюшной инфекции [5][6].
Альтернативой БКВ может быть живая интраназальная коклюшная вакцина, применяемая в виде монопрепарата для вакцинации младенцев на первом месяце жизни или для ревакцинации подростков и взрослых. Такие препараты разработаны в России (ГамЖВК) и во Франции (BPZE1) и в настоящее время проходят клинические исследования [6–13]. Вакцина, сконструированная в России, прошла необходимые этапы доклинических исследований, в том числе на экспериментальной модели двукратного введения ГамЖВК низшим приматам [14][15] и клиническое исследование на здоровых взрослых добровольцах, определившее оптимальную дозу для однократной вакцинации при интраназальном введении вакцины [9]. Показана хорошая переносимость и иммуногенность препарата [8].
Цель работы — оптимизация метода и схемы введения ГамЖВК, живой вакцины интраназального применения для профилактики коклюша, по показателям иммуногенности в клиническом исследовании у здоровых взрослых добровольцев от 18 до 40 лет.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
Клиническое исследование проведено для оптимизации метода и схемы введения препарата. Проводимое исследование было проспективным рандомизированным плацебо-контролируемым с последовательным включением добровольцев, одноцентровым. Исследование проводили в соответствии с Протоколом и этическими принципами, изложенными в Хельсинкской декларации (2013 г.), международным гармонизированным трехсторонним руководством по надлежащей клинической практике (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) Harmonised Tripartite Guideline for Good Clinical Practice), а также на основании разрешения № 382 от 2 августа 2018 г., выданного Министерством здравоохранения Российской Федерации и продления разрешения (№ 410322720-1/Др от 05.06.2019).
Все добровольцы, участвовавшие в исследовании, подписали форму добровольного информированного согласия.
Соответствие добровольцев критериям включения в исследование подтверждено с помощью стандартных лабораторных тестов, данных анамнеза и физикального обследования. Основные критерии включения и невключения, значимые для оценки иммуногенности вакцины ГамЖВК и бактериальной нагрузки в носоглоточных аспиратах, приведены ниже. Полный их перечень и описание лабораторных методов представлены в онлайн приложении №1 к статье3.
Критерии ключения: мужчины и женщины в возрасте от 18 до 40 лет с верифицированным диагнозом «здоров»; отсутствие специфических IgM-антител к возбудителю коклюша, подтвержденное отрицательным результатом тестирования; уровень специфических IgG-антител к антигенам B. рertussis ≤45 U/мл (согласно шкале использованной тест-системы RIDASCREEN®); отсутствие ДНК B. pertussis в назофарингеальных мазках, подтвержденное методом ПЦР.
Критерии невключения: наличие коклюша в анамнезе; вакцинация против коклюша в течение последних 10 лет, а также любая вакцинация в течение последнего года; наличие любого заболевания, которое, по мнению исследователя, может повлиять на результаты исследования или может привести к ухудшению состояния здоровья в ходе исследования; зарегистрированные сильные поствакцинальные осложнения в анамнезе; курсовой прием лекарственных препаратов с профилактической или лечебной целью в течение 1 мес. до скрининга; участие в других клинических исследованиях или прием исследуемых препаратов в течение 3 мес. до скрининга; наличие специфических IgM-антител к B. pertussis и уровень IgG-антител к B. pertussis >45 U/мл (согласно шкале использованной тест-системы RIDASCREEN®).
Обследование добровольцев и рандомизация
Здоровые добровольцы прошли процедуры скрининга, включающие физикальный осмотр, оценку жизненно важных показателей, лабораторные исследования, ЭКГ (электрокардиография), пикфлоуметрию, а также исследование на наличие специфических антител к возбудителю коклюша в сыворотке крови и наличие бактерий B. pertussis в носоглотке. Соответствие всем критериям включения/невключения было подтверждено до начала исследования.
В исследовании участвовали 50 здоровых добровольцев, распределенных в 2 группы по 25 человек, различающиеся методом введения исследуемого препарата. Добровольцам первой группы препарат вводили капельно через шприц без иглы, второй — через шприц с распыляющей насадкой (актуатор). В пределах каждой группы добровольцы были распределены на вакцинированных и получивших плацебо в соотношении 4:1. Рандомизационный номер присваивали методом адаптивной рандомизации. Каждую группу делили на 3 когорты по 5, 7 и 13 человек. Для каждой из групп было предусмотрено последовательное включение когорт добровольцев с промежуточной оценкой параметров безопасности.
Рандомизацию проводили в день госпитализации. Добровольцам когорт 1, 3, 5 препарат и плацебо вводили капельным методом в каждый носовой ход, добровольцам когорт 2, 4, 6 препарат и плацебо вводили методом распыления в каждый носовой ход через актуатор. Спустя 60±2 сут после первой инокуляции препарата или плацебо добровольцам соответствующих когорт повторно вводили ту же дозу препарата или плацебо, тем же способом, что и в первый раз.
Исследуемый препарат, дозы и способ введения
«ГамЖВК, живая вакцина интраназального применения для профилактики коклюша» (далее — ГамЖВК) — лиофилизат для приготовления суспензии аттенуированных бактерий в 0,9% растворе натрия хлорида, приготовлена в соответствии с проектом Регламента производства «ГамЖВК, вакцина коклюшная живая рекомбинантная, лиофилизат для приготовления суспензии для интраназального введения» на производстве филиала «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России и проконтролирована в соответствии с проектом нормативной документации «ГамЖВК, вакцина коклюшная живая рекомбинантная, лиофилизат для приготовления суспензии для интраназального введения» на производстве филиала «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. Препарат вводили в дозе (4–5)×10⁹ КОЕ.
Плацебо — стерильный лиофилизат стабилизатора для последующего растворения в 0,9% растворе натрия хлорида для инъекций.
Отбор образцов аспирата из ротоглотки и носоглотки
Клинический материал отбирали с помощью заднеглоточного тампона со слизистой задней стенки ротоглотки и назофарингеального зонда со слизистой носоглотки натощак до применения полоскания или других видов исследования при хорошем освещении. Все процедуры выполняли в соответствии с СП 3.3686-214. Материал с зондов смывали в 0,5 мл физиологического раствора, тщательно суспендировали с помощью пипетки и вортекса, центрифугировали при 7000 об/мин в течение 10 мин на микроцентрифуге типа Eppendorf®. Осадок использовали для выделения ДНК и ПЦР анализа, а супернатанты — для определения содержания секреторных антител класса IgA.
Получение и хранение образцов мононуклеаров периферической крови для оценки клеточного иммунного ответа осуществляли по методике, описанной ранее [9].
Отбор образцов крови
Периферическую венозную кровь забирали у добровольцев в вакуумные пробирки Vacuette® (Greiner Bio-One, Австрия), содержащие активатор свертывания крови (красная крышка). Пробирки центрифугировали при 300 g в течение 20 мин для уплотнения сгустка. Затем сыворотку крови аликвотировали в отдельные пробирки типа Eppendorf® объемом 1,5 мл. Для определения антител использовали незамороженные аликвоты сыворотки крови, в которые для предотвращения бактериального пророста добавляли 0,1% натрия азид. Остальные аликвоты были заморожены для проведения повторного анализа при необходимости.
Определение бактериальной нагрузки в носоглотке добровольцев
Для молекулярно-генетического анализа использовали ДНК, выделенную из смывов, полученных с заднеглоточных мазков или назофарингеальных зондов (аспиратов). Осадки препаратов после центрифугирования обрабатывали раствором гуанидинтиоцианата с последующим выделением ДНК на сорбенте согласно данным Ю.В. Нестеровой с соавт. [16]. Для определения бактериальной нагрузки (количественное определение ДНК B. pertussis в аспиратах) использовали разработанную и валидированную нами ранее тест-систему на основе ПЦР в реальном времени (ПЦР РВ) для определения количества геном-эквивалентов (ГЭ) ДНК B. pertussis в образцах [16]. В качестве параметра оценки скорости элиминации бактерий использовали время после первого или повторного интраназального введения ГамЖВК до момента, когда количество ГЭ B. pertussis в аспиратах вакцинированных добровольцев достигало значений меньших или равных усредненному количеству ГЭ в аспиратах добровольцев, получивших плацебо.
Оценка уровня специфических противококлюшных IgM-, IgG- и IgA-антител в сыворотке крови добровольцев
Специфические противококлюшные IgM-, IgA- и IgG-антитела к антигенам B. pertussis определяли в сыворотке крови добровольцев методом иммуноферментного анализа (ИФА) с использованием коммерческих наборов RIDASCREEN® Bordetella IgM (Lot: 12426, R-Biopharm, Германия), RIDASCREEN® Bordetella IgA (Lot: 13316, R-Biopharm, Германия) и RIDASCREEN® Bordetella IgG (Lot: 11037, R-Biopharm, Германия) соответственно. Анализ проводили согласно инструкциям производителя. IgM-антитела определяли только на этапе скрининга. Оценку уровня IgG- и IgA-антител проводили в динамике: в день скрининга перед введением препарата или плацебо на 8, 15, 29, 60 сут после первой и повторной вакцинации добровольцев. Повторную инокуляцию проводили на 60 сут после первой вакцинации; кровь для определения уровня специфических антител забирали перед введением препарата или плацебо.
Измерение уровня секреторного IgA в аспиратах в те же сроки проводили с использованием коммерческой тест-системы RIDASCREEN® Bordetella IgA (R-Biopharm, Германия), предназначенной для определения IgA в сыворотке крови. Измерение проводили в соответствии с инструкциями производителя с модификациями. Учитывая низкий уровень специфических IgA-антител в аспиратах в сравнении с сывороткой крови, анализируемые образцы разводили в 2 раза для проведения реакции, тогда как образцы сывороток крови рекомендуется разводить в 100 раз. Полученное значение (выраженное в U/мл) пересчитывали с поправкой на разведение образцов.
Определение коклюшных антител в реакции агглютинации (РА). Титр антител к B. pertussis в сыворотке крови добровольцев определяли с помощью «Диагностикума коклюшного жидкого» (ОАО «Биомед» им. И.И. Мечникова, Россия). Образцы сыворотки разводили в 20, 40, 80, 160 раз. Результат РА оценивали в соответствии с инструкцией производителя. Положительной реакцией в РА является степень агглютинации «+++».
Исследование параметров клеточного иммунного ответа. Клеточный иммунный ответ оценивали по синтезу цитокинов (интерферон гамма, IFN-γ и интерлейкин-17, IL-17) мононуклеарами периферической крови (peripheral blood mononuclear cells, PBMC) добровольцев в динамике (исходная точка, 8, 15, 29, 60 сут) после однократной и двукратной интраназальной вакцинации добровольцев вакциной ГамЖВК.
Культивирование клеток для оценки уровня синтезируемых цитокинов в супернатанте. PBMC вносили в лунки плоскодонных культуральных 96-луночных планшетов по 10⁶ клеток в объеме 150 мкл. Затем к клеткам добавляли в качестве контроля 50 мкл полной среды (питательная среда RPMI-1640 c добавлением 10% эмбриональной телячьей сыворотки, 1% глютамина, 1% натрия пирувата, пенициллина/стрептомицина) или 50 мкл взвеси термически инактивированных коклюшных бактерий до конечного соотношения 10⁸ бактерий на 10⁶ PBMC и инкубировали в течение 24 ч. По окончании инкубации супернатанты собирали, замораживали при минус 20 °С и хранили в замороженном состоянии до постановки ИФА.
Анализ содержания цитокинов в культуральной жидкости. Количественный анализ цитокинов IFN-γ и IL-17 в культуральных PBMC проводили при помощи тест-систем ИФА (ООО «Цитокин», Россия) в соответствии с инструкцией производителя. Образцы супернатантов предварительно не разводили; все разведения делали в соответствии с инструкцией производителя тест-систем. Оптическую плотность определяли при длине волны 450 нм. Содержание цитокинов (пг/мл) определяли по калибровочной кривой, построенной по калибровочным образцам.
Для оценки индукции клеточного ответа рассчитывали прирост уровня цитокинов на 7–60 сут после каждого введения вакцины. Индукцию после первого введения рассчитывали в сравнении с уровнем цитокинов в исходной точке (0 сут), индукцию после повторного введения вакцины — в сравнении с уровнем цитокинов на 60 сут исследования. Если прирост отсутствовал или уровень цитокинов был ниже, чем в исходной точке (перед введением вакцины), прирост считали равным нулю.
Статистическую обработку данных по эффективности иммунного ответа на введение ГамЖВК проводили с помощью программного обеспечения GraphPad Prism. Нормальность распределения оценивали с помощью теста Колмогорова — Смирнова. Для статистической обработки и оценки достоверности различий между группами использовали непараметрический критерий Манна — Уитни. При оценке гуморального ответа определяли достоверность различий измеряемых параметров в контрольных точках с их значениями в исходной точке (до вакцинации) среди добровольцев, получивших плацебо/вакцину, разными методами после первой и второй вакцинации. При повторной вакцинации рассчитывали достоверность различий в сравнении со значениями на 60 сут исследования (перед повторным введением вакцины). При оценке клеточного иммунного ответа оценивали достоверность различий кратности возрастания уровня индуцированных цитокинов. Данные представлены на рисунках 1 и 2 в виде медианы и межквартильного интервала. Для оценки достоверности различий между сравниваемыми группами для каждой контрольной точки проводили групповой анализ с использованием множественного t-теста.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Один из 50 добровольцев, включенных в исследование, отказался от исследования после рандомизации до введения препарата, поэтому в итоговый анализ было включено 49 добровольцев. Согласно Протоколу в исследовании приняли участие серонегативные добровольцы с уровнем IgG-антител к антигенам B. pertussis ≤14 U/мл (согласно шкале использованной тест-системы RIDASCREEN®), названные «наивными» добровольцами (НД), и добровольцы с уровнем IgG-антител в диапазоне 15–45 U/мл, названные «контактными» добровольцами (КД). Включение в исследование серопозитивных добровольцев и выбор порогового значения IgG-антител основан на результатах серологического анализа популяции потенциальных участников предыдущего этапа клинического исследования и обоснован нами ранее [8][9]. Распределение добровольцев по наличию специфических IgG-антител приведено в таблице 1.
Таблица 1. Распределение участников в подгруппах наивных и контактных добровольцев по наличию специфических противококлюшных IgG-антител к B. pertussis в сыворотке крови
Table 1. Distribution of volunteers to the naïve and pre-exposed subgroups by the presence of IgG antibodies specific to B. pertussis in their serum samples
Метод введения Method of administration | Наивные добровольцы Naïve volunteers | Контактные добровольцы Pre-exposed volunteers |
Капельное введение / Drops | 8 | 12 |
Распыление / Spray | 9 | 10 |
Суммарно / Total | 17 | 22 |
Плацебо / Placebo | Не распределялись (10 человек) / Not allocated to subgroups (10 persons) | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Характеристики гуморального ответа, индуцированного двукратной иммунизацией взрослых добровольцев
Ранее было показано, что двукратное введение ГамЖВК капельно или с помощью актуатора показало ее безопасность и хорошую переносимость взрослыми добровольцами [10]. В рамках проведенного исследования в группах, получивших вакцину с помощью распыления через актуатор и капельно, не было выявлено достоверных различий измеренных параметров иммунного ответа. По этой причине дальнейший анализ был направлен на изучение иммунного ответа в общей популяции добровольцев без разделения по методу введения препарата. Для изучения особенностей формирования иммунного ответа у добровольцев в зависимости от исходного серологического статуса дополнительно оценивали иммунный ответ на вакцинацию в подгруппах НД и КД.
Определение IgG- и IgА-антител в сыворотке крови вакцинированных добровольцев
На рисунке 1А представлены результаты определения уровня IgG-антител в сыворотке крови добровольцев общей группы, включающей НД и КД. Достоверные и более чем двукратные различия (p≤0,001) медиан абсолютных значений уровня IgG-антител в сравнении с исходным уровнем и уровнем в группе плацебо выявляли уже на 14 сут после введения вакцины. К 28 сут медиана значений IgG-антител в общей группе возрастала в 2,8 раза, а к 74 сут (2 нед. после повторного введения) — в 3,8 раза в сравнении со значением на момент начала исследования. Уровень IgG-антител в сыворотке крови добровольцев, получивших плацебо, оставался неизменным на протяжении всего срока наблюдения.
Схожую картину наблюдали в подгруппах НД и КД. Достоверные различия между исходным уровнем IgG-антител и плацебо выявляли в одни и те же сроки — на 14 сут после вакцинации, однако абсолютные значения уровня IgG-антител в подгруппах значимо отличались на протяжении всего срока наблюдения (рис. 1В).
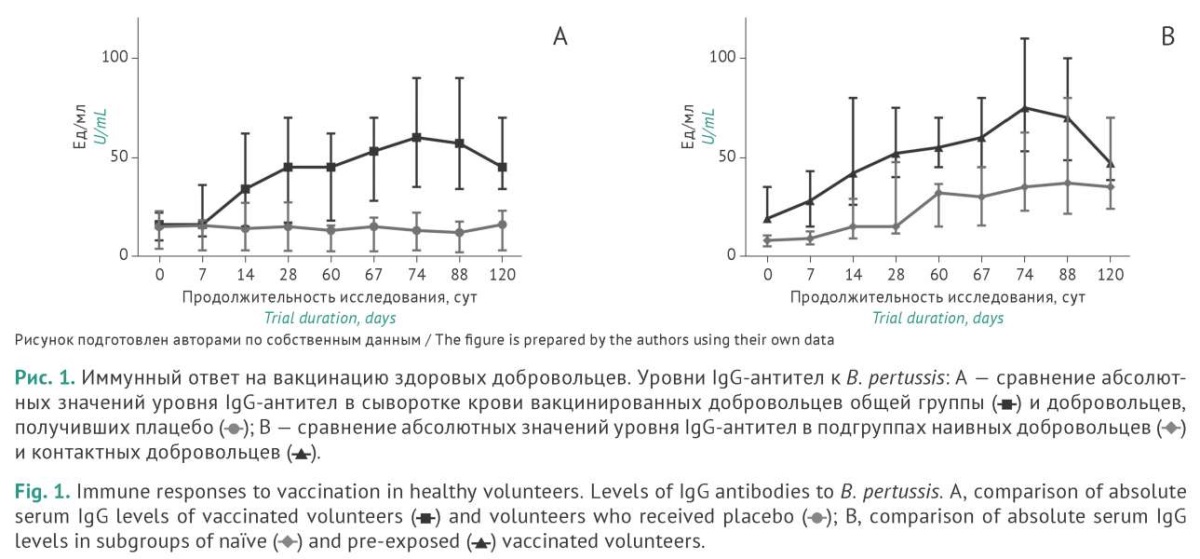
Повторное введение вакцины привело к бустерному эффекту в общей группе, а именно дальнейшему нарастанию уровня IgG-антител. Более выраженную динамику, в сравнении с НД, наблюдали у КД как после первого, так и после повторного введения бактерий. Аналогичная динамика отмечена нами в экспериментах с низшими приматами. Первая иммунизация или экспериментальная инфекция вирулентными бактериями индуцировала существенно меньший уровень антител в сыворотке крови и менее выраженную динамику процесса в сравнении с повторной и третьей иммунизацией или экспериментальной инфекцией [14][15]. В сыворотке крови всех добровольцев, получивших вакцину, были достигнуты уровни антител ≥18 Ед/мл, которые превышали границу серопозитивности, установленную производителем набора RIDASCREEN® Bordetella IgG.
На рисунке 2 приведено изменение доли добровольцев, в сыворотке крови которых было обнаружено как минимум двукратное возрастание уровня IgG-антител в разные сроки после однократной и двукратной вакцинации. После однократной вакцинации доля таких добровольцев в общей группе возрастает до 69,0%, тогда как после повторной вакцинации — до 79,5%. Подгрупповой анализ показал, что двукратное превышение уровня IgG-антител в сыворотке крови достигалось у 93,8 и 72,7% — НД и КД соотвественно. Это представляется вполне объяснимым из-за более высокого медианного значения исходного уровня IgG-антител в подгруппе КД (рис. 1). При повторном введении вакцины в обеих подгруппах наблюдали возрастание доли добровольцев, достигших более чем двукратной сероконверсии (бустерный эффект), что сопоставимо с данными по возрастанию абсолютного уровня IgG-антител в крови.
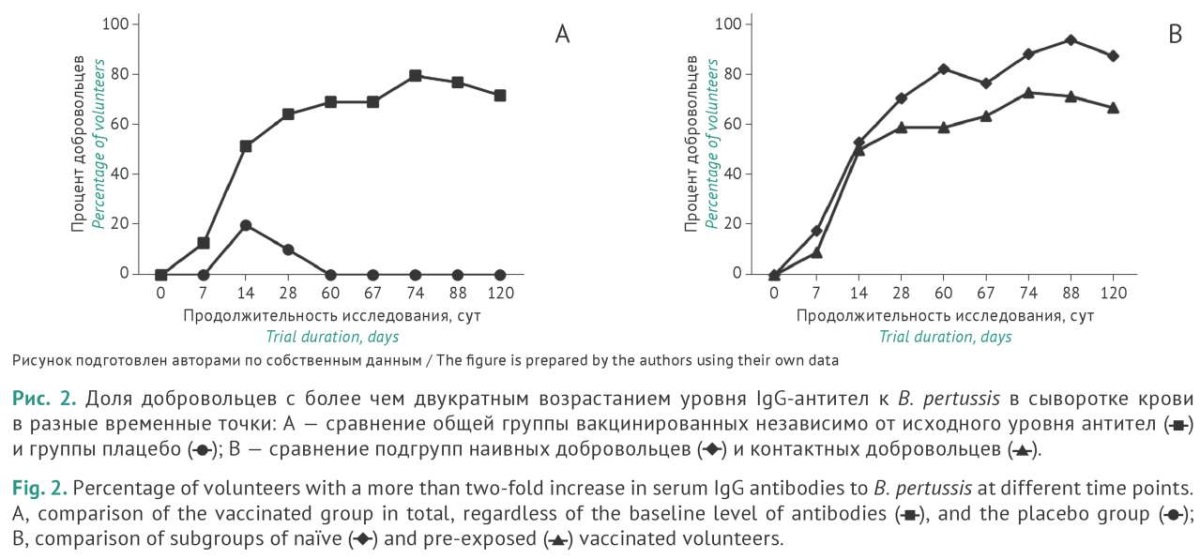
Полученные данные демонстрируют достижение контрольной точки иммуногенности вакцин: более чем двукратное увеличение значений IgG-антител у ≥80% вакцинированных добровольцев главным образом за счет лиц подгруппы НД.
Уровень IgA-антител оценивали с использованием тех же подходов, что и уровень IgG-антител. Результаты исследования приведены на рисунках 3 и 4.
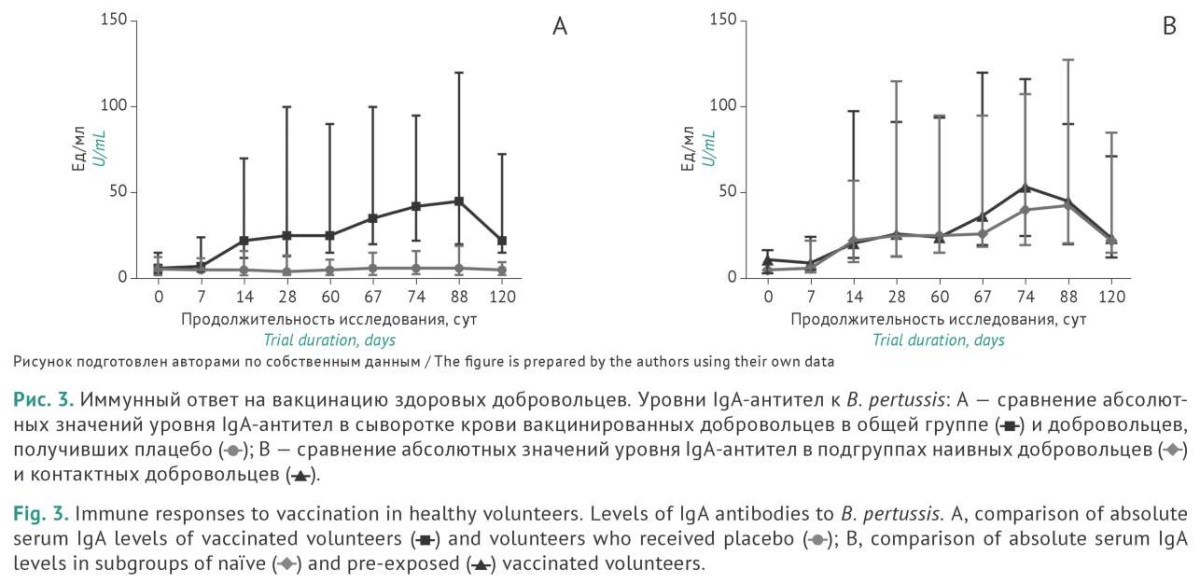
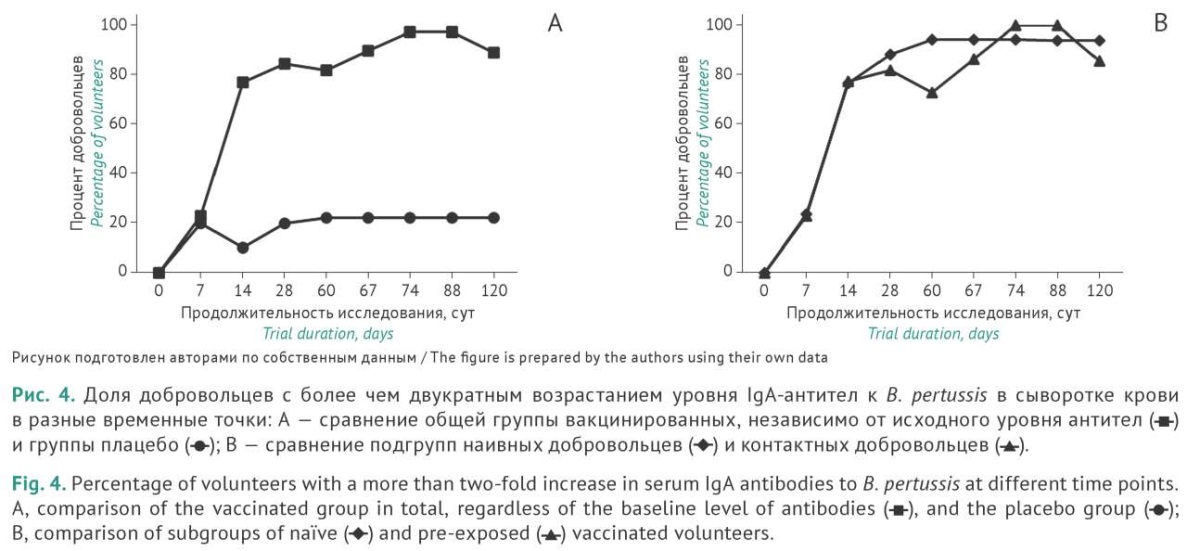
У 84,6% вакцинированных в общей группе на 14 сут после первого введения вакцины отмечается достоверный (p<0,0001) ≥2-кратный прирост уровня специфических IgA-антител в сыворотке крови. Максимальное содержание IgA-антител, превышающее исходное значение после однократной вакцинации в 9,2 раза, отмечено на 28 сут. После ревакцинации на 60 сут, как и в случае с IgG-антителами, наблюдается бустерный эффект, проявляющийся в росте уровня IgА-антител уже на 7 сут после повторного введения препарата, при этом на 14 сут медианное значение уровня IgA-антител было достоверно (p<0,052) выше уровня, зарегистрированного перед повторной вакцинацией. Таким образом, бустерный эффект повторной вакцинации выражался не просто в возрастании уровня IgA-антител, но был достоверно выше уровня IgA-антител после первой вакцинации. На 14 сут после ревакцинации у 97,4% добровольцев наблюдали возрастание уровня IgA-антител ≥2 раза.
Интересно отметить сходства и различия в динамике доли добровольцев, достигших двукратного превышения исходных уровней противококлюшных IgG- и IgA-антител при анализе подгрупп с учетом исходного серологического статуса добровольцев. Если в подгруппе НД после однократной вакцинации двукратное возрастание IgG-антител отмечали у 82,4% добровольцев, повторная вакцинация приводила к возрастанию этого показателя до 93,8%. При оценке уровня IgA-антител в этой же подгруппе доля добровольцев с двукратным превышением исходного уровня IgA-антител достигала максимальных значений (94,1%) уже после однократной вакцинации и сохранялась на этом уровне до конца исследования. В подгруппе КД наблюдали бустерный эффект второй вакцинации не только в отношении абсолютных уровней IgA-антител в крови, но и в отношении доли добровольцев с двукратным возрастанием IgA-антител. Так, если после однократной вакцинации доля таких участников составляла 81,8%, то на 14 сут после повторной вакцинации двукратное возрастание уровня IgA-антител наблюдали уже у 100% добровольцев в подгруппе КД. Эти данные представляются особенно значимыми в свете того, что IgA является основным классом антител, обеспечивающих местный иммунитет слизистых дыхательных путей, которые служат входными воротами для коклюшной инфекции. Выявленный нами высокий уровень IgA-антител в крови сопоставим с уровнем IgA-антител в секретах слизистых оболочек рото- и носоглотки (см. ниже). Таким образом, формирование мощного IgA-ответа при вакцинации ГамЖВК даже после однократной вакцинации наивных добровольцев с последующим достоверным его усилением при повторной вакцинации может играть исключительно важную роль в формировании иммунитета против B. pertussis у вакцинированных пациентов.
Определение суммарных агглютинирующих антител против бактерий возбудителя коклюша в сыворотке крови добровольцев в реакции агглютинации
Реакция агглютинации (РА) является рекомендованным методом оценки противококлюшного иммунитета, позволяющим оценить содержание агглютинирующих антител (антитела, перекрестно связывающие бактериальные клетки) независимо от их изотипа. На рисунке 5 представлены результаты оценки доли добровольцев, у которых в РА зарегистрирован результат «+++» в разведении 1:80. Отчетливо наблюдается бустерный эффект повторной вакцинации. Если после однократного введения вакцины результат «+++» в разведении 1:80 наблюдается у 48% добровольцев, то после повторной вакцинации их доля возрастает до 85%. Схожая динамика отмечена в подгруппах НД и КД, причем доля серопозитивных добровольцев в РА ожидаемо быстрее возрастает в подгруппе КД, особенно после однократной вакцинации. После повторной вакцинации доля серопозитивных добровольцев в подгруппе КД остается несколько выше, чем в подгруппе НД.
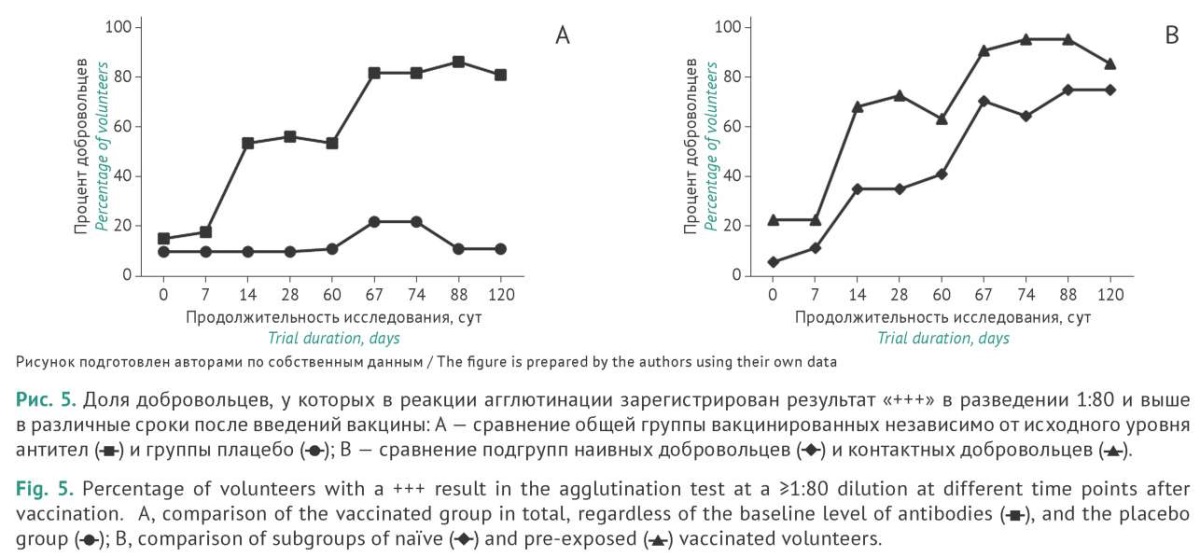
Таким образом, вакцинация ГамЖВК обеспечивает выраженный гуморальный ответ, регистрируемый как по продукции специфических IgG- и IgA-антител, так и по суммарным агглютинирующим антителам в РА после первого введения препарата и его усиление при повторном введении вакцины (бустерный эффект). Динамика ответа несколько отличается у добровольцев с различным серологическим статусом на момент их включения в исследование и выражается в более интенсивном росте количества иммуноглобулинов после повторной вакцинации или при вакцинации добровольцев из подгруппы НД.
Определение секреторного IgА в аспиратах не является в настоящее время общепринятым критерием оценки иммуногенности вакцин или рутинно применяемым тестом при диагностике коклюша. Несмотря на то что IgA-антитела — второй класс антител по концентрации в крови после IgG, они традиционно считаются основными, обеспечивающими защиту слизистых оболочек. Формирование защиты слизистых играет важную роль в реализации напряженного иммунитета при коклюше, поскольку входными воротами B. pertussis являются в первую очередь слизистые оболочки респираторного тракта. Поэтому для полноценного анализа поствакцинального иммунитета представлялось актуальным оценить уровень IgA-антител к антигенам B. pertussis в мазках со слизистых оболочек респираторного тракта.
Важными причинами низкой распространенности теста являются сложность стандартизации взятия аспиратов для исследования и отсутствие коммерческих наборов для регистрации антител в аспиратах. В настоящем исследовании для оценки уровня секреторных IgA использовали набор для определения IgA-антител в сыворотке крови в соответствии с модификациями, описанными в разделе «Материалы и методы». Поскольку указанные наборы не имеют калибровочных и стандартных образцов, предложенный метод может применяться только для регистрации изменения количества секреторных IgA в динамике, а не в абсолютных значениях.
На практике реализуются два методических подхода для взятия аспиратов: 1) использование промывки ротоглотки и отсоса биологического материала с помощью специальных приспособлений и 2) взятие назофарингеальных и/или ротоглоточных мазков в пробирки с физиологическим раствором. Первый метод представляется более стандартным и позволяет собрать большее количество секрета, содержащего IgA, но более сложен и требует дополнительной регламентации для клинических учреждений. Второй метод широко используют при диагностических манипуляциях, он регламентирован, но не позволяет стандартно и полноценным образом собрать назофарингеальные и ротоглоточные аспираты. Его применение заранее предполагает большой разброс значений любых измеряемых параметров, в том числе секреторных антител и содержания анализируемой микрофлоры носоглотки. В рамках настоящего исследования проведено параллельное исследование образцов, полученных в результате анализа смывов назальных и назофарингеальных мазков. Биологический материал собирали в соответствии с описанием, приведенным в разделе «Материалы и методы». В результате сравнительного определения количества секреторных IgA в супернатантах и количества ГЭ ДНК B. pertussis в осадках был выявлен большой нерегулярный разброс измеренных величин при обоих способах взятия материала и его минимизация при смыве зондов и последующей пробоподготовке образцов для анализа в одной пробирке. Для дальнейших исследований выбран именно этот метод — смыв назальных и назофарингеальных мазков в одной пробирке.
Оценка значений секреторных IgA-антител в общей группе показала, что на 28 сут после первого введения вакцины уровень секреторных антител вышел на плато и сохранялся на этом уровне до конца исследования. При этом уже на 14 сут после первого введения отмечался достоверный (p<0,01) прирост IgA-антител по сравнению с исходным уровнем и уровнем в группе плацебо. Следует отметить большой разброс значений содержания секреторных IgA-антител, тем не менее различия с группой плацебо оставались достоверными на протяжении всего исследования. Динамика секреторных IgA-антител в подгруппах НД и КД принципиально не отличалась от общей группы (результаты не представлены). Не было выявлено достоверного бустерного увеличения уровня IgA-антител в смывах после повторной вакцинации добровольцев, что может быть связано с упомянутым разбросом значений показателя. Тем не менее на фоне практически полного отсутствия секреторных IgA-антител в группе плацебо у 82,1% вакцинированных добровольцев регистрировали более чем двукратный прирост уровней этого показателя. Полученные данные свидетельствуют о том, что интраназальное введение вакцины добровольцам приводит к выработке специфических IgA-антител как в крови, так и в секретах слизистых оболочек носо- и ротоглотки.
Характеристика некоторых параметров клеточного иммунного ответа после интраназальной вакцинации добровольцев препаратом ГамЖВК
При оценке клеточного ответа определяли индукцию синтеза IFN-γ и IL-17 в PBMC добровольцев, вакцинированных ГамЖВК или получивших плацебо. Поскольку абсолютные значения уровней индуцируемых цитокинов значительно варьировали, в том числе в группе плацебо, в эксперименте оценивали индуцируемый прирост уровня цитокинов на 7–60 сут после каждого введения вакцины (раздел «Материалы и методы»).
Активацию Th1-лимфоцитов оценивали по индукции синтеза IFN-γ in vitro. Медианные значения прироста уровня IFN-γ в группе вакцинированных добровольцев достоверно превышали эти значения в группе плацебо на 7, 14 и 28 сут после первого введения вакцины (p=0,0047, p=0,0215 и p=0,0092 соответственно). После второй вакцинации не обнаружена достоверная индукция синтеза IFN-γ по сравнению с показателями на 60 сут (перед повторным введением), что может быть обусловлено более высоким уровнем продукции IFN-γ к моменту повторной вакцинации относительно показателей дня начала исследования.
Для IL-17, характеризующего активацию Th17-клеток, наблюдалась несколько иная картина. В сравнении с группой плацебо достоверно более сильную индукцию синтеза IL-17 наблюдали в группе вакцинированных на 7 и 14 сут после первого введения вакцины (p=0,0010 и p=0,0046 соответственно), а также на 7 сут после повторной вакцинации (p=0,0187). Графики, иллюстрирующие прирост уровня цитокинов после каждого введения вакцины, представлены в онлайн приложении №25.
Полученные данные в отношении IFN-γ согласуются с данными A. Lin с соавт. [17], согласно которым введение живой аттенуированной вакцины против В. pertussis BPZE1 приводило к индукции Th1-клеток, продуцирующих IFN-γ и TNF-α. В то же время авторы не обнаружили индукции Th17-клеток, тогда как в нашем исследовании медианные значения прироста уровня IL-17 достоверно превышали таковые в группе плацебо на ранних сроках после первого и повторного введения вакцины. Имеющиеся различия, возможно, обусловлены разными методами оценки клеточного ответа. A. Lin с соавт. в своем исследовании [17] оценивали увеличение доли клеток-продуцентов цитокинов, тогда как в нашем исследовании оценивали количество индуцируемых цитокинов в ответ на специфическую активацию in vitro.
Динамика размножения аттенуированных бактерий B. pertussis в верхних дыхательных путях добровольцев после одно- и двукратного интраназального применения вакцины ГамЖВК
Проведенные нами ранее исследования на экспериментальной модели низших приматов указывали на более эффективное выведение бактерий B. рertussis после повторного контакта с возбудителем [14][18][19]. Бактериальную нагрузку определяли по количеству ГЭ ДНК B. рertussis в аспиратах в различные сроки после вакцинации. Протокол настоящего исследования включал два способа интраназального введения вакцины — капельно и распылением через актуатор, а использованный метод рандомизации не предполагал раздельное посещение клиники для добровольцев опытной и контрольной групп. Вероятно, по этой причине при оценке бактериальной нагрузки был выявлен большой разброс значений ГЭ в большинстве точек наблюдения как в группе вакцинированных, прежде всего получивших препарат с помощью распыления, так и в группе плацебо. Можно предположить, что этот факт связан с передачей аттенуированных бактерий от вакцинированных добровольцев к добровольцам группы плацебо на совместных визитах в клинику. Аналогичное явление описано нами ранее при передаче аттенуированных бактерий от иммунизированных детенышей обезьян их матерям в исследовании иммуногенности и защитной активности препарата живой коклюшной вакцины ГамЖВК интраназального применения на экспериментальной модели детенышей обезьян Papio hamadryas. Разброс значений бактериальной нагрузки у добровольцев, получивших плацебо, не позволил корректно определить количественные значения времени выведения бактерий (раздел «Материалы и методы»). Однако измеренная динамика изменения количества ГЭ в аспиратах вакцинированных добровольцев указывала на более высокую эффективность элиминации возбудителя после повторной вакцинации в сравнении с первой.
В связи с трудностями количественной оценки времени элиминации бактерий в настоящем исследовании в качестве дополнительного критерия оценки элиминации бактерий после введения препарата вакцины была использована интегральная характеристика процесса — площадь под кривой (area under the curve, AUC) содержания ГЭ в носоглотке добровольцев. Проведенные расчеты показали, что значение AUC в общей группе после повторного введения препарата составила 9,0% от значения AUC после первого введения. При этом в подгруппе НД разница значений AUC после второй вакцинации была больше и составляла 4,8% в сравнении с первой вакцинацией. В подгруппе КД значение AUC после первого введения препарата составляло 22,7% от значения AUC после его первого введения в подгруппе НД. Представленные результаты полностью согласуются с выводами, сделанными нами и C. Locht с соавт. [18] в процессе исследований на экспериментальной модели низших приматов о том, что повторное введение аттенуированных бактерий или вирулентных бактерий B. pertussis обезьянам, интраназально иммунизированным вакциной ГамЖВК или BPZE1, приводит к сокращению длительности и количества персистирующих бактерий в носоглотке обезьян после повторного введения бактерий возбудителя коклюша [14][18].
Измеренные параметры (бактериальная нагрузка, скорость элиминации бактерий из дыхательных путей) являются важными характеристиками защитной активности любой коклюшной вакцины, способной к формированию стерильного противобактерийного иммунитета у человека или животного. Примером анализа таких параметров является оценка противобактерийного иммунитета, индуцированного АаКДС, выполненная J.M. Warfel с соавт. [5][6] на экспериментальной модели обезьян вида павиан анубис. Показано, что, в отличие от повторного экспериментального заражения животных и частично иммунизации АКДС, содержащей цельноклеточный коклюшный компонент, иммунизация АаКДС не привела к сокращению времени элиминации вирулентных бактерий B. рertussis из организма. По мнению авторов, это свидетельствует о неспособности АаКДС индуцировать стерильный иммунитет против коклюша. Возможность использования сконструированных нами аттенуированных бактерий B. pertussis в составе ГамЖВК для оценки стерильного иммунитета подтверждена приоритетом на изобретение [19].
Таким образом, результаты клинического исследования свидетельствуют о формировании противобактерийного стерильного иммунитета, индуцированного однократным интраназальным введением ГамЖВК. Повторное введение препарата демонстрирует наличие стерильного иммунитета, сформированного после первого введения, и, скорее всего, усиливает его напряженность.
ЗАКЛЮЧЕНИЕ
Проведенное клиническое исследование посвящено выбору метода и схемы введения добровольцам живой рекомбинантной коклюшной вакцины интраназального применения. При использовании для вакцинации капельного метода и распыления через актуатор не было выявлено значимых преимуществ ни одного из методов. Большой разброс измеренных значений показателей иммунного ответа, отмеченный при введении вакцины через актуатор, указал на целесообразность использования капельного метода на следующих этапах клинического исследования.
Интраназальная вакцинация ГамЖВК обеспечивает выраженный гуморальный ответ, регистрируемый по измерению как специфических IgG- и IgA-антител, так и суммарных коклюшных антител в реакции агглютинации (РА) после первого введения препарата и его усиление при повторном введении (бустерный эффект). Динамика IgG- и IgA-антител и титра антител в РА отличается в группах серонегативных и серопозитивных добровольцев. Различия проявляются в более интенсивном росте содержания IgG- и IgA-антител после повторной вакцинации или при вакцинации добровольцев, в крови которых уже содержались специфические IgG-антитела, выработанные, вероятно, в результате предыдущего контакта с возбудителем коклюша. Интраназальное введение вакцины добровольцам приводит к росту специфического секреторного IgA в секретах носо- и ротоглотки.
Оценка некоторых механизмов индукции клеточного иммунитета показала активацию Th1- и Th17-лимфоцитов при интраназальном введении вакцины. Достоверно более сильную индукцию Th1-лимфоцитов наблюдали после первого введения вакцины, тогда как активация Th17-лимфоцитов имела место на ранних сроках (7 сут) как после первой, так и после второй вакцинации.
Уровень и динамика сероконверсии, динамика роста секреторных антител и доля добровольцев, достигших целевых уровней показателей, соответствуют контрольным точкам протокола.
Продемонстрировано, что интраназальная вакцинация добровольцев формирует противобактерийный стерильный иммунитет, индуцированный однократным введением ГамЖВК. Повторное введение препарата усиливает гуморальный, клеточный и противобактерийный иммунитет.
Анализ результатов использования назальных и/или назофарингеальных зондов для отбора аспиратов, необходимых для количественного определения бактериальной нагрузки методом ПЦР РВ и уровня/динамики секреторных IgА, позволил предложить совместное применение зондов и смыв материала в одну пробирку с физиологическим раствором. После центрифугирования супернатант следует использовать для определения уровня секреторных IgА, а осадок — для выделения ДНК, регистрируемой с помощью ПЦР РВ.
При проведении следующих этапов клинических исследований ГамЖВК необходимо предусмотреть раздельные визиты добровольцев, получивших вакцину и плацебо.
Дополнительная информация. Онлайн приложение к статье. Приложение № 1. Используемые материалы и методы.
https://doi.org/10.30895/2221-996X-2025-610-annex1
Приложение №2. Результаты исследования динамики цитокинов.
https://doi.org/10.30895/2221-996X-2025-610-annex2
Additional information. Online supplements: Supplement 1. Materials & Methods.
https://doi.org/10.30895/2221-996X-2025-610-annex1
Supplement 2. Results of the monitoring of cytokine dynamics.
https://doi.org/10.30895/2221-996X-2025-610-annex2
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.А. Лиджиева — проведение эксперимента, отработка протоколов обследования добровольцев, координация данных из исследовательского центра; А.Ю. Медкова — медицинская экспертиза, написание, редактирование и оформление текста рукописи; С.В. Куликов — проведение ПЦР в реальном времени, анализ литературных данных; Л.Н. Синяшина — критические замечания при прочтении рукописи, формирование концепции исследования, идеи методов введения препарата, редактирование текста рукописи; Р.А. Сюндюкова — обсуждение полученных результатов; И.Н. Чернышова, М.В. Гаврилова, К.К. Бушкова и Н.А. Снегирева — подготовка образцов крови и смывов из рото- и носоглотки, выделение и культивирование клеток крови, постановка ИФА для оценки уровня антител в сыворотке крови и смывах, уровня цитокинов в супернатантах, постановка реакции агглютинации; И.Н. Дьяков — формирование концепции, планирование исследования, анализ литературных данных, обработка экспериментальных данных, написание текста рукописи; Г.И. Каратаев — формирование концепции, планирование исследования, редактирование рукописи, окончательная формулировка выводов и утверждение версии рукописи для публикации.
Соответствие принципам этики. Исследование проводилось в соответствии с этическими принципами медицинских исследований с участием человека, изложенными в Хельсинкской декларации (2013 г.). Клиническое исследование лекарственного препарата проводилось на основании разрешения № 382 от 2 августа 2018 г., выданного Министерством здравоохранения Российской Федерации по результатам экспертизы документов и этической экспертизы, предусмотренных статьей 39 Федерального закона от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств» и продления разрешения (№ 410322720-1/Др от 05.06.2019). Все добровольцы, участвовавшие в исследовании, подписали форму добровольного информированного согласия.
Благодарности. А.П. Марков (1950–2024), канд. биол. наук, старший научный сотрудник лаборатории генетики бактерий отдела ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России принимал активное участие в планировании исследования, анализе литературных данных и подведении итогов работы.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.A. Lidzhieva conducted experiments, processed volunteer screening protocols, and coordinated data collection from the trial site. A.Yu. Medkova conducted medical examinations and drafted, edited, and designed the manuscript. S.V. Kulikov conducted real-time PCR and analysed published data. L.N. Sinyashina provided critical remarks on the manuscript, conceptualised the study, devised vaccine administration methods, and edited the manuscript. R.A. Sioundioukova discussed the results obtained. I.N. Chernyshova, M.V. Gavrilova, K.K. Bushkova and N.A. Snegireva prepared blood samples and oropharyngeal and nasopharyngeal swabs, isolated and cultivated blood cells, conducted ELISA to assess the levels of antibodies in serum samples and swabs and the levels of cytokines in supernatants, and conducted agglutination tests. I.N. Dyakov conceptualised and designed the study, analysed published data, processed the experimental data, and drafted the manuscript. G.I. Karataev conceptualised the study, designed the study, edited the manuscript, formulated the conclusions, and approved the final version of the manuscript for publication.
Ethics approval. The study was conducted in full compliance with the ethical principles for medical research involving human subjects described in the Declaration of Helsinki (2013). The study was approved by the Ministry of Health of the Russian Federation (Approval No. 382 of 2 August 2018) on the basis of the documentation and ethics reviews provided for under Article 39 of Russian Federal Law No. 61-FZ ‘On the Circulation of Medicines’ of 12 April 2010 and the Extension of the Approval (No. 410322720-1/Dr of 5 June 2019). All the volunteers who participated in the clinical trial had signed an informed consent form.
Acknowledgments. The authors would like to express gratitude to A.P. Markov (1950–2024), Cand. Sci. (Biol.), Senior Researcher of the Laboratory of Bacterial Genetics at the National Research Center of Epidemiology and Microbiology named after the honorary academician N.F. Gamaleya. A.P. Markov was actively involved in planning the study, analysing published data, and summarising the results.
1. https://www.who.int/data/gho/data/indicators/indicator-details/GHO/pertussis-number-of-reported-cases
2. https://atlas.ecdc.europa.eu/public/index.aspx?Dataset=27&HealthTopic=38
3. https://doi.org/10.30895/2221-996X-2025-610-annex1
4. СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней», пункт XXXVII Профилактика коклюша.
5. https://doi.org/10.30895/2221-996X-2025-610-annex2
Список литературы
1. Macina D, Evans KE. Bordetella pertussis in school-age children, adolescents and adults: a systematic review of epidemiology and mortality in Europe. Infect Dis Ther. 2021;10(4):2071–118. https://doi.org/10.1007/s40121-021-00520-9
2. Macina D, Evans KE. Bordetella pertussis in school-age children, adolescents, and adults: a systematic review of epidemiology, burden, and mortality in Africa. Infect Dis Ther. 2021;10(3): 1097–113. https://doi.org/10.1007/s40121-021-00442-6
3. Kardos P, Correia de Sousa J, Heininger U, Konstantopoulos A, MacIntyre CR, Middleton D, et al. Understanding the impact of adult pertussis and current approaches to vaccination: A narrative review and expert panel recommendations. Hum Vaccin Immunother. 2024;20(1):2324547. https://doi.org/10.1080/21645515.2024.2324547
4. Kandeil W, Atanasov P, Avramioti D, Fu J, Demarteau N, Li X. The burden of pertussis in older adults: What is the role of vaccination? A systematic literature review. Expert Rev Vaccines. 2019;18(5):439–55. https://doi.org/10.1080/14760584.2019.1588727
5. Warfel JM, Zimmerman LI, Merkel TJ. Acellular pertussis vaccines protect against disease but fail to prevent infection and transmission in a nonhuman primate model. Proc Natl Acad Sci USA. 2014;111(2):787–92. https://doi.org/10.1073/pnas.1314688110
6. Warfel JM, Zimmerman LI, Merkel TJ. Comparison of three whole-cell pertussis vaccines in the baboon model of pertussis. Clin Vaccine Immunol. 2015;23(1):47–54. https://doi.org/10.1128/CVI.00449-15
7. Семин ЕГ, Синяшина ЛН, Медкова АЮ, Каратаев ГИ. Конструирование рекомбинантных аттенуированных бактерий Bordetella pertussis генотипа ptxP3. Журнал микробиологии, эпидемиологии и иммунобиологии. 2018;(4):33–41. https://doi.org/10.36233/0372-9311-2018-4-33-41
8. Медкова АЮ, Лиджиева АА, Семин ЕГ, Синяшина ЛН, Сюндюкова РА, Дьяков ИН и др. Клинические исследования безопасности и переносимости живой вакцины интраназального применения для профилактики коклюша. Разработка и регистрация лекарственных средств. 2021;10(1):114–9. https://doi.org/10.33380/2305-2066-2021-10-1-114-119
9. Медкова АЮ, Лиджиева АА, Семин ЕГ, Синяшина ЛН, Сюндюкова РА, Снегирева НА и др. Иммуногенность препарата «Живая вакцина интраназального применения для профилактики коклюша» (ГамЖВК) при однократном применении у здоровых добровольцев. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(6):706–20. https://doi.org/10.36233/0372-9311-194
10. Каратаев ГИ, Медкова АЮ, Семин ЕГ, Синяшина ЛН, Сюндюкова РА, Куликов СВ и др. Разработка способа и схемы применения живой рекомбинантной коклюшной вакцины «ГамЖВК». Безопасность и переносимость двукратной интраназальной вакцинации здоровыми взрослыми добровольцами. Разработка и регистрация лекарственных средств. 2022;11(3):202–8. https://doi.org/10.33380/2305-2066-2022-11-3-202-208
11. Li R, Lim A, Ow ST, Phoon MC, Locht C, Chow VT, et al. Development of live attenuated Bordetella pertussis strains expressing the universal influenza vaccine candidate M2e. Vaccine. 2011;29(33):5502–11. https://doi.org/10.1016/j.vaccine.2011.05.052
12. Jahnmatz M, Richert L, Al-Tawil N, Storsaeter J, Colin C, Bauduin C, et al. Safety and immunogenicity of the live attenuated intranasal pertussis vaccine BPZE1: A phase 1b, double-blind, randomised, placebo-controlled dose-escalation study. Lancet Infect Dis. 2020;20(11):1290–301. https://doi.org/10.1016/S1473-3099(20)30274-7 Erratum in: Lancet Infect Dis. 2020;20(9):e215. https://doi.org/10.1016/S1473-3099(20)30628-9
13. Keech C, Miller VE, Rizzardi B, Hoyle C, Pryor MJ, Ferrand J, et al. Immunogenicity and safety of BPZE1, an intranasal live attenuated pertussis vaccine, versus tetanus–diphtheria– acellular pertussis vaccine: a randomised, double-blind, phase 2b trial. Lancet. 2023;401(10379):843–55. https://doi.org/10.1016/S0140-6736(22)02644-7
14. Медкова АЮ, Синяшина ЛН, Амичба АА, Семин ЕГ, Шевцова ЗВ, Матуа АЗ и др. Доклинические исследования безопасности, иммуногенности и защитной активности аттенуированных бактерий на экспериментальной модели Macaca mulatta. Журнал микробиологии, эпидемиологии и иммунобиологии. 2020;97(4):312–23. https://doi.org/10.36233/0372-9311-2020-97-4-3
15. Джидарян АА, Матуа АЗ, Медкова АЮ, Семин ЕГ, Синяшина ЛН, Дьяков ИН и др. Безопасность и иммуногенность препарата живой коклюшной вакцины ГамЖВК интраназального применения на экспериментальной модели детёнышей обезьян вида павиан гамадрил. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(2):203–14. https://doi.org/10.36233/0372-9311-190
16. Нестерова ЮВ, Медкова АЮ, Бабаченко ИВ, Семин ЕГ, Калисникова ЕЛ, Синяшина ЛН и др. Клиникодиагностическое значение генетических маркеров Bordetella pertussis у контактных лиц в семейных очагах. Журнал инфектологии. 2019;11(1):17–24. https://doi.org/10.22625/2072-6732-2019-11-1-17-24
17. Lin A, Apostolovic D, Jahnmatz M, Liang F, Ols S, Tecleab T, et al. Live attenuated pertussis vaccine BPZE1 induces a broad antibody response in humans. J Clin Invest. 2020;130(5):2332–46. https://doi.org/10.1172/JCI135020
18. Locht C, Papin JF, Lecher S, Debrie AS, Thalen M, Solovay K, et al. Live attenuated Bordetella pertussis vaccine BPZE1 protects baboons against bordetella pertussis disease and infection. J Infect Dis. 2017;216(1):117–24. https://doi.org/10.1093/infdis/jix254
19. Каратаев ГИ, Синяшина ЛН, Семин ЕГ, Медкова АЮ, Лиджиева АА, Куликов СВ. и др. Способы оценки защитной активности и иммуногенности коклюшных вакцин у человека, применение живой коклюшной рекомбинантной вакцины ГамЖВК. Патент Российской Федерации № 2799018; 2023. EDN: VEYJPZ
Об авторах
А. А. ЛиджиеваРоссия
Лиджиева Алевтина Анатольевна
ул. Гамалеи, д. 18, Москва, 123098
А. Ю. Медкова
Россия
Медкова Алиса Юрьевна, канд. мед. наук
ул. Гамалеи, д. 18, Москва, 123098
С. В. Куликов
Россия
Куликов Сергей Вячеславович
ул. Гамалеи, д. 18, Москва, 123098
Л. Н. Синяшина
Россия
Синяшина Людмила Николаевна, д-р мед. наук
ул. Гамалеи, д. 18, Москва, 123098
Р. А. Сюндюкова
Россия
Сюндюкова Резида Анваровна, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098
И. Н. Чернышова
Россия
Чернышова Ирина Николаевна, канд. мед. наук
ул. Гамалеи, д. 18, Москва, 123098;
Малый Казенный пер., д. 5а, Москва, 105064
М. В. Гаврилова
Россия
Гаврилова Марина Викторовна, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098;
Малый Казенный пер., д. 5а, Москва, 105064
К. К. Бушкова
Россия
Бушкова Кристина Константиновна
Малый Казенный пер., д. 5а, Москва, 105064
Н. А. Снегирева
Россия
Снегирева Надежда Анатольевна
Малый Казенный пер., д. 5а, Москва, 105064
И. Н. Дьяков
Россия
Дьяков Илья Николаевич, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098;
Малый Казенный пер., д. 5а, Москва, 105064
Г. И. Каратаев
Россия
Каратаев Геннадий Иванович, док. биол. наук
ул. Гамалеи, д. 18, Москва, 123098
Дополнительные файлы

|
1. Приложение № 1. Используемые материалы и методы. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(135KB)
|
Метаданные ▾ | |

|
2. Приложение №2. Результаты исследования динамики цитокинов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(256KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Лиджиева А.А., Медкова А.Ю., Куликов С.В., Синяшина Л.Н., Сюндюкова Р.А., Чернышова И.Н., Гаврилова М.В., Бушкова К.К., Снегирева Н.А., Дьяков И.Н., Каратаев Г.И. Иммуногенность «ГамЖВК, живой вакцины интраназального применения для профилактики коклюша» у взрослых добровольцев: слепое рандомизированное плацебо-контролируемое исследование по оптимизации метода и схемы введения. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(1):22-36. https://doi.org/10.30895/2221-996X-2025-610
For citation:
Lidzhieva A.A., Medkova A.Yu., Kulikov S.V., Sinyashina L.N., Sioundioukova R.A., Chernyshova I.N., Gavrilova M.V., Bushkova K.K., Snegireva N.A., Dyakov I.N., Karataev G.I. Immunogenicity of GamLPV, an intranasal live vaccine for pertussis prevention, in adult volunteers: a blind, randomised, placebo-controlled trial to optimise the method and schedule of administration. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(1):22-36. (In Russ.) https://doi.org/10.30895/2221-996X-2025-610


































