Перейти к:
Кандидатный препарат на основе модифицированных однодоменных антител для терапии ботулизма, вызванного ботулиническим токсином типа А
https://doi.org/10.30895/2221-996X-2025-591
Резюме
ВВЕДЕНИЕ. Основным методом лечения ботулизма в настоящее время является применение антитоксина ботулинического, однако использование данного препарата вызывает ряд побочных эффектов, включая аллергические реакции. Перспективным направлением для лечения интоксикации ботулиническим токсином представляется разработка препаратов на основе моноклональных антител, а именно однодоменных, модифицированных Fc-фрагментом IgG1 человека.
ЦЕЛЬ. Оптимизация лабораторной технологии получения и доклинические исследования эффективности препарата на основе однодоменного антитела, модифицированного Fc-фрагментом IgG1 человека (B11-Fc), для терапии и экстренной профилактики ботулизма.
МАТЕРИАЛЫ И МЕТОДЫ. Для культивирования использовали клеточную линию CHO. Культивирование стабильного клона-продуцента В7 осуществляли в колбах Эрленмейера с использованием коммерчески доступных сред и подпиток. Для очистки препарата однодоменного антитела B11-Fc использовали многоступенчатую хроматографическую очистку (аффинная, анионообменная и мультимодальная), вирусную очистку и тангенциальную фильтрацию. Степень чистоты препарата оценивали с помощью ВЭЖХ и электрофореза. Гликановый профиль устанавливали с применением ВЭЖХ. Определение концентрации антител в культуральной жидкости, а также оценку равновесных констант диссоциации антитела с различными Fc-рецепторами проводили с использованием метода биослойной интерферометрии. Ботулинический токсин типа А (BoNT/A) получали путем культивирования штамма Clostridium botulinum А98 и дальнейшей хроматографической очистки токсина. Экспериментальные исследования in vivo проводили на мышах-самках линии BALB/c. BoNT/A вводили внутрибрюшинно (в/б) или внутрижелудочно (в/ж), оценивали тяжесть токсических признаков. Препарат антител вводили внутримышечно (в/м) или внутривенно (при исследовании фармакокинетики). Проводили изучение эффективности препарата антител (по показателю выживаемости мышей) на различных моделях интоксикации и в разных режимах применения.
РЕЗУЛЬТАТЫ. Проведена оптимизация условий культивирования клона-продуцента антитела B11-Fc. Разработанная технология очистки антитела B11-Fc обеспечивала высокий выход антитела (0,5 г/л) с чистотой более 99%. Средний диаметр частиц в препарате — 7,85 нм. Проведена характеристика гликанового профиля препарата. Определены равновесные константы диссоциации антитела B11-Fc с различными Fc-рецепторами человека. Проведено моделирование интоксикации BoNT/A на мышах. Введение (в/м) препарата антител B11-Fc в дозе 0,6 мг/кг обеспечивало 100% протективный эффект при одновременном в/б введении BoNT/A в дозе 20 LD50. Определены основные фармакокинетические параметры антитела B11-Fc. Продемонстрирована защитная эффективность препарата в профилактическом режиме применения — в течение 21 сут при в/б введении 5 LD50 токсина. В терапевтическом режиме применения через 14 ч после в/ж введения токсина в дозе 12000 LD50 (для в/б введения) антитело обеспечивало 100% защитный эффект.
ВЫВОДЫ. Проведена оптимизация лабораторной технологии получения кандидатного препарата на основе модифицированных однодоменных антител B11-Fc. В экспериментах in vivo на модели интоксикации ботулиническим токсином мышей показана высокая эффективность препарата для терапии и профилактики ботулизма. Полученные данные доклинических исследований позволили перейти к проведению фазы I клинических исследований на здоровых добровольцах.
Ключевые слова
Для цитирования:
Деркаев А.А., Рябова Е.И., Есмагамбетов И.Б., Щебляков Д.В., Носков А.Н., Виноградова И.Д., Прокофьев В.В., Полянский Д.С., Логунов Д.Ю., Гинцбург А.Л. Кандидатный препарат на основе модифицированных однодоменных антител для терапии ботулизма, вызванного ботулиническим токсином типа А. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(1):58-70. https://doi.org/10.30895/2221-996X-2025-591
For citation:
Derkaev A.A., Ryabova E.I., Esmagambetov I.B., Shcheblyakov D.V., Noskov A.N., Vinogradova I.D., Prokofiev V.V., Polyansky D.S., Logunov D.Y., Gintsburg A.L. A modified single-domain antibody candidate for the treatment of botulism caused by botulinum toxin type A. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(1):58-70. (In Russ.) https://doi.org/10.30895/2221-996X-2025-591
ВВЕДЕНИЕ
Ботулинические токсины (botulinum neurotoxin, BoNT) являются опасными природными токсинами, продуцируемыми бактериями рода Clostridium. Попадание BoNT в организм человека даже в небольших количествах (>0,5 нг/кг) вызывает ботулизм — тяжелое заболевание, характеризующееся острым симметричным нисходящим вялым параличом1. В случае развития ботулизма необходима своевременная диагностика и ранняя терапия. Ежегодно в мире регистрируется около 1000 случаев ботулизма, 10% из которых являются летальными [1]. Ежегодно в Российской Федерации выявляется около 100–200 случаев ботулизма2. В 2024 г. в России произошла вспышка ботулизма (более 400 заболевших)3.
Несмотря на то что ботулизм является хорошо описанным заболеванием с известной клинической картиной, его ранняя диагностика затруднена из-за относительно редкой встречаемости, а также симптомов, схожих с другими заболеваниями. Вследствие этого имеются сложности с началом ранней терапии и экстренной профилактики существующими средствами.
Основной метод лечения ботулизма — применение антитоксина ботулинического для нейтрализации свободно циркулирующего ботулотоксина. Существующие в настоящее время препараты антитоксина в виде сыворотки противоботулинической лошадиной являются универсальным доступным средством терапии. Однако применение препаратов вызывает ряд побочных эффектов, включая аллергические реакции и сывороточную болезнь [2]. Кроме того, для препаратов сыворотки могут возникать проблемы, связанные с вариацией показателей качества между партиями, а также вирусной безопасностью. Таким образом, актуальной задачей является разработка эффективных антитоксинов против BoNT с применением современных биотехнологических подходов, в том числе моноклональных и однодоменных антител.
В течение последних двух десятилетий были разработаны терапевтические препараты на основе моноклональных антител [3–5]. Такие препараты имеют значительный потенциал для эффективной нейтрализации токсинов. В настоящее время существуют несколько препаратов антител против различных токсинов, например препараты актоксумаб и безлотоксумаб, специфичные к токсинам бактерий Clostridium difficile.
Перспективным направлением является разработка препаратов однодоменных антител (variable heavy chain domain of a heavy chain antibody, VHH), поскольку такие препараты характеризуются повышенной стабильностью, сниженной иммуногенностью, способностью связываться с труднодоступными эпитопами, а также проникать через гематоэнцефалический барьер [6][7]. К недостаткам однодоменных антител можно отнести низкую длительность циркуляции. Использование различных модификаций антител, например связывание с человеческим Fc-фрагментом, позволяет улучшить фармакокинетические параметры антитела и обеспечить эффекторные функции в организме [8][9]. В связи с этим актуальным представляется создание препарата на основе однодоменных антител для эффективной защиты в отношении BoNT, включающее в себя этапы разработки оптимальной технологии получения препарата высокой чистоты и оценки качества, а также проведения доклинических исследований эффективности препарата.
Ранее авторами было получено однодоменное антитело B11, слитое с Fc-фрагментом IgG1 человека (B11-Fc) [10], а также клеточная линия СНО, стабильно продуцирующая антитело B11-Fc (клон В7). Описанный метод не предусматривал большой объем наработки препарата, в связи с чем потребовалась оптимизация процесса культивирования клона-продуцента и условий очистки антитела B11-Fc, которая проводилась в рамках данной работы.
Цель работы — оптимизация лабораторной технологии получения и доклинические исследования эффективности препарата на основе однодоменного антитела, модифицированного Fc-фрагментом IgG1 человека (B11-Fc), для терапии и экстренной профилактики ботулизма.
МАТЕРИАЛЫ И МЕТОДЫ
Получение однодоменного антитела B11-Fc
Получение модифицированного однодоменного антитела B11-Fc, специфичного к ботулиническому токсину типа А (botulinum neurotoxin type A, BoNT/A), а также клеточной линии, продуцирующей антитело B11-Fc, проводили, как описано ранее [10]. Подбор оптимальных условий культивирования выполняли на основе подхода, описанного ранее [11]. Для проведения культивирования использовали клетки линии CHO, полученной из коллекции ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Министерства здравоохранения Российской Федерации (ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России). Применяли питательные среды SFM4CHO и ActiPro (Cytiva, США), подпитки Cell Boost 5 и Cell Boost 7a/7b (Cytiva, США). Культивирование клеток осуществляли в колбах Эрленмейера различных объемов (Corning, США) при 37 °C, 5% CO2 и постоянном перемешивании 85–100 об/мин в инкубаторе Multitron (Infors HT, Швейцария). Концентрацию клеток и их выживаемость анализировали с использованием счетчика клеток Cedex HiRes Analyzer (Roche, Швейцария) в соответствии с инструкцией производителя.
Измерение концентрации антитела в культуральной жидкости на всех стадиях работы проводили с использованием системы биослойной интерферометрии (bio-layer interferometry, BLI) Octet RED96 (ForteBio, США) и биосенсоров Ni-NTA (ForteBio, США) в соответствии с протоколом производителя в режиме кинетического измерения. Метод BLI также использовали для установления равновесных констант диссоциации антитела с Fc-рецепторами. В ходе измерения определяли параметр «Baseline» (в течение 30 с) в кинетическом буфере (150 мМ NaCl, 20 мМ натрия фосфат, натрия азид, рН 7,2), далее белки FcRn, CD16a, CD16b, CD32a, СD32b, γRI загружали на сенсоры в концентрации 30 мкг/мл (в течение 60 с). Затем VHH-Fc вносили в различных молярных концентрациях (500; 250; 125; 62,5; 31,25; 15,62; 7,81; 0 нМ) в кинетическом буфере на 300 с. Диссоциацию осуществляли в кинетическом буфере в течение 300 с. Анализ полученных данных выполняли с использованием программного обеспечения Octet Data Analysis 10.0 (ForteBio, США).
Хроматографическую очистку антител проводили в несколько стадий с использованием аффинной, анионообменной и мультимодальной хроматографии. Для аффинной хроматографии применяли хроматографическую систему ÄKTA Pure 25 (Cytiva, США) и колонку, содержащую сорбент MabSelect SuRe (Cytiva, США). В качестве связывающего буфера использовали раствор 150 мМ NaCl, 15 мМ Na2HPO4, 5 мМ NaH2PO4, 0,1% полисорбат 80, pH 7,2; в качестве элюирующего — раствор 200 мМ глицина (pH 2,5) с 0,1% полисорбатом 80. Для анионообменной хроматографии применяли колонку Sartobind Q Nano 3 мл (Sartorius, Германия). Очистку проводили в режиме проскока, в качестве буфера использовали раствор 150 мМ NaCl, 20 мМ трис-HCl, pH 6,8. Дополнительную очистку выполняли с помощью мультимодальной хроматографии с использованием керамического гидроксиапатита CHT Type I (Bio-Rad, США). Для предварительного уравновешивания сорбента использовали раствор, содержащий 75 мМ Na2HPO4, 25 мМ NaH2PO4, 6 ppm CaCl2, pH 7,5. Далее колонку уравновешивали раствором, содержащим 150 мМ NaCl, 20 мМ трис-HCl, pH 6,8. Затем проводили нанесение образца (pH 6,8) и промывание раствором, содержащим 150 мМ NaCl, 20 мМ трис-HCl, pH 6,8. Элюирование целевых фракций осуществляли раствором, содержащим 150 мМ NaCl, 15 мМ Na2HPO4, 5 мМ NaH2PO4, pH 7,2.
Очистку препарата от вирусов проводили путем вирусной инактивации и фильтрации. Вирусную инактивацию выполняли после стадии аффинной очистки путем инкубирования фракций антител при комнатной температуре в течение 30 мин в элюирующем буфере (pH 3,0). Далее pH доводили до 7,2–7,4 раствором трис-HCl (1М, pH 9,0). После последней стадии хроматографической очистки антител проводили вирусную фильтрацию с помощью фильтров Virosart HF 200 см² (Sartorius, Германия).
Для концентрирования препарата выполняли тангенциальную фильтрацию с помощью картриджа Hollow Fiber 30 кДa 850 см² (GE Healthcare, США) в буфере 20 мМ Na2HPO4×12H2O, 0,01% полисорбат 80, 150 мМ NaCl, pH 7,2. Далее осуществляли конечную фильтрацию с использованием капсульных фильтров Sartopore 2, 0,2 мкм (Sartorius, Германия).
Степень чистоты образцов препарата антител после очистки анализировали с применением методов электрофореза и ВЭЖХ. Электрофорез в полиакриламидном геле проводили с использованием гелей Mini-Protean TGX Stain-Free Precast Gels (Bio-Rad, США). Денатурацию образцов осуществляли в буфере с 2-меркаптоэтанолом (Sigma, США) при 95 °C в течение 10 мин. ВЭЖХ проводили с использованием системы Vanquish Flex UHPLC Systems (Thermo Scientific, США) и колонки BioSep SEC-s3000 5 мкм (Phenomenex, США) в соответствии со стандартной методикой [12]. Пробу (20 мкл) наносили в изократическом режиме при скорости потока 0,5 мл/мин.
Изучение гликанового профиля осуществляли с помощью ВЭЖХ (колонка Accucore 150 Amide HILIC 2,5 мкм, 150 мм, Thermo Scientific, США) и стандартов гликанов AdvanceBio (Agilent, США).
Измерение размера частиц в растворе выполняли методом динамического светорассеяния с помощью оборудования Zetasizer Nano ZS (Malvern, Великобритания) в соответствии с инструкцией производителя.
Исследование эффективности препарата однодоменного антитела B11-Fc in vivo
Эксперименты проводили на мышах-самках линии BALB/c (масса 18–20 г), ФГБУН «Научный центр биомедицинских технологий» ФМБА России, филиал «Андреевка». Исследования проводились в соответствии с протоколом, утвержденным на заседании биоэтической комиссии ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (протокол № 16 от 08.02.2019). Исследования выполняли согласно международным и национальным требованиям4. Перед началом экспериментов предварительно стерилизовали воду, подстилку, корм и клетки. Животных содержали в условиях свободного доступа к корму и воде (ad libitum).
Ботулинический токсин типа А получали с помощью культивирования штамма Clostridium botulinum А98 и дальнейшей хроматографической очистки, как описано ранее [10].
Предварительно определяли LD50 BoNT/A при внутрибрюшинном (в/б) введении нескольких доз токсина (интервал между дозами — 1,2 раза). На основании установленного значения LD50 рассчитывали дозы в последующих экспериментах. При расчете доз LD50 BoNT/A при внутрижелудочном (в/ж) введении использовали значения доз, соответствующие LD50 для в/б введения.
При моделировании интоксикации BoNT/A клиническую картину у мышей устанавливали при в/б введении, n=5, или в/ж введении, n=10. Тяжесть токсических признаков оценивали по балльной шкале по следующим признакам: легкое (1 балл) или умеренное (2 балла) абдоминальное дыхание, тяжелое абдоминальное дыхание и/или агональное дыхание (3 балла); слюнотечение и вялость (1 балл), слабость (2 балла) или полный паралич тела (отсутствие рефлексов, 3 балла). Животных, набравших 12 баллов при последовательных наблюдениях, подвергали эвтаназии в случае, если гибель не происходила ранее.
Для исследования протективного действия антитела B11-Fc проводили распределение животных по группам (контрольные, опытные группы, n=5). Токсин BoNT/A вводили в/б в дозах 5–100 LD50. Антитело B11-Fc вводили внутримышечно (в/м) в дозах 0,03–1,2 мг/кг.
Для изучения фармакокинетики препарат B11-Fc вводили внутривенно (в/в) в дозе 0,6 мг/кг и оценивали его концентрацию через 1, 4, 24, 48, 72, 96, 168, 240, 336, 504, 672 ч в опытных группах мышей (n=3). Определение концентрации B11-Fc в образах сыворотки крови мышей проводили с использованием набора IgG общий-ИФА-БЕСТ (АО «Вектор-Бест», Россия).
Для исследования специфической активности антитела B11-Fc распределяли животных по группам (контрольные, опытные группы, n=10). Токсин BoNT/A вводили в/б и в/ж в дозах 5 LD50 и 12000 LD50 соответственно. Антитело B11-Fc вводили внутримышечно (в/м) в дозе 0,6 мг/кг.
Статистическая обработка результатов
Анализ данных проводили с использованием программного обеспечения Microsoft Office Excel 2010, GraphPad Prism 9.0 (США) и ELISA Master («АлкорБио», Россия). Для оценки межгрупповых различий значений титра антител, выживаемости животных и значений исследуемых характеристик использовали критерий Краскела — Уоллиса. Попарное сравнение значений в экспериментальных группах с контрольными проводилось с использованием критерия Даннета. Достоверность отличий оценивали с помощью t-критерия и логарифмического рангового теста. Минимальный уровень значимости составлял 5% (p<0,05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Разработка лабораторной технологии получения препарата однодоменного антитела B11-Fc
Оптимизация процесса культивирования клона-продуцента В7. Подбор условий для оптимизации культивирования клона-продуцента с целью увеличения выхода B11-Fc проводили в колбах Эрленмейера объемом 25 мл. Клетки линии СНО, предварительно адаптированные к питательным средам SFM4CHO или ActiPro, высевали в концентрации 1,0×10⁶ клеток/мл. При достижении плотности более 3,0×10⁶ клеток/мл проводили добавление подпиток CellBoost 5 или CellBoost 7a и 7b по схеме, представленной в таблице 1.
Таблица 1. Схема культивирования клона-продуцента В7 на различных средах и показатели динамики клеточного роста и продукции антитела B11-Fc
Table 1. Fed-batch culture scheme for the B7 producer clone using various media, with the time course of cell growth and B11-Fc antibody production
Среда / подпитка для культивирования Culture media / feed | Показатель Parameter | Срок культивирования, сут Cultivation time, days | ||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | ||
SFM4CHO / CellBoost 5 | Концентрация клеток, клеток/мл Cell concentration, cells/mL | 3,2 | 7,2 | 9,4 | 9,9 | 9,9 | 9,8 | 9,6 | 8,8 | – |
Выживаемость, % / Viability, % | 99 | 100 | 100 | 99 | 98 | 96 | 93 | 84 | – | |
Объем подпитки, % / Feed volume, % | 4 | 6 | 8 | 10 | 10 | 10 | 8 | – | – | |
Концентрация антитела, мкг/мл Antibody concentration, µg/mL | 9 | 14 | 28 | 66 | 126 | 163 | 219 | 352 | – | |
ActiPro / CellBoost 5 | Концентрация клеток, клеток/мл Cell concentration, cells/mL | 4,1 | 9,2 | 13,1 | 13,4 | 13,5 | 13,5 | 13,3 | 13,1 | 11,2 |
Выживаемость, % / Viability, % | 99 | 100 | 100 | 100 | 100 | 99 | 98 | 96 | 85 | |
Объем подпитки, % / Feed volume, % | 4 | 6 | 8 | 10 | 10 | 10 | 8 | 7 | – | |
Концентрация антитела, мкг/мл Antibody concentration, µg/mL | 7 | 12 | 27 | 67 | 152 | 188 | 256 | 397 | 447 | |
SFM4CHO / CellBoost 7a + CellBoost 7b | Концентрация клеток, клеток/мл Cell concentration, cells/mL | 3,2 | 7,7 | 9,9 | 11,1 | 11,3 | 11,4 | 11,2 | 10,6 | 8,4 |
Выживаемость, % / Viability, % | 99 | 100 | 100 | 100 | 99 | 97 | 95 | 90 | 83 | |
Объем подпитки, % / Feed volume, % | 1 | 1 | 1,5 | 2 | 2,5 | 2,5 | 2,5 | 2 | – | |
Концентрация антитела, мкг/мл Antibody concentration, µg/mL | 0,1 | 0,1 | 0,15 | 0,2 | 0,25 | 0,25 | 0,25 | 0,2 | – | |
Концентрация клеток, клеток/мл Cell concentration, cells/mL | 7 | 11 | 25 | 51 | 154 | 203 | 331 | 437 | 516 | |
ActiPro / CellBoost 7a + CellBoost 7b | Концентрация клеток, клеток/мл Cell concentration, cells/mL | 4,1 | 10,5 | 14,6 | 14,8 | 14,9 | 14,8 | 14,6 | 13,2 | 11,9 |
Выживаемость, % / Viability, % | 99 | 100 | 100 | 99 | 100 | 99 | 97 | 93 | 86 | |
Объем подпитки, % / Feed volume, % | 1 | 1 | 2 | 2,5 | 3 | 3 | 2,5 | 2,5 | – | |
Концентрация антитела, мкг/мл Antibody concentration, µg/mL | 0,1 | 0,1 | 0,2 | 0,25 | 0,3 | 0,3 | 0,25 | 0,25 | – | |
Концентрация клеток, клеток/мл Cell concentration, cells/mL | 8 | 13 | 28 | 59 | 181 | 237 | 370 | 534 | 608 | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Проведенные исследования показали, что концентрация клеток СНО при использовании среды для культивирования ActiPro по сравнению со средой SFM4CHO была более высокой. При этом в случае применения комбинации среды ActiPro и подпиток CellBoost 7a и 7b показатели концентрации клеток, а также концентрации антитела в среде были максимальными — 14,9×10⁶ клеток/мл и 608 мкг/мл соответственно. В связи с этим данная комбинация среды и подпиток была выбрана для дальнейшего культивирования клона-продуцента антитела B11-Fc.
Достигнутые показатели культивирования коррелировали с данными, полученными авторами ранее [11], что указывает на оптимальные свойства среды ActiPro для обеспечения высоких темпов роста клеток и продукции антител.
Оптимизация условий очистки антитела B11-Fc. Культивирование клона-продуцента B7 проводили в соответствии с подобранной схемой в течение 9 сут. Стратегия очистки препарата антител включала в себя несколько этапов: аффинная, анионообменная и мультимодальная хроматография. На первом этапе очистки антител применяли метод аффинной хроматографии с использованием сорбента MabSelect SuRe. Проводили подбор оптимального состава элюирующего буфера. Было установлено, что при элюировании антител с колонки буфером на основе 20 мМ цитрата натрия (pH 2,8) наблюдалась агрегация антител. При использовании в качестве элюента раствора 200 мМ глицина (pH 2,5) и 0,1% полисорбата 80 агрегация практически отсутствовала, в связи с чем данный буфер был выбран в качестве элюирующего.
После этапа аффинной хроматографии осуществляли вирусную инактивацию путем выдерживания элюата при pH 3,0 в течение 30 мин.
Следующий этап хроматографической очистки B11-Fc проводили с использованием анионообменной хроматографии на мембранном адсорбере Sartobind Q Nano для удаления остаточных белков и ДНК клеток СНО, а также белка А. После этого этапа очистки выход очищенного антитела составил около 95% от первоначального уровня.
Дополнительный этап хроматографической очистки осуществляли с помощью керамического гидроксиапатита первого типа 40 мкм CHT Type I. Использование хроматографии данного типа позволило достигнуть высокой чистоты препарата B11-Fc и избавиться от агрегатов (рис. 1, опубликован на сайте журнала5). Выход очищенной фракции антитела составил 85% от исходного уровня.
После финальной стадии очистки проводили вирусную фильтрацию с использованием фильтров Virosart HF 200 см². Концентрирование препарата осуществляли до концентрации 3,0 мг/мл при помощи тангенциальной фильтрации с помощью картриджа Hollow Fiber 30 кДa 850 см². Далее проводили конечную фильтрацию с помощью капсульных фильтров Sartopore 2, 0,2 мкм.
Таким образом, в условиях оптимизации процесса культивирования клона-продуцента В7 удалось повысить выход однодоменного антитела B11-Fc, а разработка схемы многостадийной хроматографической очистки позволила увеличить конечный выход антитела до значений — 500 мкг c 1 мл культуральной жидкости.
Оценка степени чистоты и основных характеристик препарата однодоменного антитела B11-Fc
При оценке содержания примесей в препарате с использованием ВЭЖХ было показано наличие одного целевого пика, который соответствовал мономерной форме антитела B11-Fc (около 99%), а также отсутствовали пики примесных белков (рис. 2).
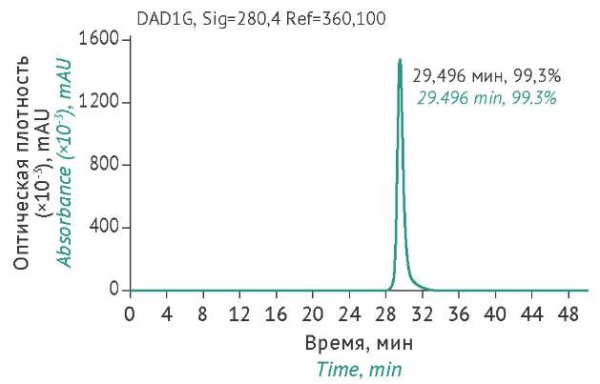
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Оценка чистоты препарата однодоменного антитела B11-Fc методом ВЭЖХ.
Fig. 2. Purity evaluation of the B11-Fc antibody preparation by HPLC.
Определение размера частиц в растворе препарата антител проводили с использованием метода динамического светорассеяния, что позволяет не только определить размер молекул и наличие их олигомеров, но и детектировать более крупные агломераты частиц, которые не определяются методом электрофореза, а также не могут быть обнаружены методом ВЭЖХ из-за их задержки на префильтрах хроматографической системы. Было показано присутствие одного основного пика, соответствующего молекулам со средним диаметром 7,85 нм, что согласуется со средним размером молекул VHH-Fc (рис. 3).
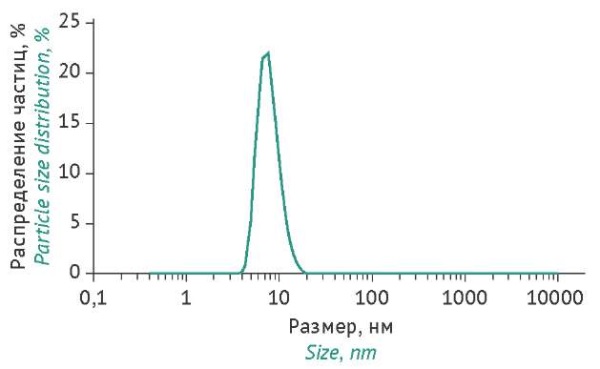
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 3. Оценка размера частиц препарата однодоменного антитела B11-Fc в растворе.
Fig. 3. Particle size evaluation of the B11-Fc single-domain antibody preparation in solution.
Изучение гликанового профиля препарата B11-Fc показало, что в зависимости от серии содержание высокоманнозилированных форм (Man5) составляло от 1 до 5% (табл. 2, опубликована на сайте журнала6). Указанный уровень значений показателя может свидетельствовать о возможности длительной циркуляции в организме [13]. Низкий уровень содержания высокогалактозилированных форм (G2+G2, 0%) позволяет предположить низкую иммуногенность препарата [14].
Поскольку препарат однодоменного антитела B11-Fc содержит Fc-фрагмент, необходимо изучение его взаимодействия с соответствующими рецепторами для оценки потенциальной роли в иммунологических реакциях [15]. Эти взаимодействия могут воздействовать на некоторые популяции иммунных клеток, а также влиять на поглощение, процессинг и представление антигена. Для изучения функциональной активности Fc-фрагмента проводили анализ взаимодействия с белками человека (FcRn, CD16a, CD16b, CD32a, СD32b, γRI), являющимися мишенями связывания с Fc-фрагментом человеческих иммуноглобулинов. Было показано, что антитело B11-Fc связывается с Fc-рецепторами человека с высокой аффинностью; значения KD представлены в таблице 3. Указанные характеристики антител могут способствовать усилению фагоцитарной активности моноцитов и макрофагов [16]. Высокая аффинность B11-Fc к FcRn может свидетельствовать о возможности длительной циркуляции антитела в организме [17].
Таблица 3. Равновесные константы диссоциации однодоменного антитела B11-Fc с различными Fc-рецепторами человека
Table 3. Equilibrium dissociation constants for the B11-Fc antibody and various human Fc receptors
Показатель Parameter | Fc-рецептор Fc receptor | |||||
CD16a | CD16b | CD32a | CD32b | FcRn | γRI | |
KD, M | 2,3×10⁻⁸ | 4,2×10⁻⁹ | 4,6×10⁻⁸ | 4,5×10⁻⁸ | 3,4×10⁻⁸ | 2,6×10⁻⁸ |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Исследование эффективности антитела B11-Fc in vivo
Моделирование интоксикации ботулиническим токсином типа А. На первом этапе исследования проводили оценку картины интоксикации при различных способах введения токсина BoNT/A. При в/б введении токсина мышам опытных групп (n=5) в дозах 5 или 10 LD50 уже через 3 ч наблюдалась острая картина интоксикации с развитием симптомов умеренной тяжести (7 из 12 баллов) — абдоминальное и агональное дыхание, спазм диафрагмы и прилегающих мышц живота, что соответствовало литературным данным [18]. Летальность регистрировали спустя 7–8 ч (рис. 4А, опубликован на сайте журнала7). Таким образом, при в/б введении токсина картина интоксикации развивалась стремительно, что не вполне соответствует длительности развития токсических симптомов у человека (12–36 ч после воздействия токсина)8.
Так как наиболее частой причиной интоксикации у людей являются пищевые отравления, то на следующем этапе работы проводили моделирование интоксикации у мышей (n=10) при в/ж введении BoNT/A в дозах 3000, 6000, 12000 и 18000 LD50, выбранных в соответствии с литературными данными [18]. Показано, что при в/ж введении токсина в дозах 12000 и 18000 LD50 летальность регистрировалась через 10 и 24 ч соответственно (рис. 4В, опубликован на сайте журнала9). При использовании более низких доз летального эффекта не наблюдали. Для оценки специфической активности антитела B11-Fc на модели интоксикации мышей при в/ж введении BoNT/A была выбрана доза 12000 LD50.
Изучение протективного действия антитела B11-Fc. Для подбора протективной дозы B11-Fc использовали острую модель интоксикации при в/б введении токсина. При дозе 10 LD50 BoNT/A и последующем незамедлительном в/м введении антитела B11-Fc в различных концентрациях была показана полная защита мышей от летального эффекта токсина при дозах антитела, равных 1,2 и 0,6 мг/кг (рис. 5A). Для дальнейшей работы была выбрана доза антитела 0,6 мг/кг как минимальная для обеспечения полной защиты от летального токсического эффекта BoNT/A.
Для оценки протективного действия антитела B11-Fc в выбранной дозе, мышам опытных групп (n=5) вводили (в/б) 5, 10, 20, 50 и 100 LD50 BoNT/A, после чего незамедлительно вводили (в/м) B11-Fc. Был показан 100% протективный эффект антитела B11-Fc при введении токсина в дозах 5, 10 и 20 LD50, 60% — при дозе 50 LD50 и 30% — при дозе 100 LD50 (рис. 5B).
Таким образом, была подобрана оптимальная протективная доза антитела B11-Fc, равная 0,6 мг/кг, обеспечивающая защиту мышей от острой интоксикации BoNT/A.
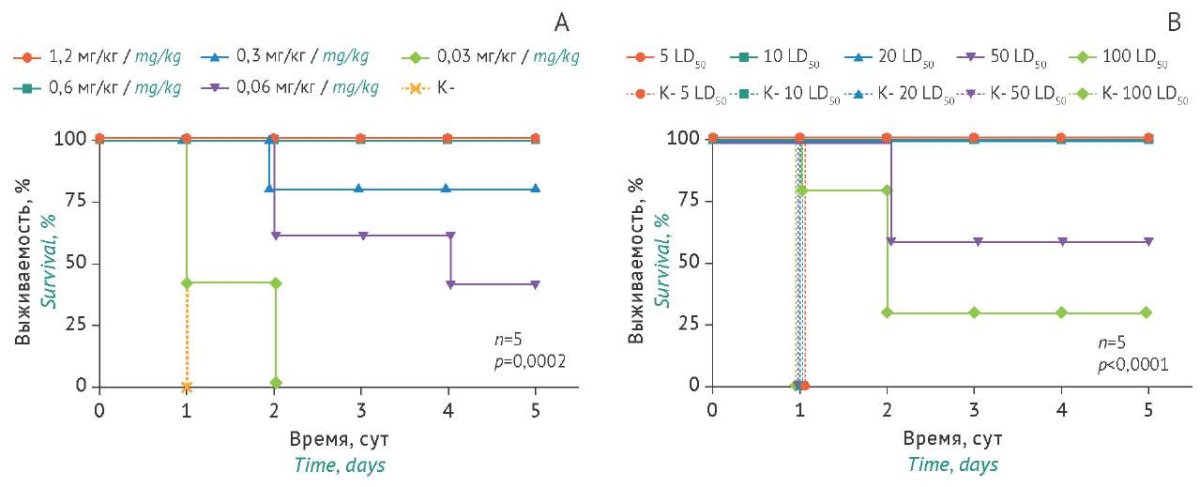
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 5. Динамика выживаемости мышей при внутримышечном (в/м) введении однодоменного антитела B11-Fc в дозах 0,03–1,2 мг/кг с последующим (незамедлительным) воздействием ботулинического токсина BoNT/A в дозе 10 LD50 (А) и при в/м введении B11-Fc в дозе 0,6 мг/кг мышам, получившим токсин в дозах 5–100 LD50 (В). Пунктиром обозначены данные в контрольных группах мышей (К-) с введением токсина, но без введения препарата антитела B11-Fc.
Fig. 5. Survival time course for mice after intramuscular (i.m.) administration of the B11-Fc single-domain antibody at doses of 0.03–1.2 mg/kg followed by (immediate) exposure to botulinum toxin type A (BoNT/A) at a dose of 10 LD50 (A) and after i.m. administration of B11-Fc at a dose of 0.6 mg/kg to mice exposed to BoNT/A at doses of 5–100 LD50 (B). The dotted lines indicate the data for the negative control mice (K-) that received BoNT/A but not B11-Fc.
Ранее авторами было показано, что в отсутствии модификации антитела Fc-фрагментом протективная активность препарата была ниже (>5 мг/кг) [10]. Следовательно, введение Fc-фрагмента приводит к повышению протективной активности, что может быть обусловлено увеличением авидности антитела.
Исследование фармакокинетики антитела B11-Fc. На первом этапе проводили изучение фармакокинетики B11-Fc, определяя концентрацию препарата в сыворотке крови после в/в введения дозы 0,6 мг/кг (рис. 6А). На основе фармакокинетической кривой были рассчитаны основные параметры фармакокинетики: максимальная концентрация, Cmax — 1,22 мкг/мл; время достижения максимальной концентрации, Tmax — 1,0 ч; площадь под фармакокинетической кривой «концентрация–время», AUC0-t — 784,55 мкг/мл×ч; период полувыведения, T1/2 — 46,4 ч.
Изучение специфической активности антитела B11-Fc в различных режимах применения. Исследование эффективности B11-Fc проводили в двух режимах его применения: профилактическом и терапевтическом.
Для оценки профилактического эффекта антитела мышам опытных групп (n=5) вводили в/м B11-Fc в дозе 0,6 мг/кг и далее через 7, 14, 21 и 28 сут вводили в/б токсин BoNT/A в дозе 5 LD50. Показано наличие защитного профилактического эффекта B11-Fc при последующем введении токсина на 7, 14 и 21 сут (рис. 6В). Однако защитный эффект отсутствовал в случае введения токсина на 28 сут после применения B11-Fc, так же как и в контрольной группе (без введения B11-Fc).
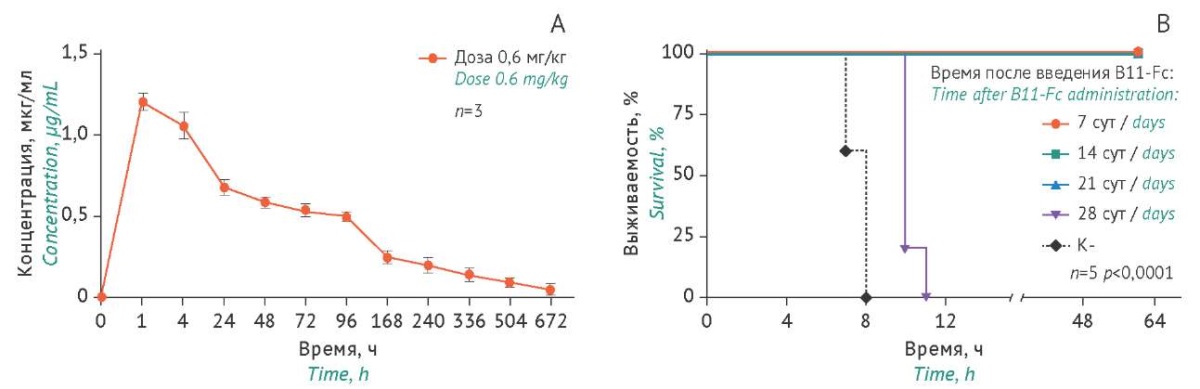
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 6. Динамика изменения концентрации однодоменного антитела B11-Fc в образцах сыворотки крови мышей (А) и динамика выживаемости мышей при использовании B11-Fc в режиме профилактического внутримышечного ведения в дозе 0,6 мг/кг с последующим воздействием ботулинического токсина BoNT/A в дозе 5 LD50 через 7, 14, 21 и 28 сут (В). Пунктиром обозначены данные в контрольной группе мышей (К-) с введением токсина, но без введения препарата антитела B11-Fc.
Fig. 6. Time courses of (A) B11-Fc concentration changes in mouse serum samples and (B) mouse survival after intramuscular administration of B11-Fc in the prophylactic mode at a dose of 0.6 mg/kg followed by exposure to botulinum toxin type A (BoNT/A) at a dose of 5 LD50 in 7, 14, 21 and 28 days after the antibody. The dotted line indicates the data for the negative control mice (K-) that received BoNT/A but not B11-Fc.
Таким образом, полная защита мышей охранялась до 21 сут и достигалась при концентрации антитела в крови 0,088 мкг/мл. Полученные данные об эффективности препарата в профилактическом режиме обусловлены, по-видимому, модификацией антитела Fc-фрагментом и увеличением периода его полувыведения, поскольку, как было показано авторами ранее, однодоменное антитело B11 без Fc-фрагмента обладает более низкой протективностью и очень коротким периодом полувыведения (< 1 ч) [10].
Для оценки эффективности антитела B11-Fc в терапевтическом режиме применения мышам опытных групп (n=10) вводили в/б токсин BoNT/A в дозе 5 LD50 и затем проводили в/м введение антитела B11-Fc (доза 0,6 мг/кг) через 0, 2, 4 и 6 ч. Было показано наличие защитного терапевтического эффекта B11-Fc при его использовании одновременно с токсином (временная точка 0 ч) и спустя 2 ч (рис. 7A). В группе с применением B11-Fc через 4 ч после токсического воздействия показана 40% выживаемость мышей, а через 6 ч — защитный эффект отсутствовал.
Для изучения эффективности B11-Fc после в/ж введения токсина (доза 12000 LD50) проводили в/м введение антитела в дозе 0,6 мг/кг через 12, 14, 16, 18 и 20 ч. В контрольной группе мышей (без лечения) умеренные симптомы интоксикации наблюдались через 14 ч, а летальность наступала спустя 24 ч после введения токсина. В группах мышей с введением B11-Fc через 12 и 14 ч после BoNT/A показана 100% выживаемость (рис. 7B). При использовании антитела через 16 и 18 ч выживаемость мышей в группах составила 60 и 50% соответственно. В группе с введением B11-Fc через 20 ч защитный эффект отсутствовал. Таким образом, показана возможность применения антитела B11-Fc для терапии интоксикации, вызванной воздействием токсина BoNT/A при его в/ж введении, до проявления симптомов ботулизма умеренной степени тяжести.
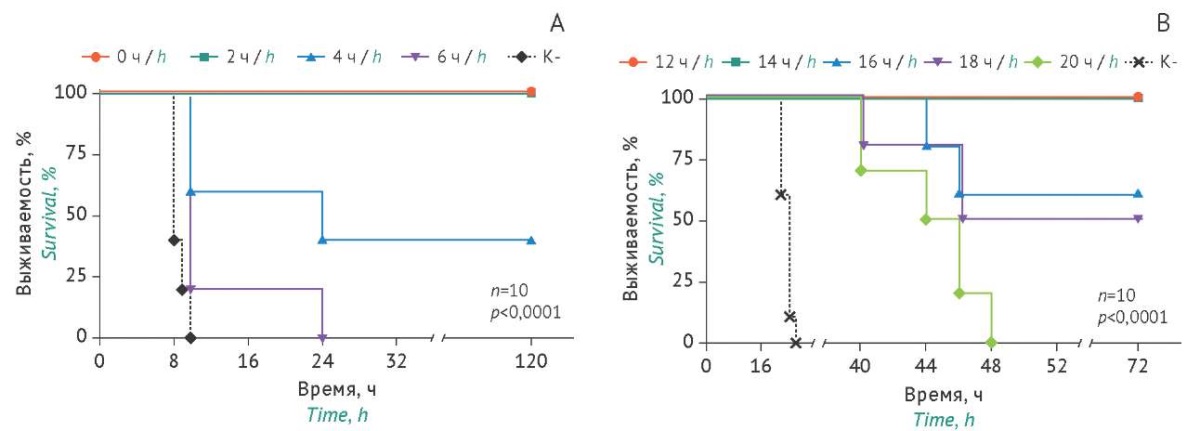
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 7. Динамика выживаемости мышей при использовании однодоменного антитела B11-Fc в режиме терапевтического внутримышечного ведения в дозе 0,6 мг/кг через 0–6 ч после внутрибрюшинного введения ботулинического токсина BoNT/A в дозе 5 LD50 (А) и через 12–20 ч после внутрижелудочного введения токсина в дозе 12000 LD50 (В). Пунктиром обозначены данные в контрольной группе мышей (К-) с введением токсина, но без введения препарата антитела B11-Fc.
Fig. 7. Time course of mouse survival after intramuscular administration of B11-Fc in the prophylactic mode at a dose of 0.6 mg/kg followed by (A) intraperitoneal administration of botulinum toxin type A (BoNT/A) at a dose of 5 LD50 in 0–6 h after the antibody or (B) intragastric administration of BoNT/A at a dose of 12,000 LD50 in 12–20 h after the antibody. The dotted lines indicate the data for the negative control mice (K-) that received BoNT/A but not B11-Fc.
Представленные данные исследования позволяют заключить, что разработанный кандидатный препарат на основе модифицированных однодоменных антител обладает эффективностью в режимах терапии, экстренной профилактики и краткосрочной профилактики в течение 21 сут после введения.
ВЫВОДЫ
- Проведена оптимизация условий культивирования клона-продуцента В7 и хроматографической очистки для получения кандидатного препарата для терапии ботулизма на основе модифицированного однодоменного антитела B11-Fc. Выход антител составил 0,5 г/л; степень чистоты — более 99%.
- Изучение гликанового профиля B11-Fcпоказало содержание высокоманнозилированных форм от 1 до 5%, высокогалактозилированных форм — 0%. Средний размер частиц в растворе препарата — 7,85 нм.
- Показана функциональная активность Fc-фрагмента препарата антитела, реализуемая за счет связывания с высокой аффинностью с различными типами Fc-рецепторов человека (FcRn, CD16a, CD16b, CD32a, СD32b, γRI).
- Продемонстрирована эффективность препарата B11-Fc на различных моделях интоксикации мышей ботулиническим токсином BoNT/A — при внутрибрюшинном и внутрижелудочном введении, а также при разных режимах применения препарата — в профилактическом и терапевтическом.
- Рассчитаны основные параметры фармакокинетики B11-Fc у мышей: Cmax— 1,22 мкг/мл, Tmax — 1,0 ч, AUC0-t — 784,55 мкг/мл×ч, T1/2 — 46,4 ч. Концентрация антител, обеспечивающая защиту от 5 LD50 ботулотоксина, составила 0,088 мкг/мл.
- Показан защитный эффект препарата B11-Fc в дозе 0,6 мг/кг при использовании для краткосрочной (до 21 сут) профилактики ботулизма (при в/б введении мышам токсина в дозе 5 LD50), что достигается благодаря наличию у однодоменного антитела Fc-фрагмента.
- Применение препарата B11-Fc в дозе 0,6 мг/кг эффективно для экстренной профилактики интоксикации и терапии пищевого ботулизма (при в/ж введении мышам токсина в дозе 12000 LD50) до проявления симптомов средней тяжести.
- Полученные результаты доклинических исследований кандидатного препарата на основе модифицированных однодоменных антител позволили перейти к проведению фазы I клинических исследований для оценки безопасности и переносимости препарата на здоровых добровольцах.
Дополнительная информация. На сайте журнала «БИОпрепараты. Профилактика, диагностика, лечение» размещены рисунки 1, 4 и таблица 2.
https://doi.org/10.30895/2221-996X-2025-591-fig1
https://doi.org/10.30895/2221-996X-2025-591-fig4
https://doi.org/10.30895/2221-996X-2025-591-table2
Additional information. Figure 1, Figure 4, and Table 2 are published on the website of Biological Products. Prevention, Diagnosis, Treatment.
https://doi.org/10.30895/2221-996X-2025-591-fig1
https://doi.org/10.30895/2221-996X-2025-591-fig4
https://doi.org/10.30895/2221-996X-2025-591-table2
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.А. Деркаев — получение клона-продуцента антитела B11-Fc, анализ качества препарата, проведение биослойной интерферометрии, исследование эффективности препарата in vivo, интерпретация результатов, написание текста рукописи; Е.И. Рябова — оптимизация условий культивирования клона-продуцента, анализ качества препарата, исследование эффективности препарата; И.Б. Есмагамбетов — концепция и дизайн исследования, интерпретация результатов, редактирование текста рукописи; Д.В. Щебляков — дизайн генетической конструкции, экспрессирующей однодоменное антитело, слитое с Fc-фрагментом, руководство исследованиями; А.Н. Носков — концепция исследования, получение и очистка ботулинического токсина А; И.Д. Виноградова — концепция исследования, изучение активности токсина; В.В. Прокофьев — оптимизация хроматографической очистки антитела, анализ качества препарата; Д.С. Полянский — культивирование клона-продуцента, оптимизация условий культивирования; Д.Ю. Логунов, А.Л. Гинцбург — руководство исследованиями, окончательное утверждение версии статьи для публикации.
Соответствие принципам этики. Исследования проводились в соответствии с протоколом, утвержденным на заседании биоэтической комиссии ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (протокол № 16 от 08.02.2019).
Благодарности. Коллектив авторов выражает благодарность коллегам из ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России, оказавшим помощь в выполнении исследования.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.A. Derkaev obtained a stable B11-Fc antibody producer clone, analysed the quality of the preparation, performed bio-layer interferometry, studied the efficacy of the preparation in vivo, interpreted the results, and drafted the manuscript. E.I. Ryabova optimised culture conditions for producer clone generation, analysed the quality of the preparation, and studied the efficacy of the preparation. I.B. Esmagambetov conceptualised and designed the study, interpreted the results, and edited the manuscript. D.V. Shcheblyakov designed the genetic construct expressing the Fc-fused single-domain antibody, and managed the experiments. A.N. Noskov conceptualised the study and produced and purified botulinum toxin A. I.D. Vinogradova conceptualised the study and studied the activity of the toxin. V.V. Prokofiev optimised chromatographic purification of the antibody and analysed the quality of the preparation. D.S. Polyansky generated the producer clone and optimised culture conditions for producer clone generation. D.Y. Logunov and A.L. Gintsburg managed the experiments and approved the final version of the manuscript for publication.
Ethics approval. The study was approved by the Bioethics Committee, National Research Center for Epidemiology and Microbiology named after the honorary academician N.F. Gamaleya, Ministry of Health of the Russian Federation (Protocol No. 16 of 8 February 2019).
Acknowledgements. The authors express gratitude to their colleagues at the National Research Center for Epidemiology and Microbiology named after the honorary academician N.F. Gamaleya for assistance with the study.
1. https://www.who.int/ru/news-room/fact-sheets/detail/botulism
2. Здравоохранение в России 2023. Статистический сборник. М.; 2023. https://rosstat.gov.ru/storage/mediabank/Zdravoohran-2023.pdf
3. https://www.rospotrebnadzor.ru/about/info/news/news_details.php?ELEMENT_ID=27998&sphrase_id=5493924
4. ГОСТ 33044-2014. Принципы надлежащей лабораторной практики.
Европейская конвенция о защите позвоночных животных, используемых для экспериментов и других научных целей. ETS N 123. Страсбург; 1986.
Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes.
5. https://doi.org/10.30895/2221-996X-2025-591-fig1
6. https://doi.org/10.30895/2221-996X-2025-591-table2
7. https://doi.org/10.30895/2221-996X-2025-591-fig4
8. Public health response to biological and chemical weapons: WHO guidance. WHO; 2004.
9. https://doi.org/10.30895/2221-996X-2025-591-fig4
Список литературы
1. Fleck-Derderian S, Shankar M, Rao AK, Chatham-Stephens K, Adjei S, Sobel J, et al. The epidemiology of foodborne botulism outbreaks: A systematic review. Clin Infect Dis. 2018;66(1):S73–S81. https://doi.org/10.1093/cid/cix846
2. Black RE, Gunn RA. Hypersensitivity reactions associated with botulinal antitoxin. Am J Med. 1980;69(4):567–70. https://doi.org/10.1016/0002-9343(80)90469-6
3. Anniballi F, Lonati D, Fiore A, Auricchio B, De Medici D, Locatelli CA. New targets in the search for preventive and therapeutic agents for botulism. Expert Rev Anti Infect Ther. 2014;12(9):1075–86. https://doi.org/10.1586/14787210.2014.945917
4. Rossetto O, Pirazzini M, Lista F, Montecucco C. The role of the single interchains disulfide bond in tetanus and botulinum neurotoxins and the development of antitetanus and antibotulism drugs. Cell Microbiol. 2019;21(11):e13037. https://doi.org/10.1111/cmi.13037
5. Shcheblyakov D, Esmagambetov I, Simakin P, Kostina L, Kozlov A, Tsibezov V. Development and characterization of two GP-specific monoclonal antibodies, which synergistically protect non-human primates against Ebola lethal infection. Antiviral Res. 2019;172:104617. https://doi.org/10.1016/j.antiviral.2019.104617
6. Muyldermans S, Cambillau C, Wyns L. Recognition of antigens by single-domain antibody fragments: The superfluous luxury of paired domains. Trends Biochem Sci. 2001;26(4):230–5. https://doi.org/10.1016/s0968-0004(01)01790-x
7. Есмагамбетов ИБ, Щебляков ДВ, Егорова ДА, Воронина ОЛ, Деркаев АА, Воронина ДВ и др. Наноантитела — потенциальный терапевтический препарат против лихорадки Эбола. Acta Naturae. 2021;13(4):53–63. https://doi.org/10.32607/actanaturae.11487
8. Kontermann RE. Strategies to extend plasma half-lives of recombinant antibodies. BioDrugs. 2009;23(2):93–109. https://doi.org/10.2165/00063030-200923020-00003
9. Danquah W, Danquah W, Meyer-Schwesinger C, Rissiek B, Pinto C, Serracant-Prat A, Amadi M, et al. Nanobodies that block gating of the P2X7 ion channel ameliorate inflammation. Sci Transl Med. 2016;8(366):366ra162. https://doi.org/10.1126/scitranslmed.aaf8463
10. Godakova SA, Noskov AN, Vinogradova ID, Ugriumova GA, Solovyev AI, Esmagambetov IB, et al. Camelid VHHs fused to human Fc fragments provide long term protection against botulinum neurotoxin A in mice. Toxins (Basel). 2019;11(8):464. https://doi.org/10.3390/toxins11080464
11. Полянский ДС, Рябова ЕИ, Деркаев АА, Старков НС, Кашапова ИС, Есмагамбетов ИБ. Разработка технологии культивирования клеточной линии, продуцирующей однодоменное антитело, слитое с Fc-фрагментом IgG1 человека. Тонкие химические технологии. 2024;19(3):240–57. https://doi.org/10.32362/2410-6593-2024-19-3-240-257
12. Mant CT, Chen Y, Yan Z, Popa TV, Kovacs JM, Mills JB, et al. HPLC analysis and purification of peptides. Methods Mol Biol. 2007;386:3–55. https://doi.org/10.1007/978-1-59745-430-8_1
13. Keck R, Nayak N, Lerner L, Raju S, Ma S, Schreitmueller T, et al. Characterization of a complex glycoprotein whose variable metabolic clearance in humans is dependent on terminal N-acetylglucosamine content. Biologicals. 2008;36(1):49–60. https://doi.org/10.1016/j.biologicals.2007.05.004
14. Newkirk MM, Novick J, Stevenson MM, Fournier MJ, Apostolakos P. Differential clearance of glycoforms of IgG in normal and autoimmune-prone mice. Clin Exp Immunol. 1996;106(2):259–64. https://doi.org/10.1046/j.1365-2249.1996.d01-847.x
15. Beck A, Haeuw JF, Wurch T, Goetsch L, Bailly C, Corvaïa N. The next generation of antibody-drug conjugates comes of age. Discov Med. 2010;10(53):329–39.
16. Jiang XR, Song A, Bergelson S, Arroll T, Parekh B, May K, et al. Advances in the assessment and control of the effector functions of therapeutic antibodies. Nat Rev Drug Discov. 2011;10(2):101–11. https://doi.org/10.1038/nrd3365
17. Reichert JM. Antibody-based therapeutics to watch in 2011. MAbs. 2011;3(1):76–99. https://doi.org/10.4161/mabs.3.1.13895
18. Rossetto O, Montecucco C. Tables of toxicity of botulinum and tetanus neurotoxins. Toxins (Basel). 2019;11(12):686. https://doi.org/10.3390/toxins11120686
Об авторах
А. А. ДеркаевРоссия
Деркаев Артем Алексеевич
ул. Гамалеи, д. 18, Москва, 123098
Е. И. Рябова
Россия
Рябова Екатерина Игоревна
ул. Гамалеи, д. 18, Москва, 123098;
ул. Академика Скрябина, д. 23, Москва, 109472
И. Б. Есмагамбетов
Россия
Есмагамбетов Ильяс Булатович, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098
Д. В. Щебляков
Россия
Щебляков Дмитрий Викторович, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098
А. Н. Носков
Носков Анатолий Николаевич, д-р биол. наук
ул. Гамалеи, д. 18, Москва, 123098
И. Д. Виноградова
Россия
Виноградова Ирина Дмитриевна, канд. биол. наук
ул. Гамалеи, д. 18, Москва, 123098
В. В. Прокофьев
Россия
Прокофьев Владимир Владимирович
ул. Гамалеи, д. 18, Москва, 123098
Д. С. Полянский
Россия
Полянский Дмитрий Сергеевич
ул. Гамалеи, д. 18, Москва, 123098
Д. Ю. Логунов
Россия
Логунов Денис Юрьевич, д-р биол. наук, академик РАН
ул. Гамалеи, д. 18, Москва, 123098
А. Л. Гинцбург
Россия
Гинцбург Александр Леонидович, д-р биол. наук, проф., академик РАН
ул. Гамалеи, д. 18, Москва, 123098
Дополнительные файлы

|
1. Рис. 1. Электрофореграмма образцов однодоменного антитела B11-Fc после этапа хроматографической очистки с использованием керамического гидроксиапатита. Образцы для электрофореза подготовлены в восстанавливающих (2–6) и невосстанавливающих (8–12) условиях. Дорожки на электрофореграмме: 1, 7 — маркер молекулярного веса; 2, 8 — фракция агрегатов; 3, 9 — целевая фракция; 4, 10 — начало сбора целевой фракции; 5, 11 — фракция несвязавшихся белков; 6, 12 — фракция до очистки. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(775KB)
|
Метаданные ▾ | |

|
2. Рис. 4. Динамика выживаемости мышей при внутрибрюшинном (A) и внутрижелудочном (B) введении ботулинического токсина BoNT/A. Пунктиром обозначено время наступления симптомов умеренной тяжести. | |
| Тема | ||
| Тип | Прочее | |
Скачать
(403KB)
|
Метаданные ▾ | |

|
3. Таблица 2. Содержание гликанов в препарате однодоменного антитела B11-Fc | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(705KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Деркаев А.А., Рябова Е.И., Есмагамбетов И.Б., Щебляков Д.В., Носков А.Н., Виноградова И.Д., Прокофьев В.В., Полянский Д.С., Логунов Д.Ю., Гинцбург А.Л. Кандидатный препарат на основе модифицированных однодоменных антител для терапии ботулизма, вызванного ботулиническим токсином типа А. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(1):58-70. https://doi.org/10.30895/2221-996X-2025-591
For citation:
Derkaev A.A., Ryabova E.I., Esmagambetov I.B., Shcheblyakov D.V., Noskov A.N., Vinogradova I.D., Prokofiev V.V., Polyansky D.S., Logunov D.Y., Gintsburg A.L. A modified single-domain antibody candidate for the treatment of botulism caused by botulinum toxin type A. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(1):58-70. (In Russ.) https://doi.org/10.30895/2221-996X-2025-591


































