Перейти к:
Анализ иммуногенной активности композиции инактивированных штаммов ротавируса вида A при иммунизации мышей
https://doi.org/10.30895/2221-996X-2024-24-4-403-414
Резюме
ВВЕДЕНИЕ. Для профилактики ротавирусной инфекции применяются живые аттенуированные вакцины. Однако, учитывая мировую и российскую практику вакцинации, а также особенности физиологии детского организма, актуальным представляется создание инактивированных ротавирусных вакцин. Необходимым условием при разработке таких вакцин является наличие стабильно реплицирующихся штаммов вируса и подбор оптимального режима инактивации для проявления необходимого уровня антигенной активности и иммуногенности.
ЦЕЛЬ. Оценка и сравнительная характеристика специфического противоротавирусного иммунного ответа на введение неинактивированных (нативных) штаммов и композиции инактивированных штаммов ротавируса вида А на модели мышей.
МАТЕРИАЛЫ И МЕТОДЫ. В работе использовали штаммы ротавируса человека вида А (RRV-4, RRV-5, RRV-6, RRV-7), стандартизированный штамм SA-11 № 2364 ГКВ, клеточные культуры линий Vero и СПЭВ. Инфекционную активность штаммов, выращенных на перевиваемых клетках линии Vero, определяли методом титрования вируса. Учет зараженных клеточных культур вели до наступления цитопатического действия и рассчитывали показатель ТЦД50 (50% тканевая цитопатическая доза) по методу Кербера в модификации Ашмарина и выражали его в lg ТЦД50/мл. Для инактивации штаммов вируса использовали формальдегид. Для оценки иммуногенной активности проводили иммунизацию нелинейных белых мышей с использованием нативных штаммов и композиции инактивированных штаммов (RRV-4, RRV-5, RRV-6, RRV-7). После иммунизации у животных отбирали кровь и в образцах сыворотки определяли титр антител к ротавирусу вида А с помощью метода гетерогенного непрямого иммуноферментного анализа.
РЕЗУЛЬТАТЫ. Штаммы ротавируса, адаптированные к росту на клеточной культуре линии Vero, проявляли инфекционную активность с уровнем титров от 8,9 до 7,9 lg ТЦД50/мл.
Показано, что инактивация штаммов наступала при температуре 37 °С и концентрации формальдегида от 0,05 до 0,025% в зависимости от длительности обработки. При оценке антигенной активности выявлено, что титр антигена в композиции инактивированных штаммов (1:16) был ниже, чем в случае нативных штаммов (1:32–1:64). Показано, что нативные штаммы и композиция инактивированных штаммов при иммунизации мышей обладали сравнимой специфической иммуногенной активностью.
ВЫВОДЫ. Получены штаммы-кандидаты ротавируса вида A, стабильно реплицирующиеся на перевиваемых клетках линии Vero. Подобраны оптимальные условия инактивации штаммов и разработана композиция инактивированных штаммов, обладающая специфической антигенной активностью и иммуногенностью. Представленные данные позволяют рассматривать полученную композицию инактивированных штаммов ротавируса вида A как основу для дальнейшей разработки инактивированной ротавирусной вакцины.
Ключевые слова
Для цитирования:
Коврижко М.В., Колпакова Е.П., Колпаков Д.С., Твердохлебова Т.И., Курбатов Е.С. Анализ иммуногенной активности композиции инактивированных штаммов ротавируса вида A при иммунизации мышей. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(4):403-414. https://doi.org/10.30895/2221-996X-2024-24-4-403-414
For citation:
Kovrizhko M.V., Kolpakova E.P., Kolpakov D.S., Tverdokhlebova T.I., Kurbatov E.S. Immunogenicity analysis of a composition of inactivated human rotavirus A strains in mice following immunisation. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(4):403-414. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-4-403-414
ВВЕДЕНИЕ
Ротавирусная инфекция является ведущей причиной тяжелых гастроэнтеритов, особенно у детей до 5 лет1. Всемирная организация здравоохранения (ВОЗ) рекомендует включение ротавирусных вакцин в программы для иммунизации детей2. В странах, где ротавирусные вакцины давно включены в национальный календарь прививок, наблюдается эффект формирования популяционного иммунитета [1][2].
Ротавирусы вида A обладают выраженным серотиповым и генотипическим разнообразием. Геном ротавирусов сегментирован, и гены, кодирующие белки вируса VP4 (P-белок) и VP7 (G-белок), могут независимо сегрегировать с образованием большого числа сочетаний этих белков [3]. По данным литературных источников, в настоящее время в мире, в том числе и в Российской Федерации, широкое распространение получили шесть комбинаций: G1P[ 8], G2P[ 4], G3P[ 8], G4P[ 8], G9P[ 8] и G12P[ 8] [4–7].
В настоящее время для профилактики ротавирусной инфекции применяются живые аттенуированные вакцины. Однако, учитывая мировую и отечественную практику вакцинации [8–10], а также принимая во внимание особенности физиологии детского организма, актуальным представляется разработка альтернативных подходов для вакцинации и создание нереплицирующихся ротавирусных вакцин [7][11], что будет являться необходимым дополнением к существующим живым вакцинам. По мнению авторов, нереплицирующиеся ротавирусные вакцины оптимальны для первоначального введения в организм ребенка с несовершенной пищеварительной системой и несформированным иммунитетом. Немаловажным аспектом является то, что использование этих вакцин не приводит к возникновению такого специфического нежелательного явления, как инвагинация кишечника (у детей группы риска). Кроме того, при применении вышеуказанных вакцин отсутствуют риски реассортации генов дикого и вакцинного штаммов в кишечнике иммунизированного ребенка, что сопряжено с опасностью возникновения эпидемического геноварианта штамма. Важно отметить, что цельновирионные инактивированные вакцины содержат стабилизированные антигены VP4, VP7, VP6 и стимулируют у человека полноценный иммунный ответ [11][12]. Нереплицирующиеся ротавирусные вакцины имеют ряд дополнительных преимуществ перед живыми вакцинами: возможность одновременного введения препарата с другими вакцинами, входящими в национальный календарь прививок, безопасность для детей из группы риска, экономическая эффективность [10][11].
В настоящее время разрабатывается ряд новых видов инактивированных (нереплицирующихся) вакцин [7][10][11][13]. Некоторые из этих вакцин успешно прошли доклинические исследования и показали перспективные результаты по защитной эффективности на экспериментальных животных [11][13] и в настоящее время находятся на этапе клинических исследований [14][15].
Следует отметить, что создание ротавирусной вакцины невозможно без наличия адаптированных к перевиваемым культурам клеток штаммов ротавируса человека. При разработке вакцинных препаратов используют линии клеток, рекомендуемые ВОЗ и разрешенные к применению в производстве3. Наиболее часто для производства вирусных вакцин используется культура клеток Vero, что связано с их высокой чувствительностью ко многим видам вирусов человека4 [16–19].
При создании полного цикла производства иммунобиологических препаратов неотъемлемой частью является разработка показателей качества вакцины5. Показатель «Подлинность» — один из важнейших при оценке качества вакцинного препарата. Поскольку технология производства ротавирусной вакцины включает в себя процесс инактивации штаммов-кандидатов, критической точкой данного этапа является контроль на специфическую антигенную активность композиции инактивированных штаммов, входящих в состав вакцинного препарата.
Цель работы — оценка и сравнительная характеристика специфического противоротавирусного иммунного ответа на введение неинактивированных (нативных) штаммов и композиции инактивированных штаммов ротавируса вида А на модели мышей.
В задачи исследования входили адаптация кандидатных штаммов ротавируса вида А к росту в культуре клеток линии Vero и их культивирование, определение инфекционной активности штаммов вируса, подбор метода их инактивации и отработка схемы иммунизации лабораторных животных для изучения иммуногенных свойств культуральных инактивированных штаммов.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы вирусов, линии клеток
В работе использовали штаммы-кандидаты ротавируса вида А (RRV-4, RRV-5, RRV-6, RRV-7), полученные из рабочей коллекции вирусов ФБУН «Ростовский научно-исследовательский институт микробиологии и паразитологии» Роспотребнадзора (ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора). Кандидатные штаммы размножали в культуре клеток почки эмбриона свиньи СПЭВ в поддерживающей среде DMEM с глутамином (ООО «БиолоТ», Россия) c добавлением антибиотиков (пенициллин 100 ЕД/мл, стрептомицин 100 мкг/мл) и 5% эмбриональной телячьей сыворотки — ЭТС (ООО «БиолоТ», Россия) при температуре 37 °C и 5% СО2. Цитопатическое действие (ЦПД) вирусов развивалось на 3–8 сут в зависимости от дозы заражения.
Штаммы-кандидаты были собраны от разных детей, больных ротавирусным гастроэнтеритом, в различные эпидемические периоды. Генотипы ротавирусных изолятов: RRV-4 G3[ P8]; RRV-5G4[ P8]; RRV-6 G9[ P8], RRV-7 G4[ P8].
Использовали стандартизированный штамм ротавируса вида А SA-11 № 2364 ГКВ, находящийся в коллекции вирусов ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора и задепонированный в Государственной коллекции вирусов (Институт вирусологии им. Д.И. Ивановского, ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России). Штамм SA-11 № 2364 ГКВ размножали в перевиваемых клетках линии СПЭВ: полная дегенерация монослоя — через 48–84 ч с концентрацией вирусных частиц не менее 10⁷–10⁸ в 1 мл культуральной жидкости; уровень титра антигена (определен с помощью иммуноферментного анализа) — не ниже 1:64.
Клетки линии Vero получены из главного банка культур клеток ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора. Клетки данной линии на всех пассажах контролировали согласно требованиям Государственной фармакопеи Российской Федерации (ГФ РФ) на стерильность, жизнеспособность, морфологическую однородность, присутствие посторонних агентов6. Подсчет клеток осуществляли в гемоцитометре по общепринятой методике [17][20].
В работе использовали вакцину для профилактики ротавирусной инфекции, пентавалентную, живую (Serum Institute of India Pvt. Ltd., Индия) в виде лиофилизата для приготовления раствора для приема внутрь, содержащую пять реассортантных штаммов ротавируса (человеческие и бычьи) серотипов G1, G2, G3, G4 и G9, выращенных на культуре клеток линии Vero. Все штаммы содержат антиген VP7 соответствующего серотипа из штаммов человеческих вирусов, реассортантных с бычьим ротавирусом (UK).
Культивирование и заражение клеточных линий вирусом
Клетки линии Vero выращивали до образования однородного монослоя (в среднем 5–6 сут). Клеточный монослой обрабатывали 0,25% раствором трипсина (ООО «БиолоТ», Россия) для получения клеточной взвеси. Клетки разводили до концентрации 100–150 тыс./мл в ростовой среде DMEM (ООО «БиолоТ», Россия) с содержанием 5–10% ЭТС и рассевали в культуральные флаконы (Greiner Bio-One, Германия) с площадью поверхности 175 см². Инкубацию клеток проводили при температуре 37 °C и 5% СО2.
Клеточный монослой перед заражением промывали три раза раствором Хенкса. Штаммы-кандидаты ротавируса перед нанесением на монослой клеток обрабатывали раствором Хенкса, содержащим трипсин (20 мкг/мл), и проводили адсорбцию вируса на клетки при температуре 37 °C, после чего добавляли среду DMEM до первоначального объема. Далее проводили ежедневное наблюдение зараженных клеток под микроскопом до появления изменений структуры монослоя и морфологии клеток. Критерием адаптации штаммов-кандидатов ротавируса к росту на клетках линии Vero являлось стабильное ЦПД в последовательных пассажах. Первые пассажи на этапе переадаптации проводились в сравнении с заражением клеток СПЭВ штаммом SA11 № 2364 ГКВ, проявляющим стабильную инфекционную активность не ниже 9,0±0,2 lg ТЦД50/мл (50% тканевая цитопатическая доза).
Выполняли молекулярно-генетический анализ штаммов ротавируса с использованием секвенирования по Сэнгеру с помощью генетического анализатора «Нанофор 05» (ООО «НПФ «Синтол», Россия) и набора реагентов производства ООО «НПФ «Синтол».
Определение инфекционной активности штаммов вируса
Инфекционную активность кандидатных штаммов ротавируса, выращенных на клетках линии Vero, определяли методом титрования вируса [21]. Титрование вируса проводили на клетках линии СПЭВ. Для этого готовили разведения вируса от 10¹ до 10⁻⁶ и с помощью каждого разведения заражали клетки СПЭВ в культуральных флаконах. Использовали следующие контроли: контроль интактной культуры клеток линии СПЭВ; контроль клеток СПЭВ в присутствии трипсина; контроль инфекционной активности ротавируса вида А (неразведенный вирус).
Учет зараженных клеточных культур вели до наступления цитопатического действия и рассчитывали показатель ТЦД50 по методу Кербера в модификации Ашмарина и выражали его в lg ТЦД50/мл [22].
Характеристика антигенной активности штаммов вируса методом иммуноферментного анализа
Методом иммуноферментного анализа (ИФА) устанавливали титры антигенов ротавируса в неинактивированных штаммах и в композиции инактивированных штаммов.
Определение титров проводили при помощи тест-системы «Ротавирус-антиген-ИФА-Бест» (АО «Вектор-Бест», Россия). Метод определения основан на твердофазном ИФА с применением моноклональных антител к группоспецифическому антигену VP6 ротавируса человека и конъюгата поликлональных антител с пероксидазой хрена.
В качестве групп сравнения использовали препарат коммерческой вакцины пентавалентной живой для профилактики ротавирусной инфекции и стандартизированный штамм ротавируса вида А SA-11 № 2364 ГКВ.
Подбор оптимальных условий инактивации штаммов-кандидатов ротавируса вида А
Для инактивации штаммов-кандидатов использовали растворы 0,1; 0,05; 0,03; 0,025% формальдегида. Инактивацию проводили при температуре 27 и 37 °C. Данные регистрировали на 5, 10, 30 сут. При оценке специфической безопасности (контроль полноты инактивации) использовали метод, включающий проведение 3 серийных пассажей штаммов ротавируса после обработки раствором формальдегида. Каждой пробой инактивированнных штаммов проводили заражение монослоя клеток линии СПЭВ. Использовали следующие контроли: интактная культура клеток линии СПЭВ; клетки СПЭВ после воздействия раствора формальдегида; контроль инфекционной активности нативного вируса. Последовательные заражения проводили независимо от характера ЦПД до трех пассажей. Положительным результатом считали тот, в котором при последовательных заражениях культуры клеток линии СПЭВ инактивированным вирусом отсутствовало ЦПД в трех заражениях; отрицательным результатом — в случае если при любом из последовательных заражений культуры клеток инактивированным вирусом наблюдалось минимальное проявление ЦПД. Критерием инактивации вирионов являлась потеря инфекционных свойств ротавируса по отношению к культуре клеток линии СПЭВ.
Лабораторные животные
Эксперименты проводили на белых нелинейных мышах в возрасте 6–8 нед. обоего пола (масса 19–21 г). Лабораторные животные были выращены в условиях конвенционального вивария ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора. В период проведения исследования животных содержали в изолированном помещении вивария при температуре 22–24 °C и относительной влажности воздуха не выше 60% в условиях свободного доступа к корму и воде на стандартном рационе кормления. Работу с животными проводили в соответствии с международными и национальными требованиями7. Протокол исследования одобрен Биоэтической комиссией ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора (протокол № 05/17 от 23.05.2023).
Оценка иммуногенной активности нативных штаммов и композиции инактивированных штаммов-кандидатов ротавируса вида А
Для оценки иммуногенной активности штаммов вирусов проводили иммунизацию мышей в количестве 70 особей (7 групп; 10 животных в группе) с использованием нативных штаммов, композиции инактивированных штаммов, стандартизированного штамма SA-11 № 2364 ГКВ; в качестве контроля применяли физиологический раствор (табл. 1). Прививочную дозу нативных штаммов-кандидатов ротавируса вида А (объем 0,2 мл) выражали в lg ТЦД50 [22]. Прививочную дозу композиции инактивированных штаммов (объем 0,2 мл) определяли до процесса инактивации и выражали в lg ТЦД50 [22].
Таблица 1. Схема иммунизации мышей
Table 1. Mouse immunisation scheme
Группа (n=10) Group (n=10) | Препарат для иммунизации Preparation used for immunisation | Прививочная доза Immunisation dose | Способ введения Route of administration | ||
1 сут Day 1 | 7 сут Day 7 | 14 сут Day 14 | |||
1 | Нативный штамм RRV-4 Native strain RRV-4 | 8,3 lg ТЦД50/0,2 мл 8.3 log10 TCID50/0.2 mL | в/м i.m. | в/б i.p. | в/м i.m. |
2 | Нативный штамм RRV-5 Native strain RRV-5 | 7,3 lg ТЦД50/0,2 мл 7.3 log10 TCID50/0.2 mL | в/м i.m. | в/б i.p. | в/м i.m. |
3 | Нативный штамм RRV-6 Native strain RRV-6 | 8,3 lg ТЦД50/0,2 мл 8.3 log10 TCID50/0.2 mL | в/м i.m. | в/б i.p. | в/м i.m. |
4 | Нативный штамм RRV-7 Native strain RRV-7 | 7,3 lg ТЦД50/0,2 мл 7.3 log10 TCID50/0.2 mL | в/м i.m. | в/б i.p. | в/м i.m. |
5 | Композиция инактивированных штаммов Inactivated strain composition | 7,8 lg ТЦД50/0,2 мл 7.8 log10 TCID50/0.2 mL | в/м i.m. | в/б i.p. | в/м i.m. |
6 | Стандартизированный штамм SA-11 № 2364 ГКВ Standard strain SA-11 NVC 2364 | 9,3 lg ТЦД50/0,2 мл 9.3 log10 TCID50/0.2 mL | в/м i.m. | в/б i.p. | в/м i.m. |
7 | Физиологический раствор Normal saline | 0,2 мл 0.2 mL | в/м i.m. | в/б i.p. | в/м i.m. |
Таблица составлена авторами по собственным данным /The table is prepared by the authors using their own data
Примечание. ТЦД50 — 50% тканевая цитопатическая доза; в/м — внутримышечно; в/б — внутрибрюшинно.
Note. TCID50, 50% tissue culture infectious dose; i.m., intramuscular; i.p., intraperitoneal.
Через 28 сут после иммунизации у животных отбирали кровь и в образцах сыворотки определяли титр антител к ротавирусу вида А с помощью метода твердофазного гетерогенного непрямого ИФА. Схема ИФА включала в себя сорбцию антигена — ротавируса вида А штамма SA-11 № 2364 ГКВ с концентрацией вирусных частиц не менее 10⁷–10⁸ в 1 мл культуральной жидкости, внесение образцов исследуемых сывороток и конъюгата антител козы (к суммарным IgG, IgA, IgM мыши) с пероксидазой хрена (ООО «Имтек», Россия). Методика включала обязательный этап отмывки реагентов от непрореагировавших компонентов на каждой стадии, в результате чего на последнем этапе анализа оставались антитела к ротавирусу вида А, содержащие суммарные иммуноглобулины классов G, A, M мыши к антигенам цельной ротавирусной частицы.
Статистические методы
Статистическую обработку экспериментальных данных проводили с использованием стандартного пакета программы Microsoft Office Excel 2010, рассчитывая значения среднего геометрического титра антител и доверительные интервалы для каждой группы образцов сыворотки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Адаптация штаммов к росту на культуре клеток линии Vero и культивирование кандидатных штаммов ротавируса вида А
На первом этапе работы было проведено исследование чувствительности к штаммам ротавируса человека вида А клеток линии Vero, которые наиболее часто используются при разработке вирусных вакцин [19].
На клетках линии Vero в ходе первых пассажей штаммов ротавируса выявлен низкий уровень ЦПД, не достигающий 80% в течение 14 сут (табл. 2). Начиная с 3–4 пассажа наблюдали увеличение уровня ЦПД с сокращением сроков его проявления — от 5 до 11 сут в зависимости от штамма.
Таблица 2. Показатели динамики проявления цитопатического действия вируса (ЦПД) при адаптации штаммов ротавируса вида А к культуре клеток линии Vero
Table 2. Indicators of changes in the cytopathic effect (CPE) with adaptation of human rotavirus A strains to Vero cells
Штаммы Strains | Время проявления (сут) и уровень ЦПД в зависимости от номера пассажа вируса на культуре клеток линии Vero CPE onset time (day) and level depending on the passage number in Vero cells | |||||||||
1 пассаж Passage 1 | 2 пассаж Passage 2 | 3 пассаж Passage 3 | 4 пассаж Passage 4 | 5 пассаж Passage 5 | ||||||
ЦПД, % CPE, % | Сут Day | ЦПД, % CPE, % | Сут Day | ЦПД, % CPE, % | Сут Day | ЦПД, % CPE, % | Сут Day | ЦПД, % CPE, % | Сут Day | |
RRV-4 | 40 | 14 | 80 | 14 | 80 | 8 | 100 | 7 | 100 | 5 |
RRV-5 | 30 | 14 | 30 | 14 | 50 | 14 | 50–70 | 12 | 100 | 9 |
RRV-6 | 20 | 14 | 20 | 14 | 30 | 10 | 80 | 10 | 90 | 10 |
RRV-7 | 20 | 14 | 40 | 14 | 50 | 10 | 50–60 | 10 | 100 | 9 |
SA-11 № 2364 ГКВ SA-11 NVC 2364 | 100 | 4 | 100 | 4 | 100 | 3 | 100 | 4 | 100 | 4 |
Таблица составлена авторами по собственным данным /The table is prepared by the authors using their own data
Примечание. SA-11 № 2364 ГКВ — стандартизированный штамм.
Note. SA-11 NVC 2364 is the standard rotavirus strain deposited at the National Virus Collection of the Russian Federation.
Для исключения кросс-контаминации образцов штаммов проводили их контроль методом секвенирования по Сэнгеру. Анализ показал, что нуклеотидная последовательность штаммов после заражения клеточного субстрата осталась прежней (данные запланированы к опубликованию).
В ходе исследований были получены штаммы ротавируса вида А, стабильно реплицирующиеся на перевиваемых клетках линии Vero. Установлено, что ЦПД изучаемых штаммов вируса характеризуется различной величиной и сроками наступления (табл. 2).
Для каждого из кандидатных штаммов, выращенных на перевиваемых клетках линии Vero, был определен инфекционный титр, значение которого составило для штамма вируса RRV-4 — 8,9 lg ТЦД50/мл; RRV-5 — 7,9 lg ТЦД50/мл; RRV-6 — 8,9 lg ТЦД50/мл; RRV-7 — 7,9 lg ТЦД50/мл. Таким образом, штаммы-кандидаты имели различную инфекционную активность на культуре клеток Vero, что свидетельствует о разной тропности поверхностных антигенов вирусов к клеточным рецепторам.
Инактивация штаммов-кандидатов ротавируса вида А
Технология производства инактивированных вирусных вакцин (против вирусов полиомиелита, гриппа и др.) является наиболее безопасной, однако требует подбора оптимальных условий [23–25].
При отработке условий инактивации кандидатных штаммов ротавируса были определены варианты инактивации, сочетающие в себе разную концентрацию формальдегида, температурный режим и продолжительность обработки штаммов (табл. 3).
Таблица 3. Результаты подбора условий инактивации штаммов ротавируса человека RRV-4, RRV-5, RRV-6, RRV-7
Table 3. Results of selecting inactivation conditions for human rotavirus strains RRV-4, RRV-5, RRV-6, and RRV-7
Концентрация формальдегида, % Formaldehyde concentration, % | Температура инактивации, °C Inactivation temperature, °C | Период инактивации, сут Inactivation time, days | Контроль полноты инактивации вируса на культуре клеток линии СПЭВ Control of viral inactivation completeness in SPEV cells | ||||
Контроль (воздействие раствора формальдегида), ЦПД, % Control with formaldehyde solution, CPE (%) | Контроль инфекционности нативного вируса, ЦПД, % Control of native virus infectivity, CPE (%) | Результат инактивации Inactivation result | |||||
ЦПД после заражения на 1 пассаже, % Infection after passage 1, CPE (%) | ЦПД после заражения на 2 пассаже, % Infection after passage 2, CPE (%) | ЦПД после заражения на 3 пассаже, % Infection after passage 3, CPE (%) | |||||
0,1 | 27 | 5 | 100 | 100 | 100 | 0 | 0 |
10 | 100 | 100 | 100 | 0 | 0 | ||
30 | 100 | 100 | 100 | 0 | 0 | ||
37 | 5 | 100 | 100 | 100 | 0 | 0 | |
10 | 100 | 100 | 100 | 0 | 0 | ||
30 | 100 | 100 | 100 | 0 | 0 | ||
0,05 | 27 | 5 | 100 | 100 | 100 | 0 | 0 |
10 | 100 | 100 | 100 | 0 | 0 | ||
30 | 100 | 100 | 100 | 0 | 0 | ||
37 | 5 | 80 | 100 | 100 | 0 | 0 | |
10 | 80 | 100 | 100 | 0 | 0 | ||
30 | 80 | 100 | 100 | 0 | 0 | ||
0,03 | 27 | 5 | 5 | 50 | 100 | 50 | 0 |
10 | 10 | 50 | 100 | 50 | 0 | ||
30 | 30 | 80 | 100 | 50 | 0 | ||
37 | 5 | 5 | 80 | 100 | 80 | 5 | |
10 | 10 | 80 | 100 | 80 | 0 | ||
30 | 30 | 50 | 100 | 50 | 0 | ||
0,025 | 27 | 5 | 50 | 100 | 50 | 10 | 10 |
10 | 50 | 100 | 50 | 20 | 10 | ||
30 | 50 | 100 | 50 | 10 | 10 | ||
37 | 5 | 50 | 100 | 50 | 10 | 10 | |
10 | 50 | 100 | 50 | 3 | 0 | ||
30 | 50 | 100 | 50 | 0 | 0 | ||
Таблица составлена авторами по собственным данным /The table is prepared by the authors using their own data
Примечание. СПЭВ — клетки свиной почки эмбриональной; ЦПД — цитопатическое действие вируса.
Note. SPEV, pig embryo kidney cells; CPE, cytopathic effect of the virus.
Представленные данные свидетельствуют о том, что инактивация вирусов наступала при температуре 37 °С и концентрации формальдегида от 0,05 до 0,025% в зависимости от длительности обработки. В тесте при оценке специфической безопасности (контроль полноты инактивации) показано отсутствие инфекционных вирусных частиц.
Сравнительную антигенную активность неинактивированных (нативных) культуральных штаммов ротавируса и композиции инактивированных штаммов в сравнении с коммерческой ротавирусной пентавалентной, живой вакциной определяли методом ИФА по содержанию антигена VP6 (табл. 4).
Таблица 4. Антигенная активность нативных штаммов ротавируса человека RRV-4, RRV-5, RRV-6, RRV-7, а также композиции инактивированных штаммов методом иммуноферментного анализа
Table 4. Antigenicity of native RRV-4, RRV-5, RRV-6, and RRV-7 strains and the inactivated strain composition determined by enzyme immunoassay
Параметр Parameter | RRV-4 | RRV-5 | RRV-6 | RRV-7 | Композиция инактивированных штаммов* Inactivated strain composition* | Коммерческая ротавирусная вакцина# Commercial rotavirus vaccine# | Стандартизированный штамм Standard strain |
Титр антигенов Antigen titre | 1:64 | 1:32 | 1:64 | 1:32 | 1:16 | 1:64 | 1:64 |
Таблица составлена авторами по собственным данным /The table is prepared by the authors using their own data
Примечание. * состав композиции включал инактивированные штаммы: RRV-4, RRV-5, RRV-6, RRV-7; # вакцина для профилактики ротавирусной инфекции, пентавалентная, живая. Стандартизированный штамм — штамм SA-11 № 2364 ГКВ.
Note. *, composition including inactivated RRV-4, RRV-5, RRV-6, and RRV-7 strains. #, pentavalent live vaccine for rotavirus prevention; standard strain SA-11 NVC 2364 (National Virus Collection of the Russian Federation).
Выявленные для нативных штаммов вируса значения титров составили от 1:32 до 1:64, что может являться характерной особенностью штаммов для этого способа культивирования при постановке реакции ИФА. Титр антигенов в композиции инактивированных штаммов был ожидаемо ниже, чем у нативных штаммов, так как в процессе инактивации при температуре 37 °С вирусные белки подвергаются конформационным изменениям в условиях длительного воздействия формальдегида. Следует отметить, что содержание антигена VP6 в нативных штаммах оказалось сопоставимо с таковым в образцах коммерческой вакцины и стандартизированного штамма.
Сравнительная иммуногенность нативных и инактивированных штаммов ротавируса
Защитная роль специфичных антител к ротавирусу вида А при иммунизации инактивированными вакцинами показана при использовании различных животных моделей, в том числе мышей [23]. Формирование гуморального иммунного ответа (по оценке сывороточных иммуноглобулинов классов A, G, M) выявлено при иммунизации с помощью разных способов введения инактивированной вакцины, при этом показано, что на полноту иммунного ответа влияет наличие белковых антигенов VP6, VP7, VP4 [23][26].
В данной работе для исследования иммуногенности использовалась модель мышей как наиболее удобная для изучения формирования гуморального иммунитета и контроля иммуногенности препарата. Для сравнительной оценки иммуногенности нативных штаммов и композиции инактивированных штаммов был использован метод ИФА (непрямой гетерогенный вариант) (табл. 5).
Таблица 5. Уровень специфических антител в образцах сыворотки крови мышей, иммунизированных с использованием нативных штаммов ротавируса человека RRV-4, RRV-5, RRV-6, RRV-7, а также композиции инактивированных штаммов
Table 5. Serum levels of antigen-specific antibodies in mice immunised with native human rotavirus strains RRV-4, RRV-5, RRV-6, and RRV-7 and the inactivated strain composition
Параметр Parameter | RRV-4 | RRV-5 | RRV-6 | RRV-7 | Композиция инактивированных штаммов* Inactivated strain composition* | Стандартизированный штамм Standard strain | Физиологический раствор Normal saline |
Среднее геометрическое значение титров антител, ед. ИФА/мл Geometric mean of antibody titres, EIA units/mL | 373,2 (355,4−392,6) | 282,8 (276,1−290,1) | 141,4 (137,8−145,0) | 174,1 (165,4−182,6) | 246,2 (242,1−250,3) | 400,0 (388,9−412,9) | 90,1 |
Таблица составлена авторами по собственным данным /The table is prepared by the authors using their own data
Примечание. * состав композиции включал инактивированные штаммы: RRV-4, RRV-5, RRV-6, RRV-7. Стандартизированный штамм — штамм SA-11 № 2364 ГКВ; ИФА — иммуноферментный анализ.
Note. *, composition including inactivated RRV-4, RRV-5, RRV-6, and RRV-7 strains. Standard strain SA11 NVC 2364 (National Virus Collection of the Russian Federation). EIA, enzyme immunoassay.
Продемонстрировано, что нативные штаммы и композиция инактивированных штаммов, введенные мышам парентерально, обладали специфической иммуногенной активностью. Значения уровней антител при иммунизации как в случае композиции инактивированных штаммов, так и в случае нативных штаммов оказались сопоставимы и отличались от фоновых значений (иммунизация физиологическим раствором). Это свидетельствует о сохранении вышеуказанными штаммами после инактивации функционально активных структур антигенспецифических эпитопов, инициирующих формирование антител.
На рисунке 1 представлены обобщенные данные по уровню антигенной активности и иммуногенности нативных штаммов, а также композиции инактивированных штаммов. Установлено, что между уровнем антителообразования и уровнем антигенной активности используемых штаммов не во всех случаях выявлена прямая зависимость. Композиция инактивированных штаммов ротавируса при меньшем уровне антигенной активности в сравнении с нативными штаммами инициировала формирование более высокого иммунного ответа с некоторыми нативными штаммами. Согласно данным литературы при первичной и вторичной ротавирусной инфекции формируются гомо- и гетеротипические антитела, способные нейтрализовать различные штаммы ротавируса вида А8 [10]. Полученные в данной работе результаты свидетельствуют о том, что композиция инактивированных штаммов, по-видимому, индуцирует гетеротипический иммунный ответ за счет наличия перекрестнореактивных эпитопов. Однако вопрос механизма формирования иммунного ответа при ротавирусной иммунизации, в том числе индукции гомо- и гетеротипических антител, требует дальнейшего изучения.
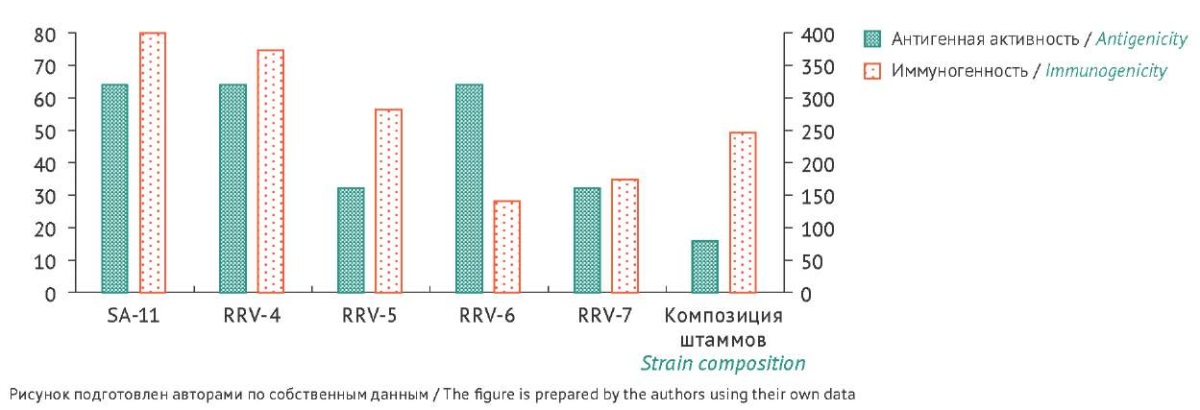
Рис. 1. Антигенная активность и иммуногенность нативных штаммов ротавируса вида А (SA-11, RRV-4, RRV-5, RRV-6, RRV-7) и композиции инактивированных штаммов (RRV-4, RRV-5, RRV-6, RRV-7). По оси Y — антигенная активность, титры антигенов (по левой оси) и иммуногенность, титры антител (по правой оси).
Fig. 1. Antigenicity and immunogenicity of native rotavirus group A strains (SA-11, RRV-4, RRV-5, RRV-6, and RRV-7) and the inactivated strain composition (based on RRV-4, RRV-5, RRV-6, and RRV-7 strains). The Y-axis represents antigenicity with antigen titres (on the left) and immunogenicity with antibody titres (on the right).
ВЫВОДЫ
- Получены кандидатные штаммы ротавируса вида A, стабильно реплицирующиеся на перевиваемых клетках линии Vero, с уровнем инфекционной активности от 8,9 до 7,9 lg ТЦД50/мл и с концентрацией, достаточной для создания вакцинного препарата.
- Инактивация штаммов-кандидатов ротавируса вида А достигается при температуре 37 °С и концентрации формальдегида от 0,05 до 0,025% в зависимости от длительности обработки. При инактивации вирусы теряют свою инфекционную активность, что было показано в тесте специфической безопасности (контроль полноты инактивации).
- После инактивации штаммов-кандидатов сохраняется антигенная активность капсидных белков (VP6) и иммуногенная активность штаммов при парентеральном введении мышам.
- Культуральные штаммы-кандидаты, полученные на клетках линии Vero, обладают специфическими антигенными свойствами ротавируса вида А, позволяющими инициировать формирование у мышей специфического гуморального иммунного ответа, регистрируемого по уровню сывороточных иммуноглобулинов классов A, G, M при постановке непрямого гетерогенного варианта ИФА.
- Показано, что между уровнем антигенной активности (титр антигена) и уровнем иммуногенности (титр антител) используемых штаммов не во всех случаях выявлена прямая зависимость.
- Для оценки иммуногенных свойств инактивированных штаммов ротавируса вида А достаточно применения экспериментальной мышиной модели. Определение иммуногенности важно для характеристики антигена ротавируса на этапах производства кандидатной вакцины для оценки ее качества по показателю «Подлинность».
- Антитела к ротавирусу вида А, полученные при иммунизации, целесообразно использовать в тест-системе для контроля промежуточных продуктов в процессе производства вакцины.
- Представленные данные позволяют рассматривать полученную композицию инактивированных штаммов ротавируса вида A в качестве основы для создания инактивированной ротавирусной вакцины.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: М.В. Коврижко — концепция исследования, формирование цели и задач исследований, написание и редактирование текста рукописи; Е.П. Колпакова — концепция исследования, написание текста рукописи, выполнение экспериментальных исследований, анализ и интерпретация результатов; Д.С. Колпаков — обсуждение результатов исследования и подготовка текста рукописи; Т.И. Твердохлебова — обсуждение и редактирование текста рукописи; Е.С. Курбатов — подготовка иллюстративного материала и редактирование текста рукописи.
Соответствие принципам этики. Протокол исследования одобрен Биоэтической комиссией ФБУН РостовНИИ микробиологии и паразитологии Роспотребнадзора (протокол № 05/17 от 23.05.2023).
Authors’ contributions. All authors confirm that their authorship meets the ICMJE criteria. The most significant contributions were as follows. M.V. Kovrizhko conceptualised the study, formulated its aim and objectives, drafted and edited the manuscript. E.P. Kolpakova conceptualised the study, drafted the manuscript, conducted the experiments, analysed and interpreted the results. D.S. Kolpakov discussed the study results and prepared the manuscript for submission. T.I. Tverdokhlebova discussed and edited the manuscript. E.S. Kurbatov prepared the illustrative material and edited the manuscript.
Ethics approval. The study protocol was approved by the Bioethics Commission of the Rostov Research Institute of Microbiology and Parasitology of the Federal Service for Surveillance in Healthcare (Protocol No. 05/17 of 23 May 2023).
1. https://iris.who.int/bitstream/handle/10665/342905/WER9628-301-319-eng-fre.pdf?sequence=1
2. Там же.
3. ОФС.1.7.1.0018.18 Иммунобиологические лекарственные препараты. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
4. ФС.3.3.1.0037.15 Вакцина полиомиелитная пероральная 1, 2, 3 типов, раствор для приема внутрь. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
5. ОФС.1.7.1.0018.18 Иммунобиологические лекарственные препараты. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
6. ОФС.1.7.2.0011.15 Требования к клеточным культурам-субстратам производства иммунобиологических препаратов. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
7. Европейская конвенция о защите позвоночных животных, используемых для экспериментов и других научных целей. ETS N 123. Страсбург; 1986.
Приказ Минздрава России от 01.04.2016 № 199н «Об утверждении Правил надлежащей лабораторной практики».
8. Морозова ОВ. Генотиповое разнообразие и филодинамика циркулирующих на территории России ротавирусов, сравнение с вакцинными штаммами: дис. … канд. биол. наук. М.; 2021.
Список литературы
1. Бондарев ВП, Шевцов ВА, Индикова ИН, Евреинова ЕЭ, Горенков ДВ. Эпидемиология ротавирусной инфекции и тактика вакцинопрофилактики. БИОпрепараты. Профилактика, диагностика, лечение. 2019;19(2):81–7. https://doi.org/10.30895/2221-996X-2019-19-2-81-87
2. De Grazia S, Filizzolo C, Bonura F, Pizzo M, Di Bernardo F, Collura A, et al. Identification of a novel intra-genotype reassortant G1P[8] rotavirus in Italy, 2021. Int J Infect Dis. 2024;140:113–8. https://doi.org/10.1016/j.ijid.2024.01.020
3. Маянский НА, Куличенко ТВ, Маянский АН. Ротавирусная инфекция: эпидемиология, патология, вакцинопрофилактика. Вестник Российской академии медицинских наук. 2015;70(1):47–54. https://doi.org/10.15690/vramn.v70i1.1231
4. Crawford SE, Ramani S, Tate JE, Parashar UD, Svensson L, Hagbom M, et al. Rotavirus infection. Nat Rev Dis Primers. 2017;3:17083. https://doi.org/10.1038/nrdp.2017.83
5. Sadiq A, Bostan N, Khan J, Aziz A. Effect of rotavirus genetic diversity on vaccine impact. Rev Med Virol. 2022;32(1):e2259. https://doi.org/10.1002/rmv.2259
6. Jain S, Vashistt J, Changotra H. Rotaviruses: is their surveillance needed? Vaccine. 2014;32(27):3367–78. https://doi.org/10.1016/j.vaccine.2014.04.037
7. Коровкин АС, Игнатьев ГМ. Результаты и перспективы вакцинопрофилактики ротавирусной инфекции в Российской Федерации. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(4):499–512. https://doi.org/10.30895/2221-996X-2023-23-4-499-512
8. Burke RM, Tate JE, Dahl RM, Aliabadi N, Parashar UD. Rotavirus vaccination is associated with reduced seizure hospitalization risk among commercially insured US children. Clin Infect Dis. 2018;67(10):1614–6. https://doi.org/10.1093/cid/ciy424
9. Bibera GL, Chen J, Pereira P, Benninghoff B. Dynamics of G2P[4] strain evolution and rotavirus vaccination: a review of evidence for Rotarix. Vaccine. 2020;38(35):5591–600. https://doi.org/10.1016/j.vaccine.2020.06.059
10. Кондакова ОА, Никитин НА, Трифонова ЕА, Атабеков ИГ, Карпова ОВ. Вакцины против ротавируса: новые стратегии и разработки. Вестник Московского университета. Серия 16. Биология. 2017;72(4):199–208. EDN: ZISVQL https://doi.org/10.3103/S0096392517040071
11. Wang Y, Li J, Liu P, Zhu F. The performance of licensed rotavirus vaccines and the development of a new generation of rotavirus vaccines: a review. Hum Vaccin Immunother. 2021;17(3):880–96. https://doi.org/10.1080/21645515.2020.1801071
12. Burke RM, Tate JE, Kirkwood CD, Steele AD, Parashar UD. Current and new rotavirus vaccines. Curr Opin Infect Dis. 2019;32(5):435–44. https://doi.org/10.1097/qco.0000000000000572
13. Zhou Y, Wu J, Hu X, Chen R, Lin X, Yin N, et al. Immunogenicity of inactivated rotavirus in rhesus monkey, and assessment of immunologic mechanisms. Hum Vaccin Immunother. 2023;19(1):2189598. https://doi.org/10.1080/21645515.2023.2189598
14. Костина ЛВ, Филатов ИЕ, Елисеева ОВ, Латышев ОЕ, Чернорыж ЯЮ, Юрлов КИ и др. Исследование безопасности и иммуногенности вакцины на основе VLP для профилактики ротавирусной инфекции на модели новорожденных карликовых свиней. Вопросы вирусологии. 2023;68(5):415–27. https://doi.org/10.36233/0507-4088-194
15. Fellows T, Page N, Fix A, Flores J, Cryz S, McNeal M, et al. Association between immunogenicity of a monovalent parenteral P2-VP8 subunit rotavirus vaccine and fecal shedding of rotavirus following Rotarix challenge during a randomized, double-blind, placebo-controlled trial. Viruses. 2023;15(9):1809. https://doi.org/10.3390/v15091809
16. Сейдахметова БА, Жаппарова ГА, Мараховская ЛГ, Теребай АА, Наханов АК. Масштабирование культуры клеток Vero для производства биопрепаратов. Биобезопасность и биотехнология. 2022;(9):44–52. https://doi.org/10.58318/2957-5702-2022-9-44-52
17. Каа КВ, Игнатьев ГМ, Синюгина АА, Ишмухаметов АА. Чувствительность клеточных линий к вирусу Чикунгунья и подбор метода наработки вирусного материала в промышленных объемах. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(1):111–120. https://doi.org/10.30895/2221-996X-2023-23-1-111-120
18. Грачев ВП, Хапчаев ЮХ. Применение перевиваемых линий клеток человека и животных для изготовления вирусных вакцин. Журнал микробиологии, эпидемиологии и иммунобиологии. 2008;(1):82–90. EDN: IJPFAR
19. Barrett PN, Mundt W, Kistner O, Howard MK. Vero cell platform in vaccine production: moving towards cell culture-based viral vaccines. Exp Rev Vaccines. 2009;8(5):607–18. https://doi.org/10.1586/erv.09.19
20. Louis KS, Siegel AC. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 2011;740:7–12. https://doi.org/10.1007/978-1-61779-108-6_2
21. Белоусова РВ, Троценко НИ, Преображенская ЭА. Практикум по ветеринарной вирусологии. Москва: КолосС; 2013.
22. Ашмарин ИП, Воробьев АА. Статистические методы в микробиологических исследованиях. Л.: Медгиз; 1962.
23. Jiang B, Gentsch JR, Glass RI. Inactivated rotavirus vaccines: a priority for accelerated vaccine development. Vaccine. 2008;26(52):6754–8. https://doi.org/10.1016/j.vaccine.2008.10.008
24. Евреинова ЕЭ, Хантимирова ЛМ, Шевцов ВА, Меркулов ВА, Бондарев ВП. Перспективные направления в совершенствовании вакцин для профилактики полиомиелита. БИОпрепараты. Профилактика, диагностика, лечение. 2022;22(2):142–53. https://doi.org/10.30895/2221-996X-2022-22-2-336
25. Отрашевская ЕВ, Трухин ВП, Меркулов ВА, Игнатьев ГМ. Прогресс в разработке вакцин для профилактики лихорадки Чикунгунья и перспективы появления на рынке. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(1):42–64. https://doi.org/10.30895/2221-996X-2023-23-1-42-64
26. Coffin SE, Moser KA, Cohen S, Clark HF, Offit PA. Immunologic correlates of protection against rotavirus challenge after intramuscular immunization of mice. J Virol. 1997;71(10):7851–6. https://doi.org/10.1128/jvi.71.10.7851-7856.1997
Об авторах
М. В. КоврижкоРоссия
Коврижко Марина Владимировна
Газетный пер., д. 119, г. Ростов-на-Дону, 344000
Е. П. Колпакова
Россия
Колпакова Елена Павловна
Газетный пер., д. 119, г. Ростов-на-Дону, 344000
Д. С. Колпаков
Россия
Колпаков Дмитрий Сергеевич
Газетный пер., д. 119, г. Ростов-на-Дону, 344000
Т. И. Твердохлебова
Россия
Твердохлебова Татьяна Ивановна, д-р мед. наук, доц.
Газетный пер., д. 119, г. Ростов-на-Дону, 344000
Е. С. Курбатов
Россия
Курбатов Егор Сергеевич
Газетный пер., д. 119, г. Ростов-на-Дону, 344000
Дополнительные файлы
Рецензия
Для цитирования:
Коврижко М.В., Колпакова Е.П., Колпаков Д.С., Твердохлебова Т.И., Курбатов Е.С. Анализ иммуногенной активности композиции инактивированных штаммов ротавируса вида A при иммунизации мышей. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(4):403-414. https://doi.org/10.30895/2221-996X-2024-24-4-403-414
For citation:
Kovrizhko M.V., Kolpakova E.P., Kolpakov D.S., Tverdokhlebova T.I., Kurbatov E.S. Immunogenicity analysis of a composition of inactivated human rotavirus A strains in mice following immunisation. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(4):403-414. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-4-403-414
JATS XML



































