Перейти к:
Реализация концепции Quality by Design для генотерапевтического лекарственного препарата на основе аденоассоциированного вирусного вектора
https://doi.org/10.30895/2221-996X-2025-580
Резюме
ВВЕДЕНИЕ. Производители генотерапевтических лекарственных препаратов на основе аденоассоциированных вирусов (ААВ) сталкиваются в настоящее время с рядом системных проблем, в основе которых лежат трудности в оценке качества препаратов из-за недостаточной базы научных данных, опыта и несовершенства нормативных и регуляторных требований. Риск-ориентированный подход для оценки критических показателей качества в рамках концепции «качество через дизайн» (Quality by Design, QbD) обеспечивает повышение эффективности разработки и производства высокотехнологичных лекарственных препаратов.
ЦЕЛЬ. Определение критических показателей качества и их диапазонов при разработке генотерапевтических лекарственных препаратов на основе ААВ для лечения миодистрофии Дюшенна в рамках реализации концепции «качество через дизайн» (QbD).
ОБСУЖДЕНИЕ. Проведен анализ подходов к разработке технологии производства ААВ с использованием концепции QbD. Обоснован перечень основных характеристик ААВ и доступных данных об их влиянии на пациентов с точки зрения эффективности и безопасности, в том числе иммунного ответа на лечение. Проведена оценка рисков и определен перечень критических показателей качества ААВ. В ходе разработки процесса производства ААВ определены диапазоны значений для показателей качества ААВ вектора: вирусный и инфекционный титры, наличие репликативно-компетентных AАВ, содержание пустых капсидов и остаточных примесей (белки, плазмидная ДНК и остаточная ДНК продуцента). Проведена комплексная оценка рисков при определении целевого профиля продукта — препарата на основе ААВ для лечения миодистрофии Дюшенна. Разработан перечень критических показателей качества препарата и основные требования к аналитическим методикам, а также установлены диапазоны значений параметров для контроля качества продукта.
ЗАКЛЮЧЕНИЕ. Применение концепции QbD и риск-ориентированного подхода является важным этапом в идентификации критических показателей качества при разработке генотерапевтических лекарственных препаратов. Использование методологии QbD позволяет сформировать новые регуляторные стандарты оценки безопасности и эффективности генотерапевтических препаратов, а также осуществлять их фармацевтическую разработку и промышленное производство.
Ключевые слова
Для цитирования:
Копеин Д.С., Порошин Г.Н., Хамитов Р.A. Реализация концепции Quality by Design для генотерапевтического лекарственного препарата на основе аденоассоциированного вирусного вектора. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):141-155. https://doi.org/10.30895/2221-996X-2025-580
For citation:
Kopein D.S., Poroshin G.N., Khamitov R.A. Implementation of the quality-by-design concept for an adeno-associated viral vector-based gene therapy. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):141-155. (In Russ.) https://doi.org/10.30895/2221-996X-2025-580
ВВЕДЕНИЕ
Генотерапевтические лекарственные препараты (ГенЛП) — инновационный класс терапевтических средств, принцип действия которых основан на доставке нового генетического материала в клетки-мишени, что открывает широкие возможности для терапии заболеваний, относящихся к неизлечимым или трудно поддающимся лечению, а также для повышения эффективности уже имеющихся терапевтических подходов за счет комбинированной стратегии. Особой группой ГенЛП являются препараты, созданные с использованием векторов на основе аденоассоциированных вирусов (ААВ). За последние годы произошло стремительное развитие в области использования ААВ в генной терапии, что продемонстрировало их значительный потенциал для лечения широкого спектра генетических заболеваний [1]. В настоящее время проводится более 250 клинических исследований с использованием ААВ в качестве терапевтического агента [2]. Эффект ААВ обусловлен действием в отношении мутаций генов, вызывающих либо отсутствие, либо дефицит функционального варианта белка. Генная терапия на основе ААВ может обеспечить подавление работоспособности гена с мутацией или коррекцию дефектного гена до функциональной копии в виде нативной либо синтетической нуклеотидной последовательности.
Разработка любых инновационных препаратов, в том числе и на основе ААВ, сталкивается с рядом научных и производственных проблем. В связи с этим актуальным представляется применение концепции «качество через дизайн» (Quality by Design, QbD)1 — системного современного подхода к разработке лекарственных препаратов. Концепция QbD основывается на постановке цели, поэтапном анализе, оценке всех стадий получения препарата, разработке стратегии контроля, валидации, а также определении всех рисков, связанных с качеством.
Авторами данной статьи рассматривается реализация подхода QbD при создании ГенЛП на основе ААВ, предназначенного для лечения миодистрофии Дюшенна, производства АО «ГЕНЕРИУМ». В основе технологии получения ААВ лежит транзиентная трансфекция клеток линии HEK293. Основной этап для реализации концепции при разработке продукта — определение биологических, физико-химических и других характеристик, для которых должны контролироваться диапазоны значений показателей для обеспечения желаемого качества продукта. Только на основе понимания критичности показателей качества продукта можно выстроить стратегию контроля на всех этапах производства и получить продукт наиболее рациональным путем.
Цель работы — определение критических показателей качества и их диапазонов при разработке ГенЛП на основе ААВ для лечения миодистрофии Дюшенна в рамках реализации концепции QbD.
ОСНОВНАЯ ЧАСТЬ
ААВ векторы как платформа для создания генотерапевтических препаратов
Первый препарат на основе ААВ Глибера (алипоген типарвовек) был одобрен в 2012 г. для терапии дефицита липопротеинлипазы. С 2017 по 2024 гг. было зарегистрировано еще несколько ГенЛП на основе ААВ, в том числе Элевидис (деландистроген моксепарвовек), предназначенный для лечения мышечной дистрофии Дюшенна [3].
ААВ представляет собой безоболочечный вирус рода Dependovirus семейства Parvoviridae, размер капсида которого составляет 20–25 нм, с геномом в виде одноцепочечной ДНК (около 4,7 тыс. п.о.). Для эффективной трансдукции клеток человека ААВ требуется коинфекция такими вспомогательными вирусами, как аденовирус или вирус простого герпеса человека [4]. Геном дикого типа вируса состоит из генов rep и cap, фланкированных двумя инвертированными терминальными повторами (inverted terminal repeats, ITR) по 145 п.о. Последовательности ITR участвуют в упаковке вирусного генома (вг), инициируют старт репликации и могут действовать как элементы интеграции в конкретную последовательность на хромосоме 19 человека (локус AAVS1) [5][6]. Ген rep кодирует четыре белка (Rep78, Rep68, Rep52 и Rep40), участвующих в репликации и упаковке вирусного генома. Ген cap кодирует три вирусных капсидных белка (VP1, VP2, VP3). Существует несколько основных серотипов ААВ (с ААВ1 по ААВ9), характеризующихся различной тканеспецифичностью [7].
Вирус дикого типа в качестве основы для создания системы доставки терапевтической нуклеотидной последовательности обладает рядом преимуществ, таких как отсутствие патогенности для человека, способность трансдуцировать делящиеся и неделящиеся клетки, а также возможность сохраняться продолжительное время в клетке в виде стабильной эписомы без интеграции в геном трансдуцированной клетки. Современные методы генной инженерии и биотехнологии позволяют получать более совершенные варианты ААВ. Так, с использованием подхода рационального дизайна были созданы новые ААВ, в гены белков оболочки капсида которых вносили мутации для увеличения тканевой специфичности или модификации антигенных участков. Варианты ААВ с улучшенными свойствами доставки гена были получены с применением методов направленной эволюции [8].
Для создания рекомбинантного ААВ гены rep и cap в геноме вируса заменяют на нуклеотидную последовательность терапевтического гена, которую требуется доставить в клетку, а гены rep и cap переносят во вспомогательный плазмидный вектор или вирус. Вследствие этого, в геноме ААВ нативным генетическим элементом вируса дикого типа остается нуклеотидная последовательность ITR. Эти изменения приводят к неспособности вектора к самостоятельной репликации и интеграции в геном человека, а также повышают уровень проникновения в клетки тканей различных типов в зависимости от серотипа вируса. Созданные векторы на основе ААВ характеризуются длительной и стабильной экспрессией генов, а также низким уровнем иммунного ответа на введение ААВ [9]. Однако кроме описанных выше преимуществ векторов на основе ААВ также следует упомянуть о некоторых недостатках, к которым относят ограничения объема доставляемой в клетку генетической информации, наличие в человеческой популяции предсуществующих, в том числе нейтрализующих, антител к белкам капсида или белку целевого трансгена.
Международный опыт в разработке ААВ векторов с использованием подхода QbD
Концепция QbD была впервые предложена экспертом по качеству Д.М. Джураном [10] и начиная с 1990-х гг. широко используется в фармацевтической промышленности, в том числе при разработке и производстве рекомбинантных белков. Подход QbD является комплексным и включает в себя определение целевого профиля качества продукта (quality target product profile, QTPP), определение критических показателей качества (critical quality attributes, CQA), разработку процесса производства и стратегии контроля. Согласно рекомендациям Международного совета по гармонизации технических требований к лекарственным средствам для медицинского применения (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)2 ключевым в подходе QbD является этап определения QTPP и CQA. Целевой профиль качества продукта основывается на данных о механизме действия разрабатываемого препарата, желаемой эффективности и безопасности, а также способе введения и дозе лекарственного препарата. Исходя из QTTP выделяют все показатели, которые могут влиять на безопасность и эффективность препарата. Далее на основе оценки риска для каждого показателя определяют CQA. Рекомендации ICH3 и Альянса регенеративной медицины (Alliance for Regenerative Medicine, ARM)4 описывают общий план управления рисками. Ранжирование рисков осуществляется следующим образом: каждый показатель качества оценивается исходя из уровня его потенциального воздействия (severity, impact) и степени неопределенности (uncertainty). При этом высокий уровень потенциального воздействия определяется для показателей качества, изменение которых может вызвать значительное изменение профиля безопасности/эффективности препарата. Что касается степени неопределенности, то низкий уровень устанавливается в случае хорошо охарактеризованного клинического эффекта, основанного на обширных данных in vitro, in vivo и клинических исследований, а высокий — для тех показателей, информация о влиянии которых на клинический эффект отсутствует либо недостаточна. Умножая уровень потенциального воздействия на степень неопределенности, можно установить уровень риска и тем самым классифицировать показатели: критические (CQA), потенциально критические или некритические (табл. 1, опубликована на сайте журнала5).
С целью контроля рисков и классификации показателей качества необходимо определить целевой профиль качества продукта — рекомбинантного ААВ. Было разработано несколько систем экспрессии для производства рекомбинантного ААВ, пригодного для использования в клинических исследованиях [9]. В зависимости от метода доставки вспомогательных элементов rep, cap и/или регуляторных элементов в клетку-продуцент способы производства ААВ можно разделить на четыре основных типа: 1) трансфекция клеток млекопитающих плазмидной ДНК; 2) получение стабильной клеточной линии млекопитающих с генами вспомогательных элементов; 3) заражение клеток млекопитающих рекомбинантными вирусами, сконструированными на основе вируса простого герпеса; 4) заражение клеток насекомых рекомбинантным бакуловирусом. Из перечисленных наиболее распространенным вариантом является первый способ производства на основе котрансфекции клеточной линии-продуцента (HEK293) тремя плазмидами, каждая из которых содержит нуклеотидную последовательность соответствующих вспомогательных элементов: плазмида с генами rep, cap; плазмида с вспомогательными вирусными генами аденовируса 5 серотипа; плазмида с терапевтическим геном и ITR. Затем трансфицированные клетки культивируют для формирования ААВ. Для извлечения вирусных частиц из клеток после культивирования используются такие варианты лизиса клеток, как осмотический шок, проведение нескольких циклов замораживания–оттаивания клеток или обработка клеток мягкими детергентами. Из полученных лизатов клеточный дебрис удаляется центрифугированием или фильтрацией. ДНК клеток HEK293 расщепляется нуклеазой для снижения вязкости клеточного лизата. Последующая очистка ААВ проводится с помощью ультрацентрифугирования и хроматографии. Ультрацентрифугирование позволяет отделить ААВ от прочих компонентов, а также фракционировать пустые и полные капсиды. Хроматография обеспечивает выделение ААВ по свойствам поверхности или размеру капсида и может представлять собой комбинацию аффинной, ионообменной и эксклюзионной хроматографии. Концентрирование и перевод в буфер готовой формы для хранения ААВ осуществляется с помощью ультрафильтрации. На последнем этапе препарат ААВ стерилизуют фильтрацией и разливают во флаконы. Общая схема производства представлена на рисунке 1.
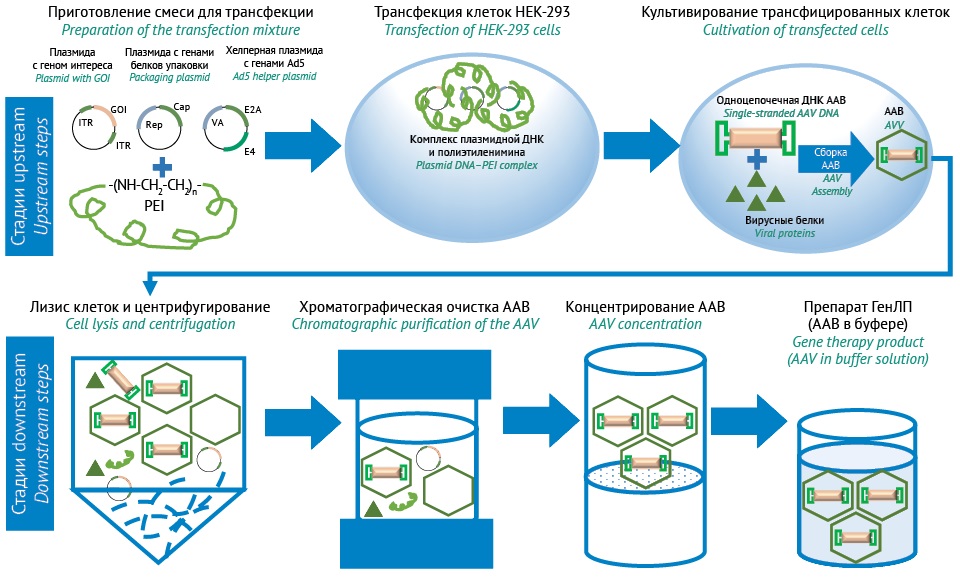
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Типовая схема производства рекомбинантных аденоассоциированных вирусов (ААВ). ГенЛП — генотерапевтический лекарственный препарат; Ad5 — аденовирус 5 серотипа; PEI — полиэтиленимин.
Fig. 1. Typical production scheme for adeno-associated viruses (AAVs). Ad5, adenovirus type 5; PEI, polyethylenimine; GOI, gene of interest.
Показатели качества ААВ (табл. 2) можно разделить на следующие основные категории:
- показатели качества целевого продукта — количественное содержание, подлинность, состав готового препарата ААВ;
- показатели качества, учитывающие наличие примесей, как связанных с ААВ, так и связанных с процессом производства;
- биологические контаминанты (инфекционные агенты, в том числе репликативно-компетентные ААВ), влияющие на безопасность или стабильность лекарственного препарата.
Таблица 2. Показатели качества при производстве рекомбинантных аденоассоциированных вирусов (ААВ)
Table 2. Quality attributes in a typical AAV production process
Показатель качества Quality attribute | Уровень риска (уровень потенциального воздействия × степень неопределенности) Risk level (potential impact × uncertainty) | Критичность показателя Attribute criticality |
Микробиологическая и вирусная безопасность Microbiological and viral safety | ||
Стерильность, эндотоксины, посторонние вирусы (вирусная безопасность), микоплазма Sterility, bacterial endotoxins, adventitious viral agents (viral safety), mycoplasma | 10 (10×1) | CQA |
Репликативно-компетентные ААВ Replication-competent AAVs | 9 (3×3) | CQA |
Подлинность Identity | ||
Наличие вирусных частиц / белков капсида, средний размер вирусных частиц Presence of viral particles / capsid proteins, average size of viral particles | 10 (10×1) | CQA |
Последовательность терапевтического гена Sequence of the gene of interest | 10 (10×1) | CQA |
Целостность вирусного генома Viral genome integrity | 10 (10×1) | CQA |
Показатели готовой лекарственной формы Finished dosage form parameters | ||
Внешний вид, рН, осмоляльность Appearance, pH, osmolality | 10 (10×1) | CQA |
Содержание и активность ААВ AAV content and strength | ||
Биологическая (специфическая) активность Biological activity (potency) | 30 (10×3) | CQA |
Инфекционный титр Infectious titre | 20 (10×2) | CQA |
Общая концентрация капсидов Capside titre | 10 (10×1) | CQA |
Геномный титр Vector genome titre | 30 (10×3) | CQA |
Чистота ААВ / Примеси AAV purity / Impurities | ||
Остаточные белки клеток-продуцентов Residual host-cell proteins | 1 (1×1) | н/к n/c |
Остаточная ДНК клеток-продуцентов Residual host-cell DNA | 3 (3×1) | п/к p/c |
Остаточная плазмидная ДНК Residual plasmid DNA | 3 (3×1) | п/к p/c |
Остаточный трансфекционный агент Residual transfection reagent | 3 (3×1) | п/к p/c |
Остаточные компоненты хроматографических сорбентов Residual components of chromatographic sorbents | 3 (3×1) | п/к p/c |
Остаточная эндонуклеаза Residual endonuclease | 3 (3×1) | п/к p/c |
Остаточные компоненты питательной среды (антибиотики, бычий сывороточный альбумин, индукторы и др.) Residual cell culture medium components (antibiotics, bovine serum albumin, inductors, etс) | 1 (1×1) | н/к n/c |
Остаточные компоненты для создания градиента плотности Residual density gradient materials | 3 (3×1) | п/к p/c |
Чистота белков капсида Capsid protein purity | 3 (3×1) | п/к p/c |
Пустые капсиды Empty capsids | 20 (10×2) | CQA |
Таблица составлена авторами по материалам Альянса регенеративной медицины6, с изменениями / The table is adapted by the authors from materials of the Alliance for Regenerative Medicine6
Примечание. CQA — критический показатель качества; п/к — потенциально критический показатель качества; н/к — некритический показатель качества.
Note. CQA, critical quality attribute; p/c, potentially critical quality attribute; n/c, non-critical quality attribute.
Оценка риска для показателей качества ААВ вектора
Каждому показателю качества присваивается уровень потенциального воздействия и степень неопределенности, по совокупности которых определяется уровень риска. В таблице 2 представлена оценка риска по основным показателям качества для ААВ.
Биологическая (специфическая) активность и титр вируса (инфекционный, геномный титры) — это первая по важности группа параметров, от которых напрямую зависит точность дозирования и, как следствие, эффективность и безопасность применения препарата.
Биологическая активность. Оценка биологической активности продуктов экспрессии гена интереса ААВ проводится по функциональной активности белка и количественной оценке содержания РНК. Например, для ААВ, несущих ген фермента, количественная оценка биологической активности может быть определена по ферментативной реакции белка in vitro. Однако для генов, продукты экспрессии которых не обладают выраженной функциональной активностью (например, ген структурного белка), определение биологической активности препарата может быть проведено методом иммуноферментного анализа (ИФА), проточной цитометрии или ПЦР на наличие РНК. В таких случаях необходимо установить соотношение между уровнем специфической активности, измеренной опосредованно, и титром вируса.
Титр ААВ вектора. Показатель титра или концентрацию вируса можно разделить на три составляющих: общая концентрация капсидов, геномный титр и инфекционный титр.
Под общей концентрацией капсида подразумевается содержание всех капсидов, независимо от наличия или отсутствия содержащегося в них генома или их способности трансдуцировать клетки. Общую концентрацию капсидов можно надежно определять с помощью простых методов, таких как ИФА (с антителами, специфичными к белкам капсида) или спектрофотометрически. Этот показатель, как правило, измеряют только при разработке и оптимизации процесса производства и обычно не включают в список показателей для контроля продукта на финальных стадиях производства.
Под инфекционным титром понимают количество функционально активных вирусов, которые способны к трансдукции. Инфекционный титр оценивают биологическим методом путем подсчета количества зараженных вирусом клеток. Поскольку инфицирование клеток ААВ не сопровождается цитопатическим эффектом, то классический метод прямого подсчета бляшек неприменим. В связи с этим для определения этого показателя необходимы либо котрансдукция хелперным вирусом, либо использование специальных клеточных линий. Однако такой метод не позволяет с достаточной точностью и воспроизводимостью количественно определять содержание вирусных частиц, способных к трансдукции целевых клеток [11]. Из-за низкой точности метода количество ААВ обычно устанавливают по геномному титру [12].
Геномный титр или концентрация вирусных геномов — это количество капсидов с инкапсулированным вирусным геномом, определяемое методом количественной ПЦР в реальном времени (ПЦР-РВ) или цифровой ПЦР (цПЦР). В настоящее время метод ПЦР-РВ является стандартом в области ААВ, что обусловлено его простотой, специфичностью и надежностью. Однако более оптимален метод цПЦР, который позволяет определять абсолютную концентрацию вирусных геномов и для которого не требуется применение стандартного образца в отличие от метода ПЦР-РВ [13][14]. Следует отметить, что при использовании ПЦР как основного метода подсчета вирусного титра необходимо соотнести количество вирусных геномов с функциональной активностью вируса с помощью еще как минимум одного метода.
Наличие в препарате ААВ пустых капсидов (без терапевтического гена) или частично заполненных капсидов, не обладающих специфической активностью, повышает вероятность развития или увеличения иммунного ответа пациентов на терапию. Кроме того, такие капсиды конкурируют с функционально активными полными капсидами за связывание с рецепторами целевых клеток и тем самым снижают вероятность трансдукции, что в итоге оказывает негативное влияние на эффективность препарата. Поэтому количество пустых или частично заполненных капсидов является вторым по важности показателем качества при разработке процесса производства. Согласно данным литературы встречаются разные значения показателя в образцах ААВ: от 1% до более 90% [15][16]. В клинических исследованиях показано, что при введении препарата ААВ с 84% пустых капсидов наблюдались Т-клеточные реакции, специфичные для капсида [17]. Известно, что для препарата Золгенсма значение этого показателя установлено как «не более 7%» [18].
Специфические антитела к ААВ являются не только одной из возможных причин снижения эффективности, но могут приводить к развитию тяжелых побочных реакций [19]. Основными мишенями иммунного ответа организма-хозяина против ААВ являются капсид и/или терапевтический белок. Из-за высокой встречаемости ААВ дикого типа в человеческой популяции в течение первых двух лет жизни часто развивается иммунный ответ практически против всех серотипов вируса. Большинство иммунных побочных реакций связано с активацией Т-клеточного звена иммунитета и в первую очередь проявляется в отношении гепатоцитов, трансдуцированных ААВ [20]. Метаанализ, проведенный на основе данных 255 клинических исследований, показал, что из 30 приостановленных в 2021–2022 гг. исследований причиной остановки 18 было выраженное токсическое действие препаратов, преимущественно гепатотоксичность [2].
Узкое терапевтическое окно препаратов на основе ААВ обусловлено близкими значениями диапазонов эффективных и токсических доз. Клиническое исследование ASPIRO (NCT03199469) препарата резамириген билпарвовек (AT132) в отношении Х-сцепленной миотубулярной миопатии было приостановлено из-за гибели 4 из 17 пациентов, получивших самую высокую дозу ААВ8 (3,5×10¹⁴ вг/кг). При лечении спинальной мышечной атрофии препаратом Золгенсма зарегистрированы случаи гибели пациентов, в том числе в России и Казахстане7. В то же время снижение дозы ААВ приводит к недостаточной терапевтической эффективности из-за эффекта нейтрализации предсуществующими или индуцированными в ходе терапии антителами.
Таким образом, малая терапевтическая широта препаратов на основе ААВ определяет высокую степень критичности таких показателей качества, как инфекционный титр вируса и/или геномный титр, а также соотношение пустых/полных капсидов [21].
Репликативно-компетентные вирусные частицы. Репликативно-компетентные ААВ (rcААВ), способные к репликации в присутствии хелперного вируса, представляют собой капсид ААВ, содержащий гены rep и cap фланкированные ITR, то есть фактически являются вирусами дикого или псевдодикого типа. Образование rcААВ происходит из-за рекомбинации между ITR, присутствующими в векторной упаковочной плазмиде, и последовательностями rep/cap, которые находятся во вспомогательных плазмидах [22]. Следует отметить, что использование ITR и rep вируса ААВ2 эффективно снижает рекомбинацию и приводит к более низкому уровню rcААВ [23]. Используемые в настоящее время подходы для производства оптимизированы для снижения количества rcААВ до уровня менее одного rcААВ на 10⁸ ААВ. Соответственно, доза в 10¹²–10¹⁵ ААВ потенциально может содержать от 10⁴ до 10⁷ вирусов, способных к репликации [9]. Проведенные исследования in vivo и in vitro не выявили прямого влияния rcААВ на безопасность [24]. Тем не менее, принимая во внимание недостаточность информации о потенциальном негативном воздействии, можно предположить возможный риск возникновения побочных эффектов на уровне отдельного пациента. В связи с этим уровень риска по показателю содержание rcААВ оценивается как средний.
Чистота ААВ и примеси. При производстве ААВ вирусные частицы могут подвергаться различным физико-химическим изменениям, таким как агрегация, деградация, окисление и др., что может негативно повлиять на эффективность и безопасность продукта. Поэтому важно определить и контролировать эти изменения, применяя соответствующие стратегии для оптимизации процессов культивирования, очистки и хранения частиц ААВ. Эти стратегии аналогичны тем, которые используются для рекомбинантных белков и вакцинных продуктов.
Наиболее часто встречается дезаминирование остатков аспарагина и глутамина в белке VP3 капсидa, уровень которого может достигать 99% (для ААВ8) [25]. Уровень дезаминирования увеличивается во время сборки ААВ в процессе культивирования и не связан с процессом очистки. Степень дезаминирования может влиять на активность трансдукции in vitro и в целом на эффективность препарата [25][26]. Однако в настоящее время отсутствует точная информация о том, какой уровень дезаминирования ААВ может влиять на трансдукционную активность. Гликозилирование белков редко встречается у ААВ [27], тем не менее сайты N-гликозилирования в белках капсида присутствуют [28]. Так как вероятность влияния дезаминирования или гликозилирования белков капсида на трансдукционную активность или иммуногенность невысока, то по данным показателям присваивается низкий уровень риска.
Остаточная ДНК клеток-продуцентов и остаточная плазмидная ДНК. Метод очистки, применяемый в производстве ААВ, включает использование нуклеаз и последующую хроматографию, что позволяет практически полностью удалить из конечного продукта внекапсидную ДНК. Однако во время сборки вирусных частиц в клетках иногда происходит случайное включение фрагментов ДНК клеток-продуцентов или плазмидной ДНК в капсиды. В очищенном препарате ААВ доля капсидов с фрагментами геномной ДНК клеток-продуцентов обычно варьирует в диапазоне от 0,04 до 3% [29], но может достигать 8% [24]. Такие фрагменты могут содержать открытую рамку считывания или регуляторные генетические элементы генома клеток, использующихся для сборки вируса. Так, например, при сборке вируса в клетках линии HEK293T возможно включение генов аденовируса E1 или Т-антигена SV40, а при сборке в клетках HeLa — генов вируса папилломы человека E6 и E7. В исследованиях in vivo показано, что риск онкогенеза, связанный с присутствием фрагментов геномной ДНК продуцента, минимальный [30], тем не менее теоретическую вероятность реализации такого риска исключить нельзя.
Плазмидная ДНК, используемая при производстве ААВ, так же как ДНК клеток-продуцентов, может быть включена в капсид вируса в процессе его сборки, и уровень ее содержания может составлять до 8% от геномной ДНК ААВ [17][29]. В остаточной плазмидной ДНК возможно присутствие потенциально генотоксических последовательностей, таких как гены rep и cap, гены антибиотиков, регуляторные элементы плазмид, гены E2A и E4 [31]. Для инкапсулированной плазмидной ДНК показана возможность трансдукции in vivo. Так, в исследовании in vivo показано, что после введения животным (макаке или собаке) препарата ААВ, содержащего приблизительно 1,3% капсидов с геном ampR, были обнаружены последовательности этого гена в тканях [32]. По результатам оценки препарата Глибера Управлением по контролю за качеством продуктов питания и лекарственных средств США (Food and Drug Administration) были выражены опасения о безопасности препарата из-за наличия открытых рамок считывания в капсидах бакуловируса, используемого как хелперный вирус при производстве этого препарата, что могло привести к экспрессии бакуловирусного белка в тканях пациента8. Между тем ни в одном клиническом исследовании не было выявлено каких-либо прямых доказательств взаимосвязи побочных эффектов с содержанием инкапсулированной плазмидной ДНК. Так, в исследованиях с применением препаратов ААВ, содержащих 0,018% последовательности cap [31], или 0,002% последовательности rep-ITR, или 1,87% последовательности гена устойчивости к канамицину [17], не было выявлено каких-либо дополнительных генотоксических эффектов. В связи с вышеописанным уровень риска для показателя остаточной ДНК клеток-продуцентов и плазмидной ДНК можно оценить как умеренный.
Остаточные белки клеток-продуцентов. Влияние остаточных белков клеток-продуцентов хорошо изучено на примере лекарственных препаратов на основе рекомбинантных белков или антител. В настоящее время регуляторными органами разных стран установлены пределы содержания остаточных белков продуцента в диапазоне от 1 до 100 ppm9, что при дозе 10 мг рекомбинантного белка составляет от 0,01 до 1 мкг. Доза, равная в 10¹⁵ вирусных частиц, включает приблизительно 10 мг капсидов, из которых около 6,5 мг приходится на белки и около 3,5 мг на ДНК. Соответственно, рекомендуемое максимальное содержание остаточных белков клеток-продуцентов на дозу в 10¹⁵ вирусных частиц не должно превышать 1 мкг.
Технологические примеси. В ходе производства есть вероятность попадания в препарат ААВ примесей таких материалов технологического процесса, как компоненты и добавки питательных сред (индукторы, антибиотики и др.), лиганды хроматографических сорбентов, компоненты буферов (детергенты, соли тяжелых металлов), ферменты (нуклеаза). Наличие таких примесей в препарате несет определенные риски, и поэтому их наличие и содержание должно контролироваться. При определении целевого профиля продукта все подобные примеси должны быть рассмотрены с точки зрения влияния на безопасность, эффективность и стабильность целевого ААВ. Для большинства этих компонентов влияние хорошо изучено в доклинических и/или клинических исследованиях, и для них можно установить диапазоны значений показателей на основе соответствующих нормативных требований10 [33].
При производстве вирусных векторов (не только ААВ) используется эндонуклеаза, способная расщеплять ДНК и РНК. Известно, что ДНКаза I и РНКаза содержатся в крови человека в концентрации около 3 нг/мл [34]. Кроме того, зарегистрирована и используется в качестве лекарственного средства ДНКаза I (дорназа альфа). Влияние на безопасность каталитической активности этого фермента считается минимальным. Тем не менее существуют риски развития аллергической реакции при применении препарата, содержащего остаточную нуклеазу.
В процессе очистки ААВ применяется ультрацентрифугирование в градиенте плотности, и для создания градиента обычно используется цезия хлорид (CsCl), сахароза или йодиксанол. Цезий является тяжелым металлом, и его остаточные примеси могут оказывать негативное влияние на организм человека, в связи с чем предпочтительна его замена на альтернативные реагенты. Сахароза и йодиксанол входят в состав многих лекарственных средств, и влияние их остаточных примесей в низких концентрациях на безопасность препарата ААВ можно оценить как минимальное.
Наличие примеси таких компонентов, как бактерии, микоплазмы, вирусы, в том числе репликативно-компетентные ААВ, и эндотоксины, относятся к критическим показателям качества продукта в связи с непосредственным влиянием на безопасность применения препарата. Из-за большого количества данных исследований по этим компонентам и соответствующих нормативных требований в фармакопеях и рекомендациях регуляторных органов разных стран степень неопределенности по данным показателям можно оценить как низкую.
Применение подхода QbD для разработки препарата на основе ААВ вектора для терапии миодистрофии Дюшенна
Разработка ГенЛП для лечения миодистрофии Дюшенна является одним из приоритетных направлений, что обусловлено наиболее высокой частотой этого заболевания среди наследственных нервно-мышечных болезней человека. В настоящее время в АО «ГЕНЕРИУМ» проводятся исследования по разработке инновационного ГенЛП на основе ААВ для лечения миодистрофии Дюшенна. Общая схема производства представлена на рисунке 2.
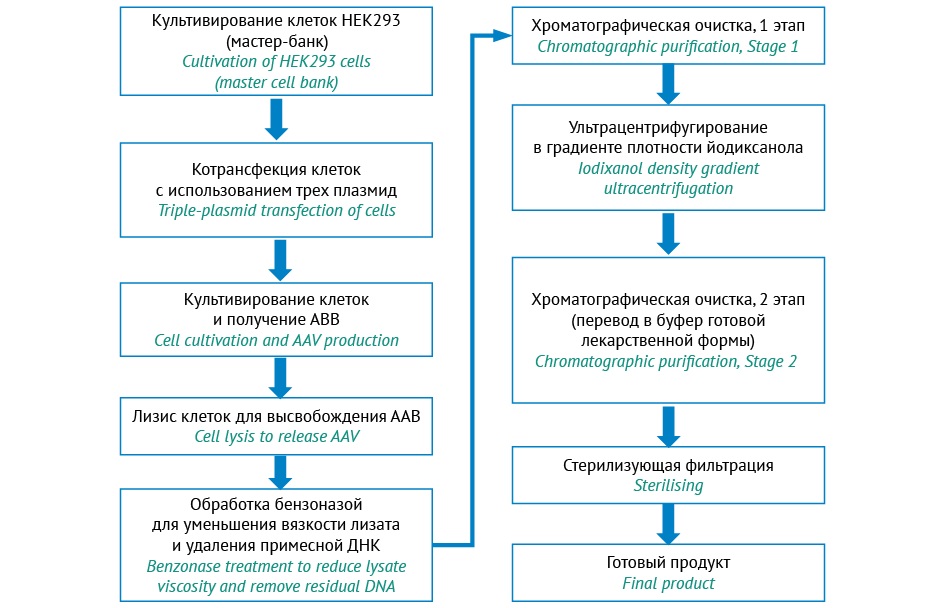
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Схема производства препарата на основе аденоассоциированного вируса (ААВ) для лечения миодистрофии Дюшенна.
Fig. 2. Production scheme for an AAV-based product for Duchenne muscular dystrophy.
В соответствии с принципами QbD на первом этапе был определен целевой профиль качества разрабатываемого продукта и затем рассмотрен производственный процесс для формирования стратегии контроля показателей качества. Затем были оценены и ранжированы риски по каждому из показателей, установлены оптимальные методы контроля качества и диапазоны допустимых значений (табл. 3).
Таблица 3. Показатели качества для препарата на основе аденоассоциированного вируса (ААВ) для лечения миодистрофии Дюшенна
Table 3. Quality attributes for an AAV-based gene therapy for Duchenne muscular dystrophy
Показатель качества Quality attribute | Уровень риска Risk level | Аналитический метод Analytical procedure | Установленный диапазон Specification |
Микробиологическая и вирусная безопасность Microbiological and viral safety | |||
Стерильность Sterility | 10 | Метод прямого посева Direct inoculation | Стерильно Sterile |
Эндотоксины Bacterial endotoxins | 10 | LAL-тест LAL-test | 0,75 ЕЭ/мл 0.75 EU/mL |
Репликативно-компетентные AАВ Replication-competent AAVs | 10 | Клеточный тест Cell-based assay | Должны отсутствовать Free of detectable replication-competent AAVs |
Посторонние вирусы Adventitious viral agents | 10 | ПЦР-РВ RT-PCR | Должны отсутствовать Free of detectable adventitious viral agents |
Микоплазмы Mycoplasma | 10 | ПЦР-РВ RT-PCR | Должны отсутствовать Free of detectable mycoplasma |
Подлинность Identity | |||
Белки капсида Capsid proteins | 10 | Вестерн-блот Western blotting | Наличие всех белков All proteins present |
Последовательность терапевтического гена Sequence of the gene of interest | 10 | ПЦР PCR | Наличие гена Gene of interest present |
Целостность вирусного генома Viral genome integrity | 10 | ПЦР-РВ, секвенирование RT-PCR, sequencing | Присутствуют полные вирусные геномы Complete viral genomes present |
Средний размер вирусных частиц Average viral particle size | 10 | Динамическое светорассеяние Dynamic light scattering | От 28 до 33 нм From 28 to 33 nm |
Содержание и активность ААВ AAV content and strength | |||
Биологическая (специфическая) активность Biological activity (potency) | 10 | Клеточный тест Cell-based assay | Наличие экспрессии гена Gene expression present |
Титр вирусного генома Vector genome titre | 20 | ПЦР-РВ, цифровая ПЦР RT-PCR, dPCR | 10¹³–10¹⁴ вг/мл 10¹³–10¹⁴ vg/mL |
Инфекционный титр Infectious titre | 30 | Клеточный тест Cell-based assay | Не менее 10⁹ МЕ ≥10⁹ МЕ |
Чистота ААВ / Примеси AAV purity / Impurities | |||
Остаточные белки клеток-продуцентов Residual host-cell protein | 1 | ИФА ELISA | Не более 10 нг на 10¹³ вг ≤10 ng per 10¹³ vg |
Остаточная ДНК клеток-продуцентов Residual host-cell DNA | 3 | ПЦР-РВ RT-PCR | Не более 115 нг на 10¹³ вг ≤115 ng per 10¹³ vg |
Остаточная плазмидная ДНК Residual plasmid DNA | 3 | ПЦР-РВ RT-PCR | Не более 680 нг на 10¹³ вг ≤680 ng per 10¹³ vg |
Остаточный трансфекционный агент Residual transfection reagent | 3 | ВЭЖХ HPLC | В процессе установления* To be established* |
Остаточный лиганд с сорбента Residual sorbent ligand | 3 | ИФА ELISA | Не более 100 нг на мл ≤100 ng per mL |
Остаточная эндонуклеаза Residual endonuclease | 3 | ИФА ELISA | Не более 1 нг на 10¹³ вг ≤1 ng per 10¹³ vg |
Остаточный йодиксанол Residual iodixanol | 3 | ВЭЖХ HPLC | Не более 10 мкг на 1 мл ≤10 μg per mL |
Чистота белков капсида Capsid protein purity | 3 | ЭФ в ПААГ, капиллярный ЭФ PAGE electrophoresis, capillary electrophoresis | Не менее 95% ≥95% |
Пустые капсиды Empty capsids | 20 | Ультрацентрифугирование Ultracentrifugation | Не более 5% ≤5% |
Агрегаты Aggregates | 10 | ВЭЖХ HPLC | Не более 4% ≤4% |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ПЦР — полимеразная цепная реакция; ПЦР-РВ — полимеразная цепная реакция в реальном времени; ИФА — иммуноферментный анализ; LAL-тест — тест с использованием лизата амебоцитов Limulus; ВЭЖХ — высокоэффективная жидкостная хроматография; ЭФ в ПААГ — электрофорез в полиакриламидном геле; вг — вирусный геном.
* — в настоящее время диапазон не установлен, ведутся исследования.
Note. PCR, polymerase chain reaction; RT-PCR, real-time PCR; dPCR, digital PCR; ELISA enzyme-linked immunosorbent assay; LAL-test, Limulus amebocyte lysate test; HPLC, high-performance liquid chromatography; PAGE, polyacrylamide gel; vg, virus genome.
* The specification is currently not established; the research is ongoing.
Специфическую биологическую активность определяли с помощью клеточного теста с последующим количественным определением РНК гена микродистрофина (micro-dystrophin, micro-DMD), а также по уровню экспрессии белка микродистрофина с использованием методов ИФА и вестерн-блота. Экспрессия белка и РНК подтверждена.
Титр вирусного генома устанавливали с помощью методов ПЦР-РВ и цифровой ПЦР. Для более точного определения титра в обоих методах использовали две пары праймеров к ITR и целевому гену микродистрофина. Методы были валидированы с использованием стандартного образца (RS-ААВ9, Charles River Laboratories, США). Для последующих доклинических и клинических исследований был установлен диапазон 10¹³–10¹⁴ вг/мл.
Для определения инфекционного титра использовали клеточный тест в сочетании с ПЦР-РВ. Клетки (HeLaRC32) инфицировали аденовирусным хелперным вирусом и производили серийные разведения rААВ вектора. После заражения проводили оценку с помощью ПЦР-РВ и рассчитывали значение 50% тканевой цитопатической дозы (ТЦД50). Диапазон значений показателя был установлен на основе литературных данных [18][35].
Подлинность определяли с использованием нескольких методов: с помощью вестерн-блота идентифицировали белки VP1, VP2, VP3; с помощью ПЦР устанавливали целостность вирусного генома с использованием пар праймеров для получения перекрывающихся последовательностей. Полная последовательность генома ААВ была установлена методом секвенирования. Средний размер вирусных частиц ААВ определяли с помощью метода динамического светорассеяния с применением анализатора Zetasizer Nano (Malvern Instruments Ltd, Великобритания).
Стерильность и эндотоксины определяли в соответствии с требованиями Государственной фармакопеи Российской Федерации (ГФ РФ)11. Диапазон значений показателя «Эндотоксины» устанавливали из расчета не более 5 ЕЭ/кг (на массу тела пациента) при внутривенном введении исходя из максимальной возможной дозы в 10¹⁵ вг. Посторонние вирусы и микоплазму детектировали с помощью ПЦР-РВ, следуя рекомендациям ГФ РФ12.
Для определения репликативных ААВ применяли клеточный тест с последующей ПЦР-РВ. В тесте использовали пермиссивную клеточную линию (HEK293) с несколькими циклами последовательного заражения для увеличения чувствительности метода.
Степень чистоты белков капсида определяли с помощью электрофореза в полиакриламидном геле и метода капиллярного электрофореза. Диапазон показателя был установлен на основе валидации метода и определения нижнего предела обнаружения и составил не менее 95%.
Наличие пустых капсидов и седиментационное распределение вирусных частиц анализировали с помощью аналитического ультрацентрифугирования с применением оборудования Optima AUC (Beckman Coulter, США). В качестве значения показателя количества пустых капсидов был установлен диапазон «не более 5%» исходя из литературных данных [15][18][36], полученных в клинических исследованиях, и собственных данных, основанных на разработке процесса производства. Указанный диапазон является более строгим, чем описанный в литературе.
Содержание остаточных белков клеток-продуцентов, лиганда хроматографического сорбента и эндонуклеазы определяли с помощью метода ИФА. Установленный диапазон значений показателя остаточных белков был рассчитан на основании подхода, представленного в разделе «Оценка риска для показателей качества ААВ вектора», и составил не более 10 нг на 10¹³ вг.
Остаточную ДНК клеток-продуцентов и плазмидную ДНК определяли с помощью метода ПЦР-РВ. Согласно имеющимся данным значение показателя содержания остаточной ДНК в вирусных частицах ААВ обычно находится в пределах 1–3% [24][17][29], что при пересчете на однократную дозу препарата может составлять несколько микрограмм. Для остаточной плазмидной ДНК доля вирусных частиц с последовательностями плазмид может составлять до 8% (как указано в разделе «Оценка риска для показателей качества ААВ вектора»), что при пересчете на однократную дозу препарата может достигать до 10 мкг. На основании приведенных выше данных, а также результатов валидации методик установлен диапазон по содержанию остаточной ДНК — не более 115 нг на 10¹³ вг, и остаточной плазмидной ДНК — не более 680 нг на 10¹³ вг.
ЗАКЛЮЧЕНИЕ
В рамках концепции «качество через дизайн» (Quality by Design, QbD) с применением метода оценки риска для показателей качества на основе международного опыта, а также с учетом данных АО «ГЕНЕРИУМ» по разработке и производству препарата на основе аденоассоциированного вируса для лечения миодистрофии Дюшенна проведено определение целевого профиля продукта и установлены критические показатели качества. Разработаны методы контроля показателей качества ААВ и установлены диапазоны значений этих показателей. Описана схема технологического процесса получения ААВ и стратегия контроля качества, реализованные при наработке генотерапевтического лекарственного препарата для проведения последующих доклинических и клинических исследований.
Реализация основных положений концепции QbD позволяет соответствовать высоким стандартам качества при проведении фармацевтической разработки генотерапевтических препаратов, а также успешно осуществлять масштабирование и трансфер технологического процесса на производство.
Дополнительная информация. На сайте журнала «БИОпрепараты. Профилактика, диагностика, лечение» размещена таблица 1.
https://doi.org/10.30895/2221-996X-2025-580-table1
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Вклад распределен следующим образом: Д.С. Копеин — концепция исследования, написание и редактирование текста рукописи, систематизация и обобщение данных литературы; Г.Н. Порошин — анализ и обобщение данных литературы, участие в написании текста рукописи; Р.А. Хамитов — формулирование выводов исследования, утверждение окончательной версии статьи для публикации.
Благодарности. Авторы выражают благодарность Р.Р. Шукурову за помощь и консультации при обсуждении результатов.
Additional information. Table 1 is published on the website of Biological Products. Prevention, Diagnosis, Treatment.
https://doi.org/10.30895/2221-996X-2025-580-table1
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. D.S. Kopein conceptualised the study, drafted and edited the manuscript, and collated and summarised literature data. G.N. Poroshin analysed and summarised literature data and drafted the manuscript. R.A. Khamitov formulated the conclusions and approved the final version of the manuscript for publication.
Acknowledgements. The authors are thankful to R.R. Shukurov for his help and advice in discussing the results.
1. ICH guideline Q8 (R2) on pharmaceutical development. EMA; 2017.
ICH Q9 (R1) Quality risk management. ICH; 2023.
ICH Q10 Pharmaceutical quality system. ICH; 2008.
2. ICH guideline Q8 (R2) on pharmaceutical development. EMA; 2017.
3. ICH Q9 (R1) Quality risk management. ICH; 2023.
4. Project A-Gene. A case study-based approach to integrating QbD principles in gene therapy CMC programs. Alliance for Regenerative Medicine; 2021. https://alliancerm.org/manufacturing/a-gene-2021/
5. https://doi.org/10.30895/2221-996X-2025-580-table1
6. Project A-Gene. A case study-based approach to integrating QbD principles in gene therapy CMC programs. Alliance for Regenerative Medicine; 2021. https://alliancerm.org/manufacturing/a-gene-2021/
7. https://pharmvestnik.ru/content/news/Dva-rebenka-so-SMA-umerli-pri-lechenii-preparatom-Zolgensma.html
8. Glybera. Product Information. EMA; 2017.
9. General Chapter <1132> Residual host cell protein measurement in biopharmaceuticals. United States Pharmacopeia. USP39–NF34.
10. ОФС.1.9.1.0001.18 Генотерапевтические лекарственные препараты. Государственная фармакопея Российской Федерации. XIV изд. 2018.
11. ОФС.1.2.4.0003.15 Стерильность. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
ОФС.1.2.4.0006.15 Бактериальные эндотоксины. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
12. ОФС.1.7.2.0031.15 Испытание на присутствие микоплазм. Государственная фармакопея Российской Федерации. XIV изд. Т. 2; 2018.
Список литературы
1. Солдатов АА, Авдеева ЖИ, Горенков ДВ, Хантимирова ЛМ, Гусева СГ, Меркулов ВА. Проблемные аспекты разработки и регистрации генотерапевтических препаратов. БИОпрепараты. Профилактика, диагностика, лечение. 2022;22(1):6–22. https://doi.org/10.30895/2221-996X-2022-22-1-6-22
2. Kolesnik VV, Nurtdinov RF, Oloruntimehin ES, Karabelsky AV, Malogolovkin AS. Optimization strategies and advances in the research and development of AAV-based gene therapy to deliver large transgenes. Clin Transl Med. 2024;14(3):e1607. https://doi.org/10.1002/ctm2.1607
3. Егорова ТВ, Пискунов АА, Потеряев ДА. Генная терапия наследственных заболеваний на основе аденоассоциированных вирусных векторов: современные проблемы применения и пути их решения. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(2):123–39. https://doi.org/10.30895/2221-996X-2024-24-2-123-139
4. Daya S, Berns KI. Gene therapy using adeno-associated virus vectors. Clin Microbiol Rev. 2008;21(4):583–93. https://doi.org/10.1128/CMR.00008-08
5. Brister JR, Muzyczka N. Mechanism of Rep-mediated adeno-associated virus origin nicking. J Virol. 2000;74(17):7762–71. https://doi.org/10.1128/JVI.74.17.7762-7771.2000
6. McCarty DM, Ryan JH, Zolotukhin S, Zhou X, Muzyczka N. Interaction of the adeno-associated virus Rep protein with a sequence within the A palindrome of the viral terminal repeat. J Virol. 1994;68(8):4998–5006. https://doi.org/10.1128/jvi.68.8.4998-5006.1994
7. Issa SS, Shaimardanova AA, Solovyeva VV, Rizvanov AA. Various AAV serotypes and their applications in gene therapy: An overview. Cells. 2023;12(5):785. https://doi.org/10.3390/cells12050785
8. Wang J-H, Gessler DJ, Zhan W, Gallagher TL, Gao G. Adeno-associated virus as a delivery vector for gene therapy of human diseases. Signal Transduct Target Ther. 2024;9(1):78. https://doi.org/10.1038/s41392-024-01780-w
9. Penaud-Budloo M, François A, Clément N, Ayuso E. Pharmacology of recombinant adeno-associated virus production. Mol Ther Methods Clin Dev. 2018;8:166–80. https://doi.org/10.1016/j.omtm.2018.01.002
10. Juran JM. Juran on quality by design: the new steps for planning quality into goods and services. Free Press; 1992.
11. François A, Bouzelha M, Lecomte E, Broucque F, Penaud-Budloo M, Adjali O, et al. Accurate titration of infectious AAV particles requires measurement of biologically active vector genomes and suitable controls. Mol Ther Methods Clin Dev. 2018;10:223–36. https://doi.org/10.1016/j.omtm.2018.07.004
12. Gimpel AL, Katsikis G, Sha S, Maloney AJ, Hong MS, Nguyen TNT, et al. Analytical methods for process and product characterization of recombinant adeno-associated virus-based gene therapies. Mol Ther Methods Clin Dev. 2021;20:740–54. https://doi.org/10.1016/j.omtm.2021.02.010
13. Lock M, Alvira MR, Chen S-J, Wilson JM. Absolute determination of single-stranded and self-complementary adeno-associated viral vector genome titers by droplet digital PCR. Human Gene Ther Methods. 2014;25(2):115–25. https://doi.org/10.1089/hgtb.2013.131
14. Dobnik D, Kogovsek P, Jakomin T, Kosir N, Tusek Znidaric M, Leskovec M, et al. Accurate quantification and characterization of adeno-associated viral vectors. Front Microbiol. 2019;10:1570. https://doi.org/10.3389/fmicb.2019.01570
15. Gao K, Li M, Zhong L, Su Q, Li J, Li S, et al. Empty virions in AAV8 vector preparations reduce transduction efficiency and may cause total viral particle dose-limiting side effects. Mol Ther Methods Clin Dev. 2014;1(9):20139. https://doi.org/10.1038/mtm.2013.9
16. Grieger JC, Soltys SM, Samulski RJ. Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector. Mol Ther. 2016;24(2):287–97. https://doi.org/10.1038/mt.2015.187
17. Allay JA, Sleep S, Long S, Tillman DM, Clark R, Carney G, et al. Good manufacturing practice production of self-complementary serotype 8 adeno-associated viral vector for a hemophilia B clinical trial. Hum Gene Ther. 2011;22(5):595–604. https://doi.org/10.1089/hum.2010.202
18. Kaspar BK, Hatfield JM, Balleydier J, Kaspar AA, Hodge RE. Means and method for producing and purifying viral vectors. Patent of the United States No. US 2021/0317474 A1; 2021.
19. Yang TY, Braun M, Lembke W, McBlane F, Kamerud J, DeWall S, et al. Immunogenicity assessment of AAV-based gene therapies: An IQ consortium industry white paper. Mol Ther Methods Clin Dev. 2022;26:471–94. https://doi.org/10.1016/j.omtm.2022.07.018
20. Martino AT, Suzuki M, Markusic DM, Zolotukhin I, Ryals RC, Moghimi B, et al. The genome of self-complementary adeno-associated viral vectors increases Toll-like receptor 9–dependent innate immune responses in the liver. Blood. 2011;117(24):6459–68. https://doi.org/10.1182/blood-2010-10-314518
21. Kishimoto TK, Samulski RJ. Addressing high dose AAV toxicity — ‘one and done’ or ‘slower and lower’? Expert Opin Biol Ther. 2022;22(9):1067–71. https://doi.org/10.1080/14712598.2022.2060737
22. Allen JM, Debelak DJ, Reynolds TC, Miller AD. Identification and elimination of replication-competent adeno-associated virus (AAV) that can arise by nonhomologous recombination during AAV vector production. J Virol. 1997;71(9):6816–22. https://doi.org/10.1128/jvi.71.9.6816-6822.1997
23. Song L, Samulski RJ, Hirsch ML. Adeno-associated virus vector mobilization, risk versus reality. Hum Gene Ther. 2020;31(19–20):1054–67. https://doi.org/10.1089/hum.2020.118
24. Wright J. Product-related impurities in clinical-grade recombinant AAV vectors: Characterization and risk assessment. Biomedicines. 2014;2(1):80–97. https://doi.org/10.3390/biomedicines2010080
25. Giles AR, Sims JJ, Turner KB, Govandasamy L, Alvira MR, Lock M, Wilson JM. Deamidation of amino acids on the surface of adeno-associated virus capsids leads to charge heterogeneity and altered vector function. Mol Ther. 2018;26(12):2848–62. https://doi.org/10.1016/j.ymthe.2018.09.013
26. Rumachik NG, Malaker SA, Poweleit N, Maynard LH, Adams CM, Leib RD, et al. Methods matter: Standard production platforms for recombinant AAV produce chemically and functionally distinct vectors. Mol Ther Methods Clin Dev. 2020;18:98–118. https://doi.org/10.1016/j.omtm.2020.05.018
27. Murray S, Nilsson CL, Hare JT, Emmett MR, Korostelev A, Ongley H, et al. Characterization of the capsid protein glycosylation of adeno-associated virus type 2 by high-resolution mass spectrometry. J Virol. 2006;80(12):6171–6. https://doi.org/10.1128/JVI.02417-05
28. Aloor A, Zhang J, Gashash EA, Parameswaran A, Chrzanowski M, Ma C, et al. Site-specific N-glycosylation on the AAV8 capsid protein. Viruses. 2018;10(11):644. https://doi.org/10.3390/v10110644
29. Lecomte E, Tournaire B, Cogne B, Dupont JB, Lindenbaum P, Martin-Fontaine M, et al. Advanced characterization of DNA molecules in rAAV vector preparations by single-stranded virus next-generation sequencing. Mol Ther Nucleic Acids. 2015;4(10):e260. https://doi.org/10.1038/mtna.2015.32
30. Sheng L, Cai F, Zhu Y, Pal A, Athanasiou M, Orrison B, et al. Oncogenicity of DNA in vivo: Tumor induction with expression plasmids for activated H-ras and c-myc. Biologicals. 2008;36(3):184–97. https://doi.org/10.1016/j.biologicals.2007.11.003
31. Hauck B, Murphy SL, Smith PH, Qu G, Liu X, Zelenaia O, et al. Undetectable transcription of cap in a clinical AAV vector: Implications for preformed capsid in immune responses. Mol Ther. 2009;17(1):144–52. https://doi.org/10.1038/mt.2008.227
32. Chadeuf G, Ciron C, Moullier P, Salvetti A. Evidence for encapsidation of prokaryotic sequences during recombinant adeno-associated virus production and their in vivo persistence after vector delivery. Mol Ther. 2005;12(4):744–53. https://doi.org/10.1016/j.ymthe.2005.06.003
33. Астапова ОВ, Берчатова АА. Генотерапевтические препараты: аспекты доклинического изучения безопасности. Безопасность и риск фармакотерапии. 2023;11(1):73–96. https://doi.org/10.30895/2312-7821-2023-11-1-329
34. Prince WS, Baker DL, Dodge AH, Ahmed AE, Chestnut RW, Sinicropi DV. Pharmacodynamics of recombinant human DNase I in serum. Clin Exp Immunol. 2001;113(2):289–96. https://doi.org/10.1046/j.1365-2249.1998.00647.x
35. Duong T, McAllister J, Eldahan K, Wang J, Onishi E, Shen K, et al. Improvement of precision in recombinant adeno-associated virus infectious titer assay with droplet digital PCR as an endpoint measurement. Hum Gene Ther. 2023;34(15–16):742–57. https://doi.org/10.1089/hum.2023.014
36. Schnödt M, Büning H. Improving the quality of adeno-associated viral vector preparations: The challenge of product-related impurities. Hum Gene Ther Methods. 2017;28(3):101–8. https://doi.org/10.1089/hgtb.2016.188
Об авторах
Д. С. КопеинРоссия
Копеин Дамир Сергеевич, канд. биол. наук
ул. Тестовская, д. 10, Москва, 123112
Г. Н. Порошин
Россия
Порошин Григорий Николаевич
ул. Тестовская, д. 10, Москва, 123112
Р. A. Хамитов
Россия
Хамитов Равиль Aвгатович, д-р мед. наук, проф.
ул. Тестовская, д. 10, Москва, 123112
Дополнительные файлы

|
1. Таблица 1. Классификация рисков для критических показателей качества | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(578KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Копеин Д.С., Порошин Г.Н., Хамитов Р.A. Реализация концепции Quality by Design для генотерапевтического лекарственного препарата на основе аденоассоциированного вирусного вектора. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):141-155. https://doi.org/10.30895/2221-996X-2025-580
For citation:
Kopein D.S., Poroshin G.N., Khamitov R.A. Implementation of the quality-by-design concept for an adeno-associated viral vector-based gene therapy. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):141-155. (In Russ.) https://doi.org/10.30895/2221-996X-2025-580


































