Перейти к:
Кинетика накопления в клетках флуоресцентно-меченного олигонуклеотида при использовании адресных фолатсодержащих катионных липосом
https://doi.org/10.30895/2221-996X-2024-24-2-188-199
Резюме
ВВЕДЕНИЕ. Использование катионных липосом является перспективным подходом для доставки терапевтических нуклеиновых кислот (НК) в клетки-мишени, так как позволяет защитить НК от деградации внеклеточными нуклеазами. Однако для обеспечения селективной доставки НК к месту терапевтического действия данный подход нуждается в совершенствовании, в том числе за счет модификации поверхности липосом адресными лигандами.
ЦЕЛЬ. Проведение сравнительного исследования кинетики накопления в клетках флуоресцентно-меченного олигонуклеотида (модельного препарата нуклеиновых кислот) с помощью адресных фолатсодержащих катионных липосом и обычных липосом.
МАТЕРИАЛЫ И МЕТОДЫ. Адресные фолатсодержащие катионные липосомы (F) и обычные липосомы (L) готовили с использованием следующих компонентов: поликатионный амфифил 2X3, цвиттер-ионный липид DOPE, фолатный липоконъюгат F12. Физикохимические характеристики липосом изучали с помощью методов динамического светорассеяния и трансмиссионной электронной микроскопии. Комплексы липосом с флуоресцентно-меченным олигонуклеотидом (FITC-ODN) формировали с использованием различных соотношений компонентов (N/P). Кинетика накопления комплексов на клетках рака шейки матки человека (линия КВ-3-1) и почки эмбриона человека (линия НЕК 293) была изучена с помощью методов проточной цитометрии, флуоресцентной и конфокальной микроскопии.
РЕЗУЛЬТАТЫ. Полученные липосомы L и F представляли собой сферические частицы диаметром от 75 до 100 нм. Сформированы комплексы катионных липосом (L и F) с FITC-ODN при оптимальном соотношении N/P, равном 2/1, при котором наблюдается образование однородных (индекс полидисперсности меньше 0,200) частиц с размером 112,4–125,1 нм. Фолатсодержащие липосомы на 25% эффективнее доставляли FITC-ODN в клетки КВ-3-1 через 90, 120 и 240 мин после начала трансфекции по сравнению с обычными липосомами, не содержащими адресного лиганда. Согласно данным флуоресцентной и конфокальной микроскопии после начала трансфекции клеток наблюдалась совместная колокализация флуоресцентных сигналов липосом и олигонуклеотида и далее происходило накопление олигонуклеотида в цитоплазме.
ВЫВОДЫ. Показана эффективная доставка флуоресцентно-меченного олигонуклеотида в цитоплазму опухолевых клеток с помощью катионных липосом. Использование адресных фолатсодержащих липосом позволяет увеличить количество трансфицированных клеток и эффективность доставки олигонуклеотида по сравнению с обычными липосомами, не содержащими адресного лиганда. Полученные результаты могут быть использованы для дальнейшей разработки препаратов направленного действия на основе терапевтических нуклеиновых кислот и липосом.
Ключевые слова
Для цитирования:
Шмендель Е.В., Марков О.В., Зенкова М.А., Маслов М.А. Кинетика накопления в клетках флуоресцентно-меченного олигонуклеотида при использовании адресных фолатсодержащих катионных липосом. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(2):188-199. https://doi.org/10.30895/2221-996X-2024-24-2-188-199
For citation:
Shmendel E.V., Markov O.V., Zenkova M.A., Maslov M.A. Time course of fluorescent-labelled oligonucleotide accumulation in cells with the use of folate receptor-targeted cationic liposomes. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(2):188-199. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-2-188-199
ВВЕДЕНИЕ
Генная терапия — новый подход для лечения наследственных и приобретенных заболеваний, в том числе онкологических, который направлен на исправление функционирования дефектных генов [1]. На основе различных типов терапевтических нуклеиновых кислот (НК) разработаны высокоспецифичные лекарственные средства нового поколения, обладающие потенциалом для перехода к персонализированной терапии. Показано, что введение плазмидной ДНК (pDNA) или мРНК (mRNA) в эукариотические клетки, приводит к экспрессии правильной копии гена и синтезу экзогенного белка. Для подавления сверхэкспрессии гена могут быть использованы антисмысловые олигодезоксинуклеотиды (ODN), малые интерферирующие РНК (siRNA), микроРНК, рибозимы и ДНКзимы. Перспективным направлением генной терапии является редактирование генома с помощью технологии CRISPR-Cas [2].
Главным ограничением в использовании терапевтических НК является высокая скорость деградации под действием внеклеточных нуклеаз, что снижает стабильность и терапевтическую эффективность НК [3]. Для решения указанной проблемы перспективной представляется разработка транспортной системы, способной осуществлять доставку НК в эукариотические клетки. Пример реализации такого подхода — препарат Gendicine (SiBiono GeneTech Co. Ltd, Китай), первый одобренный генотерапевтический препарат, предназначенный для терапии плоскоклеточного рака головы и шеи. Препарат представляет собой рекомбинантный аденовирус, содержащий последовательность проапоптотического белка p53 [4]. Вирусные системы доставки обладают рядом недостатков, к которым относятся онкогенность, иммуногенность, ограниченный размер переносимой НК и высокая стоимость [5]. В связи с этим разрабатываются невирусные системы доставки — катионные липосомы [6][7], полимеросомы [8], дендримеры [9], магнитные наночастицы [10], экзосомы [11]. Особенно широкое распространение получили системы доставки НК на основе липосом и липидных наночастиц, для формирования которых могут быть использованы природные и синтетические липиды: катионные, анионные, нейтральные или их смеси [12]. Такие системы были применены при создании мРНК-вакцин против COVID-19: mRNA-1273 (Moderna, США) и BNT162b2 (Pfizer/BioNTech, США) на основе мРНК, инкапсулированной в липидные наночастицы, состоящие из ионизируемого липида, холестерина и липидного производного полиэтиленгликоля (ПЭГ) [13].
Для решения проблемы селективного проникновения НК в клетки-мишени поверхность липидных частиц может быть функционализирована различными адресными лигандами. Например, моноклональные антитела или их фрагменты могут быть использованы для нацеливания на рецепторы опухолевых клеток: CD44, CD147, CD133, CD321 [12]. Антитела OX26 и RI7217 применяли для направленной доставки липосом к опухолевым клеткам с высокой экспрессией рецептора трансферрина [14][15]. Гиалуроновая кислота в качестве адресной молекулы была использована для доставки к рецептору CD44 опухолевых клеток (рак поджелудочной железы, молочной железы и легких) [16]. В качестве низкомолекулярного лиганда для доставки НК в составе липидных частиц перспективным представляется применение фолиевой кислоты, которая связывается с фолатными рецепторами (FR), высокоэкспрессированными на поверхности опухолевых клеток различных типов: плоскоклеточный рак эндометрия [17][18], рак яичников [18][19], шейки матки [18][20], толстой кишки [21], почек [22], хориокарцинома [18], менингиома [23], остeосаркома [24], неходжкинская лимфома [20].
Фолатсодержащие катионные липосомы были использованы для доставки антисмысловых ODN [25], FITC-ODN [26], pDNA [22][27], иммуностимулирующих РНК [27] in vitro и in vivo. Для обеспечения селективности доставки НК при разработке фолатсодержащих катионных липосом необходимо провести подбор соотношения N/P (соотношение между количеством положительно заряженных атомов азота поликатионного липида липосом — N, к количеству отрицательно заряженных фосфатных групп НК — Р) [22], оценить физико-химические характеристики как катионных липосом, так и их комплексов с НК.
Ранее авторами была показана возможность эффективной адресной доставки НК в эукариотические клетки in vitro и in vivo с использованием липосом, в состав которых входили: поликатионный амфифил 2X3 (1,26-бис(холест-5-ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан тетрагидрохлорид) [28], необходимый для связывания НК; цвиттер-ионный липид DOPE (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин), обеспечивающий эффективное высвобождение НК из эндосом; адресный липоконъюгат F12 (рис. 1А), в котором адресный лиганд — остаток фолиевой кислоты связан через ПЭГ с диглицеридом [22][26][27]. Важной особенностью этих липосом является способность трансфицировать эукариотические клетки в присутствии сыворотки крови в культуральной среде. Также было показано, что при соотношениях N/P — 1/1 или 2/1 фолатсодержащие липосомы доставляют НК в клетки, экспрессирующие рецепторы фолиевой кислоты, посредством рецептор-опосредованного эндоцитоза [22]. Однако дополнительных исследований, связанных с изучением кинетики накопления комплексов НК с катионными липосомами и их внутриклеточного распределения, ранее не проводилось.
Цель работы — проведение сравнительного исследования кинетики накопления в клетках флуоресцентно-меченного олигонуклеотида (модельного препарата нуклеиновых кислот) с помощью адресных фолатсодержащих катионных липосом и обычных липосом.
Для достижения цели были поставлены следующие задачи:
- получение адресных фолатсодержащих и обычных катионных липосом;
- изучение физико-химических характеристик липосом методами динамического светорассеяния и электронной микроскопии;
- формирование комплексов катионных липосом с FITC-ODN;
- изучение кинетики накопления полученных комплексов на клеточных культурах КВ-3-1 и НЕК 293 с помощью проточной цитометрии, флуоресцентной и конфокальной микроскопии.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
В работе использовались липиды — 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин и фосфатидилэтаноламин, меченный родамином B (Avanti Polar Lipids, США); флуоресцеин (FITC, ЛенРеактив, Россия); Lipofectamine 2000 (Invitrogen, США); органические растворители — хлороформ для ВЭЖХ, метанол для ВЭЖХ (Merck, Sigma-Aldrich, США). Для получения катионных липосом использовался поликатионный липид 2X3 и фолатсодержащий липоконъюгат F12, которые были синтезированы, как описано ранее [28][26].
Методы
Приготовление фолатсодержащих адресных и обычных катионных липосом. Все липосомы были приготовлены методом гидратации липидной пленки [29]. Для получения обычных катионных липосом (L) раствор поликатионного липида 2X3 в смеси хлороформа и метанола (5:1, об/об) добавляли к раствору DOPE в хлороформе в соотношении 1:2 (мольн.). Для приготовления адресных фолатсодержащих катионных липосом (F) к полученному раствору липидов добавляли раствор фолатного липоконъюгата F12 (2%, мольн.) в смеси хлороформа и метанола (1:1, об/об). В случае родамин B-меченных липосом к полученному раствору липидов добавляли раствор производного фосфатидилхолина и родамина В (1%, мольн.) в хлороформе. Органические растворители упаривали, образовавшуюся липидную пленку высушивали в вакууме с использованием масляного насоса (0,01 Торр). Через 4 ч к сухой пленке добавляли 1 мл деионизированной воды (Milli-Q, США) и диспергировали при 50–60 °С до полного отслоения пленки со стенок колбы. Полученную дисперсию помещали в ультразвуковую баню (Bandelin Sonorex Digitec DT 52H, Германия) на 15 мин при температуре 70 °С. Катионные липосомы L и F с концентраций по поликатионному липиду 2X3 1 мМ фильтровали через стерильный фильтр (0,45 мкм Chromafil® CA-45/25, Macherey–Nagel, Германия) и хранили при 4 °C.
Определение физико-химических характеристик катионных липосом. Гидродинамический диаметр и индекс полидисперсности липосом измеряли методом динамического светорассеяния (Delsa Nano С, Beckman Coulter, США) при следующих условиях: угол 173°, вязкость 0,890 сП, температура 25 °C, время равновесия 3 мин, показатели преломления воды и липосом — 1,33 и 1,45. Измерения проводили при концентрации катионного липида 0,05 мМ в трех повторностях.
Размер и форму липосом определяли с помощью трансмиссионного электронного микроскопа JEM-100-CX-II (Jeol, Япония). Каплю липосом помещали на медно-углеродную сетку, оставляли на 2 мин, далее избыток жидкости удаляли и окрашивали сетку каплей 3% водного уранилацетата в течение 1,5 мин, после чего сетку сушили на воздухе. Микроскопию проводили при ускоряющем напряжении 80 кВ и увеличении в 27000 раз.
Синтез FITC-ODN. Олигодезоксирибонуклеотид длиной 25 нуклеотидных звеньев (5’-TAC AGT GGA ATT GTA TGC CTA TTA T-3’), меченный по 5’-концу флуоресцеином (FITC-ODN), синтезировали твердофазным фосфитамидным методом и выделяли с помощью ВЭЖХ. Чистоту олигонуклеотида анализировали с помощью электрофореза в 20% полиакриламидном геле (ПААГ) в денатурирующих условиях; чистота составила 95–98%. Концентрацию FITC-ODN определили на спектрофотометре BioMate 3 (Thermo Fisher Scientific, США).
Приготовление комплексов катионных липосом с FITC-ODN. Растворы катионных липосом (25 мкл) и FITC-ODN (25 мкл) в концентрациях, соответствующих необходимым соотношениям N/P, смешивали в культуральной фолатдефицитной среде FD-RPMI (Gibco, США) с добавлением 5% фетальной бычьей сыворотки (FBS, HyClone, США) и инкубировали 20 мин при 24 °С.
Клеточные культуры. Клетки рака шейки матки человека линии КВ-3-1 и клетки почки эмбриона человека линии HEK 293 получены из банка клеточных культур института цитологии РАН (Россия). Клетки KB-3-1 и HEK 293 культивировали с использованием среды FD-RPMI с добавлением 5% FBS, антибиотиков (100 ед/мл пенициллина, 100 мкг/мл стрептомицина, 0,25 мкг/мл амфотерицина) в атмосфере 5% СО2 при 37 °С и регулярно пассировали для поддержания культуры клеток в экспоненциальной фазе роста.
Трансфекция клеток комплексами катионных липосом с FITC-ODN. Клетки HEK 293 и KB-3-1 высаживали в 24-луночные планшеты (2,0×10⁵ клеток на лунку для HEK 293 и 1,2×10⁵ — для KB-3-1) и инкубировали в течение 24 ч. В день трансфекции культуральную среду заменяли на среду FD-RPMI (200 мкл) с 5% FBS (без антибиотиков). К клеткам добавляли комплексы катионных липосом с FITC-ODN (1 мкМ), сформированные при соотношении N/P, равном 2/1, и инкубировали в стандартных условиях в течение 15, 45, 90, 120 и 240 мин. В случае контроля трансфекцию FITC-ODN проводили с использованием Lipofectamine 2000 согласно протоколу производителя.
Проточная цитометрия. После трансфекции FITC-ODN клетки KB-3-1 и HEK 293 дважды промывали PBS, обрабатывали раствором трипсина в PBS (0,5 мг/мл) в течение 2 мин при 37 °С, после чего открепившиеся клетки суспендировали в среде с FBS для инактивации действия трипсина, переносили в пробирки и осаждали центрифугированием (Contron T42K, Centricon Instruments, США) при 1000 об/мин (200 g) в течение 10 мин. Супернатант убирали, клетки дважды промывали PBS и фиксировали 2% раствором формальдегида в PBS (600 мкл). Количество трансфицированных клеток и среднее значение интенсивности флуоресценции в клеточной популяции измеряли с помощью цитофлуориметра Cytomics FC500 (Beckman Coulter, США) с использованием программы CXP analysis (Beckman Coulter, США). В каждом образце анализировали не менее 20000 клеток. Средние значения были получены в результате трех независимых экспериментов. Стандартное отклонение не превышало 7–9%.
Флуоресцентная и конфокальная микроскопия. Клетки КВ-3-1 высаживали на покровные стекла в лунках 24-луночного планшета (2,0×10⁵ клеток на лунку), инкубировали в течение 18 ч для прикрепления и затем трансфицировали комплексами в течение 45, 90 или 120 мин в соответствии с методикой, описанной выше. Далее клетки однократно промывали PBS, фиксировали в 4% растворе формальдегида в PBS в течение 20 мин при 37 °С в темноте и двукратно промывали PBS. Покровные стекла с клетками помещали на предметные стекла в каплю среды ProLong™ Glass Antifade Mountant с NucBlue™ (Thermo Fisher Scientific, США) и инкубировали в течение 18–24 ч при комнатной температуре в темноте для отверждения среды. Анализ образцов проводили с помощью флуоресцентной микроскопии с использованием микроскопа Axioskop 2 Plus (Zeiss, Германия), объектив — Plan NEOFLUAR 40×/0,75 Ph2 и конфокальной лазерной сканирующей микроскопии на микроскопе LSM 710 (Zeiss, Германия), объектив — Plan-Apochromat 40×/0,95 Korr M27. Для получения фотографий использовали три канала: синий канал (B) — визуализация ядер клеток, окрашенных красителем NucBlue (Thermo Fisher Scientific, США); зеленый канал (G) — визуализация FITC-ODN; красный канал (R) — визуализация липосом, окрашенных родамином В.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Приготовление катионных липосом и изучение их физико-химических характеристик
Были приготовлены адресные фолатсодержащие катионные липосомы (F) на основе компонентов: поликатионный амфифил 2X3 [28], цвиттер-ионный липид DOPE и фолатный липоконъюгат F12 [26] (соотношение компонентов — 33:65:2, мольн.) (рис. 1А). В качестве препарата сравнения были использованы обычные липосомы (L) на основе компонентов: 2X3, DOPE (соотношение компонентов — 1:2, мольн.) и Lipofectamine 2000 (Lf 2000). Липосомы получали методом гидратации липидной пленки с последующей обработкой ультразвуком, как описано ранее [29].
Согласно данным динамического светорассеяния размеры обычных липосом составили 75,1±1,7 нм, а фолатных липосом — 95,7±2,5 нм (рис. 1C), что соответствует интервалу оптимальных размеров наночастиц для использования в медицине (от 30 до 200 нм), обеспечивающему низкий уровень их выведения почками и захвата клетками ретикуло-эндотелиальной системы [30]. Индекс полидисперсности обычных липосом составил 0,280, а фолатных липосом — 0,283, что указывает на формирование однородных по размеру частиц (рис. 1D) и согласуется с данными трансмиссионной электронной микроскопии (рис. 1B). Электронные микрофотографии липосом L и F показали, что они представляют собой однородные сферические частицы размером от 40 до 144 нм (рис. 1B).
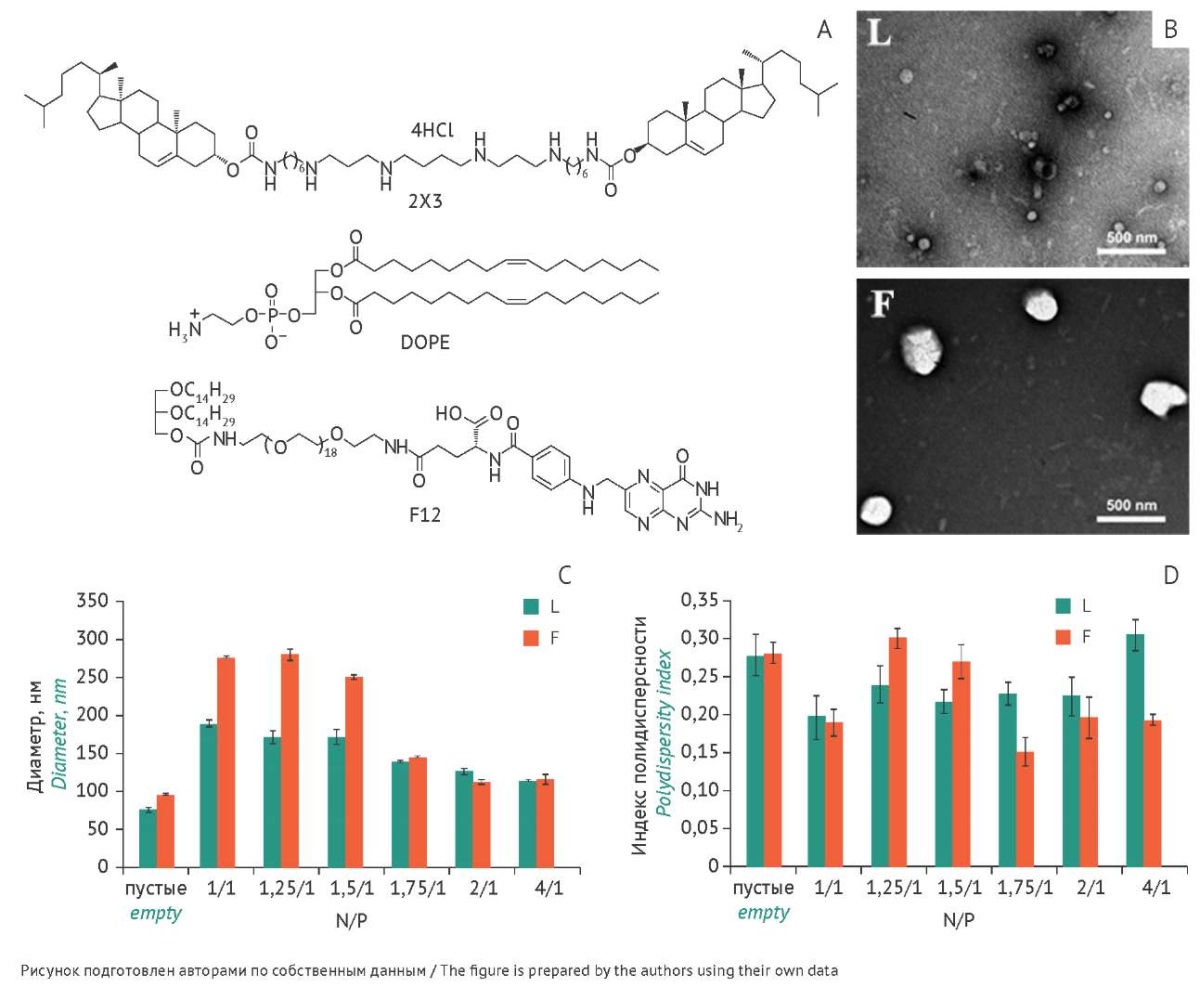
Рис. 1. Структурные формулы компонентов липосом и физико-химические характеристики адресных фолатсодержащих катионных липосом (F) и обычных липосом (L): А — структурные формулы компонентов липосом: поликатионный амфифил 2X3 (1,26-бис(холест-5-ен-3β-илоксикарбониламино)-7,11,16,20-тетраазагексакозан тетрагидрохлорид), цвиттер-ионный липид DOPE (1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин), фолатный липоконъюгат F12; B — трансмиссионная электронная микроскопия липосом F и L; C — гидродинамический диаметр липосом; D — индекс полидисперсности липосом F и L: пустых и их комплексов с меченным олигонуклеотидом (FITC-ODN) при различных соотношениях N/P (соотношение между количеством положительно заряженных атомов азота поликатионного амфифила липосом — N, к количеству отрицательно заряженных фосфатных групп НК — Р).
Fig. 1. Structural formulas of liposome components and physicochemical characteristics of folate receptor-targeted cationic liposomes (F) and conventional liposomes (L): A, structural formulas of liposome components: polycationic amphiphile 2X3 (1,26-bis(cholest-5-en-3β-yloxycarbonylamino)-7,11,16,20-tetraazahexacosane tetrahydrochloride), zwitterionic helper lipid DOPE (1,2-dioleoyl-sn-glycero-3-phosphoethanolamine), and folate lipoconjugate F12. B, transmission electron microscopy images of F- and L-liposomes. C, hydrodynamic diameters of liposomes. D, polydispersity indices of empty F- and L-liposomes and their complexes with a labelled oligonucleotide (FITC-ODN) at different N/P ratios (where N is the number of positively charged nitrogen atoms of polycationic amphiphile liposomes, and P is the number of negatively charged nucleic acid phosphate groups).
Для изучения влияния физико-химических характеристик на эффективность доставки НК были сформированы комплексы катионных липосом с FITC-ODN при различных соотношениях N/P. При низких соотношения N/P формировались крупные частицы в случае комплексов FITC-ODN как c обычными, так и фолатными липосомами. При этом максимальные размеры наблюдались при соотношении N/P, равном 1/1, для обычных липосом (188,9±1,7 нм) и при N/P, равном 1,25/1, для фолатных липосом (280,4±8,5 нм) (рис. 1В). С увеличением соотношения N/P до 2/1 и выше размеры комплексов вновь уменьшались до значений 112–125 нм. Представленные данные согласуются с нашими результатами, полученными ранее при формировании комплексов катионных липопосом с плазмидной ДНК pEGFP [31].
Индекс полидисперсности комплексов фолатсодержащих липосом с FITC-ODN, начиная с соотношения N/P, равного 1,75/1, не превышал 0,200, что указывает на формирование однородных по размеру частиц (рис. 1D). В случае комплексов FITC-ODN с обычными липосомами при N/P, равном 4/1, наблюдалась большая гетерогенность. Дзета-потенциал комплексов FITC-ODN с липосомами L и F при соотношении N/P, равном 1/1, был отрицательным (-25,2 и -38,2 мВ соответственно), и с увеличением количества катионных липосом в комплексах (соотношении N/P — 2/1) дзета-потенциал становился положительным (36,1 и 42,0 мВ соответственно).
Далее трансфекцию проводили при соотношении N/P, равном 2/1. При данном соотношении механизм транспорта комплексов FITC-ODN с адресными липосомами F опосредован рецептор-опосредованным эндоцитозом, который превалирует над электростатическим взаимодействием положительно заряженных комплексов с отрицательно заряженной поверхностью мембраны клеток [26].
Изучение кинетики накопления в клетках меченного олигонуклеотида при использовании катионных липосом
Ранее нами было показано, что увеличение количества катионных липосом в составе комплекса (рост соотношения N/P) приводит к увеличению эффективности трансфекции, но при этом снижается селективность комплексов в отношении фолатных рецепторов [22]. В рамках данного исследования кинетику накопления комплексов FITC-ODN с катионными липосомами изучали в условиях культивирования клеток KB-3-1 и НЕК 293 с использованием фолатдефицитной среды (FD-RPMI), что приводило к увеличению количества фолатных рецепторов на мембране клеток [22][32]. Трансфекцию клеток осуществляли при соотношении N/P, равном 2/1. Эффективность трансфекции клеток оценивали методом проточной цитометрии, измеряя количество флуоресцентно-окрашенных трансфицированных клеток (%) и среднюю интенсивность флуоресценции в клеточной популяции, что косвенно свидетельствует о количестве FITC-ODN, попавшего в клетки (рис. 2).

Рис. 2. Накопление комплексов меченного олигонуклеотида (FITC-ODN) с катионными липосомами (F — адресные фолатсодержащие липосомы, L — обычные липосомы) в клеточных культурах КВ-3-1 (A, B) и HEK 293 (C, D) согласно данным проточной цитометрии через 15, 45, 90, 120 и 240 мин инкубации клеток с комплексами. A, C — количество флуоресцентно-окрашенных трансфицированных клеток (%). B, D — уровень средней интенсивности флуоресценции клеток в популяции (отн. ед.).
Fig. 2. Accumulation of complexes of a fluorescent-labelled oligonucleotide (FITC-ODN) with cationic liposomes (F, folate-receptor targeted liposomes; L, conventional liposomes) in KB-3-1 (A, B) and HEK 293 (C, D) cell cultures at 15, 45, 90, 120, and 240 minutes of cell incubation with the complexes, according to flow cytometry data. A, C: percentage of fluorescent-labelled transfected cells (%); B, D: mean fluorescence intensities of cell populations (in relative fluorescence units, RFU).
Для всех исследуемых липосом было отмечено увеличение эффективности трансфекции в интервале от 15 до 240 мин после начала трансфекции — как по количеству флуоресцентно-окрашенных (FITC-положительных клеток), так и по средней интенсивности флуоресценции клеток.
Через 15 мин после начала трансфекции количество клеток линии КВ-3-1, трансфицированных FITC-ODN, составляло 86 и 87% (для липосом L и F соответственно) (рис. 2А), а в случае клеток линии HEK 293 — 54 и 30% соответственно (рис. 2C). При этом для клеток КВ-3-1 средняя интенсивность флуоресценции клеток была выше при использовании адресных липосом по сравнению с обычными липосомами — 20,4 и 15,1 отн. ед. (для липосом F и L соответственно) (рис. 2B); для клеток HEK 293 липосомы L (12,4 отн. ед.) оказались эффективнее липосом F (8,1 отн. ед.) (рис. 2D).
Дальнейшая инкубация клеток с комплексами приводила к увеличению внутриклеточного накопления FITC-ODN. Этот процесс достигал плато уже при 90 мин инкубации и далее рос менее интенсивно до конечной точки 240 мин (рис. 2). Было выявлено существенное преимущество адресных фолатсодержащих липосом в доставке FITC-ODN по сравнению с обычными липосомами в клетках КВ-3-1 — через 90, 120 и 240 мин количество трансфицированных клеток было примерно на 25% выше в случае липосом F (рис. 2B). Уровень накопления фолатсодержащих и обычных липосом в случае клеток линии HEK 293 был приблизительно одинаковый с учетом статистической погрешности (рис. 2C, D), что согласуется с данными исследований, в которых клетки линии НЕК 293 были выбраны в качестве негативного контроля для изучения адресной доставки фолатсодержащих катионных липосом [33].
Следует отметить, что результаты контрольной трансфекции клеток FITC-ODN в присутствии реагента Lf 2000 через 240 мин показали низкий уровень значений интенсивности флуоресценции: 13,1±1,2 отн. ед. для клеток КВ-3-1, 27,2±2,5 отн. ед. для клеток HEK 293.
Микроскопический анализ клеток КВ-3-1, трансфицированных комплексами липосом с FITC-ODN, был проведен через 45 мин (активная фаза накопления олигонуклеотида в клетках) и 120 мин (момент достижения наибольших показателей количества трансфицированных клеток и интенсивности флуоресценции) при N/P, равном 2/1 (рис. 3). Показано, что через 45 мин комплексы L/FITC-ODN имели небольшие размеры и были прикреплены к мембране клеток, тогда как комплексы F/FITC-ODN имели немного большие размеры и были в меньшей степени локализованы на клеточной мембране (рис. 3А, В). В обоих случаях наблюдается эффективная доставка FITC-ODN в цитоплазму клеток, при этом распределение сигнала для липосом L более дискретное, в отличие от диффузного сигнала при использовании адресных липосом F (рис. 3А). Следует отметить высокую колокализацию сигналов FITC-ODN и родамин В-меченных липосом, что может указывать на незначительное высвобождение олигонуклеотида из комплексов в данной временной точке (рис. 3А, В). Через 120 мин инкубации комплексов с клетками наблюдалось значительное увеличение уровня накопления олигонуклеотида при использовании адресных липосом, при этом внутриклеточная локализация сигнала FITC-ODN оставалась диффузной (рис. 3D). Накопление олигонуклеотида с помощью обычных липосом проходило менее эффективно, при этом локализация комплексов оставалась околомембранной с сохранением дискретности сигнала олигонуклеотида (рис. 3С).
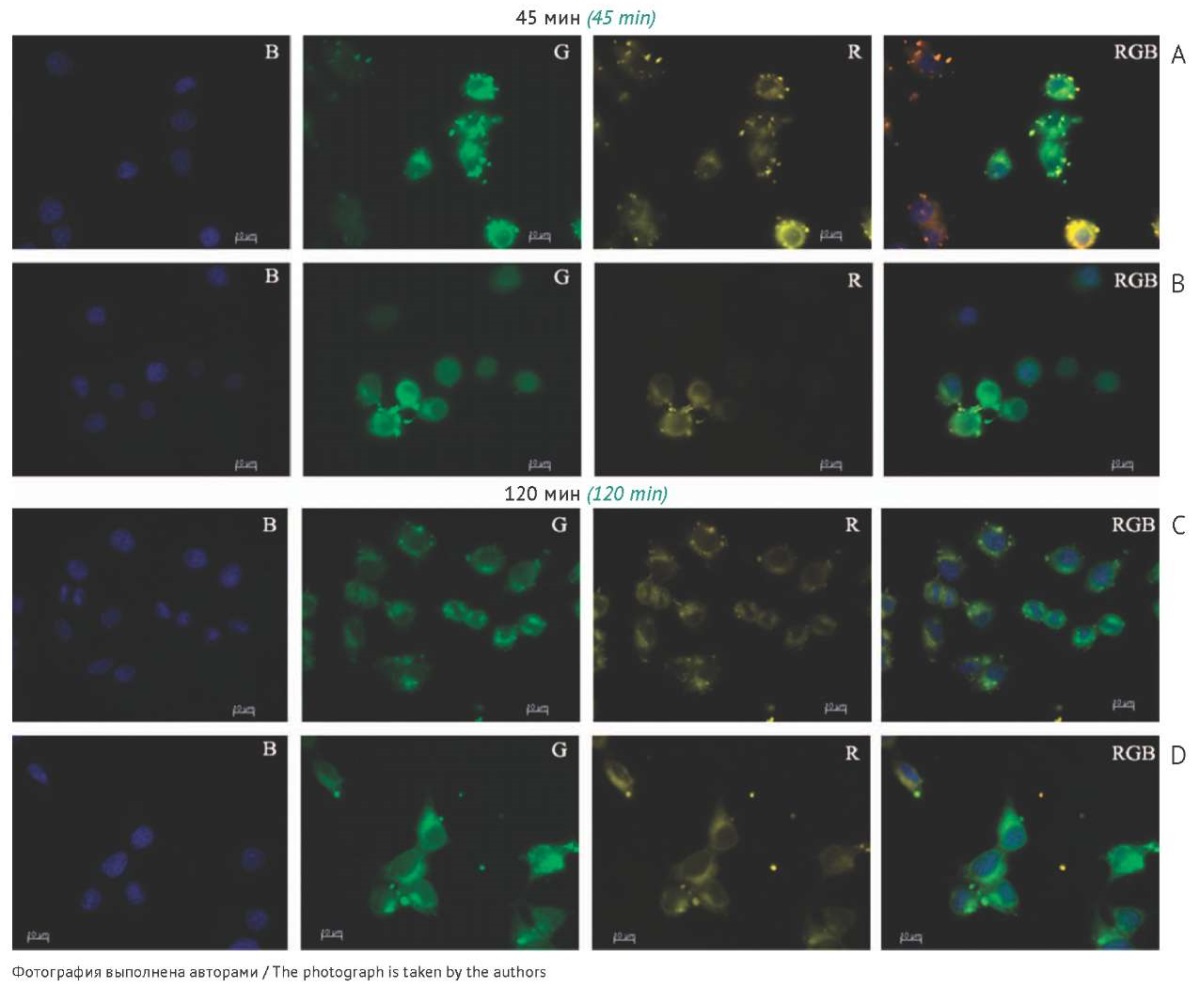
Рис. 3. Накопление комплексов меченного олигонуклеотида (FITC-ODN) с катионными липосомами (L — обычные липосомы (А, С), F — адресные фолатсодержащие липосомы (B, D)) в клетках линии КВ-3-1 через 45 мин (А, В) и 120 мин (C, D) от начала инкубации согласно данным флуоресцентной микроскопии (увеличение ×400). При получении микрофотографий использовали три канала для анализа: синий канал (B) — визуализация ядер клеток, окрашенных красителем NucBlue; зеленый канал (G) — визуализация FITC-ODN; красный канал (R) — визуализация липосом, модифицированных родамином В.
Fig. 3. Accumulation of complexes of a fluorescent-labelled oligonucleotide (FITC-ODN) with cationic liposomes (L, conventional liposomes (A, C); F, folate receptor-targeted liposomes (B, D)) in KB-3-1 cells after 45 min (А, B) and 120 min (C, D) of incubation, according to fluorescence microscopy data (×400 magnification). Microphotographs used three channels for analysis: blue (B) to visualise cell nuclei stained with NucBlue, green (G) to visualise the FITC-ODN, and red (R) to visualise rhodamine B-labelled liposomes.
Для более детального анализа клеточной локализации комплексов FITC-ODN с липосомами с использованием конфокальной микроскопии была выбрана временная точка 90 мин при N/P, равном 2/1 (рис. 4). Было подтверждено, что доставка олигонуклеотида с помощью адресных фолатсодержащих липосом проходила более эффективно по сравнению с обычными липосомами, при этом локализация сигнала FITC-ODN имела диффузный характер (рис. 4А, В). В случае использования обычных липосом локализация сигнала FITC-ODN была очень дискретна и представляла собой небольшие сфокусированные участки (рис. 4А). Можно предположить, что при доставке FITC-ODN с помощью адресных липосом задействован механизм рецептор-опосредованного эндоцитоза, который приводит к более эффективной доставке олигонуклеотида в клетки и активному выходу олигонуклеотида из эндосом по сравнению с обычными липосомами. Однако установление точного механизма внутриклеточного транспорта нуждается в дальнейшем исследовании.
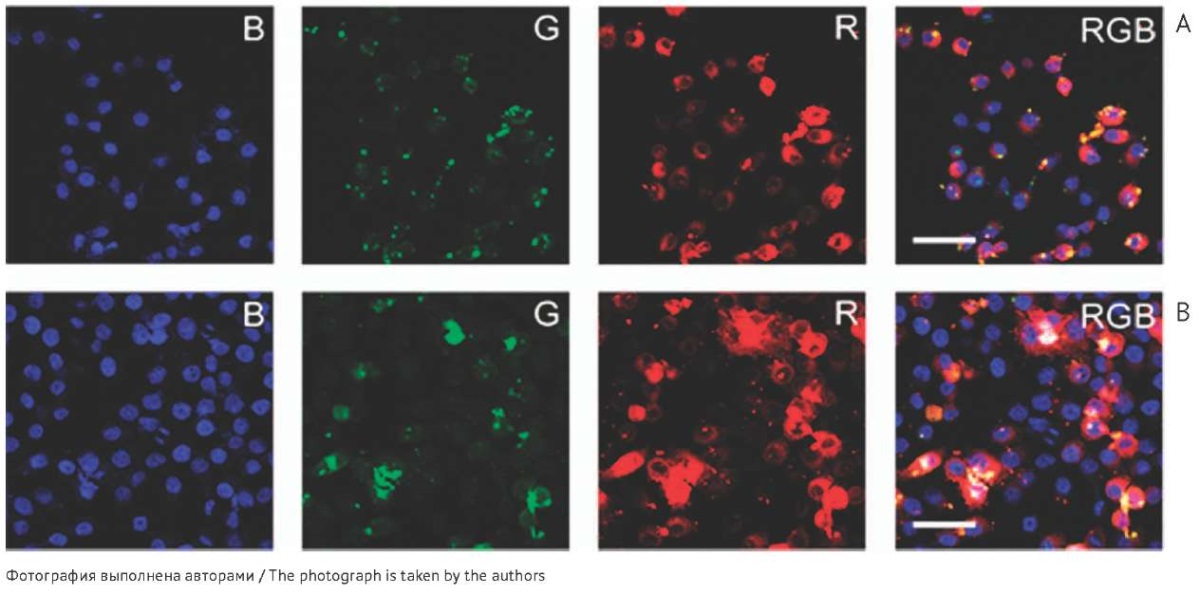
Рис. 4. Накопление комплексов меченного олигонуклеотида (FITC-ODN) с катионными липосомами (L — обычные липосомы (А), F — адресные фолатсодержащие липосомы (B)) в клетках линии КВ-3-1 через 90 мин от начала инкубации согласно данным конфокальной микроскопии (увеличение ×400). При получении микрофотографий использовали три канала для анализа: синий канал (B) — визуализация ядер клеток, окрашенных красителем NucBlue; зеленый канал (G) — визуализация FITC-ODN; красный канал (R) — визуализация липосом, модифицированных родамином В. Масштабная линейка — 50 мкм.
Fig. 4. Accumulation of complexes of a fluorescent-labelled oligonucleotide (FITC-ODN) with cationic liposomes (L, conventional liposomes (A); F, folate-receptor targeted liposomes (B)) in KB-3-1 cells after 90 min of incubation, according to confocal microscopy data (×400 magnification). Microphotographs used three channels for analysis: blue (B) to visualise cell nuclei stained with NucBlue, green (G) to visualise the FITC-ODN, and red (R) to visualise rhodamine B-labelled liposomes. Scalebar: 50 µm.
ВЫВОДЫ
- Получены адресные фолатсодержащие катионные липосомы, которые способствовали более эффективной доставке в клетки флуоресцентно-меченного олигонуклеотида (FITC-ODN) в сравнении с контролем (использование коммерческого реагента для трансфекции Lipofectamine 2000) через 240 мин после начала трансфекции.
- Изучена кинетика накопления комплексов FITC-ODN с катионными липосомами в клетках линий КВ-3-1 и НЕК 293 с использованием метода проточной цитометрии. Показано, что адресные фолатсодержащие катионные липосомы способствовали более эффективному накоплению олигонуклеотида в клетках КВ-3-1 по сравнению с обычными липосомами, не содержащими адресного лиганда (примерно на 25%).
- Проведена оценка внутриклеточной локализации комплексов FITC-ODN с катионными липосомами с помощью методов флуоресцентной и конфокальной микроскопии. Высказано предположение о возможной роли в накоплении комплексов механизма рецептор-опосредованного эндоцитоза, опосредованного адресными фолатсодержащими катионными липосомами, однако установление точного механизма внутриклеточного транспорта требует дополнительного изучения.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.В. Шмендель — концепция работы, экспериментальная работа по созданию катионных липосом и их комплексов с FITC-ODN, исследование физико-химических параметров липосом, проведение проточной цитометрии, флуоресцентной микроскопии, написание текста рукописи, формулировка выводов; О.В. Марков — экспериментальная работа по проведению флуоресцентной микроскопии, конфокальной микроскопии, написание текста рукописи; М.А енкова — концепция работы, утверждение окончательной версии рукописи для публикации; М.А. Маслов — концепция работы, написание текста рукописи, формулировка выводов; утверждение окончательной версии рукописи для публикации.
Благодарности. Авторы выражают признательность А.В. Владимировой (ФГБУН Институт химической биологии и фундаментальной медицины СО РАН) за помощь в поддержании культур клеток, а также А.С. Алексеевой (ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН) за проведение экспериментов по трансмиссионной электронной микроскопии.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. E.V. Shmendel conceptualised the study, created cationic liposomes and liposome–FITC-ODN complexes, analysed their physicochemical characteristics by flow cytometry and fluorescence microscopy, drafted the manuscript, and formulated the conclusions. O.V. Markov performed fluorescence and confocal microscopy and drafted the manuscript. M.A. Zenkova conceptualised the study and approved the final version of the manuscript for publication. M.A. Maslov conceptualised the study, drafted the manuscript, formulated the conclusions, and approved the final version of the manuscript for publication.
Acknowledgements. The authors express their gratitude to A.V. Vladimirova (Institute of Chemical Biology and Fundamental Medicine, Siberian Branch of the Russian Academy of Sciences (RAS)) for her assistance with cell culture maintenance. The authors also express appreciation to A.S. Alekseeva (Shemyakin–Ovchinnikov Institute of Bioorganic Chemistry, RAS) for performing transmission electron microscopy experiments.
Список литературы
1. Shchaslyvyi AY, Antonenko SV, Tesliuk MG, Telegeev GD. Current state of human gene therapy: approved products and vectors. Pharmaceuticals (Basel. 2023;16(10):1416. https://doi.org/10.3390/ph16101416
2. Mendes BB, Conniot J, Avital A, Yao D, Jiang X, Zhou X, et al. Nanodelivery of nucleic acids. Nat Rev Methods Primers. 2022;2:24. https://doi.org/10.1038/s43586-022-00104-y
3. Zhang H, Vandesompele J, Braeckmans K, De Smedt SC, Remaut K. Nucleic acid degradation as barrier to gene delivery: a guide to understand and overcome nuclease activity. Chem Soc Rev. 2024;53(1):317–60. https://doi.org/10.1039/d3cs00194f
4. Zhang WW, Li L, Li D, Liu J, Li X, Li W, et al. The first approved gene therapy product for cancer Ad-p53 (Gendicine): 12 years in the clinic. Hum Gene Ther. 2018;29(2):160–79. https://doi.org/10.1089/hum.2017.218
5. Ghosh S, Brown AM, Jenkins C, Campbell K. Viral vector systems for gene therapy: a comprehensive literature review of progress and biosafety challenges. Appl Biosaf. 2020;25(1):7–18. https://doi.org/10.1177/1535676019899502
6. Shmendel EV, Puchkov PA, Maslov MA. Design of folatecontaining liposomal nucleic acid delivery systems for antitumor therapy. Pharmaceutics. 2023;15(5):1400. https://doi.org/10.3390/pharmaceutics15051400
7. Hald Albertsen C, Kulkarni JA, Witzigmann D, Lind M, Petersson K, Simonsen JB. The role of lipid components in lipid nanoparticles for vaccines and gene therapy. Adv Drug Deliv Rev. 2022;188:114416. https://doi.org/10.1016/j.addr.2022.114416
8. Iqbal S, Blenner M, Alexander-Bryant A, Larsen J. Polymersomes for therapeutic delivery of protein and nucleic acid macromolecules: from design to therapeutic applications. Biomacromolecules. 2020;21(4):1327–50. https://doi.org/10.1021/acs.biomac.9b01754
9. Rai DB, Pooja D, Kulhari H. 9 — Dendrimers in gene delivery. In: Pharmaceutical applications of dendrimers. Elsevier; 2019. P. 211–31. https://doi.org/10.1016/B978-0-12-814527-2.00009-3
10. Mirza Z, Karim S. Nanoparticles-based drug delivery and gene therapy for breast cancer: recent advancements and future challenges. Semin Cancer Biol. 2021;69:226–37. https://doi.org/10.1016/j.semcancer.2019.10.020
11. Duan L, Xu L, Xu X, Qin Z, Zhou X, Xiao Y, et al. Exosomemediated delivery of gene vectors for gene therapy. Nanoscale. 2021;13(3):1387–97. https://doi.org/10.1039/d0nr07622h
12. Luiz MT, Dutra JAP, Tofani LB, de Araújo JTC, Di Filippo LD, Marchetti JM, Chorilli M. Targeted liposomes: a nonviral gene delivery system for cancer therapy. Pharmaceutics. 2022;14(4):821. https://doi.org/10.3390/pharmaceutics14040821
13. Meo SA, Bukhari IA, Akram J, Meo AS, Klonoff DC. COVID-19 vaccines: comparison of biological, pharmacological characteristics and adverse effects of Pfizer/BioNTech and Moderna vaccines. Eur Rev Med Pharmacol Sci. 2021;25(3):1663–9. https://doi.org/10.26355/eurrev_202102_24877
14. Ulbrich K, Hekmatara T, Herbert E, Kreuter J. Transferrinand transferrin-receptor-antibody-modified nanoparticles enable drug delivery across the blood–brain barrier (BBB). Eur J Pharm Biopharm. 2009;71(2):251–6. https://doi.org/10.1016/j.ejpb.2008.08.021
15. Wang B, Zhang J, Song F, Tian M, Shi B, Jiang H, et al. EGFR regulates iron homeostasis to promote cancer growth through redistribution of transferrin receptor 1. Cancer Lett. 2016;381(2):331–40. https://doi.org/10.1016/j.canlet.2016.08.006
16. Mattheolabakis G, Milane L, Singh A, Amiji MM. Hyaluronic acid targeting of CD44 for cancer therapy: from receptor biology to nanomedicine. J Drug Target. 2015;23(7–8):605–18. https://doi.org/10.3109/1061186X.2015.1052072
17. Kim SH, Kim JK, Lim SJ, Park JS, Lee MK, Kim CK. Folate-tethered emulsion for the target delivery of retinoids to cancer cells. Eur J Pharm Biopharm. 2008;68(3):618–25. https://doi.org/10.1016/j.ejpb.2007.08.010
18. Siwowska K, Schmid RM, Cohrs S, Schibli R, Müller C. Folate receptor-positive gynecological cancer cells: in vitro and in vivo characterization. Pharmaceuticals (Basel). 2017;10(3):72. https://doi.org/10.3390/ph10030072
19. Kalber TL, Kamaly N, So PW, Pugh JA, Bunch J, McLeod CW, et al. A low molecular weight folate receptor targeted contrast agent for magnetic resonance tumor imaging. Mol Imaging Biol. 2011;13(4):653–62. https://doi.org/10.1007/s11307-010-0400-3
20. Antony AC. The biological chemistry of folate receptors. Blood. 1992;79(11):2807–20. PMID: 1586732
21. Liang X, Luo M, Wei XW, Ma CC, Yang YH, Shao B, et al. A folate receptor-targeted lipoplex delivering interleukin-15 gene for colon cancer immunotherapy. Oncotarget. 2016;7(32):52207–17. https://doi.org/10.18632/oncotarget.10537
22. Kabilova TO, Shmendel EV, Gladkikh DV, Chernolovskaya EL, Markov OV, Morozova NG, et al. Targeted delivery of nucleic acids into xenograft tumors mediated by novel folate-equipped liposomes. Eur J Pharm Biopharm. 2018;123:59–70. https://doi.org/10.1016/j.ejpb.2017.11.010
23. Pierce JT, Cho SS, Nag S, Zeh R, Jeon J, Holt D, et al. Folate receptor overexpression in human and canine meningiomas — immunohistochemistry and case report of intraoperative molecular imaging. Neurosurgery. 2019;85(3):359–68. https://doi.org/10.1093/neuros/nyy356
24. Yang R, Kolb EA, Qin J, Chou A, Sowers R, Hoang B, et al. The folate receptor alpha is frequently overexpressed in osteosarcoma samples and plays a role in the uptake of the physiologic substrate 5-methyltetrahydrofolate. Clin Cancer Res. 2007;13(9):2557–67. https://doi.org/10.1158/1078-0432.CCR-06-1343
25. Rait AS, Pirollo KF, Xiang L, Ulick D, Chang EH. Tumor-targeting, systemically delivered antisense HER-2 chemosensitizes human breast cancer xenografts irrespective of HER-2 levels. Mol Med. 2002;8(8):475–86. https://doi.org/10.1007/bf03402027
26. Shmendel EV, Kabilova TO, Morozova NG, Zenkova MA, Maslov MA. Effects of spacers within a series of novel folate-containing lipoconjugates on the targeted delivery of nucleic acids. J Drug Deliv Sci Technol. 2020;57:101609. https://doi.org/10.1016/j.jddst.2020.101609
27. Bishani A, Makarova DM, Shmendel EV, Maslov MA, Sen’kova AV, Savin IA, et al. Influence of the composition of cationic liposomes on the performance of cargo immunostimulatory RNA. Pharmaceutics. 2023;15(9):2184. https://doi.org/10.3390/pharmaceutics15092184
28. Petukhov IA, Maslov MA, Morozova NG, Serebrennikova GA. Synthesis of polycationic lipids based on cholesterol and spermine. Russ Chem Bull. 2010;59:260–8. https://doi.org/10.1007/s11172-010-0071-x
29. Luneva AS, Puchkov PA, Shmendel EV, Zenkova MA, Kuzevanova AY, Alimov AA, et al. Optimization of the technology for the preparation of cationic liposomes for the delivery of nucleic acids. Russ J Bioorg Chem. 2018;44:724–31. https://doi.org/10.1134/s1068162019010084
30. Cabral H, Matsumoto Y, Mizuno K, Chen Q, Murakami M, Kimura M, et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nat Nanotechnol. 2011;6(12):815–23. https://doi.org/10.1038/nnano.2011.166
31. Mikheev AA, Shmendel EV, Nazarov GV, Maslov MA. Influence of liposome composition on plasmid DNA delivery to eukaryotic cells. Russ J Bioorg Chem. 2021;47:1034–42. https://doi.org/10.1134/S1068162021050319
32. Mornet E, Carmoy N, Lainé C, Lemiègre L, Le Gall T, Laurent I, et al. Folate-equipped nanolipoplexes mediated efficient gene transfer into human epithelial cells. Int J Mol Sci. 2013;14(1):1477–501. https://doi.org/10.3390/ijms14011477
33. Gorle S, Ariatti M, Singh M. Novel serum-tolerant lipoplexes target the folate receptor efficiently. Eur J Pharm Sci. 2014;59:83–93. https://doi.org/10.1016/j.ejps.2014.04.012
Об авторах
Е. В. ШмендельРоссия
Шмендель Елена Васильевна, канд. хим. наук
просп. Вернадского, д. 86, Москва, 119571
О. В. Марков
Россия
Марков Олег Владимирович, канд. биол. наук
проспект Академика Лаврентьева, д. 8, г. Новосибирск, 630090
М. А. Зенкова
Россия
Зенкова Марина Аркадьевна, д-р. биол. наук, проф., член-корр. РАН
проспект Академика Лаврентьева, д. 8, г. Новосибирск, 630090
М. А. Маслов
Россия
Маслов Михаил Александрович, д-р хим. наук, доц.
просп. Вернадского, д. 86, Москва, 119571
Дополнительные файлы
Рецензия
Для цитирования:
Шмендель Е.В., Марков О.В., Зенкова М.А., Маслов М.А. Кинетика накопления в клетках флуоресцентно-меченного олигонуклеотида при использовании адресных фолатсодержащих катионных липосом. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(2):188-199. https://doi.org/10.30895/2221-996X-2024-24-2-188-199
For citation:
Shmendel E.V., Markov O.V., Zenkova M.A., Maslov M.A. Time course of fluorescent-labelled oligonucleotide accumulation in cells with the use of folate receptor-targeted cationic liposomes. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(2):188-199. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-2-188-199


































