Перейти к:
Разработка и валидация методики определения остаточного белка А в фармацевтических субстанциях терапевтических моноклональных антител
https://doi.org/10.30895/2221-996X-2024-24-1-32-45
Резюме
АКТУАЛЬНОСТЬ. При контроле качества препаратов терапевтических моноклональных антител важной задачей является определение остаточного белка А, появление которого связано с вымыванием из носителя в процессе аффинной хроматографической очистки антител. Иммуноферментное определение белка А осложняется эффектом влияния присутствия неродственных соединений (иммуноглобулины) в образце (эффект матрицы), что может приводить к ложноотрицательным результатам анализа. Для повышения эффективности иммуноферментного анализа (ИФА) необходимо разработать этап пробоподготовки образцов, позволяющий необратимо разорвать связь в комплексе «белок А – моноклональное антитело».
ЦЕЛЬ. Разработка и валидация аналитической методики иммуноферментного определения остаточного белка А в фармацевтических субстанциях терапевтических моноклональных антител с использованием набора реагентов для ИФА на основе реактивов собственного производства (in-house).
МАТЕРИАЛЫ И МЕТОДЫ. В качестве антигена использовали рекомбинантный белок А. Наработку поликлональных антител к белку А проводили путем иммунизации кур с последующим отбором яиц и выделением из них антител. Специфичные к белку А антитела очищали с применением аффинной хроматографии. Остаточный белок А определяли после предварительной пробоподготовки образцов с помощью сэндвич-ИФА. Валидацию методики проводили в соответствии с требованиями Государственной фармакопеи Российской Федерации (ОФС.1.1.0012).
РЕЗУЛЬТАТЫ. Наработаны, выделены и очищены куриные антитела (IgY) против рекомбинантного белка А. Разработаны условия пробоподготовки и методика для проведения иммуноферментного определения остаточного белка А. Подобраны оптимальные составы буферных растворов, в том числе состав денатурирующего буфера для разрушения комплекса «белок А – моноклональное антитело». Проведена валидация разработанной методики. Измеряемые значения белка А при оценке правильности методики находились в пределах 83–108% от номинального, при оценке межлабораторной прецизионности – в пределах 96–116%, при оценке повторяемости – до 13%. Нижний предел количественного определения составил 10 нг/мл при минимально необходимом разведении 1:10. Аналитическая область методики – от 10 до 40 нг/мл. Методика показала сопоставимые результаты по сравнению с аналогичным набором реагентов иностранного производства.
ВЫВОДЫ. Разработанная методика определения остаточного белка А c использованием набора реагентов для иммуноферментного анализа на основе реактивов собственного производства позволяет минимизировать эффект матрицы в препаратах терапевтических моноклональных антител. Применение методики позволит решить проблему импортозамещения и снизить затраты на контроль качества российских иммунобиологических препаратов.
Ключевые слова
Для цитирования:
Ноздрина Е.В., Мазалев Д.А., Рогозина Д.Р., Живодеров С.П., Лягоскин И.В., Шукуров Р.Р. Разработка и валидация методики определения остаточного белка А в фармацевтических субстанциях терапевтических моноклональных антител. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):32-45. https://doi.org/10.30895/2221-996X-2024-24-1-32-45
For citation:
Nozdrina E.V., Mazalev D.A., Rogozina D.R., Zhivoderov S.P., Lyagoskin I.V., Shukurov R.R. Development and validation of an analytical procedure for the determination of residual protein A in active substances of therapeutic monoclonal antibodies. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):32-45. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-32-45
Введение
Благодаря способности связывать иммуноглобулины белок А золотистого стафилококка широко применяется в практической биотехнологии и биохимии. В частности, аффинные сорбенты с белком А в качестве лиганда часто используются для выделения терапевтических моноклональных антител в фармацевтическом производстве. Основные преимущества аффинной хроматографии на основе белка А при очистке терапевтических антител — способность специфически связывать антитела и возможность достигать высокой чистоты продукта. Однако недостатком данного метода является эффект вымывания белка А из носителя — часть белка А (лиганд) элюируется с колонки совместно с антителом [1].
Белок А является одним из факторов патогенности Staphylococcus aureus за счет способности связываться с Fc-фрагментом иммуноглобулинов, однако кроме этого белок А может вызывать воспалительные реакции, инициируемые взаимодействием с TNF-α, фактором фон Виллебранда и рецептором к C1q-компоненту комплемента (C1qR) [2]. Известно, что производственные примеси, присутствующие после очистки продукта (белки клетки-хозяина, липиды или ДНК клеток-продуцентов, белки контаминирующих агентов и др.), могут индуцировать иммунный ответ или, выполняя роль адъювантов, стимулировать иммунные реакции на целевой рекомбинантный белок [3].
Используемый в настоящее время для аффинной хроматографии белок А был модифицирован путем сайт-направленного мутагенеза с целью повышения рН, при котором возможно элюирование антител с аффинного носителя [4]. Однако присутствие остаточного белка А в конечном продукте, тем не менее, возможно, что является нежелательным, в связи с чем должно контролироваться на всех этапах очистки.
Наиболее распространенными методами анализа остаточного белка А являются различные варианты иммуноферментного анализа (ИФА). Основной недостаток ИФА — невозможность обнаружения белка А в низких концентрациях (менее 1 нг/мл), что осложняется эффектом влияния присутствия неродственных соединений в образце (эффект матрицы), искажающим результаты.
На рынке представлены наборы реагентов ИФА различных производителей: Cygnus Technologies (США), GenScript (США), R&D Systems (США) и др. Однако не все наборы реагентов позволяют решить проблему, связанную с влиянием эффекта матрицы. Важным ограничивающим фактором являются трудности, связанные с логистикой иностранных наборов реагентов и их высокой стоимостью. Разработка набора реагентов для ИФА на основе реактивов собственного производства (in-house) может решить проблему импортозамещения и снизить затраты на контроль качества российских иммунобиологических препаратов.
Цель работы — разработка и валидация аналитической методики иммуноферментного определения остаточного белка А в фармацевтических субстанциях терапевтических моноклональных антител с использованием набора реагентов для ИФА на основе реактивов собственного производства (in-house).
Материалы и методы
Материалы
В работе использовали следующие реактивы:
- на стадиях хроматографической очистки, разработки и валидации методики, а также при иммунизации животных использовали рекомбинантный белок А (АО «ГЕНЕРИУМ»);
- полиэтиленгликоль 6000 (Sigma-Aldrich, кат. № 81260);
- для приготовления буферных растворов использовали натрия фосфат 1-замещенный 2-водный (PanReac AppliChem, кат. № 141677.0416), натрия хлорид (AKZO NOBEL Salt А/S, кат. № 11711/01-270421), натрия ацетат 3-водный (PanReac AppliChem, кат. № 131632.1211), натрия гидрофосфат (Sigma-Aldrich, кат. № S9736);
- ИФА проводили с использованием реагентов: натрия гидрокарбонат (Sigma-Aldrich, кат. № S6297), натрия карбонат безводный (Sigma-Aldrich, кат. № S7795), натрия гидроксид (PanReac AppliChem, кат. № 141687), бычий сывороточный альбумин (Sigma-Aldrich, кат. № A7030), фосфатно-солевой буфер рН 7,2–7,6 (ЭКО Сервис, кат. № В-60201), полисорбат 20 (PanReac AppliChem, кат. № 142312), желатин (Sigma-Aldrich, кат. № G1890-100G), трис(гидроксиметил)аминометан (Scharlau, кат. № TR04221000), тритон Х-100 (Sigma-Aldrich, кат. № T9284), лимонная кислота безводная (PanReac AppliChem, кат. № 141808.1211), 3-натрия цитрат 2-водный (PanReac AppliChem, кат. № 131655.1211), HEPES (BioFroxx, кат. № 1194KG001), 3,3’,5,5’ тетраметилбензидин (Биотест Системы, кат. № 01016-1), серная кислота концентрированная (PanReac AppliChem, кат. № 471058), соляная кислота (PanReac AppliChem, кат. № 141020.1611), набор для конъюгирования (Bio-Rad, кат. № LNK004P), рекомбинантный белок L (Thermo Scientific™, кат. № 21189), набор реагентовMix-N-Go Protein A Assay (Cygnus Technologies, США, кат. № F610).
Методы
Иммунизация. Экспериментальные работы проводили на базе ФГБНУ «Федеральный исследовательский центр вирусологии и микробиологии» (ФГБНУ ФИЦВиМ) на курах-несушках породы Русская (виварий лаборатории молекулярной вирусологии). Протокол исследования на животных был одобрен этическим комитетом ФГБНУ ФИЦВиМ (протокол № 05-23 от 18.07.2023). Выбор экспериментальных животных обусловлен следующими факторами: птичьи иммуноглобулины IgY (функциональный эквивалент IgG млекопитающих) не имеют сайтов связывания белка А; IgY накапливаются в желтках, что позволяет проводить гуманную иммунизацию без тотального отбора крови у животных [5][6].
Проводили пятикратную иммунизацию с двухнедельным интервалом. В качестве антигена использовали белок А (АО «ГЕНЕРИУМ») в соотношении 1:1 с полным адъювантом Фрейнда (для первого введения) или неполным адъювантом Фрейнда (для следующих введений). Отбор яиц осуществляли с 49 сут и до окончания иммунизации.
Выделение и очистка антител. Куриные антитела выделяли путем осаждения полиэтиленгликолем 6000 по стандартной методике [7]. Осадок антител растворяли буфером, содержащим 15 мМ натрия фосфат, 150 мМ натрия хлорид, pH 7,4 из расчета 5 мл буфера на 1 желток.
Очистку антител проводили с использованием метода аффинной хроматографии с помощью хроматографа AKTA avant 25 (GE HealthCare, Швеция) с применением сорбента с иммобилизованным белком А в качестве лиганда. Хроматографическую колонку Tricorn 10/150 (GE HealthCare, Швеция) объемом 10 мл перед нанесением образца промывали 5 объемами буфера для нанесения (15 мМ натрия фосфат, 150 мМ натрия хлорид, pH 7,4) при скорости потока 380 см/ч. Антитела перед началом хроматографии разбавляли буфером для нанесения в три раза и наносили на колонку со скоростью потока 300 см/ч, после чего колонку промывали 5 объемами буфера для нанесения и кондиционирующего буфера (10 мМ натрия фосфат, 10 мM натрия ацетат, 50 мM натрия хлорид, pH 6,5) со скоростью 380 см/ч. Элюцию проводили в присутствии кислого буфера (50 мM натрия ацетат, 50 мМ натрия хлорид, pH 2,8) при скорости потока 300 см/ч. Момент начала сбора фракции соответствовал значению оптической плотности элюата 20 mAU при длине волны 280 нм; сбор фракции заканчивали (после прохождения максимума на кривой элюции) при снижении значения оптической плотности до 30 mAU. По окончании элюции в целевую фракцию добавляли 0,5 M натрия гидрофосфат до конечной концентрации 50 мМ и 1 М натрия гидроксид до значения pH 7,0.
Иммуноферментный анализ. Методика определения остаточного белка А в присутствии моноклональных антител основана на сэндвич-ИФА с использованием образцов, прошедших предварительную подготовку. В лунки планшета для ИФА вносили куриные антитела к белку А (0,5 мкг/лунка), сорбцию проводили в течение 14–16 ч при 5 °C. На этапе пробоподготовки к образцам и калибровочным растворам добавляли денатурирующий буфер, инкубировали 15 мин при комнатной температуре. После инкубации и центрифугирования образцов 25 мкл супернатанта вносили в лунки планшета с нейтрализующим буфером, инкубировали 1,5 ч при 25 °C. Образовавшийся комплекс «белок А — моноклональное антитело» выявляли с помощью куриных антител к белку А (0,07 мкг/лунку), конъюгированных с пероксидазой хрена; инкубацию проводили в течение 1 ч при 25 °C. Оптическую плотность окрашенного продукта определяли с использованием спектрофотометра xMark (Bio-Rad, США) при длинах волн 450/650 нм.
Результаты измерений обрабатывали автоматически с помощью программного обеспечения Microplate Manager (Bio-Rad, США) путем построения калибровочного графика зависимости среднего значения оптической плотности каждого из калибровочных растворов от десятичного логарифма содержания белка А, применяя 4-параметрическую логистическую функцию.
Приготовление модельных и калибровочных растворов. Калибровочные растворы готовили путем внесения рекомбинантного белка А в буферный раствор для разведения образцов до концентраций 10,00, 5,00, 2,50, 1,25, 0,63, 0,31 и 0,16 нг/мл.
Для разработки методики готовили модельные образцы из 6 различных субстанций моноклональных антител производства АО «ГЕНЕРИУМ» (A, B, C, D, E, F) с добавлением 100 нг/мл белка А в каждую. Все модельные образцы и субстанции (без внесения белка А) исследовали в разведениях 1:40, 1:80, 1:160, 1:320.
Для проведения валидации методики (оценка правильности и прецизионности) готовили модельные образцы субстанции E. В субстанцию вносили рекомбинантный белок А до концентрации 10, 16, 20, 24, 40 нг/мл. Для оценки специфичности в буфер готовой лекарственной формы моноклонального антитела на основе субстанции E добавляли 10 нг/мл, в субстанцию E — 50 нг/мл рекомбинантного белка L (иммуноглобулин-связывающий белок, используемый для выделения моноклональных антител наряду с белком А).
Перед проведением валидационных испытаний полученные модельные образцы разводили в 10, 20, 40 и 80 раз буфером для разведения.
Статистическая обработка результатов. Для оценки результатов валидации использовали статистические методы анализа с вычислением коэффициента вариации (coefficient of variation, CV, %) и степени извлечения (recovery, R, %). Коэффициент вариации рассчитывали как отношение стандартного отклонения (relative standard deviation, RSD) к среднему значению экспериментально установленной концентрации белка А (найденное значение), выраженное в процентах. Степень извлечения рассчитывали как отношение найденного значения к истинному значению концентрации белка А, внесенному в модельный образец (номинальное значение), выраженное в процентах1. Все расчеты проводили в программе Microsoft Office Excel 2016.
Результаты и обсуждение
Разработка методики определения остаточного белка А
На первом этапе разработки методики необходимым условием был подбор оптимальных составов буферных растворов для проведения ИФА. Для получения корректных результатов перед проведением анализа необходимо обеспечить разрыв связи в комплексе «белок А — моноклональное антитело» и не допустить повторного образования комплекса (рис. 1) [8]. Подбор условий диссоциации осложняется природой образования комплекса, так как белок А может реагировать с Fc-фрагментом большинства IgG, Fab-фрагментом антител, содержащих VHIII домен, и паратопом специфичных антител [9].
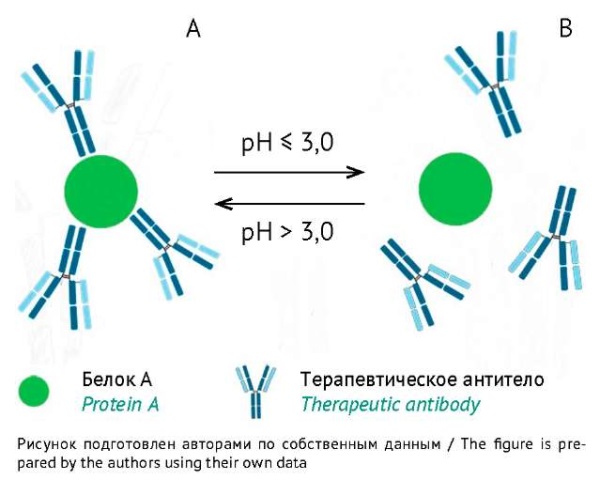
Рис. 1. Схематичное изображение комплекса «белок А — моноклональное антитело» и его диссоциации. А — при pH выше 3,0 антитело и белок А существуют в виде комплекса; В — при pH ниже 3,0 все связи в комплексе разрушаются, антитело и белок А диссоциируют.
Fig. 1. Schematic image of the protein A–monoclonal antibody complex and its dissociation. A, the antibody and protein A exist as a complex at a pH above 3.0; B, all bonds in the complex are destroyed, and the antibody and protein A are dissociated at a pH below 3.0.
В ходе исследования взаимодействия белка А и IgG1 было показано, что при рН 3,0 разрушаются электростатические взаимодействия молекулы белка А и иммуноглобулина и молекулы диссоциируют [10]. Таким образом, на этапе пробоподготовки рН испытуемых образцов необходимо поддерживать на уровне не выше 3,0. Однако куриные иммуноглобулины IgY активны в диапазоне pH от 3,5 до 11,0 [6], следовательно, перед нанесением на планшет для ИФА подкисленные образцы должны пройти нейтрализацию. Нейтрализация образцов, в свою очередь, может привести к повторному образованию комплекса «белок А — моноклональное антитело» и снижению чувствительности из-за эффекта матрицы [11]. Для решения этой проблемы необходимо было денатурировать моноклональные антитела таким образом, чтобы они не могли повторно взаимодействовать с белком А (рис. 2).

Рис. 2. Схематичное представление разработанной методики определения остаточного белка А. А — комплекс «белок А — моноклональное антитело»; В — комплекс диссоциирует при pH не выше 3,0, детергент блокирует повторное связывание терапевтического антитела с белком А; С — свободный белок А вступает в реакцию иммуноферментного анализа при значениях рН от 6,5 до 8,5.
Fig. 2. Schematic representation of the developed analytical procedure for the determination of residual protein A. A, a protein A–monoclonal antibody complex; B, the protein A–monoclonal antibody complex dissociates at a pH no higher than 3.0, and the detergent blocks the re-binding of the therapeutic antibody to protein A; C, free protein A reacts in the enzyme immunoassay at a pH of 6.5 to 8.5.
Были подобраны оптимальные составы буферного раствора для разведения образцов, денатурирующего и нейтрализующего буферных растворов, которые образуют единую систему, позволяющую с достаточной правильностью определять аналит (табл. 1). Значения pH всех буферных растворов подобраны таким образом, что при добавлении в буфер для разведения денатурирующего буфера обеспечивается значение рН, равное 3,0, а при внесении подготовленных образцов в нейтрализующий буфер значение pH не сдвигается в сторону кислых значений.
Таблица 1. Описание буферных растворов
Table 1. Description of buffer solutions
Наименование Name | Описание* Description* |
Буферный раствор для разведения образцов Sample dilution buffer | Трис-содержащий буферный раствор с протектором, защищающим белок А от денатурации Tris-containing buffer solution with a protector that shields protein A from denaturation |
Денатурирующий буферный раствор Denaturing buffer | Цитратный буфер, поддерживающий оптимальное значение pH для реакции, содержащий детергенты, обеспечивающие необратимую денатурацию иммуноглобулинов Citrate buffer that maintains the optimum pH value for the reaction, containing detergents that ensure irreversible denaturation of immunoglobulins |
Нейтрализующий буферный раствор Neutralising buffer | 0,1 М HEPES |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. * — состав буферных растворов оформлен
в виде заявки на получение ноу-хау АО «ГЕНЕРИУМ» №534.
Note. *, the authors filed a know-how request for the composition of buffer solutions
(know-how No. 534 of GENERIUM JSC).
С применением описанных буферных растворов был проведен ИФА. В качестве образцов были использованы субстанции шести различных моноклональных антител, относящихся к подклассам IgG1 (субстанции A, C, D и E), IgG2 (субстанция B), IgG4 (субстанция F), а также модельные образцы с внесением 100 нг/мл белка А в каждый образец субстанции. Результаты проведенных экспериментов показали эффективность денатурации и правильность методики: степень извлечения для модельных образцов не выходила за пределы 20% отклонения от номинального значения (рис. 3). При этом эффективность ИФА не зависела от подкласса IgG. Содержание белка А в субстанциях без внесения белка А было ниже предела чувствительности методики, поэтому было приравнено к нулю (данные не представлены).

Рис. 3. Определение содержания белка А в модельных образцах методом иммуноферментного анализа. Данные представлены в виде найденного значения содержания белка А в каждом модельном образце и допустимой ошибки анализа (100±20%). В легенде представлено описание модельных образцов.
Fig. 3. Results of measuring protein A in simulated samples using enzyme immunoassay. The data are presented as the measured protein A concentration in each simulated sample and the acceptable analysis error (100±20%). The legend lists the simulated samples.
Валидация методики определения остаточного белка А
Валидацию методики проводили с использованием субстанции Е в соответствии с требованиями Государственной фармакопеи Российской Федерации XV изд. (ГФ РФ XV)2 и Решения Коллегии Евразийской экономической комиссии № 1133. Согласно указанным документам аналитическая методика количественного определения примесей должна быть оценена по следующим валидационным характеристикам: правильность (accuracy), повторяемость (repeatability), промежуточная (внутрилабораторная) прецизионность (intermediate (intra-laboratory) precision), селективность (selectivity), специфичность (specificity), нижний предел количественного определения (lower limit of quantification), линейность (linearity), диапазон применения (аналитическая область) (range). Кроме перечисленных критериев также были оценены минимально необходимое разведение (minimum required dilution) и межлабораторная прецизионность (inter-laboratory precision).
Оценка правильности между аналитическими циклами и внутрилабораторной прецизионности. Правильность между аналитическими циклами и внутрилабораторная прецизионность оценивались совместно в шести независимых опытах (табл. 2). Пять модельных образцов, содержащих от 10 до 40 нг/мл белка А, и субстанцию без внесения белка А испытывали в четырех разведениях в двух повторностях каждое (раздел «Материалы и методы», подраздел «Приготовление модельных и калибровочных растворов»). В испытаниях участвовали два аналитика, каждый из которых не проводил более одного опыта для оценки правильности в один день. После расчета среднего значения (по шести опытам) для каждого образца определяли степень извлечения (R, %) и коэффициент вариации и оценивали их приемлемость по критериям:
- для образцов с концентрацией белка А 10 нг/мл значение Rдолжно быть в пределах 75–125%, для остальных образцов — 80–120%;
- для образцов с концентрацией белка А 10 нг/мл значение CVне должно превышать 25%, для остальных образцов — 20%.
Таблица 2. Результаты оценки правильности между опытами
и внутрилабораторной прецизионности методики определения остаточного белка А
Table 2. Results of assessing the between-run accuracy
and intermediate precision of the analytical procedure for the determination of residual protein A
Номинальное значение концентрации белка А, нг/мл Nominal concentration of protein A, ng/mL | Номер опыта Experiment number | Найденное значение концентрации белка А, нг/мл Measured protein A concentration, ng/mL | Среднее значение ± RSD, нг/мл Mean ± RSD, ng/mL | R, % | CV, % |
0 | 1 | 0 | 0 | – | – |
2 | 0 | ||||
3 | 0 | ||||
4 | 0 | ||||
5 | 0 | ||||
6 | 0 | ||||
10 | 1 | 9,169 | 9,738±0,770 | 97 | 8 |
2 | 10,278 | ||||
3 | 10,206 | ||||
4 | 8,429 | ||||
5 | 10,028 | ||||
6 | 10,315 | ||||
16 | 1 | 15,023 | 16,312±1,112 | 102 | 7 |
2 | 14,883 | ||||
3 | 16,719 | ||||
4 | 17,018 | ||||
5 | 17,630 | ||||
6 | 16,597 | ||||
20 | 1 | 18,649 | 19,485±0,747 | 97 | 4 |
2 | 19,392 | ||||
3 | 18,796 | ||||
4 | 19,495 | ||||
5 | 20,687 | ||||
6 | 19,892 | ||||
24 | 1 | 23,144 | 23,430±0,919 | 98 | 4 |
2 | 23,468 | ||||
3 | 22,562 | ||||
4 | 22,426 | ||||
5 | 24,230 | ||||
6 | 24,747 | ||||
40 | 1 | 41,133 | 39,182±2,106 | 98 | 5 |
2 | 37,376 | ||||
3 | 35,872 | ||||
4 | 40,763 | ||||
5 | 39,533 | ||||
6 | 40,416 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. R — степень извлечения; CV — коэффициент вариации; RSD — относительное стандартное отклонение; «–» не применимо.
Note. R, recovery; CV, coefficient of variation; RSD, relative standard deviation; –, not applicable.
Значения R и CV в каждом опыте удовлетворяли установленным критериям, что подтвердило правильность и прецизионность методики между аналитическими циклами.
Оценка правильности и прецизионности внутри аналитического цикла. Правильность внутри аналитического цикла и прецизионность (повторяемость) оценивались совместно в пяти независимых опытах (табл. 3). В каждом опыте анализировали шесть независимых повторностей одного из шести модельных образцов в четырех разведениях в двух повторностях каждое (раздел «Материалы и методы», подраздел «Приготовление модельных и калибровочных растворов»). После расчета среднего значения (по шести повторностям) каждого образца определяли R и CV и оценивали их приемлемость по критериям аналогично оценке правильности между циклами и повторяемости.
Таблица 3. Результаты оценки правильности и прецизионности
внутри аналитического цикла методики определения остаточного белка А
Table 3. Results of assessing the within-run accuracy and precision
of the analytical procedure for the determination of residual protein A
Номинальное значение концентрации белка А, нг/мл Nominal concentration | Номер повторности Replicate number | Найденное значение концентрации белка А, нг/мл Measured protein A concentration, ng/mL | Среднее значение ± RSD, нг/мл Mean ± RSD, ng/mL | R, % | CV, % |
0 | 1 | 0 | 0 | – | – |
2 | 0 | ||||
3 | 0 | ||||
4 | 0 | ||||
5 | 0 | ||||
6 | 0 | ||||
10 | 1 | 8,876 | 8,303±0,608 | 83 | 11 |
2 | 8,656 | ||||
3 | 8,812 | ||||
4 | 7,721 | ||||
5 | 8,339 | ||||
6 | 7,411 | ||||
16 | 1 | 13,616 | 13,854±0,496 | 87 | 5 |
2 | 14,578 | ||||
3 | 13,114 | ||||
4 | 13,923 | ||||
5 | 13,746 | ||||
6 | 14,147 | ||||
20 | 1 | 19,815 | 18,616±0,838 | 93 | 7 |
2 | 17,863 | ||||
3 | 18,464 | ||||
4 | 18,168 | ||||
5 | 17,896 | ||||
6 | 19,488 | ||||
24 | 1 | 27,918 | 25,934±1,550 | 108 | 13 |
2 | 27,726 | ||||
3 | 25,506 | ||||
4 | 25,573 | ||||
5 | 24,666 | ||||
6 | 24,217 | ||||
40 | 1 | 38,107 | 38,962±1,296 | 97 | 4 |
2 | 41,535 | ||||
3 | 38,234 | ||||
4 | 38,930 | ||||
5 | 38,326 | ||||
6 | 38,638 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. R — степень извлечения; CV — коэффициент вариации; RSD — относительное стандартное отклонение; «–» не применимо.
Note. R, recovery; CV, coefficient of variation; RSD, relative standard deviation; –, not applicable.
Полученные значения R и CV для каждого модельного образца удовлетворяли установленным критериям приемлемости. Таким образом, правильность и прецизионность методики внутри аналитического цикла были подтверждены.
Оценка специфичности и селективности. Методика должна однозначно оценивать содержание определяемого вещества в присутствии сопутствующих компонентов. Поэтому селективность и специфичность методики определения остаточного белка А оценивались путем измерения содержания белка А в трех модельных образцах:
- буфер готовой лекарственной формы моноклонального антитела на основе субстанции E;
- буфер готовой лекарственной формы, содержащий 10 нг/мл белка А;
- субстанция E, содержащая 50 нг/мл белка L.
Оптическая плотность в разведениях модельного образца 1 не превышала оптическую плотность буферного раствора для разведения образцов без белка А, поэтому содержание анализируемого вещества приравнивалось к 0 (табл. 4). В модельном образце 2 содержание белка А определялось с необходимой правильностью: R в пределах 80–120%. Полученные результаты подтверждают отсутствие перекрестной реакции с компонентами раствора.
Таблица 4. Результаты оценки специфичности
методики определения остаточного белка А
Table 4. Results of assessing the specificity
of the analytical procedure for the determination of residual protein A
Параметр Parameter | Модельный образец Simulated sample | ||
Буфер готовой лекарственной формы Formulation buffer | Буфер готовой лекарственной формы, содержащий 10 нг/мл белка А Formulation buffer containing 10 ng/mL protein A | Субстанция E, содержащая 50 нг/мл белка L Substance E containing 50 ng/mL protein L | |
Найденное значение концентрации белка А, нг/мл Measured protein A concentration, ng/mL | 0 | 10,209 | 0 |
R, % | – | 102 | – |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. R — степень извлечения; «–» — не применимо.
Note. R, recovery; –, not applicable.
Отсутствие реакции с белком L в разведениях модельного образца 3 указывает на специфичность используемых в анализе антител к белку А и отсутствие перекрестной реакции с другим белком, способным связывать иммуноглобулины.
Оценка нижнего предела количественного определения и минимально необходимого разведения. Нижний предел количественного определения (НПКО) субстанции напрямую зависит от минимально необходимого разведения. Валидируемая методика имеет ограничения, связанные с содержанием моноклональных антител в растворе. Если концентрация антител в образце превышает 2 мг/мл, то наблюдается эффект матрицы, что приводит к ложноотрицательным результатам анализа. Таким образом, субстанция Е, содержащая 20 мг/мл белка, должна быть разведена не менее чем в 10 раз. Каждый проведенный эксперимент подтвердил, что образцы субстанции Е, содержащие белок А в диапазоне 10–40 нг/мл, в разведении 1:10 определялись с требуемой правильностью.
В качестве НПКО выбрано значение 10 нг/мл белка А, так как оптическая плотность двух последовательных разведений такого образца (1:10 и 1:20) превосходила оптическую плотность наименьшего калибровочного раствора, а содержание белка А определялось с требуемой правильностью.
Оценка линейности и аналитической области. Линейность и аналитическая область оценивались совместно с правильностью между аналитическими циклами. Регрессионная зависимость среднего значения найденной в модельных образцах концентрации белка А от фактически внесенной концентрации имеет линейный характер (рис. 4).

Рис. 4. Оценка линейности методики определения остаточного белка А.
Данные представлены в виде регрессионной зависимости среднего значения найденной в модельных образцах концентрации белка А от их номинального значения.
На графике приведены уравнение полученной линейной функции и коэффициент вариации.
Fig. 4. Results of assessing the linearity of the analytical procedure for the determination of residual protein A.
The data are presented as a regression of the mean protein A concentration measured in simulated samples versus the nominal concentration.
The graph shows the equation of the resulting linear function and the coefficient of variation.
Коэффициент корреляции (R²) полученной линейной функции составил 0,9985, k=0,9242, что соответствует заданным критериям приемлемости (R²≥0,99; 0,8≤k≤1,2). Аналитическая область была определена как интервал концентрации остаточного белка А от 10 до 40 нг/мл, что представляет собой диапазон 50–200% от допустимого содержания белка А в субстанции Е (20 нг/мл).
Оценка межлабораторной прецизионности. Межлабораторную прецизионность оценивали как отношение среднего значения найденной в модельных образцах концентрации белка А аналитиками второй лаборатории к среднему значению найденной в модельных образцах концентрации белка А аналитиками первой лаборатории (R, %). Полученные результаты (табл. 5) оценивались согласно критерию приемлемости: отношение должно находиться в интервале от 80 до 120% (для модельного образца 10 нг/мл — от 75 до 125 %).
Таблица 5. Результаты оценки межлабораторной прецизионности
методики определения остаточного белка А
Table 5. Results of assessing the inter-laboratory precision
of the analytical procedure for the determination of residual protein A
Номинальное значение концентрации белка А, нг/мл Nominal concentration of protein A, ng/mL | Среднее найденное значение концентрации белка А, установленное аналитиками в лаборатории, нг/мл Mean concentration of protein A, ng/mL, measured by analysts in | R, % | |
Лаборатория № 1 Laboratory 1 | Лаборатория № 2 Laboratory 2 | ||
0 | 0 | 0 | – |
10 | 9,738 | 11,261 | 116 |
16 | 16,312 | 17,359 | 106 |
20 | 19,485 | 19,351 | 99 |
24 | 23,430 | 23,768 | 101 |
40 | 39,182 | 37,687 | 96 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. R — степень извлечения; «–» — не применимо.
Note. R, recovery; –, not applicable.
Результаты оценки межлабораторной прецизионности удовлетворяли заданным критериям. Таким образом, воспроизводимость методики была подтверждена.
Сравнение разработанной методики c использованием набора реагентов для ИФА на основе реактивов собственного производства (in-house) с коммерческим набором реагентов
Так как разработанная методика соответствовала всем валидационным критериям, на следующем этапе работы была рассмотрена ее пригодность в качестве альтернативы коммерческому набору реагентов Mix-N-Go Protein A Assay.
Проводили параллельное измерение содержания белка А в двух субстанциях (D и E) и их полупродуктах (промежуточные продукты процесса хроматографической очистки), полученных на производстве, с использованием набора реагентов для ИФА на основе реактивов собственного производства (in-house) и коммерческого набора реагентов Mix-N-Go Protein A Assay (табл. 6). Определение содержания белка А в полупродуктах необходимо в рамках характеризации и валидации процесса очистки. Результаты, полученные с помощью набора реагентов для ИФА на основе реактивов собственного производства, находились в пределах 80–120% от значений, полученных с применением коммерческого набора, что указывает на сопоставимость полученных данных и возможность применения разработанной методики для определения содержания белка А не только в субстанции, но и в ее полупродуктах.
Таблица 6. Сравнение разработанной методики определения
остаточного белка А с коммерческим набором реагентов
Table 6. Comparison of the developed analytical procedure
for the determination of residual protein A with a commercial test kit
Испытуемый образец Test sample | Найденное значение концентрации белка А, нг/мл Measured protein A concentration, ng/mL | R, % | CV, % | |
Набор реагентов Mix-N-Go Protein A Assay Mix-N-Go Protein A Assay Kit | Набор реагентов для ИФА на основе реактивов собственного производства (in-house) In-house ELISA test kit | |||
Полупродукт субстанции D № 1 Intermediate substance D1 | 88,873 | 108,951 | 82 | 14 |
Полупродукт субстанции D № 2 Intermediate substance D2 | 69,588 | 76,810 | 91 | 7 |
Полупродукт субстанции D № 3 Intermediate substance D3 | 25,676 | 23,633 | 109 | 6 |
Полупродукт субстанции D № 4 Intermediate substance D4 | 0 | 0 | – | – |
Субстанция D Substance D | 7,923 | 7,989 | 99 | 1 |
Полупродукт субстанции Е № 1 Intermediate substance E1 | 46,639 | 52,061 | 89 | 8 |
Полупродукт субстанции Е № 2 Intermediate substance E2 | 0 | 0 | – | – |
Полупродукт субстанции Е № 3 Intermediate substance E3 | 0 | 0 | – | – |
Субстанция Е Substance E | 0 | 0 | – | – |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. R — степень извлечения; CV — коэффициент вариации; «–» не применимо.
Note. R, recovery; CV, coefficient of variation; –, not applicable.
Выводы
- Разработана методика определения остаточного белка А в фармацевтических субстанциях терапевтических моноклональных антител с использованием набора реагентов для иммуноферментного анализа на основе реактивов собственного производства (in-house). Подобран состав буферных растворов для проведения анализа (буфер для разведения образцов, денатурирующий и нейтрализующий буферы), что позволило решить проблему эффекта матрицы.
- Проведена валидация методики определения остаточного белка А. Установлено, что методика соответствует всем валидационным параметрам: полученные значения при оценке правильности методики находились в пределах 83–108% от номинального, при оценке межлабораторной прецизионности — в пределах 96–116%, при оценке повторяемости — до 13%. Нижний предел количественного определения составил 10 нг/мл, минимально необходимое разведение — 1:10, аналитическая область — 10–40 нг/мл.
- Результаты, полученные с помощью набора реагентов для иммуноферментного анализа с реактивами собственного производства (in-house), сопоставимы с данными, получаемыми при использовании коммерческого набора реагентов иностранного производства. Применение разработанной методики определения остаточного белка А и набора реагентов с реактивами собственного производства позволит решить проблему импортозамещения и снизить затраты на контроль качества российских иммунобиологических препаратов.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.В. Ноздрина — выполнение экспериментальных работ (разработка методики, приготовление модельных образцов, проведение валидационных испытаний, интерпретация результатов исследования, оценка всех валидационных характеристик методики), написание текста рукописи; Д.А. Мазалев — выделение и хроматографическая очистка антител, редактирование текста рукописи; Д.Р. Рогозина — выполнение экспериментальных работ (приготовление модельных образцов, проведение валидационных испытаний); С.П. Живодеров — проведение иммунизации животных; И.В. Лягоскин — разработка концепции исследования, критический пересмотр содержания рукописи; Р.Р. Шукуров — утверждение окончательной версии статьи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. E.V. Nozdrina conducted experiments (developed the analytical procedure, prepared simulated samples, validated the procedure, interpreted the study results (assessed all validation characteristics of the procedure), and drafted the manuscript. D.A. Mazalev performed isolation and chromatographic purification of antibodies and edited the manuscript. D.R. Rogozina conducted experiments (prepared simulated samples and validated the procedure). S.P. Zhivoderov immunised animals. I.V. Lyagoskin conceptualised the study, critically reviewed the manuscript. R.R. Shukurov approved the final version of the manuscript for publication.
Соответствие принципам этики. Протокол исследования с использованием экспериментальных животных был одобрен этическим комитетом ФГБНУ ФИЦВиМ (протокол № 05-23 от 18.07.2023).
Благодарности. Авторы выражают благодарность начальнику лаборатории хроматографических методов И.П. Фабричному за активное участие разработке методики.
Ethics approval. The animal study protocol was approved by the ethics committee at the Federal Research Center for Virology and Microbiology (Protocol No. 05-23 dated 18 July 2023).
Acknowledgements. The authors are grateful to I.P. Fabrichny, Head of the laboratory of chromatographic methods, for active participation in the development of the analytical procedure.
1. Bioanalytical method validation. Guidance for industry. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research, Center for Veterinary Medicine; 2018.
2. ОФС.1.1.0012 Валидация аналитических методик. Государственная фармакопея Российской Федерации. XV изд. Т. 1; 2023.
3. Решение Коллегии Евразийской экономической комиссии № 113 от 17.07.2018 «Об утверждении Руководства по валидации аналитических методик проведения испытаний лекарственных средств».
Список литературы
1. Sanchez-Trasvina C, Flores-Gatica M, Enriquez-Ochoa D, Rito-Palomares M, Mayolo-Deloisa K. Purification of modified therapeutic proteins available on the market: an analysis of chromatography-based strategies. Front Bioeng Biotechnol. 2021;9:717326. https://doi.org/10.3389/fbioe.2021.717326
2. Mazigi O, Schofield P, Langley DB, Christ D. Protein A superantigen: structure, engineering and molecular basis of antibody recognition. Protein Eng Des Sel. 2019;32(8):359–66. https://doi.org/10.1093/protein/gzz026
3. Wilson LJ, Lewis W, Kucia-Tran R, Bracewell DG. Identification and classification of host cell proteins during biopharmaceutical process development. Biotechnol Prog. 2022;38(1):e3224. https://doi.org/10.1002/btpr.3224
4. Choe W, Durgannavar TA, Chung SJ. Fc-binding ligands of immunoglobulin G: an overview of high affinity proteins and peptides. Materials (Basel). 2016;9(12):994. https://doi.org/10.3390/ma9120994
5. Kovacs-Nolan J, Mine Y. Egg yolk antibodies for passive immunity. Annu Rev Food Sci Technol. 2012;3:163–82. https://doi.org/10.1146/annurev-food-022811-101137
6. Pereira EPV, van Tilburg MF, Florean EOPT, Guedes MIF. Egg yolk antibodies (IgY) and their applications in human and veterinary health: a review. Int Immunopharmacol. 2019;73:293–303. https://doi.org/10.1016/j.intimp.2019.05.015
7. Amro WA, Al-Qaisi W, Al-Razem F. Production and purification of IgY antibodies from chicken egg yolk. J Genet Eng Biotechnol. 2018;16(1):99–103. https://doi.org/10.1016/j.jgeb.2017.10.003
8. Steindl F, Armbruster C, Hahn R, Armbruster C, Katinger HWD. A simple method to quantify staphylococcal protein A in the presence of human or animal IgG in various samples. J Immunol Methods. 2000;235(1–2):61–9. https://doi.org/10.1016/S0022-1759(99)00211-2
9. Cruz AR, den Boer MA, Strasser J, Zwarthoff SA, Beurskens FJ, de Haas CJC, et al. Staphylococcal protein A inhibits complement activation by interfering with IgG hexamer formation. Proc Natl Acad Sci USA. 2021;118(7):e2016772118. https://doi.org/10.1073/pnas.2016772118
10. Liu FF, Huang B, Dong X-Y, Sun Y. Molecular basis for the dissociation dynamics of protein A-immunoglobulin G1 complex. PLoS One. 2013;8(6):e66935. https://doi.org/10.1371/journal.pone.0066935
11. Ren D, Darlucio MR, Chou JH. Development of a multi-product leached protein A assay for bioprocess samples containing recombinant human monoclonal antibodies. J Immunol Methods. 2011;366(1–2):20–7. https://doi.org/10.1016/j.jim.2011.02.003
Об авторах
Е. В. НоздринаРоссия
Ноздрина Елена Васильевна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Д. А. Мазалев
Россия
Мазалев Денис Алексеевич
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Д. Р. Рогозина
Россия
Рогозина Дарья Романовна
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
С. П. Живодеров
Россия
Живодеров Сергей Петрович, канд. вет. наук
ул. Академика Бакулова, д. 1, пос. Вольгинский, Петушинский район, Владимирская область, 601125
И. В. Лягоскин
Россия
Лягоскин Иван Владимирович, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Р. Р. Шукуров
Россия
Шукуров Рахим Рахманкулыевич, канд. биол. наук
ул. Владимирская, д. 14, пос. Вольгинский, Петушинский район, Владимирская область, 601125
Дополнительные файлы
Рецензия
Для цитирования:
Ноздрина Е.В., Мазалев Д.А., Рогозина Д.Р., Живодеров С.П., Лягоскин И.В., Шукуров Р.Р. Разработка и валидация методики определения остаточного белка А в фармацевтических субстанциях терапевтических моноклональных антител. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):32-45. https://doi.org/10.30895/2221-996X-2024-24-1-32-45
For citation:
Nozdrina E.V., Mazalev D.A., Rogozina D.R., Zhivoderov S.P., Lyagoskin I.V., Shukurov R.R. Development and validation of an analytical procedure for the determination of residual protein A in active substances of therapeutic monoclonal antibodies. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):32-45. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-32-45


































