Перейти к:
Детекция антилекарственных антител к трастузумабу в сыворотке крови методом иммуноферментного анализа
https://doi.org/10.30895/2221-996X-2025-552
Резюме
ВВЕДЕНИЕ. Трастузумаб — препарат на основе рекомбинантных гуманизированных моноклональных антител к HER2, показан для таргетной терапии HER2+ рака молочной железы. Применение трастузумаба стало рутинной практикой в лечении рака и позволяет повысить общую выживаемость пациенток. Однако в ряде случаев трастузумаб способен вызывать появление антилекарственных антител (АЛА), снижающих эффективность таргетной терапии. По этой причине своевременное выявление АЛА в сыворотке крови необходимо для возможной коррекции терапии.
ЦЕЛЬ. Разработка и валидация методики полуколичественного определения общих АЛА к трастузумабу в биологических жидкостях методом твердофазного иммуноферментного анализа.
МАТЕРИАЛЫ И МЕТОДЫ. Тест-система представлена в виде классического ИФА-набора, в состав которого входят 96-луночный планшет с иммобилизованным на внутренней поверхности лунок трастузумабом, раствор вторичных антител (трастузумаб, конъюгированный с пероксидазой хрена), субстратный раствор (3,3’,5,5’-тетраметилбензидин) и стоп-раствор. Оптическую плотность определяли с помощью планшетного фотометра при длине волны 450 нм. Растворы для контроля качества готовили путем разведения моноклональных антител к трастузумабу в буферном растворе, содержащем сыворотку крови человека.
РЕЗУЛЬТАТЫ. Наименьшая определяемая концентрация АЛА составила 2 нг/мл при 2-кратном значении показателя минимального необходимого разведения. Методика устойчива к наличию 116 нг/мл трастузумаба при уровне 16 нг/мл АЛА и 1000 нг/мл трастузумаба при уровне 100 нг/мл АЛА. Доказана специфичность, селективность и прецизионность методики внутри одной аналитической серии, а также между разными сериями. Вероятность «хук»-эффекта от избыточных концентраций АЛА исключается в диапазоне от 0,16 до 640 нг/мл. Продемонстрирована краткосрочная стабильность АЛА в образцах в течение 6 ч при комнатной температуре, долгосрочная стабильность при хранении образцов при минус 70 °С в течение 90 сут и стабильность при трех циклах замораживания до минус 70 °С (по 12 ч) и оттаивания.
ВЫВОДЫ. Установленные параметры представленной тест-системы свидетельствуют о возможности ее применения для выявления антилекарственных антител к трастузумабу в биологических жидкостях при таргетной терапии.
Ключевые слова
Для цитирования:
Писарев В.В., Иванов А.В. Детекция антилекарственных антител к трастузумабу в сыворотке крови методом иммуноферментного анализа. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):226-238. https://doi.org/10.30895/2221-996X-2025-552
For citation:
Pisarev V.V., Ivanov A.V. Detection of anti-drug antibodies to trastuzumab in serum by enzyme-linked immunosorbent assay. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):226-238. (In Russ.) https://doi.org/10.30895/2221-996X-2025-552
Список сокращений
- СCP (confirmatory cut point) — предел исключения подтверждающего метода;
- CV — коэффициент вариации;
- FSCP (floating screening cut point) — плавающий предел исключения;
- mAb (monoclonal antibody) — моноклональные антитела;
- PSCP (plate-specific cut point) — предел исключения для каждой аналитической серии;
- SCP (screening cut point) — фиксированный предел исключения;
- АЛА — антилекарственные антитела;
- ВПК — верхний положительный контроль;
- ИФА — иммуноферментный анализ;
- КП — коэффициент позитивности;
- МНР — минимальное необходимое разведение;
- НК — негативный контроль (отрицательный контроль);
- НОК — наименьшая определяемая концентрация;
- НПК — нижний положительный контроль;
- ОП — оптическая плотность;
- ПК — положительный контроль;
- РМЖ — рак молочной железы;
- СПК — средний положительный контроль;
- ФСБ — фосфатно-солевой буфер.
ВВЕДЕНИЕ
Рак молочной железы (РМЖ) является наиболее распространенным онкологическим заболеванием у женщин и остается вторым по смертности среди всех онкологических заболеваний, несмотря на достигнутый за последние десятилетия прогресс в его лечении и диагностике. Природа и молекулярные причины возникновения и прогрессии РМЖ достаточно гетерогенны, при этом одним из наиболее неблагоприятных вариантов до конца XX века считался РМЖ, ассоциированный с гиперэкспрессией рецептора эпидермального фактора роста человека типа 2 (HER2). Распространенность HER2-позитивного РМЖ (HER2+ РМЖ) составляет 20–30% от всех случаев РМЖ [1]. HER2 является трансмембранной тирозин-специфичной протеинкиназой и способствует передаче межклеточных сигналов по каскадам PI3K-Akt и RAS-MAPK. В норме на поверхности эпителиальных клеток молочных желез, яичников, печени и почек находится крайне незначительное количество молекул HER2 (около 20 тыс. на клетку). В случаях злокачественного перерождения с участием HER2 на поверхности малигнизированной клетки выявляется до 2 млн молекул HER2 [2]. В результате клетки утрачивают контроль над прохождением клеточного цикла и происходит их неконтролируемая пролиферация. Карциномы с амплификацией гена HER2 (ERBB2) и, как следствие, высокой представленностью рецепторов на поверхности клеток, особенно димеризованных с другими рецепторами семейства HER, характеризуются резистентностью к стандартным режимам цитостатической терапии [3][4]. В результате происходит быстрая генерализация опухолевого процесса.
Долгое время HER2+ РМЖ считался одним из наиболее агрессивных подтипов с неблагоприятным прогнозом. Данную ситуацию переломило появление таргетной терапии, основанной на иммунологическом блокировании молекул HER2 посредством связывания мышиного моноклонального антитела (monoclonal antibody, mAb) 4D5 с внеклеточным доменом HER2. В дальнейшем 95% аминокислотных последовательностей такого антитела (кроме непосредственно антигенсвязывающего участка) были заменены на человеческие, в результате чего был создан первый генно-инженерный препарат для лечения РМЖ — трастузумаб. Трастузумаб блокирует передачу сигнала с внутриклеточного домена HER2 на нижележащие регуляторные каскады. Раковая клетка останавливается в фазе G1 интерфазы, что тормозит неконтролируемую пролиферацию. Трастузумаб подавляет ангиогенез и активирует антителозависимую клеточную цитотоксичность [5] (включает натуральные киллеры, макрофаги, нейтрофилы и эозинофилы), приводящую к общей активации иммунной системы организма.
Подобные свойства трастузумаба позволили продемонстрировать результаты достаточно эффективной терапии HER2+ злокачественных новообразований, особенно в комбинации с классическими химиотерапевтическими агентами, 5-фторурацилом и препаратами платины [6]. Трастузумаб включен ВОЗ в список жизненно необходимых препаратов для лечения HER2+ РМЖ1. Согласно многолетним наблюдениям клиническое применение трастузумаба обладает рядом особенностей [7]. Так как препараты mAb, в том числе трастузумаб, являются чужеродными молекулами белковой природы, их введение в организм человека способно вызвать активацию гуморального иммунитета и секрецию В-лимфоцитами антилекарственных антител (АЛА). Феномен АЛА для терапевтических mAb был обнаружен вскоре после начала применения данного класса препаратов [8][9]. В результате нейтрализации mAb отмечено снижение эффективности их применения, особенно у людей с аутоиммунными заболеваниями и дисфункцией иммунной системы [10]. Применение метода компьютерной симуляции (Simcyp-коррелированный алгоритм Монте-Карло) иммуногенности к белковым препаратам на основе антител показало, что 89% таких препаратов могут вызывать появление АЛА, которые в 49% случаев снижают эффективность применения препарата [11].
АЛА к трастузумабу впервые описаны в исследовании P. Pohlmann с соавт. [12]. Padrón с соавт. [13] отметили, что появление АЛА к трастузумабу сопровождается формированием иммунных комплексов, которые блокируют действие препарата и достаточно быстро выводятся из организма. Данное событие препятствует связыванию трастузумаба с HER2, что приводит к ограничению его фармакологического эффекта.
Частота возникновения АЛА к трастузумабу и его биоаналогам у пациенток с HER2+ РМЖ составляет по разным оценкам от 1 до 1,5% [14][15]. Тем не менее рекомендовано принимать во внимание потенциальную иммуногенность трастузумаба при клиническом применении, так как АЛА могут вызвать серьезные побочные эффекты и/или резистентность к трастузумабу.
Для выявления АЛА к трастузумабу успешно применяется метод иммуноферментного анализа (ИФА). Так, в подходе, предложенном N. Nath с соавт. [16], применен вариант мостикового ИФА (bioluminescent bridging immunoassay) с использованием в качестве репортера целентеразин-зависимой люциферазы NanoLuc с улучшенными характеристиками свечения. Особенностью такого ИФА является двойной антиидиотипический захват АЛА между иммобилизованными на подложке и вторичными мечеными антителами с антителом-мишенью в качестве мостика. В данном случае чувствительность метода достигает 100 нг/мл общих АЛА при 500-кратном избытке свободного препарата в сыворотке крови.
Преимущества метода ИФА для анализа содержания препаратов иммунологической природы в биологических жидкостях человека заключаются в высокой чувствительности и специфичности, а также возможности его рутинного использования в диагностических лабораториях. Это обусловило разработку и появление на рынке значительного количества зарубежных и отечественных тест-систем. Так, для трастузумаба разработаны и валидированы тест-системы на основе ИФА [17][18]. В то же время тест-система для определения АЛА к трастузумабу является принципиально новым биотехнологическим продуктом, позволяющим поставить мониторинг эффективности таргетной терапии РМЖ на качественно новый уровень. Особенно перспективным представляется подход с одновременным измерением концентраций препарата на основе mAb и АЛА к нему в крови пациента.
Цель работы — разработка и валидация методики полуколичественного определения общих АЛА к трастузумабу в биологических жидкостях методом твердофазного иммуноферментного анализа.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Тест-система разработана из отдельных компонентов и представлена в виде классического набора для ИФА. Набор состоит из 96-луночного планшета, покрытого первичными антителами (трастузумаб); раствора вторичных (детектирующих) антител, конъюгированных с пероксидазой хрена; субстратного раствора (3,3’,5,5’-тетраметилбензидин, ТМБ) и стоп-раствора (1М серная кислота, «Химмед», Россия). При постановке варианта теста «с гидролизом» (табл. 1) на стадии пробоподготовки для разведения проб дополнительно используют планшет с поверхностью из несорбирущего полистирола. В состав набора также входит концентрат промывочного буферного раствора, адгезивная пленка и комплект документации (инструкция и паспорт).
Таблица 1. Основные этапы используемых вариантов теста
Table 1. Main stages for test versions
№ этапа Stage No. | Наименование этапа Stage name | Прямой анализ Direct analysis | Анализ с гидролизом Analysis with dissociation |
1 | Подготовка и внесение Sample preparation and plating | В каждую лунку ПСТ вносят по 100 мкл образца (контрольного и исследуемого). Используют дозатор со сменными наконечниками Add 100 µL of sample (control and test) to each well of the PWT. Use pipettes with disposable tips | 1a. В каждую лунку несорбирующего планшета для подготовки вносят по 30 мкл образца и 30 мкл разбавителя 1b. Перемешивают на шейкере в течение 1 мин при 600 об/мин 1c. Добавляют по 120 мкл глицинового буфера 1d. Инкубируют в течение 30 мин при 37 °С на шейкере при 600 об/мин 1e. Вносят по 100 мкл подготовленного образца из каждой лунки в ПСТ 1f. Добавляют по 50 мкл 1М Трис (рН 9,5) 1a. Add 30 µL of sample and 30 µL of diluent to each well of a non-absorbent preparation plate 1b. Shake for 1 min at 600 rpm 1c. Add 120 µL of glycine buffer 1d. Incubate for 30 min at 37 °С with shaking at 600 rpm 1e. Add 100 µL of the prepared sample from each well to the PWT 1f. Add 50 µL of 1M TRIS (pH 9,5) |
2 | Первая инкубация Incubation 1 | Заклеивают пленкой, инкубируют в течение 60 мин при 37 ºС на шейкере при 600 об/мин Cover with film and incubate for 60 min at 37 ºС with shaking at 600 rpm | |
3 | Первая промывка Wash 1 | Удаляют содержимое и трижды промывают промывочным буфером Remove contents and wash three times with wash buffer | |
4 | Вторая инкубация с мечеными антителами Incubation 2, with labelled antibodies | Вносят по 100 мкл рабочего раствора конъюгата, инкубируют в течение 60 мин при 37 ºС на шейкере при 600 об/мин Add 100 µL of conjugate working solution and incubate for 60 min at 37 ºС with shaking at 600 rpm | |
5 | Вторая промывка Wash 2 | Удаляют содержимое и трижды промывают промывочным буфером Remove contents and wash three times with wash buffer | |
6 | Реакция с субстратом ТМБ Reaction with TMB substrate | Вносят по 100 мкл субстратного раствора ТМБ. Инкубируют в течение 15 мин при 37 ºС в темноте Add 100 µL of TMB substrate solution. Incubate for 15 min at 37 °C in the dark | |
7 | Остановка реакции Reaction quenching | Вносят по 100 мкл стоп-раствора Add 100 µL of stop solution | |
8 | Измерение ОП OD measurement | Измеряют ОП на планшетном фотометре при длине волны 450 нм Measure the OD on a microplate photometer at 450 nm | |
9 | Интерпретация результата Result interpretation | Расчет концентрации антилекарственных антител к трастузумабу проводят с использованием программного обеспечения Scanit, Origin Pro, Magellan или подобного Calculate concentrations of anti-drug antibodies to trastuzumab using Scanit, Origin Pro, Magellan, or similar software | |
Таблица составлена авторами / The table is prepared by the authors
Примечание. ПСТ — планшет с трастузумабом; ТМБ — 3,3’,5,5’-тетраметилбензидин; ОП — оптическая плотность.
Note. PWT, plate with trastuzumab; TMB, 3,3’,5,5’-tetramethylbenzidine; OD, optical density.
Образцами для контроля качества служили растворы mAb к трастузумабу НСА177 (Bio-Rad, Великобритания)2 в исходной концентрации 0,5 мг/мл. Образцы положительного контроля (ПК) готовили путем смешивания рабочих растворов HCA177 с предварительно разведенной сывороткой крови. В качестве исходного раствора трастузумаба использовали медицинский препарат Герцептин (Герцептин®, F.Hoffmann-La Roche, Швейцария) в концентрации 15 мг/мл. Для оценки селективности методики использовали исходный раствор пертузумаба (Перьета®, Roche Diagnostics, Германия) в концентрации 30 мг/мл.
Образцы сыворотки крови человека, использованные для приготовления образцов для контроля качества и бланковых сывороток, были предоставлены для научных исследований ГКУЗ Тверской области «Станция переливания крови» Министерства здравоохранения Тверской области.
Оборудование
Оптическую плотность (ОП) образцов (далее — отклик образцов) измеряли с помощью планшетного фотометра Multiskan FC (Thermo Scientific, США) при длине волны 450 нм.
В работе использовали центрифугу MiniSpin (Eppendorf, Германия), термошейкер PST-60HL (BioSan, Латвия), дозаторы объемами 0,5–10, 2–20 и 10–200 мкл, автоматический промыватель планшетов HydroFlex (Tecan, Швейцария), холодильную камеру +2–8 °С (Polair, Россия) и морозильную камеру (Liebherr, Германия).
Методы
Для проведения иммуноферментного анализа готовили следующие стандартные растворы:
1) промывочный буферный раствор — 0,01 М фосфатно-солевой буфер, ФСБ (pH 7,4±0,2), содержащий 0,025% Твин-20 (Sigma-Aldrich, США);
2) разбавитель, содержащий 0,1% бычьего сывороточного альбумина и 0,1% Твин-20 в ФСБ;
3) раствор вторичных (детектирующих) антител — конъюгат трастузумаба с пероксидазой хрена («НПЦ Пробиотек», Россия) в разбавителе в разведении 1:33000 (разведение осуществляли в 2 этапа: сначала к 20 мкл раствора конъюгата трастузумаба с пероксидазой в глицерине добавляли 980 мкл разбавителя, затем 36 мкл полученного раствора разводили в 12 мл разбавителя);
4) стоп-раствор, содержащий 1 М серную кислоту;
5) глициновый буфер для гидролиза, содержащий 0,2 М глицина (Alfa Aesar, Германия);
6) 1 М Трис pH 9,5 (Panreac, Испания).
Проведение теста возможно в двух вариантах методической реализации: прямой анализ и модифицированный анализ с диссоциацией (далее — анализ с гидролизом). Модифицированный анализ применяли для повышения толерантности к трастузумабу, для чего использовали кислотный гидролиз комплексов АЛА-трастузумаб с последующей частичной ассоциацией АЛА с трастузумабом, сорбированным на поверхности планшета. Для скринингового анализа целесообразно использовать прямой анализ, а для подтверждения — анализ с гидролизом. Основные этапы двух вариантов теста представлены в таблице 1.
Статистическая обработка данных. Выбор параметров валидации методики, включая все формулы вычисления пределов исключения, проводили согласно международному протоколу гармонизации исследований антилекарственных антител [19]. Для определения предела исключения и обнаружения выбросов применяли фильтрацию грубых промахов методом Тьюки3 внутри каждого индивидуального планшета. В случае вычисления скринингового предела исключения выбран плавающий предел исключения (FSCP), рассчитанный как разность между фиксированным пределом исключения (SCP), определенным в ходе данного теста, и средним значением аналитического сигнала негативного контроля (СрЗнач(НК)) между всеми группами по формуле (1):
FSCP = SCP – СрЗнач(НК). (1)
Фиксированный предел исключения для скринингового анализа определяли как 95-й процентиль откликов образцов, не содержащих антител к препарату из всех групп.
Предел исключения для каждой аналитической серии (PSCP) вычисляли как сумму плавающего предела исключения (FSCP) и среднего значения аналитического сигнала образца НК (СрЗнач(НК)) в этой серии по формуле (2):
PSCP = FSCP – СрЗнач(НК). (2)
Для вычисления предела исключения подтверждающего анализа определяли относительное ингибирование сигнала (далее — гашение сигнала) через отношение отклика образцов, содержащих избыток препарата (образцы «с гашением»), к отклику нативных образцов без добавления препарата по формуле (3):
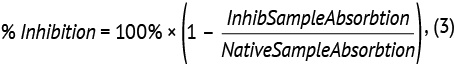
где % Inhibition — относительное ингибирование сигнала; Inhib Sample Absorbtion — отклик образцов, содержащих избыток препарата; Native Sample Absorbtion — отклик нативных образцов без добавления препарата.
Коэффициент позитивности (КП) рассчитывали по формуле (4):
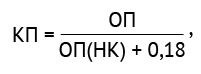 (4)
(4)
где ОП — оптическая плотность пробы; ОП(НК) — оптическая плотность образца негативного контроля.
Для расчета оптической плотности (ОП) образцов применяли программное обеспечение Scanit для Microplate Reader v. 5.0 (Bio-Rad, Великобритания).
Для расчетов использовали программу Excel 2010 (Microsoft, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно международным требованиям по валидации аналитических методик4, рекомендациям G. Shankar с соавт. [20] и протоколу H. Myler с соавт. [19], настоящее исследование состояло из следующих этапов: определение наименьшей определяемой концентрации (НОК); минимального необходимого разведения (МНР); влияния препарата; предела исключения скринингового метода; предела исключения подтверждающего метода; определение специфичности, селективности, прецизионности, «хук»-эффекта; краткосрочной и долгосрочной стабильности, а также стабильности при замораживании-оттаивании.
Тест-система представляет собой набор реактивов для полуколичественного выявления АЛА к трастузумабу оригинальной компоновки. Данный метод предусматривает вычисление отношения ОП экспериментальной пробы к определенному пороговому значению и вычисление КП. Исследование образцов включает следующие этапы.
- Проведение скринингового анализа. Если величина ОП образца не превышает PSCP, образец признается отрицательным по наличию АЛА, в остальных случаях проводят подтверждающий анализ.
- Проведение подтверждающего анализа. Если величина ОП образца при выполнении скрининга превышает PSCP, то вычисляют величину предела исключения подтверждающего метода (confirmatory cut point, ССР). В случае если относительное ингибирование сигнала образца не превышает величину CCP, образец также признается отрицательным по наличию АЛА. Если относительное ингибирование сигнала образца превосходит величину CCP, образец признается положительным по наличию АЛА.
Определение наименьшей определяемой концентрации
Наименьшую определяемую концентрацию (НОК) в буферном растворе вычисляли через соотношение отклика образца положительного контроля (ПК) различной концентрации к отклику образца, содержащего чистый разбавитель. Стоковый раствор HCA177 (1000 нг/мл) разводили до тех пор, пока среднее значение отклика образца, содержащего HCA177, не стало превышать значение отклика образца, содержащего чистый буферный раствор, ≥2 раза. Эксперименты проводили путем снижения концентраций в два этапа: первоначально с 1000 до 1,95 нг/мл и затем с 31,25 до 0,24 нг/мл. В результате значение НОК составило 2 нг/мл. В дальнейшем при проведении тестов на минимальное необходимое разведение и толерантность к препарату значение НОК (2 нг/мл) было подтверждено как в прямом анализе, так и в анализе с гидролизом.
Определение минимального необходимого разведения
Для определения минимального необходимого разведения (МНР) проанализировали образцы ПК, содержащие mAb в концентрациях от 0,5 до 125 нг/мл и разведенную в 2, 4 и 8 раз матрицу (цельная сыворотка крови, содержащая множество искажающих отклик компонентов). Критерием оценки служило ≥2-кратное превышение отношения значений ОП образцов ПК и НК (ПК/НК). Результаты измерений образцов, содержащих разные концентрации mAb, представлены в таблице S15 (дополнительная информация).
Таким образом, по результатам теста значение МНР составило «2 раза», при этом было подтверждено, что концентрация антител 2 нг/мл соответствовала значению НОК. По сравнению с работой P. Pohlmann с соавт. [12], в которой значение МНР составило «10 раз», в представленной тест-системе достигнуты гораздо лучшие показатели. Вероятной причиной является использование препарата антител HCA177, отсутствовавшего при первом описании АЛА к трастузумабу [12]. В ходе определения МНР установление значения НОК повторяли с использованием образцов ПК и НК, приготовленных из сыворотки крови с учетом МНР.
Оценка влияния лекарственного препарата на выявление АЛА
Поскольку антитела к трастузумабу, как правило, продолжают проявлять активность in vitro, необходимо принимать во внимание возможность получения ложноотрицательных результатов из-за нейтрализации активных центров антител свободными молекулами трастузумаба. Оценку влияния эффекта присутствия трастузумаба на возможность определения концентраций АЛА к нему выполняли по двум направлениям: определяли минимальную подавляющую концентрацию (МПК) и абсолютную подавляющую концентрацию (АПК).
Показатель МПК характеризует такую концентрацию лекарственного препарата в сыворотке крови, при которой определение АЛА к нему технически затруднено, так как сложно определить разницу между изначально пограничным уровнем аналитического сигнала АЛА и его подавлением ввиду наличия трастузумаба в концентрации выше АПК. Были проанализированы образцы ПК, содержащие АЛА в концентрациях от 100 до 4000 нг/мл и трастузумаб в концентрациях 100, 200, 500 и 1000 нг/мл. Данный диапазон концентраций включает ожидаемые концентрации трастузумаба в образцах сыворотки крови добровольцев при достижении максимального терапевтического эффекта препарата, когда появление АЛА наиболее вероятно. Критерием приемлемости служил отклик образца, содержавшего 4000 нг/мл HCA177, с добавлением искомой концентрации трастузумаба ниже величины 95-го процентиля откликов образцов НК в той же серии. По результатам тестов определили, что методика устойчива к влиянию 116 нг/мл трастузумаба при уровне 16 нг/мл АЛА, а также устойчива к влиянию 1000 нг/мл трастузумаба при уровне 100 нг/мл АЛА. В качестве АПК выбрали 10 мкг/мл трастузумаба, что в 10 раз превышает его максимальную концентрацию, изученную в исследовании.
Расчет предела исключения
Было установлено, что значение показателя FSCP соответствовало 0,0028 единиц ОП. Предел исключения подтверждающего анализа был определен как 99-й процентиль всех значений относительного ингибирования отклика образцов, не содержащих антител к препарату. Таким образом, значение показателя CCP составило 6,66%.
Оценка специфичности методики
Специфичность — возможность аналитической методики однозначно выявлять анализируемое вещество в присутствии сопутствующих компонентов, даже близкого химического состава. Для проверки специфичности методики проанализировали 4 образца: образец НК (не содержал АЛА) и 3 образца ПК, содержавших различные концентрации HCA177, сыворотку крови и 100 мкг/мл пертузумаба (гуманизированное mAb к HER2 с аналогичными трастузумабу параметрами). Концентрации АЛА к трастузумабу в образцах ПК распределяли следующим образом: нижний положительный контроль (НПК) соответствовал двум значениям НОК (2×НОК), или 4 нг/мл; средний положительный контроль (СПК) — 16×НОК, или 32 мг/мл; верхний положительный контроль (ВПК) — 32×НОК, или 64 нг/мл. Всего выполнили 12 измерений образцов НК и 24 измерения 3 образцов ПК; для каждой измеренной концентрации АЛА в образцах вычисляли среднее значение ОП. Результаты измерений отклика образцов без добавления и с добавлением пертузумаба представлены в таблице S26 (дополнительная информация).
Для оценки специфичности методики применяли следующие критерии приемлемости: не менее 5 из 6 измерений индивидуальных образцов ПК оказались положительными при сравнении как со скрининговым, так и с подтверждающим пределом исключения, а все образцы НК были отрицательными при сравнении с подтверждающим пределом исключения. Согласно результатам проведенной оценки (табл. S2) (дополнительная информация) специфичность методики была доказана.
Оценка селективности методики
Селективность — характеристика методики, с помощью которой можно оценить стабильность аналитического сигнала исследуемого вещества при анализе различных источников, включая источники, содержащие помехи. Для оценки селективности методики применяли следующие критерии приемлемости: 1) не менее 80% индивидуальных бланковых образцов сыворотки крови имели отклик ниже скринингового предела исключения; 2) не менее 80% образцов ПК демонстрировали среднее значение отклика выше или равное скрининговому пределу исключения при значении коэффициента вариации (coefficient of variation, CV) <20% между повторностями; 3) не менее 80% образцов ПК, приготовленных с использованием индивидуальных бланковых образцов сыворотки крови, характеризовались значением CV<20% между повторностями (для значения относительного ингибирования). Всего было проанализировано влияние 12 различных источников матрицы и образцы ПК, содержащие 2 разные концентрации АЛА к трастузумабу — НПК (4 нг/мл) и ВПК (64 нг/мл). Согласно результатам проведенной оценки методика соответствовала всем критериям приемлемости (табл. S3)7 (дополнительная информация) и была признана селективной.
Определение прецизионности внутри одной аналитической серии
Прецизионность методики внутри одной аналитической серии оценивали на основании анализа образцов ПК, содержащих три концентрации АЛА к трастузумабу: НПК (4 нг/мл), СПК (32 нг/мл) и ВПК (64 нг/мл). Всего исследовали 6 наборов образцов ПК «без гашения» (12 независимых повторов) и 3 набора образцов ПК «с гашением» (6 независимых повторов). Полученные результаты представлены в таблице 2. Прецизионность методики была доказана, так как результаты оценки удовлетворяли всем критериям приемлемости: значения CV<20% — для показателей ОП образцов каждого уровня ПК (НПК, СПК и ВПК) и НК; значения CV<20% — для показателей относительного ингибирования к каждому уровню образцов ПК; более чем 4 из 6 образцов ПК каждого уровня демонстрировали отклик, превышающий скрининговый предел исключения; значения отклика образца НПК были меньше отклика образца ВПК во всех случаях; не менее 2 из 3 образцов ПК каждого уровня «с гашением» демонстрировали значения относительного ингибирования, превышающие подтверждающий предел исключения.
Таблица 2. Результаты оценки прецизионности внутри одной аналитической серии
Table 2. Validation results for within-run precision
Тип образца Sample type | ВПК HPC | СПК MPC | НПК LPC | НК NC |
Без гашения / Without competitive signal inhibition | ||||
Среднее значение ОП / Mean OD | 0,755 | 0,406 | 0,091 | 0,046 |
Коэффициент вариации, % / CV, % | 11,56 | 17,11 | 17,64 | 2,86 |
Всего образцов / Total number of samples | 6 | 6 | 6 | 9 |
Положительных / Positive | 6 | 6 | 6 | 0 |
С гашением / With competitive signal inhibition | ||||
Среднее значение коэффициента ингибирования, % Mean inhibition coefficient, % | 93,0 | 85,4 | 38,1 | Не применимо Not applicable |
Коэффициент вариации, % / CV, % | 0,73 | 2,10 | 8,66 | |
Всего образцов / Total number of samples | 3 | 3 | 3 | |
Положительных / Positive | 3 | 3 | 3 | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. НК — негативный контроль; ВПК — верхний положительный контроль; СПК — средний положительный контроль; НПК — нижний положительный контроль, ОП — оптическая плотность.
Note. NC, negative control; HPC, high positive control; MPC, medium positive control; LPC, low positive control; OD, optical density; CV, coefficient of variation.
Определение прецизионности между аналитическими сериями
Прецизионность методики между аналитическими сериями оценивали на основании анализа образцов НК и ПК (НПК, СПК и ВПК). Для оценки использовали результаты, полученные в ходе определения предела исключения: значения ОП и значения относительного ингибирования для образцов «с гашением» сигнала. Всего проанализировали 36 образцов ПК «без гашения» и 18 образцов «с гашением» в 6 аналитических сериях. Согласно полученным результатам, представленным в таблице 3, методика соответствовала критерию приемлемости, так как CV значений ОП между аналитическими сериями были <20% для каждого уровня образцов ПК.
Таблица 3. Результаты оценки прецизионности между аналитическими сериями
Table 3. Validation results for between-run precision
Тип образца Sample type | ВПК HPC | СПК MPC | НПК LPC | НК NC |
Без гашения / Without competitive signal inhibition | ||||
Среднее значение ОП / Mean OD | 0,782 | 0,432 | 0,092 | 0,046 |
Коэффициент вариации, % / CV, % | 17,65 | 17,15 | 13,37 | 3,43 |
Всего образцов / Total number of samples | 36 | 36 | 36 | 9 |
Положительных / Positive | 36 | 36 | 36 | 0 |
С гашением / With competitive signal inhibition | ||||
Среднее значение коэффициента ингибирования, % Mean inhibition coefficient, % | 94,09 | 88,89 | 47,03 | Не применимо Not applicable |
Коэффициент вариации, % / CV, % | 0,84 | 2,14 | 7,23 | |
Всего образцов / Total number of samples | 18 | 18 | 18 | |
Положительных / Positive | 18 | 18 | 18 | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. НК — негативный контроль; ВПК — верхний положительный контроль; СПК — средний положительный контроль; НПК — нижний положительный контроль; ОП — оптическая плотность.
Note. NC, negative control; HPC, high positive control; MPC, medium positive control; LPC, low positive control; OD, optical density; CV, coefficient of variation.
Оценка «хук»-эффекта
Термин «хук»-эффект (от англ. hook effect, проагглютинационная зона) следует понимать как отсутствие повышения уровня детектируемого сигнала при увеличении концентрации аналита. Для проверки возможности ингибирования отклика образцов, содержащих избыток АЛА к трастузумабу, проанализировали серию образцов, содержащих последовательные двукратные разведения АЛА с 640 до 0,16 нг/мл. Полученные значения ОП и интерпретированные результаты представлены в таблице S48 (дополнительная информация). Результаты проведенной оценки удовлетворяют критерию приемлемости, согласно которому отклик каждого полученного образца должен превышать величину скринингового предела исключения вплоть до уровня НОК.
Оценка стабильности методики
В ходе валидации методики оценивали краткосрочную и долгосрочную стабильность, а также стабильность при замораживании-оттаивании. Для оценки краткосрочной стабильности проанализировали три образца ПК (НПК, СПК и ВПК), хранившиеся при комнатной температуре в течение 6 ч. Исследования проводили в составе аналитической серии, включающей образцы НК, бланковой матрицы для приготовления всех образцов ПК и свежеприготовленных образцов ПК как «без гашения», так и «с гашением». Для оценки долгосрочной стабильности исследовали три размороженных образца НПК, СПК и ВПК, хранившиеся при температуре минус 70 °С в течение 90 сут. После размораживания все образцы проанализировали в составе аналитической серии со свежеприготовленными аналогичными образцами, образцами НК и бланковой матрицы как «без гашения», так и «с гашением».
Аналогичные условия измерений и состав аналитической серии использовали для оценки стабильности при замораживании-оттаивании. Экспериментальные образцы подвергали трехкратному циклу замораживания-оттаивания до минус 70 °С и хранению в течение 12 ч. Во всех случаях рассчитывали PSCP и подтверждали пригодность аналитических циклов. Результаты экспериментов по оценке стабильности представлены в таблице 4.
Таблица 4. Результаты тестов на краткосрочную и долгосрочную стабильность, а также стабильность при замораживании-оттаивании
Table 4. Results of short-term, long-term and freeze–thaw stability tests
Образец Sample | Среднее значение ОП Mean OD | Коэффициент вариации, % CV, % | Среднее ингибирование, % Mean inhibition, % |
Краткосрочная стабильность / Short-term stability | |||
НПК / LPC | 0,12 | 0,003 | 69,24 |
ExНПК / ExLPC | 0,047 | 0,001 | |
СПК / MPC | 0,669 | 0,006 | 92,93 |
ExСПК / ExMPC | 0,047 | 0,001 | |
ВПК / HPC | 1,163 | 0,097 | 95,76 |
ExВПК / ExHPC | 0,049 | 0,001 | |
Долгосрочная стабильность / Long-term stability | |||
НПК / LPC | 0,149 | 0,003 | 96,88 |
ExНПК / ExLPC | 0,049 | 0,0002 | |
СПК / MPC | 0,856 | 0,039 | 66,98 |
ExСПК / ExMPC | 0,049 | 0,0003 | |
ВПК / HPC | 1,511 | 0,043 | 94,31 |
ExВПК / ExHPC | 0,049 | 0,001 | |
Стабильность при замораживании-оттаивании / Freeze–thaw stability | |||
НПК / LPC | 0,132 | 0,006 | 68,89 |
ExНПК / ExLPC | 0,049 | 0,002 | |
СПК / MPC | 0,76 | 0,081 | 93,16 |
ExСПК / ExMPC | 0,048 | 0,001 | |
ВПК / HPC | 1,231 | 0,037 | 96,01 |
ExВПК / ExHPC | 0,049 | 0,001 | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Ex — обозначение образца «с гашением»; НК — негативный контроль; ВПК — верхний положительный контроль; СПК — средний положительный контроль; НПК — нижний положительный контроль; ОП — оптическая плотность.
Note. Ex, samples with an excess of trastuzumab for competitive signal inhibition; NC, negative control; HPC, high positive control; MPC, medium positive control; LPC, low positive control; OD, optical density; CV, coefficient of variation.
Во всех случаях исследованные образцы признаны стабильными, так как средний отклик образцов ПК (НПК, СПК и ВПК) превышал величину скринингового предела исключения как минимум на 66,7% для каждого уровня, а значения CV между повторностями при анализе всех уровней образцов ПК были <20% (критерий приемлемости). Лишь в одном измерении из девяти (СПК при замораживании-оттаивании, 11,1%) образец не соответствовал критерию приемлемости по вариабельности между повторностями (табл. 5).
Таблица 5. Результаты исследования стабильности (хранение образцов при минус 70 °С и 3 циклах замораживания-оттаивания)
Table 5. Stability study results (storage at –70 °C and three freeze–thaw cycles)
Образец Sample | Среднее значение ОП Mean OD | Ингибирование, % Inhibition,% | Сравнение с SCP Compared with SCP | Сравнение с CCP Compared with CCP |
FT70 LPC | 0,1339 | 64,68 | POS | POS |
FT70 ExLPC | 0,0473 | NEG | ||
FT70 MPC | 0,7025 | 93,30 | POS | POS |
FT70 ExMPC | 0,0471 | NEG | ||
FT70 HPC | 1,2411 | 96,00 | POS | POS |
FT70 ExHPC | 0,0496 | NEG | ||
FT70 LPC | 0,1257 | 60,06 | POS | POS |
FT70 ExLPC | 0,0502 | NEG | ||
FT70 MPC | EXL | 92,10 | EXL | EXL |
FT70 ExMPC | 0,0495 | NEG | ||
FT70 HPC | 1,2615 | 96,13 | POS | POS |
FT70 ExHPC | 0,0488 | NEG | ||
FT70 LPC | 0,1372 | 63,92 | POS | POS |
FT70 ExLPC | 0,0495 | NEG | ||
FT70 MPC | 0,8171 | 94,09 | POS | POS |
FT70 ExMPC | 0,0483 | NEG | ||
FT70 HPC | 1,1904 | 95,90 | POS | POS |
FT70 ExHPC | 0,0488 | NEG | ||
Всего образцов Total number of samples | НПК / LPC | 3 | Из них пригодны Number of acceptable samples | 3 |
СПК / MPC | 3 | 2 | ||
ВПК / HPC | 3 | 3 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. POS — образец признан положительным при сравнении с данным пределом исключения; NEG — образец признан отрицательным при сравнении с данным пределом исключения; EXL — образец не соответствует критерию приемлемости по вариабельности между повторностями; FT70 — образец для исследования стабильности при замораживании-оттаивании; НПК — нижний положительный контроль; СПК — средний положительный контроль; ВПК — верхний положительный контроль; Ex — обозначение образца «с гашением»; ОП — оптическая плотность; SCP — фиксированный предел исключения; CCP — предел исключения подтверждающего метода.
Note. POS, positive sample relative to the above exclusion limit; NEG, negative sample relative to the above exclusion limit; EXL, sample non-compliant with the acceptance criterion for variability between replicates; FT70, freeze–thaw stability sample; LPC, low positive control; MPC, medium positive control; HPC, high positive control; Ex, sample with an excess of trastuzumab for competitive signal inhibition; OD, optical density; SCP, screening cut point; CCP, confirmatory cut point.
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования валидирована методика полуколичественного определения антилекарственных антител к трастузумабу в образцах сыворотки крови методом твердофазного иммуноферментного анализа.
Полученные валидационные параметры представленной тест-системы свидетельствуют в пользу ее практической применимости для оценки наличия антилекарственных антител к трастузумабу в образцах сыворотки крови пациентов, получающих таргетные препараты в сочетании с химиотерапией.
Дополнительная информация. Дополнительные материалы к статье размещены в репозитории Mendeley Data и доступны по ссылке
https://data.mendeley.com/datasets/fvfp4htspn/2
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: В.В. Писарев — разработка концепции исследования, проведение экспериментов и общее руководство; А.В. Иванов — обработка данных и написание текста рукописи.
Additional information. Supplementary materials for this article are available in the Mendeley Data repository and can be accessed at
https://data.mendeley.com/datasets/fvfp4htspn/2
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. V.V. Pisarev conceptualised the study, conducted the experiments, and provided general supervision. A.V. Ivanov processed the data and drafted the manuscript.
1. Model list of essential medicines. 21st List. WHO; 2019.
2. https://images.bio-rad-antibodies.com/datasheets/datasheet-HCA177.pdf
3. https://www.itl.nist.gov/div898/handbook/prc/section4/prc471.htm
4. Guideline on bioanalytical method validation. EMA; 2011.
Immunogenicity assessment for therapeutic protein products. FDA; 2014.
Решение Совета ЕЭК от 03.11.2016 №89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
5. https://data.mendeley.com/datasets/fvfp4htspn/2
6. https://data.mendeley.com/datasets/fvfp4htspn/2
7. Там же.
8. https://data.mendeley.com/datasets/fvfp4htspn/2
Список литературы
1. Harbeck N, Gnant M. Breast cancer. Lancet. 2017;389(10074):1134–50. https://doi.org/10.1016/s0140-6736(16)31891-8
2. Xiao Y, Ding J, Ma D, Chen S, Li X, Yu K. Predicting pathological complete response in neoadjuvant dual blockade with trastuzumab and pertuzumab in HER2 gene amplified breast cancer. Front Immunol. 2022;13:877825. https://doi.org/10.3389/fimmu.2022.877825
3. Schlam I, Tarantino P, Tolaney SM. Overcoming resistance to HER2-directed therapies in breast cancer. Cancers (Basel). 2022;14(16):3996. https://doi.org/10.3390/cancers14163996
4. Pernas S, Tolaney SM. HER2-positive breast cancer: new therapeutic frontiers and overcoming resistance. Ther Adv Med Oncol. 2019;11:1758835919833519. https://doi.org/10.1177/1758835919833519
5. Pereira N, Chan K, Lin P, Song Z. The “less-is-more” in therapeutic antibodies: Afucosylated anti-cancer antibodies with enhanced antibody-dependent cellular cytotoxicity. MAbs. 2018;10(5):693–711. https://doi.org/10.1080/19420862.2018.1466767
6. Nader-Marta G, Martins-Branco D, de Azambuja E. How we treat patients with metastatic HER2-positive breast cancer. ESMO Open. 2022;7(1):100343. https://doi.org/10.1016/j.esmoop.2021.100343
7. Derakhshani A, Rezaei Z, Safarpour H, Sabri M, Mir A, Sanati M, et al. Overcoming trastuzumab resistance in HER2-positive breast cancer using combination therapy. J Cell Physiol. 2020;235(4):3142–56. https://doi.org/10.1002/jcp.29216
8. Baert F, Noman M, Vermeire S, Van Assche G, D’Haens G, Carbonez A, Rutgeerts P. Influence of immunogenicity on the long-term efficacy of infliximab in Crohn’s disease. N Engl J Med. 2003;348(7):601–8. https://doi.org/10.1056/nejmoa020888
9. Bartelds G, Krieckaert C, Nurmohamed M, van Schouwenburg P, Lems W, Twisk J, et al. Development of antidrug antibodies against adalimumab and association with disease activity and treatment failure during long-term follow-up. JAMA. 2011;305(14):1460–8. https://doi.org/10.1001/jama.2011.406
10. van Schouwenburg P, van de Stadt L, de Jong R, van Buren E, Kruithof S, de Groot E, et al. Adalimumab elicits a restricted anti-idiotypic antibody response in autoimmune patients resulting in functional neutralisation. Ann Rheum Dis. 2013;72(1):104–9. https://doi.org/10.1136/annrheumdis-2012-201445
11. Kierzek A, Hickling T, Figueroa I, Kalvass J, Nijsen M, Mohan K, et al. A quantitative systems pharmacology consortium approach to managing immunogenicity of therapeutic proteins. CPT Pharmacometrics Syst Pharmacol. 2019;8(11):773–6. https://doi.org/10.1002/psp4.12465
12. Pohlmann P, Miller T, Blum D, Pareh D, Yan H, Sutton C, et al. Trastuzumab-reactive antibodies in serum and trastuzumab benefit prediction in patients with HER2-overexpressing breast cancer. J Clin Oncol. 2012;30(30 suppl):77. https://doi.org/10.1200/jco.2012.30.30_suppl.77
13. Padrón I, García J, Díaz R, Lenza I, Nicolás F. Anti-drug antibodies anti-trastuzumab in the treatment of breast cancer. J Oncol Pharm Pract. 2021;27(6):1354–6. https://doi.org/10.1177/1078155220953873
14. Pivot X, Bondarenko I, Nowecki Z, Dvorkin M, Trishkina E, Ahn J, et al. A phase III study comparing SB3 (a proposed trastuzumab biosimilar) and trastuzumab reference product in HER2-positive early breast cancer treated with neoadjuvant-adjuvant treatment: final safety, immunogenicity and survival results. Eur J Cancer. 2018;93:19–27. https://doi.org/10.1016/j.ejca.2018.01.072
15. Kilany L, Gaber A, Aboulwafa M, Zedan H. Trastuzumab immunogenicity development in patients’ sera and in laboratory animals. BMC Immunol. 2021;22(1):15. https://doi.org/10.1186/s12865-021-00405-z
16. Nath N, Godat B, Flemming R, Urh M. Bioluminescent bridging immunoassay for anti-drug antibody (ADA) detection. Methods Mol Biol. 2022;2313:313–22. https://doi.org/10.1007/978-1-0716-1450-1_20
17. Елисеева ОА, Колганова МА, Шохин ИЕ, Дементьев СП, Власов АМ, Замятнин АА и др. Разработка и валидация методики определения антител к трастузумабу в сыворотке крови человека методом иммуноферментного анализа. Разработка и регистрация лекарственных средств. 2022;11(4):120–7. https://doi.org/10.33380/2305-2066-2022-11-4(1)-120-127
18. Писарев ВВ, Иванов АВ. Валидация тест-системы для количественного определения концентрации трастузумаба (Герцептин, Гертикад) в биологических жидкостях методом твердофазного иммуноферментного анализа. Фармакокинетика и фармакодинамика. 2023;(1):58–64. https://doi.org/10.37489/2587-7836-2023-1-58-64
19. Myler H, Pedras-Vasconcelos J, Phillips K, Hottenstein CS, Chamberlain P, Devanaryan V, et al. Anti-drug antibody validation testing and reporting harmonization. AAPS J. 2021;24(1):4. https://doi.org/10.1208/s12248-021-00649-y
20. Shankar G, Devanarayan V, Amaravadi L, Barrett Y, Bowsher R, Finco-Kent D, et al. Recommendations for the validation of immunoassays used for detection of host antibodies against biotechnology products. J Pharm Biomed Anal. 2008;48(5):1267–81. https://doi.org/10.1016/j.jpba.2008.09.020
Об авторах
В. В. ПисаревРоссия
Писарев Владимир Викторович, канд. хим. наук
ул. 5-я Кабельная, д. 2-Б, стр. 1, Москва, 111024
А. В. Иванов
Россия
Иванов Андрей Владимирович, канд. биол. наук
ул. 5-я Кабельная, д. 2-Б, стр. 1, Москва, 111024
Дополнительные файлы
Рецензия
Для цитирования:
Писарев В.В., Иванов А.В. Детекция антилекарственных антител к трастузумабу в сыворотке крови методом иммуноферментного анализа. БИОпрепараты. Профилактика, диагностика, лечение. 2025;25(2):226-238. https://doi.org/10.30895/2221-996X-2025-552
For citation:
Pisarev V.V., Ivanov A.V. Detection of anti-drug antibodies to trastuzumab in serum by enzyme-linked immunosorbent assay. Biological Products. Prevention, Diagnosis, Treatment. 2025;25(2):226-238. (In Russ.) https://doi.org/10.30895/2221-996X-2025-552
JATS XML



































