Перейти к:
Разработка стандартного образца пустых капсидов рекомбинантного аденоассоциированного вируса для контроля качества препаратов генной терапии
https://doi.org/10.30895/2221-996X-2024-24-2-200-214
Резюме
ВВЕДЕНИЕ. При фармацевтической разработке российских препаратов генной терапии на основе аденоассоциированных вирусов (AAV) необходимым этапом является создание стандартных образцов (СО), которые используются на протяжении всего цикла разработки препарата, а также установление стабильности СО при хранении. В качестве материала для СО AAV 9 серотипа (AAV9) может выступать препарат пустых капсидов AAV9.
ЦЕЛЬ. Разработка методик оценки физико-химических показателей качества для характеристики стандартного образца пустых капсидов AAV9 и исследование его стабильности при хранении.
МАТЕРИАЛЫ И МЕТОДЫ. Наработку СО пустых капсидов AAV9 проводили в суспензионных клетках HEK293 с использованием бессывороточной среды при оптимизированных параметрах трансфекции с последующим осветлением, концентрированием, хроматографической очисткой AAV9 на аффинном сорбенте (AAVX) и диафильтрацией. Для анализа образцов применяли электрофорез, трансмиссионную электронную микроскопию, иммуноферментный анализ (ИФА), эксклюзионную хроматографию, динамическое светорассеяние, спектрофотометрию и биослойную интерферометрию. Определение концентрации капсидов проводили методом ИФА. Для разработки методов оценки физического титра использовали СО AAV с известным титром. При исследовании стабильности СО хранили при –80 °C в течение 9 мес.
РЕЗУЛЬТАТЫ. Наработанный СО AAV9 обладал высокой степенью чистоты по результатам эксклюзионной хроматографии — содержание мономеров вирусных капсидов составляло не менее 98%. С использованием методов динамического светорассеяния, эксклюзионной хроматографии и электронной микроскопии показано отсутствие агрегатов в образце. Установлена стабильность полученного СО пустых капсидов AAV9 в течение 9 мес. Показано, что при определении физического титра СО пустых капсидов AAV9 оптимальными для рутинного анализа качества являются методы динамического рассеяния света и спектрофотометрии; метод биослойной интерферометрии рекомендуется для регулярного анализа. Определенные тремя указанными методами значения титра вирусных частиц варьировали от 1,48×10¹³ до 5,6×10¹³.
ВЫВОДЫ. Разработан стандартный образец пустых капсидов AAV9, который может быть пригоден для контроля качества препаратов генной терапии на основе AAV9.
Ключевые слова
Для цитирования:
Тумаев А.В., Волошин Д.Ю., Бердинских Е.С., Сахибгараева Е.Л., Головин Е.В., Субчева Е.Н., Васильева О.О., Галиева А.А., Чувашов А.А., Новикова Е.С., Карабельский А.В. Разработка стандартного образца пустых капсидов рекомбинантного аденоассоциированного вируса для контроля качества препаратов генной терапии. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(2):200-214. https://doi.org/10.30895/2221-996X-2024-24-2-200-214
For citation:
Tumaev A.V., Voloshin D.Yu., Berdinskikh E.S., Sakhibgaraeva E.L., Golovin E.V., Subcheva E.N., Vasileva O.O., Galieva A.A., Chuvashov A.A., Novikova E.S., Karabelsky A.V. Development of recombinant adeno-associated virus empty capsids as a reference standard for quality control of gene therapy products. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(2):200-214. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-2-200-214
ВВЕДЕНИЕ
Результаты клинических исследований подтверждают безопасность и эффективность использования препаратов на основе рекомбинантных аденоассоциированных вирусов (adeno-associated viruses, AAV) в генной терапии тяжелых наследственных заболеваний [1]. Управлением по контролю за качеством продуктов питания и лекарственных средств США (Food and Drug Administration, FDA) и Европейским агентством по лекарственным средствам (European Medicines Agency, ЕМА) в 2022–2023 гг. были одобрены к применению препараты для лечения дефицита декарбоксилазы ароматических аминокислот (Upstaza®, eladocagene exuparvovec), гемофилии А (Roctavian®, valoctocogene roxaparvovec) и Б (Hemgenix®, etranacogene dezaparvovec), мышечной дистрофии Дюшенна (Elevidys®, delandistrogene moxeparvovec). Одним из самых востребованных препаратов для лечения спинальной мышечной атрофии 1 типа является препарат на основе AAV серотипа 9 (AAV9) — Zolgensma® (onasemnogene abeparvovec), одобренный в США в 2019 г. Природный серотип AAV9 широко используется, так как способен эффективно трансдуцировать клетки нейронального происхождения, как, например, моторные нейроны, повреждающиеся при спинальной мышечной атрофии [2], или ганглиозные клетки сетчатки, дефекты которых приводят к атрофии зрительного нерва и потере зрения [3].
Технология получения AAV9 как в лабораторном, так и в промышленном масштабе требует разработки физико-химических и биологических методов для определения количества векторных частиц (титр) в образце (количество вирусных геномов; количество вирусных капсидов, физический титр), наличия примесей и родственных соединений, в том числе агрегатов, остаточных белков и ДНК, соотношения пустых и полных капсидов и др.
Основные подходы к оценке показателей качества биотехнологических препаратов в Российской Федерации представлены в Решении Совета Евразийской экономической комиссии (ЕЭК) № 891. Препараты на основе AAV напрямую не относятся к сфере применения этого документа, тем не менее описанные в нем требования в наибольшей степени соответствуют структурным и функциональным особенностям вирусных векторов. Также целесообразно учитывать гармонизированные с ICH требования EMA, сформулированные в руководстве ICH Q6B2. В обоих руководствах содержатся следующие характеристики продукта: чистота, физико-химические, биологические и иммунохимические характеристики. В свою очередь, физико-химические характеристики соответствуют таким показателям качества биотехнологических продуктов, как подлинность, чистота и примеси, количественное содержание.
Для аналитической и фармацевтической разработки препаратов на основе AAV требуются создание и аттестация стандартных образцов (СО), в том числе СО примесей родственных соединений, что необходимо для разработки технологического процесса выделения и очистки целевого продукта, а также для валидации методик количественного определения чистоты продукта. Например, СО пустых капсидов AAV позволяет оценить фактор отклика и селективность хроматографической системы по отношению к аналитическому сигналу, соответствующему полным капсидам AAV [4]. Такие СО используются на протяжении всего цикла фармацевтической разработки препарата, в связи с чем критическими этапами являются задачи контроля стабильности СО и своевременного получения новых стандартов по истечении срока годности СО.
Цель работы — разработка методик оценки физико-химических показателей качества для характеристики СО пустых капсидов AAV9 и исследование его стабильности при хранении.
Для достижения цели были поставлены следующие задачи:
- наработка СО пустых капсидов AAV9 в суспензионной культуре HEK293 и его характеристика;
- оценка титра вирусных частиц с помощью ортогональных методов анализа;
- изучение стабильности СО при хранении в течение 9 мес.
МАТЕРИАЛЫ И МЕТОДЫ
Оборудование
Лабораторный инкубационный шейкер Multitron (INFORS HT, Швейцария); хроматографическая система среднего давления NGC Quest 10 с коллектором фракций (Bio-Rad, США); центрифуга Eppendorf Centrifuge 5418 R (Eppendorf, Германия); сканирующий электронный микроскоп Crossbeam 550 (Carl Zeiss, Германия); спектрофотометр NanoDrop OneC (Thermo Fisher Scientific, США); анализатор размера частиц Zetasizer Ultra (Malvern Panalytical Ltd, Великобритания); система ВЭЖХ Vanquish Flex (Thermo Fisher Scientific, США); гель-документирующая станция ChemiDoc Imaging System (Bio-Rad, США); мультимодальный ридер CLARIOstar Plus (BMG Labtech, Германия); интерферометр Octet QKe ForteBio (Sartorius AG, Германия).
Методы
Получение плазмид. Для получения AAV векторов использовали: хелперную плазмиду pHelper Vector (кат. № 340202, Cell Biolabs Inc., США); упаковочную плазмиду pAAV2/9n (кат. № 112865, AddGene, США), кодирующую последовательность белков капсида и репликативных белков AAV; плазмиду pAAV-GFP (кат. № VP-401, Cell Biolabs Inc., США), содержащую ген зеленого флуоресцентного белка. Концентрацию и чистоту плазмидной ДНК определяли спектрофотометрически по протоколам, рекомендованным производителем. Соответствие плазмид картам (структуру плазмид) проверяли с помощью рестрикционного анализа, для чего использовали специфические эндонуклеазы рестрикции HincII (кат. № R0103S, NEB, США), PstI (кат. № R0140T, NEB, США) и SapI (кат. № R0569S, NEB, США). Для подтверждения количества и размера рестрикционных фрагментов ДНК плазмид полученные рестрикционные смеси наносили на 1% агарозный гель и визуализировали с помощью гель-документирующей станции ChemiDoc Imaging System. Если структура плазмиды не соответствовала плазмидной карте, то ее далее не использовали в работе.
Культивирование клеток HEK293 и подготовка к трансфекции. Для получения AAV использовали адаптированную к суспензионному культивированию клеточную линию HEK293 (ECACC; № 85120602). Криопробирки с клетками (50×10⁶ кл/мл) размораживали, помещали в бессывороточную среду BalanCD HEK293 (Irvine Scientific, США) с добавлением 4 мМ L-глутамина и проводили инкубацию при 37 °С, влажности 80%, содержании СО2 5%. При культивировании использовали лабораторный инкубационный шейкер Multitron, скорость вращения платформы — 100 об/мин. На этапе роста и накопления биомассы проводили трехкратное пассирование культурального материала для выхода клеток на достаточный уровень пролиферации после заморозки при сохранении уровня жизнеспособности не ниже 95%. Далее клетки засевали в колбы Эрленмейера объемом 500 мл и растили до плотности жизнеспособных клеток (6–9)×10⁶ кл/мл. Затем клетки пересевали в колбы объемом 500 мл в конечной концентрации 0,5×10⁶ кл/мл.
Трансфекция и наработка AAV9. Через 24 ч после посева клеток HEK293 в колбе проводили трансфекцию клеток плазмидами в следующих условиях: концентрация клеток 1×10⁶ кл/мл; уровень жизнеспособных клеток выше 95%; количество плазмидной ДНК 1,5 мкг на 1×10⁶ клеток; соотношение pHelper Vector:pAAV2/9n — 1:5; соотношение ДНК:PEI 40000 (Polysciences, США) — 1:5; объем трансфицирующей смеси составлял 5% от стартового объема культуральной жидкости. Трансфицирующую смесь готовили в питательной среде Opti-Mem (Gibco, США). Клетки культивировали 120 ч при температуре 37 °С, влажности 80% и концентрации СО2 5% на шейкере при скорости вращения 100 об/мин. Для получения СО AAV9-GFP проводили трансфекцию и культивирование клеток в аналогичных условиях, но при соотношении плазмид pHelper Vector:pAAV2/9n:pAAV-GFP, равном 2:5:2.
Лизис клеток, осветление и концентрирование культуральной жидкости. После культивирования в колбу с клетками добавляли Tween-20 (Sigma-Aldrich, США) до конечной концентрации 0,05% и инкубировали в течение 1 ч. Далее добавляли бензонуклеазу — препарат, выделенный из штамма Escherichia coli, экспрессирующего ген нуклеазы из микроорганизма Serratia marcescens (Sigma-Aldrich, Германия), до 30 МЕ/мл и MgCl2 до 1–2 мM и инкубировали в течение 1 ч. Затем полученный лизат центрифугировали в течение 10 мин при 3000 g. Полученный супернатант переливали в чистую емкость с последующим добавлением диатомита Celite® 503 (Merck, Германия) в количестве 1 г на 100 мл культурального материала. После перемешивания культуральную жидкость фильтровали (полиэфирсульфонный (PES) мембранный фильтр, 0,22 мкм) и концентрировали в 10 раз с помощью кассеты Vivaflow 200 (Sartorius, Германия) площадью 200 см² со скоростью диализа 7 мл/мин и входным давлением не более 1,5 бар. Полученный концентрат фильтровали через PES фильтр 0,22 мкм.
Хроматографическая очистка. Аффинную хроматографию проводили с помощью сорбента POROS CaptureSelect AAVX Affinity Resin (Thermo Fisher Scientific, США) с использованием колонки Diba Omnifit EZ (Thermo Fisher Scientific, США). На этапе подготовки сорбент уравновешивали буфером, содержащим 50 мM трис-HCl, 0,05% Tween 20, 0,15 M NaCl, pH 8,0, а затем полученный концентрат после этапа тангенциальной фильтрации наносили на колонку. Элюцию проводили буфером 0,1 M глицин-HCl, 0,05% Tween 20, 0,5 M L-аргинин, pH 2,0. Все работы по препаративной очистке AAV проводили с использованием хроматографической системы NGC Quest 10.
Концентрирование и диафильтрация. Очищенный препарат концентрировали с помощью центрифужного концентратора Vivaspin® 500 Centrifugal Concentrator Polyethersulfone 100 kDa (кат. № VS0141, Sartorius, Германия). После концентрирования вирусные частицы ресуспендировали в 450 мкл буфера для хранения — 0,37 М NaCl, 0,001% Pluronic F-68 (Gibco, США) в фосфатно-солевом буфере (PBS). Полученный образец стерилизовали фильтрацией с использованием шприцевого фильтра (0,22 мкм, кат. № 99722, TPP, Швейцария), отбирали аликвоты для последующих аналитических операций и хранения (–80 °С).
Электрофорез в полиакриламидном геле. Контроль белкового состава образца (подлинность капсида и наличие примесей пептидной природы) проводили с помощью электрофореза в полиакриламидном геле (ПААГ) в денатурирующих условиях с восстановлением (SDS-PAGE) [5][6].
Аликвоту препарата непосредственно перед анализом смешивали с буфером (Laemmli Sample Buffer, кат. № 161-0747, Bio-Rad, США), инкубировали при 95 °С в течение 5 мин и наносили 10 мкл на дорожку. Электрофорез проводили в трис-глициновом буфере (концентрирование — 4% гель, 50 В; разделение — 10% гель, 150 В, длина геля — 7,3 см). Использовали маркер молекулярного веса белков (Precision Plus Protein Dual Color Standards, 10–250 кДа, кат. № 161-0394, Bio-Rad, США). Окрашивали гель с помощью Coomassie G-250 (кат. № 1610436, Bio-Rad, США). Визуализацию проводили с применением гель-документирующей станции ChemiDoc Imaging System. Нахождение капсидных белков на электрофореграмме определяли визуально, ориентируясь на маркер молекулярного веса белков.
Просвечивающая электронная микроскопия. Морфологию вирусных капсидов и наличие пустых капсидов изучали с помощью сканирующей просвечивающей электронной микроскопии (scanning transmission electron microscopy, STEM) с использованием микроскопа Crossbeam 550 с детектором для просвечивающей электронной микроскопии при ускоряющем напряжении 30 кВ. Для равномерного распределения частиц предварительно проводили обработку сеток плазмой воздуха в течение 10 с на лабораторной плазменной установке Zepto (Diener Electronic, Германия). Образец разводили бидистиллированной водой в соотношении 1:5 и 10 мкл исследуемых частиц наносили на поддерживающую сетку (Carbon/Formvar 300 mesh, Agar Scientific, Великобритания), затем инкубировали 2 мин, дважды промывали водой и контрастировали 1% водным раствором уранилацетата (кат. № 0379, Polysciences, США) в течение 1 мин. Высушивание сеток проводили на воздухе при комнатной температуре.
Количество пустых капсидов (%) оценивали визуально путем подсчета на микрофотографиях суммарного количества и процентного содержания вирусных частиц, числа пустых, полных и частично заполненных капсидов с последующим расчетом среднего арифметического значения (не менее 15 микрофотографий на каждый образец).
Определение физического титра вирусных частиц и оценка наличия агрегатов методом динамического рассеяния света. Анализ проводили методом динамического рассеяния света (ДРС) с применением анализатора Zetasizer Ultra. Для измерения использовали образцы объемом 65 мкл и кварцевую кювету малого объема (кат. № ZEN2112, Malvern Panalytical Ltd, Великобритания). Данные обрабатывали с помощью программного обеспечения ZS XPLORER (Malvern Panalytical Ltd, Великобритания), которое позволяет учитывать статистику повторных измерений (среднее значение, стандартное отклонение, относительное стандартное отклонение, минимальные и максимальные значения).
Эксклюзионная хроматография. Определение относительного содержания мономера AAV, высокомолекулярных фракций (агрегатов) и низкомолекулярных фракций (фрагментов AAV) проводили методом эксклюзионной хроматографии (size-exclusion chromatography, SEC) с помощью жидкостного хроматографа Vanquish Flex. Разделение фракций осуществляли в изократическом режиме с помощью хроматографической колонки XBridge Protein BEH SEC (2,5 μм, 4,6 мм×300 мм, кат. № 186009180, Waters, США) и подвижной фазы — 20 мМ Na2HPO4, 150 мM KCl, pH 7,0 при скорости потока 0,5 мл/мин. Детектирование осуществлялось с использованием флуориметрического детектора с длиной волны возбуждения 280 нм и длиной волны эмиссии 350 нм. Для обработки полученных данных использовали программное обеспечение Chromeleon (Thermo Fisher Scientific, США), при этом проводилась общая базовая линия от начала выхода высокомолекулярных фракций до окончания выхода низкомолекулярных фракций, после чего фракции разделяли и определяли их относительное содержание. Для идентификации мономера AAV9 использовали значение времени удерживания пика мономера СО полных капсидов (RS-AAV9-FL, Vigene Biosciences, США).
Определение физического титра вирусных частиц с помощью метода УФ-спектрофотомерии. Для определения физического титра использовали спектрофотометр NanoDrop OneC при длине волны 260 нм. Проводили не менее трех последовательных измерений оптической плотности и рассчитывали среднее арифметическое значение и относительное стандартное отклонение (relative standard deviation, RSD). Физический титр рассчитывали как отношение среднего значения оптической плотности к коэффициенту экстинкции. Для AAV9 коэффициент экстинкции был установлен экспериментально с использованием образца AAV9-GFP c известным физическим титром, определенным методами иммуноферментного анализа (ИФА) с применением набора реагентов PRAAV9XP (Progen, Германия) и динамического светорассеяния.
Определение физического титра вирусных частиц методом биослойной интерферометрии. Исследование проводили с помощью интерферометра Octet QKe ForteBio с использованием калибровочной кривой стандартного препарата с известной концентрацией. Измеряемым параметром выступала скорость связывания вирусных капсидов с антителами, которые были иммобилизованы на сенсоре. При проведении анализа антитело Biotin Anti-AAVX Conjugate (Thermo Fisher Scientific, США) в концентрации 5 мкг/мл иммобилизировали на биосенсоры Octet SA Biosensors (Sartorius, Германия) в PBS (ПанЭко, Россия) c 1% раствором бычьего сывороточного альбумина (БСА, Sigma-Aldrich, Германия), затем стабилизировали сенсоры в буфере и проводили связывание с калибровочными образцами, далее отмывали (трижды в 0,5М фосфорной кислоте и PBS с 1% БСА), затем снова стабилизировали сенсоры и загружали измеряемые образцы. Для построения калибровочной кривой был использован образец AAV9-GFP c известным физическим титром, определенным методом ИФА с помощью набора реагентов (PRAAV9XP, Progen, Германия). Для построения калибровочной кривой были использованы следующие концентрации: 1,00×10¹² вирусных капсидов (вк)/мл, 0,50×10¹² вк/мл, 2,50×10¹² вк/мл, 1,25×10¹² вк/мл, 0,62×10¹² вк/мл. Анализируемый СО AAV9 испытывали в разведениях 1:20 и 1:40. На основании калибровочной кривой рассчитывали концентрацию исследуемого образца2 [7].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение стандартных образцов пустых капсидов AAV9
Наработку СО пустых капсидов AAV9 проводили по схеме, представленной на рисунке 1, включающей в себя этапы трансфекции и культивирования суспензионной культуры НЕК293 в колбах объемом до 500 мл в бессывороточной среде с последующим осветлением, концентрированием и хроматографической очисткой на аффинном сорбенте.
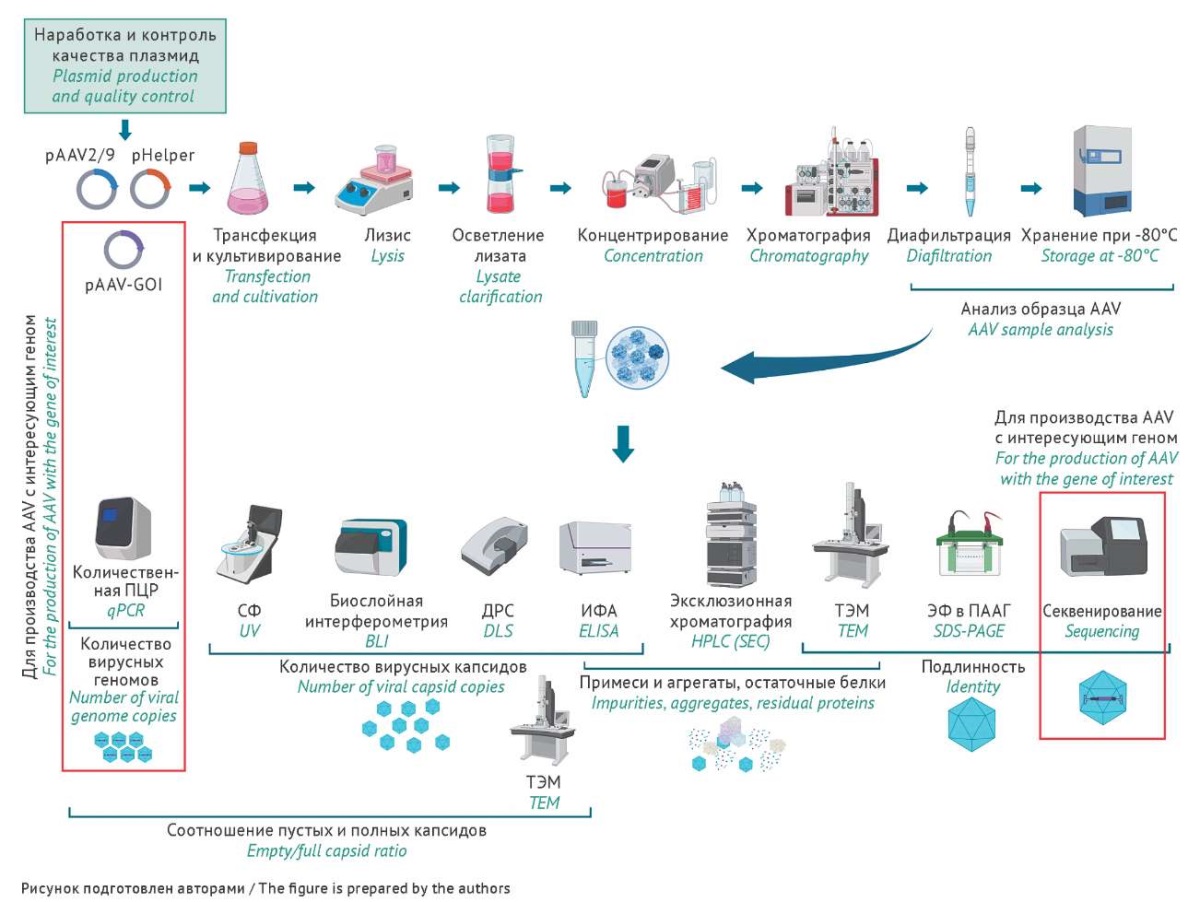
Рис. 1. Общая схема наработки, выделения и анализа образцов аденоассоциированного вируса (adeno-associated virus, AAV). Красной рамкой отмечены этапы, необходимые при наработке образцов AAV, содержащих интересующий ген. ПЦР — полимеразная цепная реакция, ИФА — иммуноферментный анализ, СФ — спектрофотометрия, ДРС — динамическое рассеяние света, ТЭМ — трансмиссионная электронная микроскопия, ЭФ в ПААГ — денатурирующий электрофорез в полиакриламидном геле.
Fig. 1. General outline of production, isolation, and analysis of adeno-associated virus (AAV) samples. Red boxes indicate the steps required for the production of AAV samples containing the gene of interest. qPCR, quantitative polymerase chain reaction; ELISA, enzyme-linked immunosorbent assay; UV, ultraviolet spectrophotometry; BLI, bio-layer interferometry; DLS, dynamic light scattering; HPLC (SEC), size-exclusion high-performance liquid chromatography; TEM, transmission electron microscopy; SDS-PAGE, sodium dodecyl sulfate–polyacrylamide gel electrophoresis.
Для получения рекомбинантных AAV часто используют трансфекцию с эквимолярным соотношением трех плазмид (херперная плазмида; плазмида с генами rep и cap; плазмида с геном интереса — 1:1:1) в трансфекционной смеси [8]. Для получения AAV в данной работе применяли оптимизированный протокол трансфекции (для наработки СО AAV9 проводили трансфекцию двумя плазмидами — хелперной и плазмидой с генами rep и cap), ориентируясь на наиболее критичные параметры этого процесса (количество клеток, ДНК, соотношение плазмид, соотношение ДНК:PEI и др.) [9]. Это позволило достигнуть высокой продуктивности суспензионных клеток HEK293 (до 10⁵ продуцируемых вирусных частиц на клетку, или до 10¹⁴ частиц на 1 л).
Очистку СО пустых капсидов AAV9 проводили с помощью аффинной хроматографии с помощью сорбента POROS CaptureSelec AAVX Affinity Resin, содержащего AAV-специфичный лиганд (молекулярная масса 15 кДа). В структуре лиганда фрагмента находятся три комплементарных области, которые определяют антигенсвязывающую способность и селективность сорбента [10][11]. На рисунке 2А представлена хроматограмма процесса очистки СО AAV9. Высокая селективность сорбента и его пористая структура позволили провести быструю одноступенчатую очистку препарата. Данные электрофореза свидетельствуют о присутствии в очищенном препарате трех белков вирусного капсида: VP1, VP2, VP3 (рис. 2B). Показано отсутствие низкомолекулярных примесей, что позволило сделать вывод о получении образца высокой чистоты (рис. 2B)3.
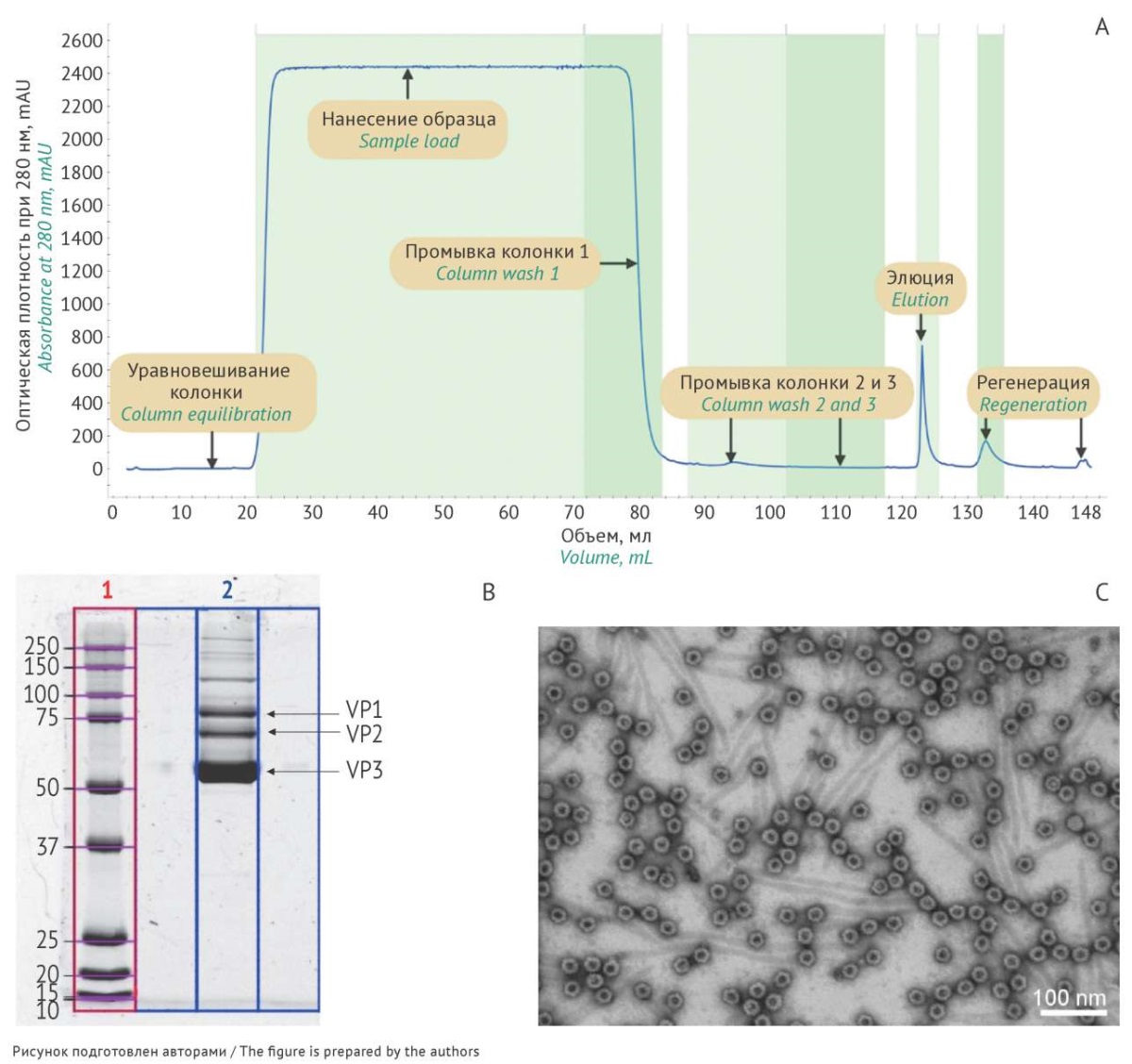
Рис. 2. Очистка и анализ стандартного образца (СО) пустых капсидов аденоассоциированного вируса 9 серотипа (AAV9): A — хроматограмма процесса очистки СО AAV9 с помощью аффинного сорбента. Зеленым выделены границы начала и окончания сбора фракций при нанесении образца, при промывках колонки, при элюции и при регенерации сорбента; B — оценка подлинности СО с использованием электрофореза: дорожка 1 — белковый маркер (10–250 кДа), дорожка 2 — препарат СО AAV9. Стрелками отмечены три белка капсида AAV (viral proteins — VP1, VP2, VP3); C — микрофотография СО AAV9, метод сканирующей просвечивающей электронной микроскопии, увеличение ×160000.
Fig. 2. Purification and analysis of the reference standard for empty capsids of adeno-associated virus serotype 9 (AAV9 RS): A) A chromatogram of the AAV9 RS purification with affinity resin. Green highlights indicate the beginning and end of fraction collection during sample application, column washing, elution, and sorbent regeneration. B) Electrophoretic RS identification: lane 1, protein marker kit (10–250 kDa); lane 2, AAV9 RS. Arrows indicate three AAV capsid proteins (viral proteins VP1, VP2, and VP3). C) A scanning transmission electron microscope photo of the AAV9 RS at a magnification of ×160,000.
Оценка качества стандартного образца AAV методом электронной микроскопии
После концентрирования и диализа анализировали СО пустых капсидов AAV9 с помощью электронной микроскопии [12]. Данный метод позволяет оценить ряд важных показателей: морфология и размеры, наличие дефектных частиц, белковых или мембранных клеточных остатков, агрегатов, содержимое капсидов (полный или пустой), наличие разрушенных капсидов. Визуализацию СО пустых капсидов AAV9 проводили с использованием метода негативного контрастирования 1% водным раствором уранилацетата. Равномерность распределения образцов обеспечивали за счет модификации поверхности поддерживающих медных сеток с углеродной подложкой плазмой воздуха, которая значительно увеличивает ее гидрофильность. На полученных микрофотографиях идентифицировали частицы правильной формы с размерами порядка 25 нм с выраженными осями симметрии, характерными для AAV (рис. 2С). Дополнительных примесей, в том числе белковых, обнаружено не было. В ходе визуального анализа полученных микрофотографий для определения соотношения пустых и полных капсидов процентное содержание пустых капсидов можно было принять равным 100% (в полях зрения встречаются единичные частично заполненные капсиды при общем количестве вирусных частиц порядка 100).
Оценка количества агрегатов с помощью эксклюзионной хроматографии
Количественное определение агрегированных частиц имеет важное значение при оценке качества препаратов на основе AAV для обеспечения их безопасности и эффективности, так как агрегаты могут вызывать нежелательные иммунные реакции в организме и снижать эффективность терапии [13]. В биофармацевтических исследованиях эксклюзионная хроматография является основным методом определения агрегатов из-за простоты, высокой производительности и скорости анализа. Метод основан на различии гидродинамических объемов растворенных веществ [14].
Для определения относительного содержания фракций AAV9 использовали флуориметрический детектор, что позволило достичь предельных значений количественного определения — 5×10⁸ капсидов за один анализ; стандартное отклонение относительного содержания фракции менее 1,5%. Относительное стандартное отклонение времени удерживания пика мономера не превышало 0,2%. При выборе подвижной фазы особое внимание уделяли ионной силе раствора, что оказывает влияние на разделение и относительное содержание фракций. В подвижной фазе без добавления хлорида калия наблюдали низкое разрешение между фракциями, а также высокую асимметрию хроматографических пиков. Однако при увеличении концентрации хлорида калия в составе подвижной фазы со 150 до 350 мМ относительное содержание низкомолекулярных фракций возрастало на 10%. Хроматограмма анализа СО пустых капсидов AAV9 представлена на рисунке 3B. Относительное содержание мономера для данной серии СО составило 99,1%, а доля агрегатов — 0,9%.
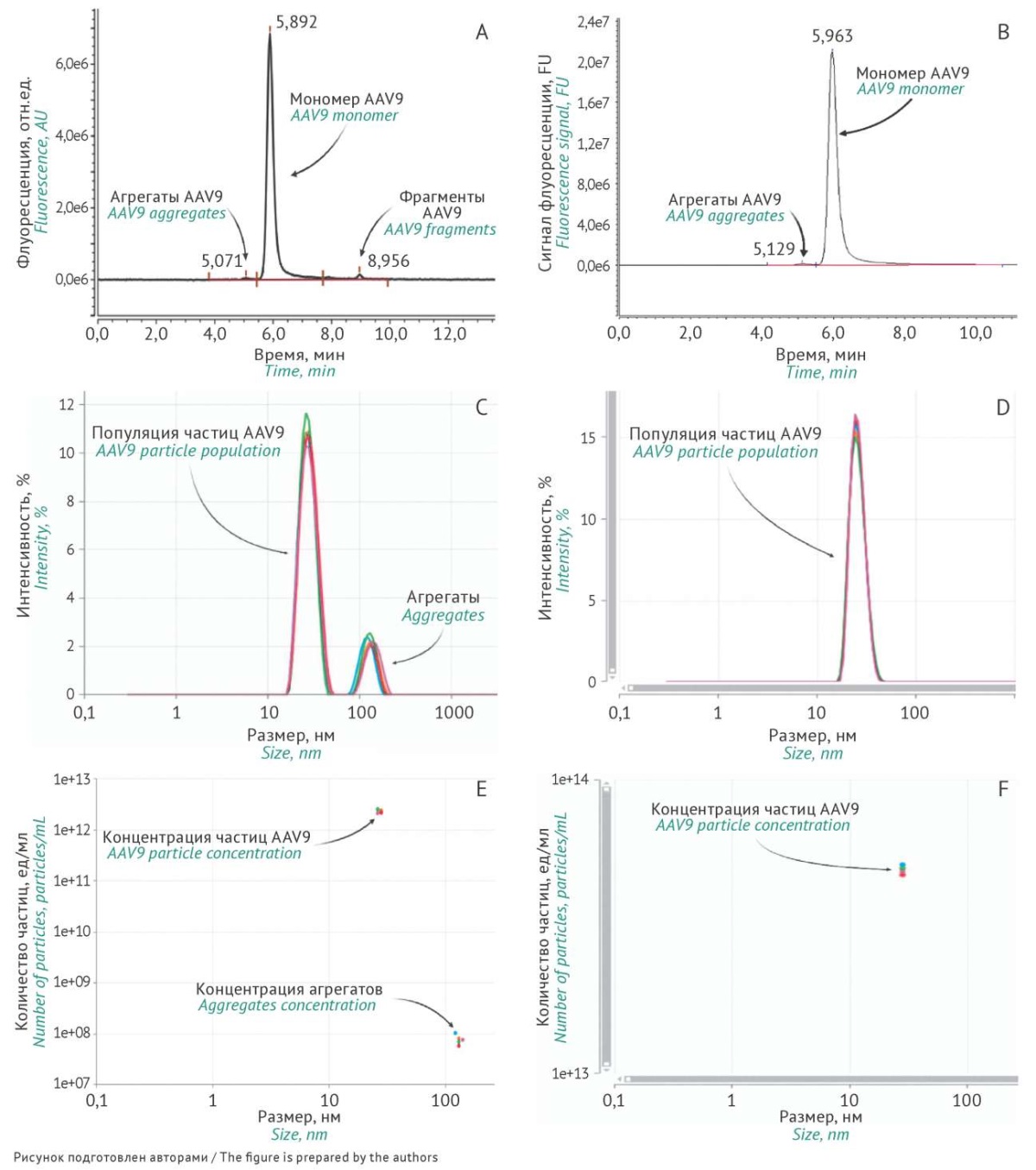
Рис. 3. Анализ аденоассоциированного вируса 9 серотипа (AAV9) методами эксклюзионной жидкостной хроматографии (ЭЖХ) и динамического рассеяния света (ДРС): A — пример хроматограммы ЭЖХ для препарата AAV9, содержащего агрегаты и низкомолекулярные примеси; B — хроматограмма ЭЖХ стандартного образца (СО) пустых капсидов AAV9; C — пример графика интенсивности сигнала ДРС препарата AAV9, содержащего агрегаты и низкомолекулярные примеси; D — график интенсивности сигнала ДРС СО пустых капсидов AAV9; E — пример графика распределения количества частиц по размеру, рассчитанный по результатам ДРС препарата AAV, содержащего агрегаты и низкомолекулярные примеси; F — график распределения количества частиц по размеру, рассчитанный по результатам ДРС СО пустых капсидов AAV9.
Fig. 3. Analysis of adeno-associated virus serotype 9 (AAV9) by size-exclusion chromatography (SEC) and dynamic light scattering (DLS): A) An example of SEC chromatogram of an AAV9 sample containing aggregates and low molecular weight (LMW) impurities. B) A SEC chromatogram of the AAV9 reference standard (RS). C) An example of a DLS signal intensity graph for the AAV9 sample containing aggregates and LMW impurities. D) A DLS signal intensity graph for the AAV9 RS. E) An example of DLS graph of particle size distribution for the AAV preparation containing aggregates and LMW impurities. F) A DLS graph of particle size distribution for the AAV9 RS. RS, reference standard; AAV, adeno-associated virus; SEC, size-exclusion high-performance liquid chromatography; DLS, dynamic light scattering.
Учитывая ряд ограничений данного метода, таких как фильтрация крупных агрегатов неподвижной фазой и неспецифические взаимодействия между агрегатами и фриттой (фильтр, предотвращающий попадание крупных частиц или загрязнений из образца или фазы) колонки4, требуется дополнительная характеристика образца ортогональными (взаимно-подтверждающими) методами: аналитическое ультрацентрифугирование, метод динамического рассеяния света (для оценки наличия более крупных агрегатов, d>100 нм).
Метод эксклюзионной хроматографии может быть дополнительно использован совместно с многоугловым детектором светорассеяния, что позволит определять молекулярные массы разделенных соединений. Кроме того, возможно применение диодно-матричного детектора вместо флуориметрического, что, в свою очередь, позволит одновременно производить оценку соотношения пустых и полных капсидов. Однако данные методы имеют низкую чувствительность, что не позволяет широко их использовать при производстве AAV5.
Определение физического титра AAV
Метод ИФА используется для определения физического титра вирусных частиц на ранних стадиях разработки препаратов на основе AAV. Метод позволяет работать с низкими концентрациями капсидов, например при разработке способов очистки вирусных векторов из культуральной жидкости. Недостатком ИФА является высокая стоимость и низкая доступность наборов для исследователей в настоящее время, а также достаточно длительная процедура анализа. Возможен вариант разработки собственного набора для ИФА, но это рационально осуществлять лишь в случае дальнейшего масштабирования производства. По этой причине поиск ортогональных методов определения титра вирусных частиц является в настоящее время крайне актуальной и востребованной задачей. В данной работе с этой целью использовали методы динамического рассеяния света, биослойной интерферометрии и спектрофотометрии для оценки физического титра СО пустых капсидов AAV9.
Определение физического титра вирусных частиц, а также оценка содержания агрегатов методом динамического рассеяния света
Метод динамического рассеяния света, предназначенный для измерения размеров нано- и субмикронных частиц дисперсной фазы, позволяет проводить измерения образца в нативной форме на основе многоуглового рассеяния света и осуществлять оценку гидродинамического диаметра, модальности распределения вирусных капсидов и их долевых соотношений6. Исследование СО пустых капсидов AAV9 проводили при 25 °C с помощью анализатора Zetasizer Ultra, оснащенного He-Ne-лазером (длина волны 633 нм, максимальная мощность 10 мВт). Показано, что концентрация СО пустых капсидов AAV9 составила 4,7×10¹³ вк/мл (RSD=8,04%); значение среднего гидродинамического диаметра — 29 нм (RSD=1,05%) (рис. 3D). При этом в СО отсутствовали агрегаты вирусных капсидов большего размера (рис. 3D, F).
Определение физического титра вирусных частиц методом спектрофотометрии
При измерении оптической плотности раствора вирусных частиц поглощение в ультрафиолетовой области обусловлено аминокислотными остатками белков, находящихся во внешней сфере капсида [15][16]. Коэффициент экстинкции был вычислен при длине волны 260 нм на основании оптической плотности образца раствора вирусных капсидов AAV9-GFP (раствор в 50 мМ Tris-HCl), физический титр которого определяли методами ИФА и динамического рассеяния света, и составил 3×10¹⁴. В диапазоне разведений раствора образца AAV9-GFP 8×10¹¹–4×10¹³ вк/мл наблюдали линейную зависимость оптической плотности раствора от физического титра (рис. 4A). Физический титр СО пустых капсидов AAV9 составил 1,48×10¹³ вк/мл (RSD=1,01%).
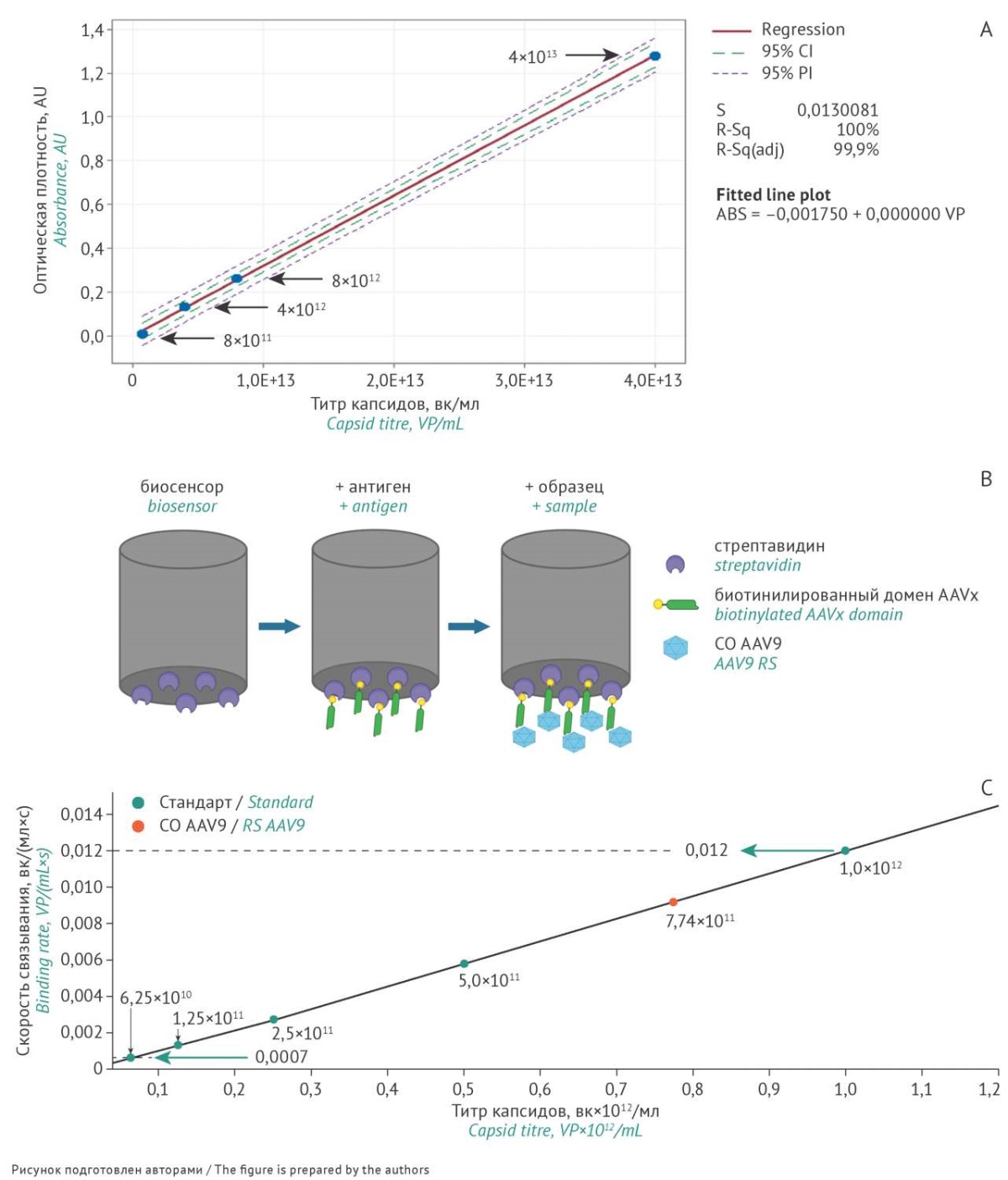
Рис. 4. Определение физического титра аденоассоциированного вируса (AAV) с помощью методов спектрофотометрии и биослойной интерферометрии: А — линейная зависимость оптической плотности раствора образца AAV9-GFP при длине волны 260 нм от физического титра вирусных капсидов; B — последовательность нанесения молекул на биосенсор при определении количества вирусных капсидов AAV методом биослойной интерферометрии; C — зависимость скорости связывания антитела на биосенсоре с капсидами от используемого титра (голубыми стрелками указана скорость связывания в двух выбранных точках). СО AAV9 — стандартный образец аденоассоциированного вируса 9 серотипа, AAVX –анти-AAV антитела, вк — вирусные капсиды.
Fig. 4. Determination of the physical titre of adeno-associated virus (AAV) by spectrophotometry and bio-layer interferometry: A) The linear function of the AAV9–GFP solution absorbance at 260 nm vs the physical titre of viral capsids. B) The order of molecule application to the biosensor during viral capsid quantification. C) The rate of binding between the antibodies immobilised on the biosensor and the capsids as a function of the titre used (blue arrows indicate binding rates at two selected points). AAV9 RS, reference standard for adeno-associated virus serotype 9; GFP, green fluorescent protein; AAVx, anti-AAV antibodies; VP, viral particles.
Определение физического титра пустых капсидов AAV методом биослойной интерферометрии
Следует отметить, что нижний предел количественного определения вирусных капсидов AAV9 методами динамического рассеяния света и спектрофотометрии достаточно высокий, что ограничивает возможность применения этих методов, особенно на начальных этапах разработки. В качестве альтернативного и достаточно точного метода оценки титра помимо ИФА в последнее время используется метод биослойной интерферометрии (bio-layer interferometry) [15]7. Метод основан на определении в реальном времени кинетики специфического взаимодействия антитела, иммобилизованного на биосенсоре, с белками капсида AAV в исследуемом образце, что позволяет регистрировать кинетику образования комплекса антитела с антигеном и не требует внесения вторичных антител или дополнительных меток [17].
Для проведения анализа в работе применялись универсальные биосенсоры со стрептавидином и биотинилированные VHH-домены антител, специфичных к AAV — AAVХ (рис. 4B). При апробации методики с использованием СО AAV9-GFP с известным титром, определенным методом ИФА, был установлен динамический диапазон методики (6,2×10¹⁰–1,0×10¹² вк/мл) и построена калибровочная кривая (рис. 4С). Установленная в эксперименте скорость связывания (в диапазоне титра 6,2×10¹⁰–1,0×10¹² вк/мл) была сопоставима со скоростью связывания с использованием коммерчески доступных сенсоров8. Было показано, что концентрация пустых капсидов AAV9 в образце с 20-кратным разведением капсидов была выше предела детекции прибора, а концентрация капсидов в образце с 40-кратным разведением составляла 0,774×10¹² вк/мл, что соответствовало титру СО AAV9 — 3,1×10¹³ вк/мл.
Следует отметить, что в данной работе представлена проверка концепции методики (proof-of-concept), так как к моменту написания статьи достаточного количества повторностей не было набрано и статистика анализа не была проведена в полной мере. Постановка полного эксперимента с большим количеством измерений на точку запланирована на следующем этапе работы.
Оценка физического титра стандартного образца пустых капсидов AAV9 и анализ стабильности препаратов при хранении
Исследование стабильности СО пустых капсидов AAV9 проводили каждые три месяца в течение первого года хранения при температуре –80 °C. Проводили определение следующих показателей: физический титр AAV методами динамического рассеяния света и спектрофотометрии, методом биослойной интерферометрии (последняя точка контроля); относительное содержание мономера, низко- и высокомолекулярных фракций методом эксклюзионной хроматографии; концентрация агрегатов методом динамического рассеяния света; подлинность капсида подтверждали методом электрофореза в ПААГ. Результаты исследования представлены в таблице 1. Данные анализа концентрации СО пустых капсидов AAV9 методом биослойной интерферометрии представлены только для образцов после хранения в течение 9 месяцев (данная методика применялась в исследовании на последнем этапе). Было показано, что СО пустых капсидов AAV9 обладает высокой стабильностью при хранении. При этом значения титров, определенные тремя разными методами, варьировали от 1,48×10¹³ до 5,6×10¹³.
Таблица 1. Результаты определения физического титра и содержания примесей стандартного образца (СО) пустых капсидов аденоассоциированного вируса 9 серотипа (AAV9) при исследовании стабильности
Table 1. Physical titre and impurity content values for the reference standard (RS) for empty capsids of adeno-associated virus serotype 9 (AAV9) measured during stability studies
Метод Method | Параметр, единицы измерения Parameter | Значение параметра Parameter value | |||
СО на этапе получения After production | СО при сроке хранения After storage for | ||||
3 мес. 3 months | 6 мес. 6 months | 9 мес. 9 months | |||
Динамическое рассеяние света Dynamic light scattering | Концентрация капсидов, вк/мл Capsid concentration, VP/mL | 4,7×10¹³ RSD=8,042% | 5,2×10¹³ RSD=6,408% | 5,6×10¹³ RSD=4,871% | 4,0×10¹³ RSD=3,612% |
Спектрофотометрия Spectrophotometry | Концентрация капсидов, вк/мл Capsid concentration, VP/mL | 1,48×10¹³ RSD=1,01% | 1,56×10¹³ RSD=1,64% | 1,65×10¹³ RSD=3,63% | 1,52×10¹³ RSD=3,66% |
Биослойная интерферометрия Bio-layer interferometry | Концентрация капсидов, вк/мл Capsid concentration, VP/mL | – | – | – | 3,1×10¹³ |
Динамическое рассеяние света Dynamic light scattering | Концентрация агрегатов, ед/мл Aggregate concentration, units/mL | <1,0×10⁵ | <1,0×10⁵ | <1,0×10⁵ | <1,0×10⁵ |
Эксклюзионная хроматография Size-exclusion chromatography | Относительное содержание высокомолекулярной фракции, % Relative HMWS content, % | 0,88 | 0,98 | 1,81 | 0,86 |
Относительное содержание фракции мономеров, % Relative monomer content, % | 99,12 | 99,02 | 98,19 | 99,14 | |
Относительное содержание низкомолекулярной фракции, % Relative LMWS content, % | 0 | 0 | 0 | 0 | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. вк/мл — количество вирусных капсидов в 1 мл; RSD — относительное стандартное отклонение.
Note. VP/mL, viral particles per 1 mL; RSD, relative standard deviation; HMWS, high molecular weight species; LMWS, low molecular weight species.
ВЫВОДЫ
- Проведена наработка стандартного образца пустых капсидов AAV9 в клетках HEK293, адаптированных к росту в суспензионной культуре, а также его очистка и характеризация. Физический титр полученного препарата составил ~10¹³вк/мл. Наработанный стандартный образец пустых капсидов AAV9 обладал высокой степенью чистоты по результатам эксклюзионной хроматографии — содержание мономеров вирусных капсидов составляло не менее 98%. С использованием методов динамического светорассеяния, эксклюзионной хроматографии и электронной микроскопии было показано отсутствие агрегатов в образце.
- Показана стабильность полученного стандартного образца пустых капсидов AAV9 в течение 9 месяцев, что свидетельствует о его пригодности для оценки селективности хроматографического разделения пустых и полных капсидов.
- Наиболее оптимальным представляется использование методов динамического рассеяния света и спектрофотометрии как наиболее доступных для рутинного анализа стандартного образца пустых капсидов AAV9 при определении физического титра (рабочий диапазон методик от 1,0×10¹⁰до 1,0×10¹² вк/мл в образце). Для регулярного анализа качества (контрольные точки — раз в шесть месяцев) предлагается использовать метод биослойной интерферометрии.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.В. Тумаев — культивирование и трансфекция клеток, выделение и очистка пустых капсидов AAV; Д.Ю. Волошин — хроматографическая очистка образцов, анализ полученных результатов, редактирование и форматирование текста рукописи; Е.С. Бердинских — разработка методов анализа AAV с помощью эксклюзионной хроматографии и иммуноферментного анализа, характеристика образцов, анализ полученных результатов; Е.Л. Сахибгараева — проведение работ, связанных с характеристикой полученных образцов пустых капсидов AAV методами спектрофотометрии, динамического светорассеяния и эксклюзионной хроматографии, выполнение работ по исследованию стабильности, анализ полученных результатов; Е.В. Головин — разработка методик определения физического титра AAV методами спектрофотометрии и иммуноферментного анализа, анализ полученных результатов; Е.Н. Субчева — проведение просвечивающей электронной микроскопии, анализ полученных результатов; О.О. Васильева — разработка методики анализа количества частиц методом биослойной интерферометрии, анализ полученных результатов, редактирование текста рукописи; А.А. Галиева — проведение электрофореза, подготовка образцов для трансмиссионной электронной микроскопии, наработка образцов AAV9-GFP; редактирование и форматирование текста рукописи, участие в подготовке иллюстраций; А.А. Чувашов — руководство аналитической разработкой, редактирование и форматирование текста рукописи, анализ полученных данных, формулирование выводов; Е.С. Новикова — редактирование и форматирование текста рукописи, анализ полученных результатов, формулирование выводов; А.В. Карабельский — формирование концепции статьи, руководство проведением работ, редактирование и форматирование текста рукописи, систематизация информации на основании источников литературы, формулирование выводов.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.V. Tumaev performed cell culture and transfection, isolated and purified AAV capsids. D.Yu. Voloshin performed chromatographic purification of the samples, analysed the results obtained, edited and formatted the manuscript. E.S. Berdinskikh developed the methodology for AAV analysis by size-exclusion chromatography and enzyme-linked immunosorbent assay, characterised the samples, and analysed the results obtained. E.L. Sakhibgaraeva characterised the samples of empty AAV capsids by spectrophotometry, dynamic light scattering, and size-exclusion chromatography; conducted the stability study; and analysed the results obtained. E.V. Golovin developed analytical procedures for AAV physical titre determination by ultraviolet spectrophotometry and enzyme-linked immunosorbent assay and analysed the results obtained. E.N. Subcheva performed transmission electron microscopy and analysed the resulting images. O.O. Vasileva developed analytical procedures for particle quantification by bio-layer interferometry, analysed the results obtained, and edited the manuscript. A.A. Galieva conducted electrophoresis, prepared the samples for transmission electron microscopy, produced the AAV9–GFP samples, edited and formatted the manuscript, participated in the preparation of figures. A.A. Chuvashov supervised the analytical development, edited and formatted the manuscript, analysed the results obtained, and formulated the conclusions. E.S. Novikova edited and formatted the manuscript, analysed the results obtained, and formulated the conclusions. A.V. Karabelsky conceptualised and supervised the study, edited and formatted the manuscript, collated the information presented in the literature, and formulated the conclusions.
1. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
2. https://www.sartorius.com/en/products/protein-analysis/octet-bli-detection/biosensors-and-kits/octet-aavx-biosensors
3. https://assets.thermofisher.com/TFS-Assets/LSG/manuals/100038399_POROS_CapSel_AAV8_AAV9_Resins_UG.pdf
4. https://www.chromatographyonline.com/view/protein-aggregates-and-gel-filtration-chromatography-improving-quantitation-and-throughput-uhplc-m-0
5. https://www.chromatographyonline.com/view/quantifying-aav-quality-attributes-using-sec-mals
6. https://www.malvernpanalytical.com/en/assets/poster%20aav%20concentration%20comparison%20madls%20concentration%20with%20elisa%20with%20allergan%20(1)_tcm50-65801.pdf
7. https://acs.digitellinc.com/sessions/571925/view
8. https://www.sartorius.com/download/1323012/octet-aavx-biosensors-quantitation-aav-capsids-protein-analy-1--data.pdf
Список литературы
1. Minskaia E, Galieva A, Egorov AD, Karabelsky AV. Viral vectors in gene replacement therapy. Biochemistry (Mosc). 2023;88(12):2157–78. https://doi.org/10.1134/s0006297923120179
2. Mendell JR, Al-Zaidy S, Shell R, Arnold WD, RodinoKlapac LR, Prior TW, et al. Single-dose gene-replacement therapy for spinal muscular atrophy. N Engl J Med. 2017;377(18):1713–22. https://doi.org/10.1056/nejmoa1706198
3. Coovert DD, Le TT, McAndrew PE, Strasswimmer J, Crawford TO, Mendell JR, et al. The survival motor neuron protein in spinal muscular atrophy. Hum Mol Genet. 1997;6(8):1205–14. https://doi.org/10.1093/hmg/6.8.1205
4. Wang C, Mulagapati SHR, Chen Z, Du J, Zhao X, Xi G, et al. Developing an anion exchange chromatography assay for determining empty and full capsid contents in AAV6.2. Mol Ther Methods Clin Dev. 2019;15:257–63. https://doi.org/10.1016/J.OMTM.2019.09.006
5. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970;227(5259):680–5. https://doi.org/10.1038/227680A0
6. Hofmann A, Clokie S, eds. Wilson and Walker’s principles and techniques of biochemistry and molecular biology. 8th ed. Griffith University; 2018. https://doi.org/10.1017/9781316677056
7. Petersen RL. Strategies using bio-layer interferometry biosensor technology for vaccine research and development. Biosensors (Basel). 2017;7(4):49. https://doi.org/10.3390/BIOS7040049
8. Рябова ЕИ, Деркаев АА, Есмагамбетов ИБ, Щебляков ДВ, Довгий МА, Бырихина ДВ и др. Сравнение различных технологий получения рекомбинантного аденоассоциированного вируса в лабораторном масштабе. БИОпрепараты. Профилактика, диагностика, лечение. 2021;21(4):266–78. https://doi.org/10.30895/2221-996X-2021-21-4-266-278
9. Grieger JC, Soltys SM, Samulski RJ. Production of recombinant adeno-associated virus vectors using suspension HEK293 cells and continuous harvest of vector from the culture media for GMP FIX and FLT1 clinical vector. Mol Ther. 2016;24(2):287. https://doi.org/10.1038/MT.2015.187
10. Terova O, Soltys S, Hermans P, De Rooij J, Detmers F. Overcoming downstream purification challenges for viral vector manufacturing: enabling advancement of gene therapies in the clinic. Cell and Gene Therapy Insights. 2018;4(2):101–11. https://doi.org/10.18609/CGTI.2018.017
11. Florea M, Nicolaou F, Pacouret S, Zinn EM, Sanmiguel J, Andres-Mateos E, et al. High-efficiency purification of divergent AAV serotypes using AAVX affinity chromatography. Mol Ther Methods Clin Dev. 2023;28:146–59. https://doi.org/10.1016/J.OMTM.2022.12.009
12. Richert-Pöggeler KR, Franzke K, Hipp K, Kleespies RG. Electron microscopy methods for virus diagnosis and high-resolution analysis of viruses. Front Microbiol. 2019;9:3255. https://doi.org/10.3389/fmicb.2018.03255
13. Yang TY, Braun M, Lembke W, McBlane F, Kamerud J, DeWall S, et al. Immunogenicity assessment of AAV-based gene therapies: an IQ consortium industry white paper. Mol Ther Methods Clin Dev. 2022;26:471–94. https://doi.org/10.1016/j.omtm.2022.07.018
14. Deb PK, Kokaz SF, Abed SN, Paradkar A, Tekade RK. Chapter 6. Pharmaceutical and biomedical applications of polymers. In: Tekade RK, ed. Basic fundamentals of drug delivery. A volume in advances in pharmaceutical product development and research. Amsterdam: Elsevier; 2019. P. 203–67. https://doi.org/10.1016/C2018-0-03215-6
15. Sommer JM, Smith PH, Parthasarathy S, Isaacs J, Vijay S, Kieran, et al. Quantification of adeno-associated virus particles and empty capsids by optical density measurement. Mol Ther. 2003;7(1):122–8. https://doi.org/10.1016/S1525-0016(02)00019-9
16. Grimm D, Storm TA, Hammami N, Graf M, Kay MA, Maheshri N, et al. 899. Directed evolution of the AAV-2 capsid yields novel mutants. Mol Ther. 2003;7(5):S347–8. https://doi.org/10.1016/s1525-0016(16)41341-9
17. Ульянова КВ, Казаров АА, Пантюшенко МС, Оленев АА, Лягоскин ИВ, Симонов ВМ. Разработка и валидация методики определения концентрации антитела человека, блокирующего связывание PD-1 с лигандами, в сыворотке крови яванского макака методом биослойной интерферометрии. БИОпрепараты. Профилактика, диагностика, лечение. 2020;20(4):257–67.
Об авторах
А. В. ТумаевРоссия
Тумаев Артем Валериевич
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
Д. Ю. Волошин
Россия
Волошин Данил Юрьевич
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
Е. С. Бердинских
Россия
Бердинских Евгений Сергеевич
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
Е. Л. Сахибгараева
Россия
Сахибгараева Елена Любомировна
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
Е. В. Головин
Россия
Головин Евгений Валерьевич
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
Е. Н. Субчева
Россия
Субчева Елена Николаевна
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
О. О. Васильева
Россия
Васильева Ольга Олеговна
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
А. А. Галиева
Россия
Галиева Алима Абдураимовна
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
А. А. Чувашов
Россия
Чувашов Антон Андреевич
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
Е. С. Новикова
Россия
Новикова Екатерина Сергеевна
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
А. В. Карабельский
Россия
Карабельский Александр Владимирович, канд. биол. наук
Олимпийский проспект, д. 1, пгт. Сириус, Краснодарский край, 354340
Дополнительные файлы
Рецензия
Для цитирования:
Тумаев А.В., Волошин Д.Ю., Бердинских Е.С., Сахибгараева Е.Л., Головин Е.В., Субчева Е.Н., Васильева О.О., Галиева А.А., Чувашов А.А., Новикова Е.С., Карабельский А.В. Разработка стандартного образца пустых капсидов рекомбинантного аденоассоциированного вируса для контроля качества препаратов генной терапии. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(2):200-214. https://doi.org/10.30895/2221-996X-2024-24-2-200-214
For citation:
Tumaev A.V., Voloshin D.Yu., Berdinskikh E.S., Sakhibgaraeva E.L., Golovin E.V., Subcheva E.N., Vasileva O.O., Galieva A.A., Chuvashov A.A., Novikova E.S., Karabelsky A.V. Development of recombinant adeno-associated virus empty capsids as a reference standard for quality control of gene therapy products. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(2):200-214. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-2-200-214
































