Перейти к:
Анализ качества вакцины БЦЖ для иммунотерапии рака мочевого пузыря с помощью контрольных карт Шухарта
https://doi.org/10.30895/2221-996X-2024-24-1-76-90
Резюме
АКТУАЛЬНОСТЬ. Сложность стандартизации иммунобиологических лекарственных препаратов, в том числе вакцины БЦЖ, обусловливает необходимость совершенствования статистического подхода к анализу стабильности показателей качества препарата. Одним из инструментов анализа качества являются контрольные карты Шухарта (ККШ), использование которых позволяет выявлять и анализировать тренды изучаемых процессов как в режиме реального времени, так и ретроспективно.
ЦЕЛЬ. Оценка показателей качества вакцины БЦЖ для иммунотерапии рака мочевого пузыря с применением контрольных карт Шухарта для мониторинга стабильности процессов производства и проведения испытаний по показателям качества.
РЕЗУЛЬТАТЫ. Значение коэффициента корреляции (r) при анализе данных производителя и ИЦ составило от 0,34 до 0,70. Проверка данных испытательного центра с помощью критерия согласия Пирсона выявила нормальное распределение для показателей качества: «Дисперсность» (χ²=14,03) и «Потеря в массе при высушивании» (χ²=4,93). При анализе ККШ по показателям качества «Потеря в массе при высушивании» и «Специфическая активность» были обнаружены признаки выхода процесса производства и/или процесса проведения испытания при оценке качества из состояния статистической управляемости. При мониторинге показателей качества «Общее содержание бактерий» и «Дисперсность» выявлено, что было достигнуто состояние статистической управляемости. Определены контрольные границы для дальнейшего мониторинга стабильности результатов по показателю «Дисперсность» в реальном времени.
ВЫВОДЫ. Подтверждена применимость ККШ для оценки качества вакцины БЦЖ для иммунотерапии рака мочевого пузыря при проведении контроля в испытательном центре. Показана необходимость внедрения постоянного мониторинга стабильности показателей качества для повышения стандартизации процессов при производстве вакцины и методик проведения испытаний, что позволит обеспечить высокий уровень выпускаемой продукции.
Ключевые слова
Для цитирования:
Савина А.А., Воропаев А.А., Алесина А.А. Анализ качества вакцины БЦЖ для иммунотерапии рака мочевого пузыря с помощью контрольных карт Шухарта. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):76-90. https://doi.org/10.30895/2221-996X-2024-24-1-76-90
For citation:
Savina A.A., Voropaev A.A., Alesina A.A. Quality analysis of BCG vaccine for bladder cancer immunotherapy using Shewhart control charts. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):76-90. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-76-90
Введение
Согласно данным Всемирной организации здравоохранения (ВОЗ) на 2024 г. рак мочевого пузыря входит в десять наиболее распространенных в мире онкологических заболеваний1. Основной причиной неблагоприятных исходов при немышечно-инвазивном раке мочевого пузыря является высокая частота развития рецидивов заболевания после хирургического лечения. Риск рецидива может составлять до 70% [1]. Иммунотерапия с применением вакцины БЦЖ является эффективным способом лечения рака мочевого пузыря [2]. Проведенные исследования в течение 40 лет использования вакцины БЦЖ при немышечно-инвазивном раке мочевого пузыря показали, что БЦЖ-терапия приводит к снижению рисков развития рецидива и прогрессирования заболевания и имеет преимущество перед применением внутрипузырной химиотерапии [2].
Впервые проведение иммунотерапии на основе живого аттенуированного штамма Mycobacterium bovis BCG Frappier при раке мочевого пузыря было предложено в 1976 г. в исследовании A. Morales и соавт. [3]. Изучение механизма противоопухолевого действия БЦЖ-вакцины показало, что микобактерии, входящие в состав вакцины, индуцируют активацию CD4+ и CD8+ Т-лимфоцитов, NK-клеток, макрофагов, дендритных клеток, а также секрецию ряда цитокинов (IL-1, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, IL-15, IL-18), фактора некроза опухоли (TNF-α), интерферона-γ (IFN-γ), опосредующих местный противоопухолевый иммунный ответ. Как адаптивный, так и врожденный иммунный ответ имеет решающее значение в терапии БЦЖ. Однако механизм противоопухолевого ответа на введение БЦЖ до конца не ясен и, вероятно, является многофакторным [4][5].
В настоящее время для лечения рака мочевого пузыря в Российской Федерации разрешен к применению отечественный препарат Имурон-вак (Вакцина БЦЖ для иммунотерапии рака мочевого пузыря)2, выпускаемый ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал»). Препарат представляет собой микобактерии вакцинного штамма Mycobacterium bovis субштамм BCG-1 (Russia), лиофилизированные в 1,5% растворе глутамата натрия3.
Требования к показателям качества препарата изложены в Государственной фармакопее Российской Федерации XIV изд.4 (ГФ РФ XIV). Мониторинг стабильности показателей качества лекарственных препаратов — важный компонент системы управления производственным процессом. Контроль качества иммунобиологических лекарственных препаратов является основополагающим условием для обеспечения безопасности и эффективности выпускаемой продукции. Каждый производственный или технологический процесс обладает определенной изменчивостью вследствие действия на него множества факторов: вариативность исходных реактивов и материалов, оборудования, методик выполнения работ и проведения испытаний, навыков персонала. В силу этого результаты процесса — продукция и характеристики ее качества — обладают определенной степенью вариации, но в рамках допустимых пределов [6]. Принимая во внимание сложность стандартизации иммунобиологических лекарственных препаратов, в том числе вакцины БЦЖ, актуальной задачей является разработка системного статистического подхода к анализу показателей качества препарата вакцины при проведении мониторинга стабильности производственного процесса. Основная задача статистического управления процессом состоит в недопущении отклонений параметров от установленных стандартов, а также в своевременном обнаружении подобных отклонений [7].
Одним из инструментов оценки стабильности и анализа показателей производственного процесса являются контрольные карты Шухарта (ККШ), использование которых позволяет выявлять и анализировать тренды изучаемых процессов как в режиме реального времени, так и ретроспективно. В Российской Федерации метод описан в стандартах ГОСТ Р ИСО 7870-1-2022 и ГОСТ Р ИСО 7870-2-20155. Контрольные карты — простой и эффективный стандартизированный статистический инструмент для контроля изменчивости и управления технологическими процессами. Метод позволяет получать достоверные данные о процессе, выявлять сбои, проводить корректировку для достижения статистически управляемого состояния [7][8]. В фармацевтической промышленности качество и безопасность продуктов играют решающую роль, поэтому применение контрольных карт является неотъемлемой частью стратегии обеспечения высокого качества выпускаемой продукции. Они предоставляют необходимые инструменты для мониторинга и контроля производственных процессов, которые позволяют своевременно идентифицировать негативные тенденции и риски для качества производимых фармацевтических препаратов, что способствует принятию наиболее правильных решений [9][10].
ККШ используют в том числе для оценки стабильности производства вакцин. Их применение обеспечивает возможность эффективной оценки данных при подтверждении соответствия характеристик лекарственных препаратов требованиям нормативной документации (НД) [11]. В соответствии с ГОСТ ISO/IEC 17025-20196 установлено требование использования статистических методов для мониторинга и контроля процессов в испытательных лабораториях. При этом статистические подходы не конкретизированы, поэтому вполне допустимо применение лабораториями для более точного контроля процессов измерения таких инструментов, как ККШ.
Цель работы — оценка показателей качества вакцины БЦЖ для иммунотерапии рака мочевого пузыря с применением контрольных карт Шухарта для мониторинга стабильности процессов производства и проведения испытаний по показателям качества.
Для выполнения цели были поставлены следующие задачи:
- определить показатели качества вакцины для иммунотерапии рака мочевого пузыря, которые можно использовать для статистического контроля с помощью ККШ;
- систематизировать результаты анализа показателей качества вакцины за 2019–2023 гг. согласно данным предприятия-производителя и испытательного центра и построить на их основе ККШ;
- оценить эффективность применимости использования ККШ при мониторинге качества вакцины.
Материалы и методы
Материалы
Образцы препарата Имурон-вак (Вакцина БЦЖ для иммунотерапии рака мочевого пузыря), лиофилизат для приготовления суспензии для внутрипузырного введения, 8–15 млн/мг, 50 мг во флаконе, производства ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал»); 138 коммерческих серий 2019–2023 гг. выпуска, поступивших в Испытательный центр (ИЦ) экспертизы качества медицинских иммунобиологических препаратов ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России для подтверждения соответствия показателей качества препарата требованиям нормативной документации (НД).
Оборудование
Для проведения испытаний использовали оборудование с действительным свидетельством о поверке (аттестации): шкаф ламинарный II класса биологической защиты NU-425-500E (NuAire Inc., США); термостат-инкубатор с естественной конвекцией BD240 (Binder GmbH, Германия); колориметр фотоэлектрический КФК-3 (ОАО «ЗОМЗ», Россия); весы аналитические специальные 1-го класса точности BP 221S (ООО «Сартогосм», Россия); термостат ТС-1/80 СПУ (ОАО «Смоленское СКТБ СПУ», Россия); дозаторы механические одноканальные 20–200 и 500–5000 мкл (Biohit, Sartorius, Финляндия).
Методы
При ретроспективном анализе были использованы данные испытаний вакцины БЦЖ для иммунотерапии рака мочевого пузыря согласно результатам, предоставленным предприятием-производителем, и результатам, полученным при контроле качества в ИЦ. Испытания по показателям качества проводились в соответствии с методиками, описанными в ГФ РФ XIV7 и в НД производителя.
Общее содержание бактерий. Показатель определяли фотометрическим методом в соответствии с требованиями ФС.3.3.1.0053.188. Препарат восстанавливали до содержания 1 мг/мл микробных клеток БЦЖ путем добавления во флакон 0,9% раствора натрия хлорида. Определяли оптическую плотность (ОП) восстановленного препарата при длине волны 490 нм. Контролем служил стерильный 0,9% раствор натрия хлорида.
Дисперсность. Испытание проводили совместно с определением общего содержания бактерий фотометрическим методом по методике, изложенной в нормативной документации на препарат9. ОП раствора образца измеряли при 440 и 670 нм, показатель дисперсности (n) вычисляли по формуле (1):
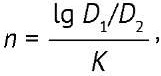 (1)
(1)
где D1, D2, — ОП при длине волны λ1 и λ2, К — постоянный множитель.
Специфическая активность. Для оценки показателя согласно требованиям ФС.3.3.1.0053.1810 проводили определение числа жизнеспособных клеток БЦЖ в 1 мг вакцины методом посева восстановленного препарата на плотную питательную среду Левенштейна — Йенсена с последующим инкубированием в течение 28 сут при 37 °С и подсчетом выросших колоний.
Потеря в массе при высушивании. Показатель определяли гравиметрическим методом в соответствии с требованиями ОФС.1.2.1.0010.1511.
Статистическую обработку данных проводили, рассчитывая среднее значение, стандартное отклонение, коэффициент корреляции, с использованием программы Microsoft Office Excel 2007.
Построение контрольных карт Шухарта. ККШ строили на основе данных, полученных в ИЦ в ходе проведения испытаний на соответствие требованиям НД. Были построены и проанализированы два типа ККШ: карты скользящих размахов (R-карта) и карты индивидуальных значений (X-карта). Величину скользящих размахов (R) определяли как разность между двумя последовательными значениями. Значения размахов и индивидуальные значения откладывали на X- и R-картах на оси ординат в зависимости от номеров серий препарата, которые были отмечены по оси абсцисс в хронологическом порядке. На каждой контрольной карте отмечали центральную линию (CL), верхнюю (UCL) и нижнюю контрольную границы (LCL). Эти границы были рассчитаны с учетом R. Полученные результаты были интерпретированы в соответствии с требованиями ГОСТ Р ИСО 7870-2-201512.
Результаты и обсуждение
Обоснование выбора показателей качества вакцины
При выборе анализируемых показателей качества вакцины БЦЖ для иммунотерапии рака мочевого пузыря (табл. 1) предпочтительным было использование показателей, имеющих количественный тип данных, поскольку они являются информативными и позволяют проводить анализ, отслеживать состояние процесса во времени и, главное, воздействовать на процесс до того, как он выйдет из-под контроля. Поэтому для исследования были отобраны показатели качества, имеющие числовые значения: «Общее содержание бактерий», «Дисперсность», «Потеря в массе при высушивании» и «Специфическая активность».
Таблица 1. Показатели качества вакцины БЦЖ для иммунотерапии рака мочевого пузыря
Table 1. Quality indicators of BCG vaccines for bladder cancer immunotherapy
Наименование показателя качества вакцины Vaccine quality indicator | Тип данных показателей качества Type of data |
Общее содержание бактерий Дисперсность Потеря в массе при высушивании Специфическая активность Bacterial concentration Dispersity index Loss on drying Potency | Количественный Quantitative |
Описание Подлинность Проходимость через иглу Время восстановления препарата Герметичность (вакуум) Отсутствие посторонней микрофлоры Аномальная токсичность Специфическая безопасность Description Identification Syringeability Reconstitution time Container–closure integrity (vacuum) Bacterial and fungal contamination Abnormal toxicity Virulent mycobacteria | Альтернативный Alternative |
Таблица составлена авторами по данным нормативной документации с изменениями / The table is prepared by the authors using the product specification file
Сравнительный анализ значений показателей качества вакцины
Результаты испытаний по выбранным показателям качества вакцины БЦЖ для иммунотерапии рака мочевого пузыря согласно данным предприятия-производителя и ИЦ представлены в таблице 2. Средние значения показателей и значения стандартных отклонений результатов полностью совпали для показателей качества «Общее содержание бактерий» и «Дисперсность», небольшие различия были определены для показателя «Специфическая активность». При посерийном анализе была выявлена выраженная корреляционная связь для всех показателей, кроме показателя «Общее содержание бактерий», для которого характерна умеренная связь (r=0,34).
Таблица 2. Значения показателей качества вакцины БЦЖ
для иммунотерапии рака мочевого пузыря
согласно данным предприятия-производителя и испытательного центра,
полученные в 2019–2023 гг.
Table 2. Quality indicators for the BCG vaccine for bladder cancer immunotherapy
according to the data submitted by the manufacturer
and the data obtained at the testing centre in 2019–2023
Параметр Parameter | Место испытаний Testing site | Показатель качества препарата Product quality indicator | |||
Общее содержание бактерий, ОЕ Bacterial concentration, OD | Дисперсность, n Dispersity index, n | Потеря в массе при высушивании, % Loss on drying, % | Специфическая активность, млн клеток/мг Potency, million cells/mg | ||
Среднее значение Mean value | А | 0,35 | 1,4 | 1,5 | 12,22 |
В | 0,35 | 1,4 | 2,9 | 12,83 | |
Стандартное отклонение Standard deviation | А | 0,03 | 0,1 | 0,6 | 2,23 |
В | 0,03 | 0,1 | 0,8 | 2,82 | |
Минимальное значение Minimum value | А | 0,30 | 1,2 | 0,4 | 8,00 |
В | 0,30 | 1,2 | 0,9 | 8,00 | |
Максимальное значение Maximum value | А | 0,39 | 1,6 | 3,6 | 15,00 |
В | 0,40 | 1,6 | 4,8 | 17,02 | |
Коэффициент корреляции, r Correlation coefficient, r | – | 0,34 | 0,70 | 0,64 | 0,58 |
Значение показателя согласно требованиям НД PSF requirement | – | 0,30–0,40 | ≥1,2 | ≤5,0 | 8–15 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. А — данные результатов анализа, предоставленные предприятием-производителем; В — данные, полученные при контроле качества в Испытательном центре; НД — нормативная документация.
Note. A, test results submitted by the manufacturer; B, quality control results obtained at the testing centre; PSF, product specification file.
Стоит отметить значительные различия между результатами испытаний предприятия-производителя и ИЦ по показателю «Потеря в массе при высушивании» при заметной корреляционной связи. Возможные причины получения таких данных: недостаточная стандартизация процесса лиофилизации и определения показателя «Потеря в массе при высушивании». Сложность оценки данного показателя обусловлена особенностями процесса высушивания, при котором наблюдается так называемый «эффект краевого флакона». Данный эффект объясняется неравномерной передачей тепла в камере лиофильной сушки — крайние флаконы получают тепло и от полки камеры, и от стенок сушильного аппарата, а центральные — только от полки. Неравномерный нагрев вызывает разную скорость сублимации, в результате чего внутри одной серии препарата может наблюдаться существенная разница в остаточной влажности. Также на скорость сублимации влаги влияет загрузка камеры — при увеличении количества флаконов в камере скорость сублимации снижается.
Кроме того, определение остаточной влажности гравиметрическим методом сопряжено с некоторыми сложностями технического характера, что влияет на высокую неопределенность результатов измерений, которая связана с большой гигроскопичностью исследуемых образцов препарата вакцины и малыми массами навесок исследуемых образцов [12]. Различие между данными ИЦ и производителя может быть объяснено недостаточным удалением влаги из образцов в процессе испытания на базе предприятия-производителя.
Построение и анализ контрольных карт Шухарта
Применение ККШ предполагает, что исследуемая характеристика подчиняется нормальному распределению, так как коэффициенты, используемые для расчета контрольных границ, выведены для нормального распределения. В ГОСТ P ИСО 7870-2-201513 имеется отдельное предупреждение о необходимости проявления осторожности при интерпретации карт индивидуальных значений, если распределение не является нормальным.
Гистограммы распределения для каждого показателя качества представлены на рисунке 1. Проверка данных за 2019–2023 гг. с помощью критерия согласия Пирсона показала, что нормальное распределение выявлено для двух показателей качества: «Дисперсность» (по данным производителя χ²=6,7; по данным ИЦ χ²=14,03; критическое значение χ²=14,07) и «Потеря в массе при высушивании» (по данным производителя χ²=12,56; по данным ИЦ χ²=4,93; критическое значение χ²=14,07). Для остальных показателей значение критерия χ² превысило критическое значение: 16,56 для показателя «Общее содержание бактерий»; 35 и 133 для показателя «Специфическая активность» по данным производителя и ИЦ соответственно. Таким образом, построение ККШ по показателям качества «Общее содержание бактерий» и «Специфическая активность» на данном этапе не дает информативного результата. Однако согласно ГОСТ Р ИСО 7870-2-201514 (раздел 6) «небольшие отклонения характеристики процесса от нормального распределения не должны быть препятствием в использовании таких карт как эмпирической процедуры принятия решений» (рис. 2, 3).
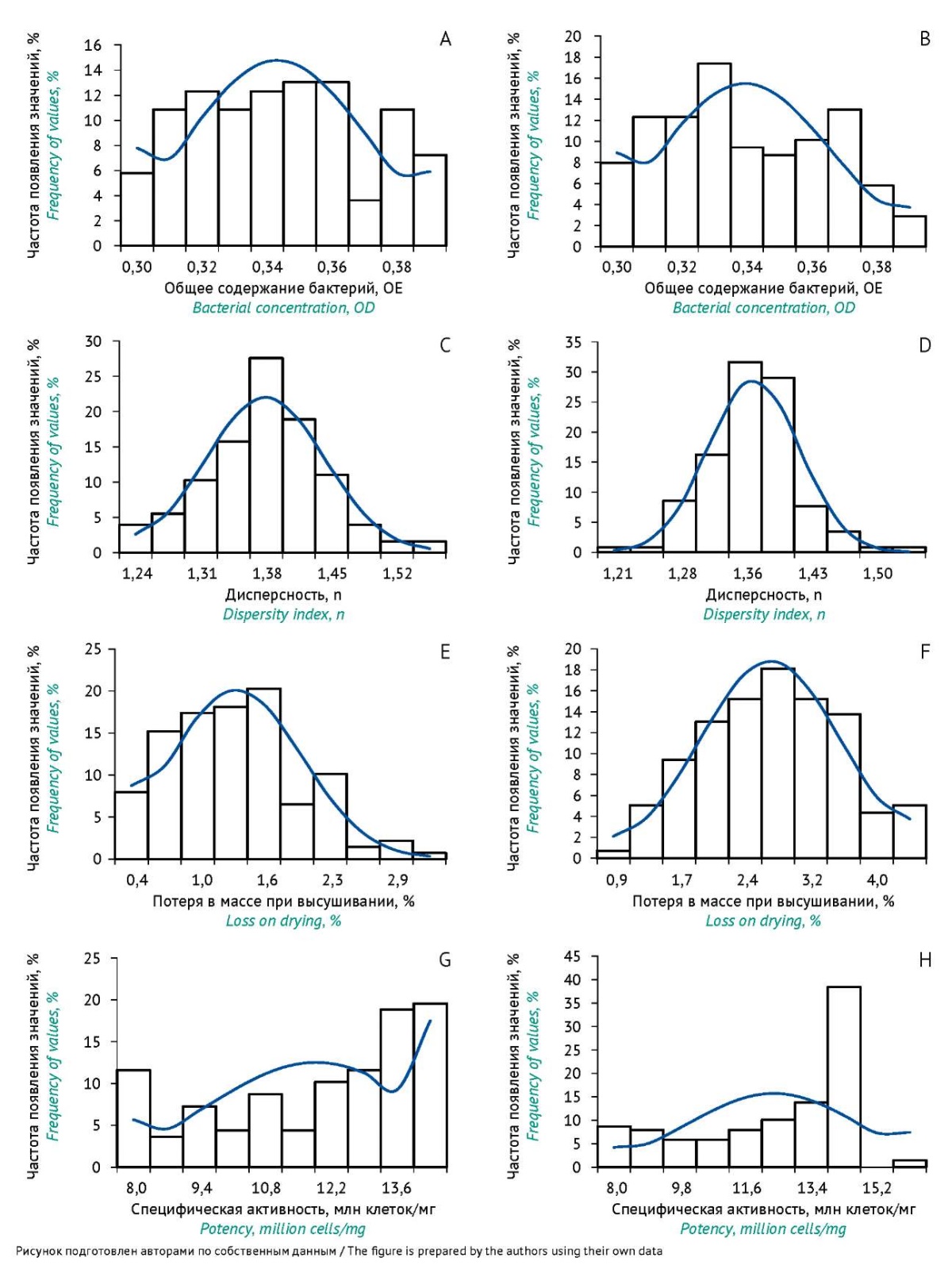
Рис. 1. Гистограммы распределения значений результатов испытаний за 2019–2023 гг. по показателям качества: «Общее содержание бактерий» (A, B), «Дисперсность» (C, D), «Потеря в массе при высушивании» (E, F), «Специфическая активность» (G, H). A, C, E, G — результаты анализа предприятия-производителя; B, D, F, H — результаты контроля качества в испытательном центре.
Fig. 1. Histograms showing the distribution of quality test results for 2019–2023 by quality indicators: bacterial concentration (A, B), dispersity index (C, D), loss on drying (E, F), and potency (G, H). A, C, E, G, testing by the manufacturer; B, D, F, H, quality control at the testing centre.
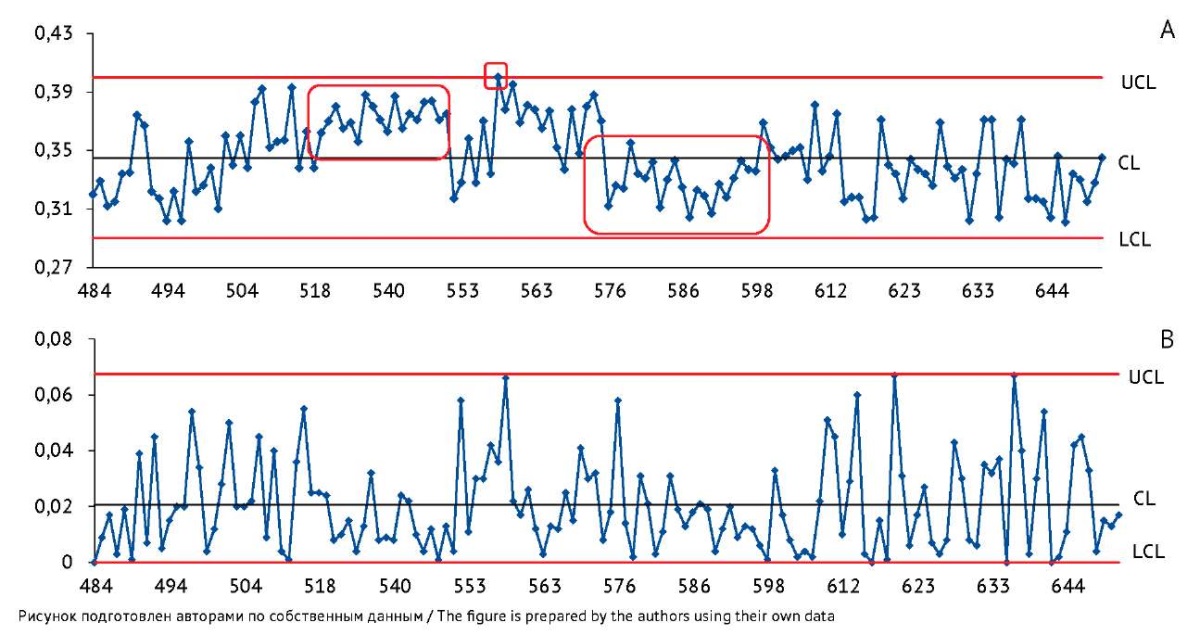
Рис. 2. Контрольные карты по значениям показателя качества «Общее содержание бактерий» вакцины БЦЖ для иммунотерапии рака мочевого пузыря, построенные по результатам контроля качества в испытательном центре. На карте индивидуальных значений (А) ось Y — индивидуальные значения показателя «Общее содержание бактерий» (оптические единицы). На карте скользящих размахов (В) ось Y — значения размахов показателя между последовательными сериями препарата. Ось X — порядковые номера серий вакцины. CL — центральная линия; UCL и LCL — верхняя и нижняя контрольные границы. Область, выделенная красным цветом, включает точки, соответствующие одному из критериев особых причин.
Fig. 2. Control charts for the bacterial concentration measured at the testing centre during quality control of the BCG vaccine for bladder cancer immunotherapy. The Y-axis of the individuals control chart (A) shows individual bacterial concentration values (optical density units). The Y-axis of the moving range control chart (B) shows quality indicator ranges between successive batches of the product. The X-axis shows sequential numbers of vaccine batches. CL, central line; UCL/LCL, upper/lower control limits. The area highlighted in red includes points that meet a special cause criterion.
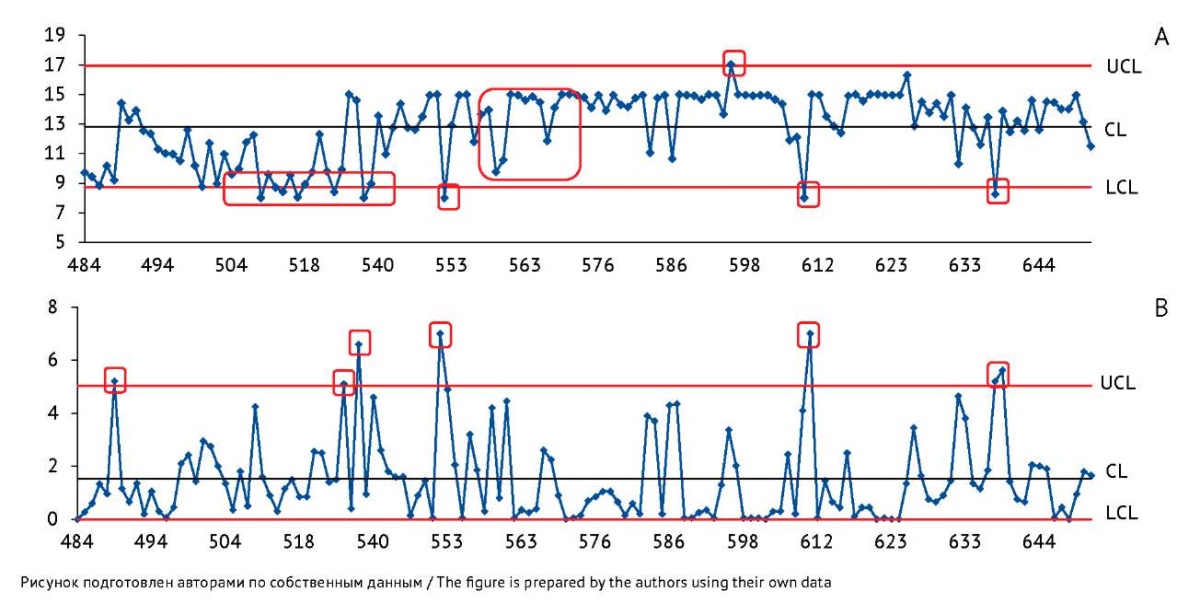
Рис. 3. Контрольные карты по значениям показателя качества «Специфическая активность» вакцины БЦЖ для иммунотерапии рака мочевого пузыря, построенные по результатам контроля качества в испытательном центре. На карте индивидуальных значений (А) ось Y — индивидуальные значения показателя «Специфическая активность» (млн клеток/мг). На карте скользящих размахов (В) ось Y — значения размахов показателя между последовательными сериями препарата. Ось X — порядковые номера серий вакцины. CL — центральная линия; UCL и LCL — верхняя и нижняя контрольные границы. Область, выделенная красным цветом, включает точки, соответствующие одному из критериев особых причин.
Fig. 3. Control charts for the potency measured at the testing centre during quality control of the BCG vaccine for bladder cancer immunotherapy. The Y-axis of the individuals control chart (A) shows individual potency values (million cells/mg). The Y-axis of the moving range control chart (B) shows quality indicator ranges between successive batches of the product. The X-axis shows sequential numbers of vaccine batches. CL, central line; UCL/LCL, upper/lower control limits. The area highlighted in red includes points that meet a special cause criterion.
Контрольные карты Шухарта по значениям показателя качества «Общее содержание бактерий». На карте индивидуальных значений по показателю «Общее содержание бактерий» (рис. 2А) наблюдалось появление критериев особых причин: выход одной точки за контрольные границы (значение 0,400; результат подтверждается данными производителя), а также выявлены структуры расположения точек по одну сторону от центральной линии (рис. 2А, области выделены красным цветом). Такое расположение точек (тренд) может быть объяснено внесением некоторых изменений в технологический процесс, при которых поменялось среднее значение показателя в данные отрезки времени, при этом среднее значение стандартного отклонения не изменилось, что свидетельствует о стабильности процесса.
Контрольные карты Шухарта по значениям показателя качества «Специфическая активность». На карте индивидуальных значений по показателю «Специфическая активность» (рис. 3А, В) наблюдался большой разброс значений скользящих размахов, выходы точек за контрольные границы, а также необычные структуры расположения точек. Наиболее вероятно, что широкий диапазон нормативных значений (от 8 до 15 млн клеток/мг) влияет на отсутствие нормального распределения данных (рис. 1G, H).
Несмотря на то что культуральный метод является официально рекомендованным ВОЗ15, он имеет ряд недостатков. Высокая вариабельность результатов метода возможна из-за ошибок разведения, модификации среды во время культивирования и ошибок подсчета. Существенным недостатком метода является способность клеток БЦЖ к агрегации (слипанию), которая обусловлена составом и структурой клеточных мембран этих бактерий16 [13–16]. Это обстоятельство может вызывать искажение истинного значения показателя числа жизнеспособных микобактерий в препарате, так как часть микроорганизмов, не давших рост отдельных колоний, не может быть учтена. Также существенное влияние на результаты могут оказывать компоненты питательной среды: для культурального метода анализа как на предприятии-производителе вакцины, так и в ИЦ используется натуральная яичная среда Левенштейна — Йенсена. Натуральные среды характеризуются сложным непостоянным химическим составом, уступают синтетическим средам по стандартности и воспроизводимости результатов [17][18]. Возможно, при расхождении результатов, полученных предприятием-производителем и ИЦ, также следует обратить внимание на компоненты питательной среды. Учитывая вышеизложенное, производителям и контрольным лабораториям следует рассмотреть альтернативные методы определения специфической активности, основанные на биолюминесценции, колориметрии или проточной цитометрии, отличающиеся быстротой и большей воспроизводимостью.
Контрольные карты Шухарта по значениям показателя качества «Потеря в массе при высушивании». Контрольные карты, полученные по результатам определения показателя «Потеря в массе при высушивании», представлены на рисунке 4. На карте скользящих размахов наблюдалась только одна точка выхода за контрольные границы. На карте индивидуальных значений (рис. 4А) выявлен выход точек за контрольную границу, и неблагоприятные тренды. Отдельно стоит выделить структуру расположения точек (с 639 по 651 серию), формирующую тренд в виде буквы «V», и резкий подъем значений, близкий и к верхней контрольной линии, и к границе нормативных требований, что повышает риск получения серии, не соответствующей требованиям НД.
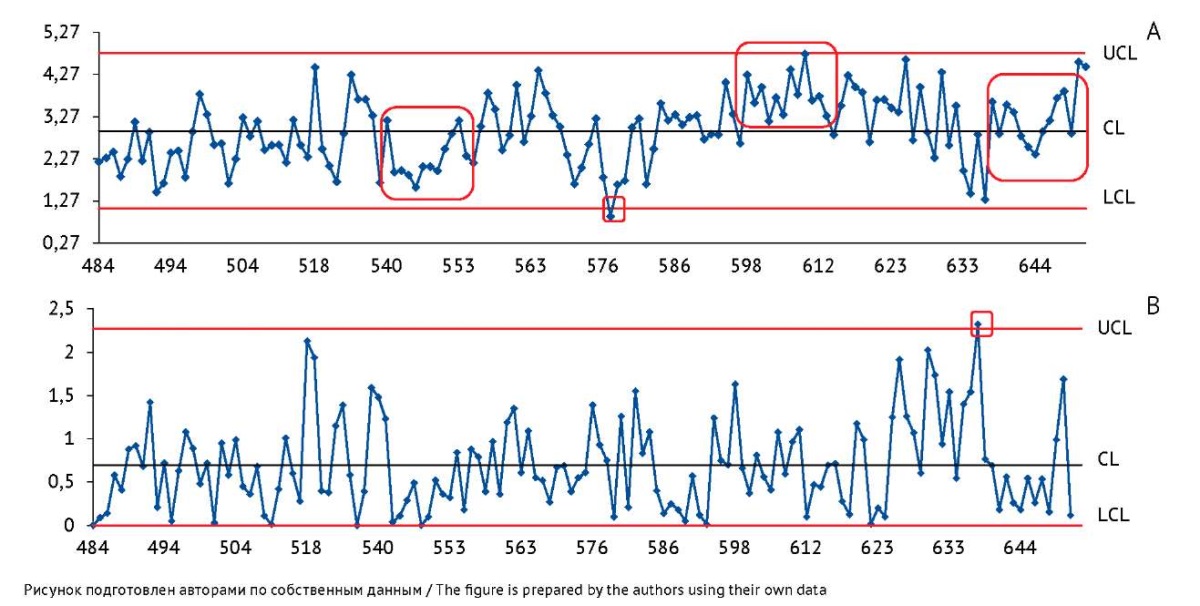
Рис. 4. Контрольные карты по значениям показателя качества «Потеря в массе при высушивании» вакцины БЦЖ для иммунотерапии рака мочевого пузыря, построенные по результатам контроля качества в испытательном центре. На карте индивидуальных значений (А) ось Y — индивидуальные значения показателя «Потеря в массе при высушивании» (%). На карте скользящих размахов (В) ось Y — значения размахов показателя между последовательными сериями препарата. Ось X — порядковые номера серий вакцины. CL — центральная линия; UCL и LCL — верхняя и нижняя контрольные границы. Область, выделенная красным цветом, включает точки, соответствующие одному из критериев особых причин.
Fig. 4. Control charts for the loss on drying measured at the testing centre during quality control of the BCG vaccine for bladder cancer immunotherapy. The Y-axis of the individuals control chart (A) shows individual loss-on-drying results (%). The Y-axis of the moving range control chart (B) shows quality indicator ranges between successive batches of the product. The X-axis shows sequential numbers of vaccine batches. CL, central line; UCL/LCL, upper/lower control limits. The area highlighted in red includes points that meet a special cause criterion.
Представленные данные демонстрируют признаки неуправляемости процесса, что делает невозможным использование полученных контрольных границ для мониторинга качества вакцины и указывает, что процесс был подвергнут воздействию особых причин. В такой ситуации предприятию-производителю необходимо стандартизировать процесс лиофилизации и методики определения потери в массе при высушивании для приведения процесса в статистически управляемое состояние.
Контрольные карты Шухарта по значениям показателя качества «Дисперсность». При проведении испытаний все значения по показателю качества «Дисперсность» соответствовали требованиям НД — не менее 1,2. Средние значения показателя производителя и ИЦ составили 1,40 и 1,39 соответственно при относительном стандартном отклонении не более 4,8% (табл. 2), что также может свидетельствовать о стабильности как производственного процесса, так и определения значений данного показателя. На построенных ККШ (рис. 5А, В) в начале наблюдаемого периода имелись признаки выхода процесса из состояния статистической управляемости: неоднородность размахов, выход точек за переделы контрольных границ, что может свидетельствовать о влиянии на процесс особых причин. Однако в период после серии 550 выявлена стабилизация процесса.
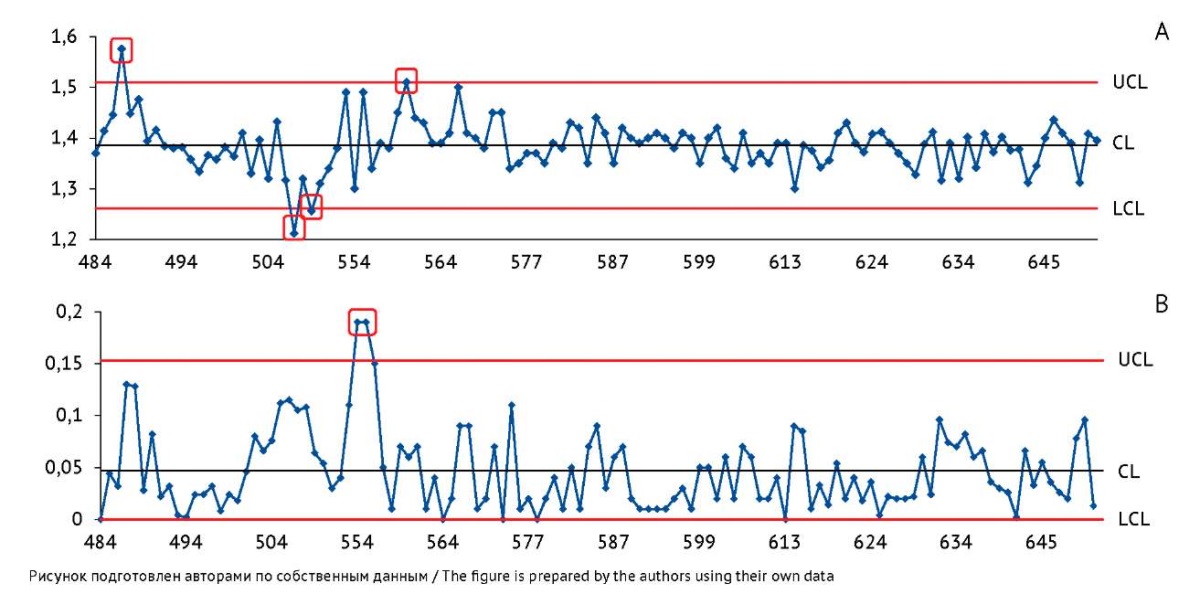
Рис. 5. Контрольные карты по значениям показателя качества «Дисперсность» вакцины БЦЖ для иммунотерапии рака мочевого пузыря, построенные по результатам контроля качества в испытательном центре. На карте индивидуальных значений (А) ось Y — индивидуальные значения показателя «Дисперсность» (n). На карте скользящих размахов (В) ось Y — значения размахов показателя между последовательными сериями препарата. Ось X — порядковые номера серий вакцины. CL — центральная линия; UCL и LCL — верхняя и нижняя контрольные границы. Область, выделенная красным цветом, включает точки, соответствующие одному из критериев особых причин.
Fig. 5. Control charts for the dispersity index measured at the testing centre during quality control of the BCG vaccine for bladder cancer immunotherapy. The Y-axis of the individuals control chart (A) shows individual dispersity index values (n). The Y-axis of the moving range control chart (B) shows quality indicator ranges between successive batches of the product. The X-axis shows sequential numbers of vaccine batches. CL, central line; UCL/LCL, upper/lower control limits. The area highlighted in red includes points that meet a special cause criterion.
При оценке стабильности проведения испытаний по данному показателю такими причинами могут являться смещение кюветы, плохая подготовка кюветы, ошибки при пробоподготовке, неверная установка длины волны. В соответствии с ГОСТ Р ИСО 7870-2-201517 данные, на которые могли повлиять эти причины, должны быть удалены, а контрольные границы пересчитаны.
Точки, оставшиеся после удаления данных за 2019 г., отображают собственную изменчивость процесса; контрольная карта демонстрирует состояние статистической управляемости, в связи с чем можно рассчитать более точные контрольные границы (рис. 6).
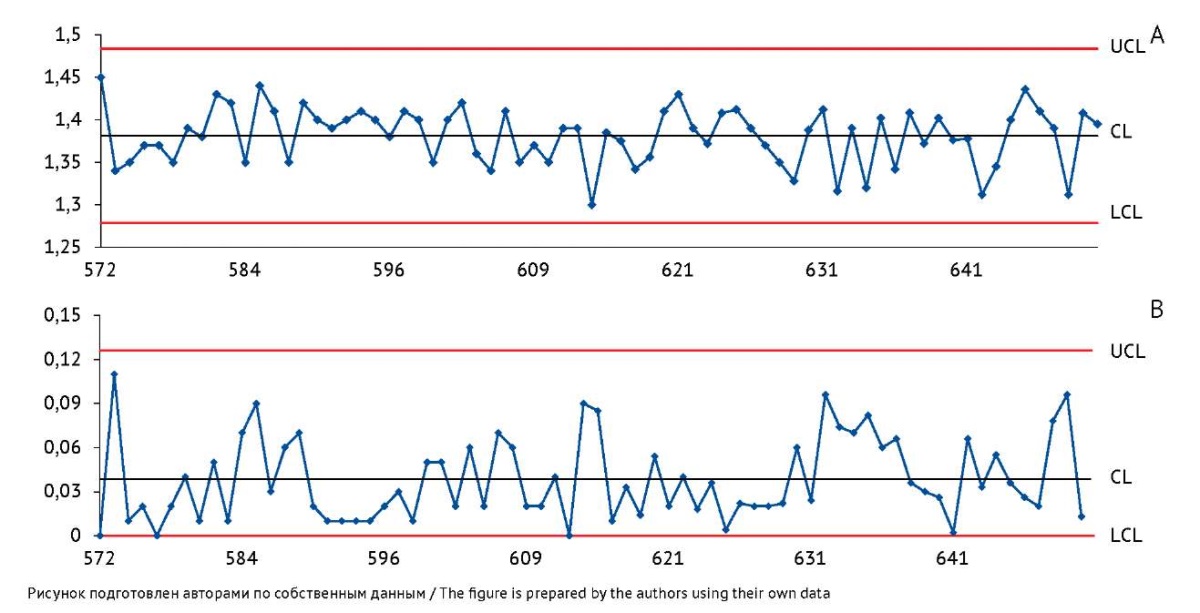
Рис. 6. Контрольные карты по значениям показателя качества «Дисперсность» вакцины БЦЖ для иммунотерапии рака мочевого пузыря, построенные по результатам контроля качества в испытательном центре после удаления данных по препаратам серий 484–571. На карте индивидуальных значений (А) ось Y — индивидуальные значения показателя «Дисперсность» (n); на карте скользящих размахов (В) ось Y — значения размахов показателя между последовательными сериями препарата. Ось X — порядковые номера серий вакцины. CL — центральная линия; UCL и LCL — верхняя и нижняя контрольные границы.
Fig. 6. Control charts for the dispersity index measured at the testing centre during quality control of the BCG vaccine for bladder cancer immunotherapy, without the results for batches 484–571. The Y-axis of the individuals control chart (A) shows individual dispersity index values (n). The Y-axis of the moving range control chart (B) shows quality indicator ranges between successive batches of the product. The X-axis shows sequential numbers of vaccine batches. CL, central line; UCL/LCL, upper/lower control limits.
Новые контрольные границы, определенные в ходе испытаний на подтверждение соответствия требованиям показателя качества «Дисперсность», можно использовать для дальнейшего мониторинга стабильности показателей качества в реальном времени с параметрами, приведенными в таблице 3.
Таблица 3. Параметры для мониторинга стабильности производства вакцины БЦЖ
для иммунотерапии рака мочевого пузыря по показателю качества «Дисперсность»
Table 3. Parameters for monitoring the consistency of production of the BCG vaccine
for bladder cancer immunotherapy by the dispersity index
Параметр Parameter | Значение параметра Parameter value |
Количество данных Amount of data | 68 |
Среднее значение показателя Mean value of the quality indicator | 1,394 |
Верхняя контрольная граница Upper control limit | 1,482 |
Нижняя контрольная граница Lower control limit | 1,307 |
Среднее значение скользящих размахов Mean value of moving ranges | 0,033 |
Верхняя контрольная граница карты скользящих размахов Upper control limit for the moving range chart | 0,107 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Таким образом, представленные в работе данные продемонстрировали признаки нестабильности процесса производства и/или процесса проведения испытания при оценке качества вакцины БЦЖ для иммунотерапии рака мочевого пузыря по показателям «Специфическая активность» и «Потеря в массе при высушивании». Принимая во внимание, что полученные результаты по показателю «Специфическая активность» не имеют нормального распределения, а показатель характеризуется широким диапазоном нормативных значений, построение контрольных границ для последующего мониторинга с помощью контрольных карт на данном этапе затруднительно. Однако согласно требованиям ГОСТ Р ИСО 7870-2-2015 (раздел 6)18 «небольшие отклонения характеристики процесса от нормального распределения не должны быть препятствием в использовании таких карт как эмпирической процедуры принятия решений».
Представленные данные по показателю «Потеря в массе при высушивании» указывают на признаки неуправляемости процесса, что делает невозможным использование полученных контрольных границ для мониторинга качества вакцины и свидетельствуют о необходимости стандартизации процесса лиофилизации и методики испытания. Таким образом, допускается возможность внедрения постоянного мониторинга производственного процесса даже в условиях его нестабильности.
Проведенный с помощью контрольных карт Шухарта анализ показателей качества «Общее содержание бактерий» и «Дисперсность» свидетельствует о стабильности процесса производства препарата вакцины БЦЖ для иммунотерапии рака мочевого пузыря, однако наличие предупреждающих сигналов указывает на необходимость проведения дополнительных мероприятий, направленных на стандартизацию технологического процесса.
Выводы
- Определены показатели качества вакцины для иммунотерапии рака мочевого пузыря, которые можно использовать для статистического анализа с помощью контрольных карт Шухарта: «Общее содержание бактерий», «Дисперсность», «Потеря в массе при высушивании» и «Специфическая активность».
- При сравнительном анализе средних значений показателей качества предприятия-производителя и испытательного центра установлено, что для показателей «Общее содержание бактерий» и «Дисперсность» средние значения и их стандартные отклонения совпадали и составляли 0,35±0,03 ОЕ и 1,4±0,1 соответственно. Для показателей «Потеря в массе при высушивании» и «Специфическая активность» наблюдается расхождение средних значений между предприятием-производителем и испытательным центром. Так, по показателю «Потеря в массе при высушивании» средние значения составили 1,5±0,6 и 2,9±0,8%, а по показателю «Специфическая активность» — 12,22±2,23 и 12,83±2,82 млн клеток/мг соответственно. При посерийном корреляционном анализе наблюдалась выраженная связь для всех показателей кроме показателя «Общее содержание бактерий» — значения коэффициента корреляции (r) составляли от 0,34 до 0,70.
- При оценке данных испытательного центра с помощью критерия согласия Пирсона выявлено нормальное распределение для показателей качества «Дисперсность» (χ²=14,03) и «Потеря в массе при высушивании» (χ²=4,93). При анализе карт по показателям «Потеря в массе при высушивании» и «Специфическая активность» наблюдались признаки выхода процесса производства и/или процесса проведения испытания из состояния статистической управляемости. При мониторинге показателей «Общее содержание бактерий» и «Дисперсность» выявлено, что было достигнуто состояние статистической управляемости. Установлены параметры для дальнейшего мониторинга стабильности производства вакцины БЦЖ для иммунотерапии рака мочевого пузыря по показателю «Дисперсность» в реальном времени: значение верхней контрольной границы — 1,482; значение нижней контрольной границы — 1,307; значение верхней контрольной границы карты скользящих размахов — 0,107.
- Проведенная оценка данных показала, что технологический процесс и/или методика проведения испытаний вакцины выходили из состояния статистической управляемости. Продемонстрирована необходимость внедрения контрольных карт Шухарта и постоянного мониторинга стабильности показателей качества для повышения стандартизации процессов и обеспечения высокого уровня выпускаемой продукции как на производстве вакцины, так и в испытательном центре, а также целесообразность дальнейших совместных исследований.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.А. Савина — экспериментальная работа по определению показателей качества вакцин, обобщение экспериментальных данных, анализ и интерпретация результатов, концепция работы, критический пересмотр текста рукописи, утверждение окончательной версии рукописи для публикации; А.А. Воропаев — концепция работы, экспериментальная работа по определению показателей качества вакцин; анализ и интерпретация результатов исследования; написание текста рукописи; А.А. Алесина — экспериментальная работа по определению показателей качества вакцин; анализ и интерпретация результатов исследования; написание текста рукописи.
Благодарности. Авторы благодарят О.В. Чапой, инженера-лаборанта лаборатории бактериальных вакцин, и Т.Н. Ермолаеву, эксперта 1 категории лаборатории бактериофагов и препаратов нормофлоры с коллекцией микроорганизмов Испытательного центра экспертизы качества медицинских иммунобиологических препаратов ФГБУ «НЦЭСМП» Минздрава России, за помощь в выполнении экспериментальной части работы.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. А.A. Savina tested vaccine samples for the quality indicators of interest, summarised the experimental data, analysed and interpreted the results, conceptualised the study, critically revised the manuscript, and approved the final version for publication. A.A. Voropaev conceptualised the study, tested vaccine samples for the quality indicators of interest, analysed and interpreted the study results, and drafted the manuscript. A.A. Alesina tested vaccine samples for the quality indicators of interest, analysed and interpreted the study results, and drafted the manuscript.
Acknowledgements. The authors express their gratitude to O.V. Chapoi, Laboratory Technician, Laboratory of Bacterial Vaccines, Centre for Biological Medicinal Products Evaluation and Control, Scientific Centre for Expert Evaluation of Medicinal Products, and T.N. Ermolaeva, 1st Professional Category Expert, Laboratory of Bacteriophages and Normal Flora Preparations with a Collection of Microorganisms, Centre for Biological Medicinal Products Evaluation and Control, Scientific Centre for Expert Evaluation of Medicinal Products, for their help with the experiments.
1. https://gco.iarc.fr/today/home
2. Государственный реестр лекарственных средств. https://grls.rosminzdrav.ru
3. Государственный реестр лекарственных средств. Инструкция по медицинскому применению препарата Имурон-вак (Вакцина БЦЖ для иммунотерапии рака мочевого пузыря). https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=2c603cdb-8b61-4ae5-b196-689e5e8ee3ef
4. ФС.3.3.1.0053.18 Вакцина БЦЖ для иммунотерапии рака мочевого пузыря живая. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
5. ГОСТ Р ИСО 7870-1-2022. Статистические методы. Контрольные карты. Часть 1. Общие принципы.
ГОСТ Р ИСО 7870-2-2015. Статистические методы. Контрольные карты. Часть 2. Контрольные карты Шухарта.
6. ГОСТ ISO/IEC 17025-2019. Общие требования к компетентности испытательных и калибровочных лабораторий.
7. ФС.3.3.1.0053.18 Вакцина БЦЖ для иммунотерапии рака мочевого пузыря живая. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
8. Там же.
9. Нормативная документация НД Р N001970/01–120722 Имурон-вак (Вакцина БЦЖ для иммунотерапии рака мочевого пузыря).
10. ФС.3.3.1.0053.18 Вакцина БЦЖ для иммунотерапии рака мочевого пузыря живая. Государственная фармакопея Российской Федерации. XIV изд. Т. 4; 2018.
11. ОФС.1.2.1.0010.15 Потеря в массе при высушивании. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
12. ГОСТ Р ИСО 7870-2-2015. Статистические методы. Контрольные карты. Часть 2. Контрольные карты Шухарта.
13. ГОСТ Р ИСО 7870-2-2015. Статистические методы. Контрольные карты. Часть 2. Контрольные карты Шухарта.
14. Там же.
15. Recommendations to assure the quality, safety and efficacy of BCG vaccines. Annex 3. WHO Technical Report Series No. 979. WHO; 2013.
16. Там же.
17. ГОСТ Р ИСО 7870-2-2015. Статистические методы. Контрольные карты. Часть 2. Контрольные карты Шухарта.
18. ГОСТ Р ИСО 7870-2-2015. Статистические методы. Контрольные карты. Часть 2. Контрольные карты Шухарта.
Список литературы
1. Jeong SH, Han JH, Jeong CW, Kim HH, Kwak C, Yuk HD, Ku JH. Clinical determinants of recurrence in pTa bladder cancer following transurethral resection of bladder tumor. BMC Cancer. 2022;22(1):631. https://doi.org/10.1186/s12885-022-09733-8
2. Коняшкина СЮ, Рева СА, Петров СБ. Лабораторные предикторы ответа на внутрипузырную БЦЖ-терапию у пациентов с немышечно-инвазивным раком мочевого пузыря. Вестник урологии. 2022;10(4):155–64. https://doi.org/10.21886/2308-6424-2022-10-4-155-164
3. Herr HW, Morales A. History of bacillus Calmette-Guerin and bladder cancer: an immunotherapy success story. J Urol. 2008;179(1):53–6. https://doi.org/10.1016/j.juro.2007.08.122
4. Jiang S, Redelman-Sidi G. BCG in bladder cancer immunotherapy. Cancers (Basel). 2022;14(13):3073. https://doi.org/10.3390/cancers14133073
5. Mukherjee N, Julián E, Torrelles JB, Svatek RS. Effects of Mycobacterium bovis Calmette et Guérin (BCG) in oncotherapy: bladder cancer and beyond. Vaccine. 2021;39(50):7332–40. https://doi.org/10.1016/j.vaccine.2021.09.053
6. Солонин СИ. Метод контрольных карт. М.–Берлин: Директ-Медиа; 2015. EDN: VQENBJ.
7. Шпер ВЛ. Инструменты качества и не только! Часть 7. Контрольные карты Шухарта (продолжение). Методы менеджмента качества. 2022;(2):48–54. EDN: CSBWIH
8. Ильюченко ИЮ, Чернова АП. Мониторинг системы водоподготовки. Контрольные карты Шухарта. Лаборатория и производство. 2020;13(3–4):130–9. https://doi.org/10.32757/2619-0923.2020.3-4.13.130.139
9. Zhu Fugen. Application of Shewhart control charts in the inspection of pharmaceutical manufacturing process. Int J Pharm Chem. 2019;5(1):1–11. https://doi.org/10.11648/j.ijpc.20190501.11
10. Suman G, Prajapati DR. Control chart applications in healthcare: a literature review. Int J Metrol Qual Eng. 2018;(9):5. https://doi.org/10.1051/ijmqe/2018003
11. Савина АА, Александрова НВ, Немировская ТИ. Мониторинг показателей качества вакцин для профилактики туберкулеза методом контрольных карт Шухарта. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(3):310–20. https://doi.org/10.30895/2221-996X-2023-23-3-310-320
12. Фадейкина ОВ, Воропаев АА, Давыдов ДС, Волкова РА. Оценка неопределенности результатов измерений при определении потери в массе при высушивании биологических лекарственных препаратов. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(3–1):452–62. https://doi.org/10.30895/2221-996X-2023-23-3-1-452-462
13. Moghawry HM, Rashed ME, Gomaa K, AbdelGhani S, Dishisha T. Development of a fast and precise potency test for BCG vaccine viability using flow cytometry compared to MTT and colony-forming unit assays. Sci Rep. 2023;13(1):11606. https://doi.org/10.1038/s41598-023-38657-x
14. Yang YC, Tsai MH, Cheng HF. Determine the potency of BCG vaccines by flow cytometer. Biotechnol Biotechnol Equip. 2011;(25):2394–8. https://doi.org/10.5504/BBEQ.2011.0048
15. Singh Jadaun GP, Kasana H, Malik N. Quality control testing of BCG vaccine: current practices and technological advancements. Int J Vaccine Res. 2016;1(1):4. https://doi.org/10.15226/2473-2176/1/1/00103
16. Gweon E, Choi C, Kim J, Kim B, Kang H, Park T, et al. Development of a new approach to determine the potency of bacille Calmette–Guérin vaccines using flow cytometry. Osong Public Health Res Perspect. 2017;8(6):389–96. https://doi.org/10.24171/j.phrp.2017.8.6.06
17. Федорова ОВ, Понкратова СА, Валеева РТ, Исламгулов ИР. Питательные среды в производствах медицинских и ветеринарных препаратов. Вестник Технологического университета. 2017;20(4):130–3. EDN: XYEEVX
18. Ларионова ЕЕ, Андриевская ИЮ, Андреевская СН, Смирнова ТГ, Севастьянова ЭВ. Культуральный метод исследования микобактерий. Плотные питательные среды. Вестник Центрального научно-исследовательского института туберкулеза. 2020;(3):75–86. https://doi.org/10.7868/S2587667820030103
Об авторах
А. А. СавинаРоссия
Савина Анна Александровна
Петровский б-р, д. 8, стр. 2, Москва, 127051
А. А. Воропаев
Россия
Воропаев Андрей Андреевич
Петровский б-р, д. 8, стр. 2, Москва, 127051
А. А. Алесина
Россия
Алесина Анна Алексеевна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Савина А.А., Воропаев А.А., Алесина А.А. Анализ качества вакцины БЦЖ для иммунотерапии рака мочевого пузыря с помощью контрольных карт Шухарта. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):76-90. https://doi.org/10.30895/2221-996X-2024-24-1-76-90
For citation:
Savina A.A., Voropaev A.A., Alesina A.A. Quality analysis of BCG vaccine for bladder cancer immunotherapy using Shewhart control charts. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):76-90. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-76-90


































