Перейти к:
Выделение новых бактериофагов Actinomyces oris и Aggregatibacter actinomycetemcomitans и исследование их биологических характеристик in vitro
https://doi.org/10.30895/2221-996X-2024-24-1-103-116
Резюме
АКТУАЛЬНОСТЬ. В связи с увеличением числа случаев возникновения инфекций пародонта, вызванных устойчивыми к антибиотикам штаммами бактерий Actinomyces oris и Aggregatibacter actinomycetemcomitans, способными формировать биопленки в полости рта, и недостаточной эффективностью противомикробных препаратов в борьбе с биопленками, актуальной задачей представляется выделение бактериофагов, активных в отношении данных бактерий.
ЦЕЛЬ. Выделение бактериофагов, активных в отношении Aggregatibacter actinomycetemcomitans и Actinomyces oris, изучение их биологических свойств и подбор оптимальных параметров культивирования системы «фаг-клетка» для получения чистых линий бактериофагов с высокими титрами.
МАТЕРИАЛЫ И МЕТОДЫ. Бактериофаги выделяли из биообразцов слюны, зубного налета и содержимого пародонтального кармана и определяли их характеристики: оптимальные значения множественности инфекции, время культивирования системы «фаг-клетка», устойчивость к различным температурам и рН, стабильность при хранении. Морфологию фагов изучали с помощью трансмиссионной электронной микроскопии. Морфологию негативных колоний, литическую активность, спектр хозяев и специфичность оценивали, используя спот-тестирование и метод Грациа. В работе использовали бактерии из коллекции штаммов НПЦ «Микромир».
РЕЗУЛЬТАТЫ. Выделены и изучены биологические свойства трех новых изолятов бактериофагов, активных в отношении A. oris (vB_AorP_1/G-12, vB_AorP_2/Ch-28, vB_AorP_3/Bl-35), и бактериофага, активного в отношении Ag. actinomycetemcomitans (vB_AacS_1/Dc-1). Фаги бактерий A. oris отнесены к подовирусам, а бактериофаг vB_AacS_1/Dc-1 – к сифовирусам. Фаги образуют полностью прозрачные бляшки округлой формы без ореола, диаметром от 0,8±0,1 до 4,0±0,2 мм. Установлено, что для получения чистых линий фагов с максимальными значениями титра оптимальными являются следующие параметры: значение множественности инфекции – 0,1–10, время культивирования системы «фаг-клетка» – 8–12 ч. Выявлена способность бактериофагов A. oris лизировать штаммы Actinomyces naeslundii. Из 15 исследуемых штаммов A. оris, бактериофаги vB_AorP_1/G-12, vB_AorP_2/Ch-28, vB_AorP_3/Bl-35 лизировали 10, 8 и 12 бактериальных штаммов соответственно, а изолят фага vB_AacS_1/Dc-1 проявлял литическую активность в отношении обоих тестируемых штаммов Ag. actinomycetemcomitans. Исследуемые фаги продемонстрировали стабильность при абиотическом стрессе и длительном хранении.
ВЫВОДЫ. Выделены три новых бактериофага, активных в отношении A. oris, и один бактериофаг, активный в отношении Ag. actinomycetemcomitans, а также изучены их биологические свойства. Выделенные бактериофаги являются перспективными для дальнейших научных исследований на клинических штаммах, а также для проведения полногеномного секвенирования.
Ключевые слова
Для цитирования:
Кочетова Т.А., Юскевич В.В., Зурабов Ф.М., Садикова Г.Т., Медведев П.В., Попова В.М. Выделение новых бактериофагов Actinomyces oris и Aggregatibacter actinomycetemcomitans и исследование их биологических характеристик in vitro. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):103-116. https://doi.org/10.30895/2221-996X-2024-24-1-103-116
For citation:
Kochetova T.A., Yuskevich V.V., Zurabov F.M., Sadykova G.T., Medvedev P.V., Popova V.M. Isolation of novel Actinomyces oris and Aggregatibacter actinomycetemcomitans bacteriophages and study of their biological characteristics in vitro. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):103-116. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-103-116
Введение
Микробиом ротовой полости включает от нескольких сотен до нескольких тысяч разнообразных видов микроорганизмов [1–3]. Сообщество микроорганизмов, обитающих в полости рта, характеризуется вариабельностью и уникальностью для разных индивидуумов [3]. Микробная колонизация патогенной и условно-патогенной микрофлорой и связанное с ней образование биопленки представляют серьезную проблему, влияющую на качество жизни и системное здоровье человека, так как способствуют развитию различных воспалительных заболеваний пародонта, вплоть до разрушения коллагеновых волокон, которые поддерживают зуб в альвеолярной кости [3–6]. Формирование биопленки на искусственных стоматологических поверхностях может привести к воспалению и разрушению мягких и твердых тканей, окружающих зубные имплантаты, коронки или протезы [3][6]. В связи с увеличением числа случаев возникновения пародонтальных инфекций, вызванных лекарственно-устойчивыми штаммами, и недостаточной эффективностью противомикробных препаратов в борьбе с биопленками, актуально использование антибактериальных препаратов на основе бактериофагов [4][6][7]. Основные преимущества фаготерапии: специфичность бактериофагов к определенному виду бактерий, способность лизировать антибиотикоустойчивые микроорганизмы, безопасность, отсутствие ущерба нормофлоре, а также эффективность в отношении не только бактерий в планктонном состоянии, но и бактерий в виде биопленки1 [4][6–8].
Бактерии Aggregatibacter actinomycetemcomitans и Actinomyces oris, способные формировать биопленку, являются одними из многих этиологических факторов заболеваний пародонта [1][6][9–13]. A. oris — грамположительный факультативно-анаэробный микроорганизм, ранний колонизатор в развитии биопленок полости рта, был идентифицирован при инфекциях корневых каналов, актиномикозах и периимплантите [1][2][9–11][14][15]. Основной патоген пародонта — Ag. actinomycetemcomitans — является поздним колонизирующим микроорганизмом, который выделялся при запущенных формах заболеваний пародонта, таких как локализованный агрессивный периодонтит, а также в полости рта здоровых людей [1][4][5][12][16–18]. Ag. actinomycetemcomitans — грамотрицательный факультативно-анаэробный патобионт полости рта, для жизнедеятельности которому требуется от 5 до 10% диоксида углерода [12][13][18]. Установлена роль Ag. actinomycetemcomitans и A. oris в развитии воспалительных заболеваний полости рта [4][5], в связи с чем приоритетной задачей является выделение бактериофагов против данных микроорганизмов.
Цель работы — выделение бактериофагов, активных в отношении Ag. actinomycetemcomitans и A. oris, изучение их биологических свойств и подбор оптимальных параметров культивирования системы «фаг–клетка» для получения чистых линий бактериофагов с высокими значениями титра.
Материалы и методы
Материалы
Штаммы бактерий и условия роста. Клинические изоляты A. oris G-12, A. oris Ch-28, A. oris Bl-35, Ag. actinomycetemcomitans Dc-1, использованные в данном исследовании, были получены из рабочей коллекции штаммов НПЦ «Микромир» (Россия). Подтверждение видовой (штаммовой) принадлежности изолятов проводили с использованием микроскопического, бактериологического, биохимического и масс-спектрометрического методов идентификации микроорганизмов.
Штаммы бактерий проверяли на наличие профагов индукцией ультрафиолетовым излучением [19], а также без воздействия индуцирующего фактора по методике, предложенной С. Лурией и Д. Дарнеллом [20]. Штаммы, проявляющие лизогенные свойства, выбраковывали.
Штаммы A. oris культивировали в течение 18–22 ч на BHI агаре (HiMedia Laboratories, Индия) или в BHI бульоне (HiMedia Laboratories, Индия) при температуре 37 °С в термостате (Binder, Германия).
Штаммы Ag. actinomycetemcomitans культивировали в течение 18–22 ч на BHI агаре или в BHI бульоне в атмосфере 10% углекислого газа в инкубаторе МСО-175 (SANYO, Япония) при температуре 37 °С.
Бактериофаги. Для выделения бактериофагов и проведения экспериментов использовали штаммы: A. oris G-12, A. oris Ch-28, A. oris Bl-35, Ag. actinomycetemcomitans Dc-1. Эти штаммы представляются наиболее удобными для производства бактериофагов и обладают наибольшей чувствительностью. Для каждого бактериофага использовали отдельный штамм: A. oris G-12 для vB_AorP_1/G-12, A. oris Ch-28 для vB_AorP_2/Ch-28, A. oris Bl-35 для vB_AorP_3/Bl-35 и Ag. actinomycetemcomitans Dc-1 для vB_AacS_1/Dc-1. Выделенные фаги были названы в соответствии с предложенной A.M. Kropinski с соавт. [21] системой наименований.
Методы
Выделение бактериофагов. Выделение бактериофагов и изучение их биологических свойств проводили методами, предложенными М. Адамсом [22] и Д.М. Гольдфарбом [23]. Образцы биоматериала из ротовой полости (слюна, зубной налет и содержимое пародонтального кармана) использовались в качестве источника для выделения фагов, специфичных к изолированным штаммам A. oris и Ag. actinomycetemcomitans.
Образцы биоматериала центрифугировали при 5000 об/мин в течение 20 мин на центрифуге Avanti J-E (Beckman Coulter, США) для удаления бактериальных клеток и крупных частиц [23]. Супернатант отделяли от осадка и фильтровали через мембранные фильтры с диаметром пор — 1,2; 0,45; 0,22 мкм (Sartorius, Германия).
Бактериофаги выделяли, используя метод обогащения «с подсевом»2. К 10 мл разлитого по пробиркам BHI бульона добавляли 1 мл культур A. oris и Ag. actinomycetemcomitans (10⁸ КОЕ/мл), взятых в экспоненциальной фазе роста. Одновременно в пробирки вносили 10 мл ранее приготовленного фильтрата и инкубировали при 37 °C в течение 24 ч для получения обогащенного фагового лизата [23]. В общей сложности для процедуры обогащения использовали 12 штаммов (10 штаммов A. oris и 2 штамма Ag. actinomycetemcomitans). После периода обогащения смеси центрифугировали при 5000 об/мин в течение 20 мин на центрифуге Avanti J-E (Beckman Coulter, США). Супернатант отделяли от осадка и центрифугировали на ультрацентрифуге Optima L-90K (Beckman Coulter, США) при 27000 об/мин в течение 120 мин. Осадок ресуспендировали в 0,05 М трис-HCl буфере (pH 7,0–7,2) и фильтровали через мембранные фильтры с диаметром пор — 1,2; 0,45; 0,22 мкм (Sartorius, Германия). Подтверждение наличия фагов в обогащенном лизате проводили путем точечного нанесения фильтрата фагов на бактериальный газон исследуемых культур (спот-тест) [24]. При обнаружении лизиса культуры в месте нанесения капли фильтрата бактериофагов или появлении в этом участке мелких стерильных пятен фаговые лизаты продолжали исследовать, используя метод агаровых слоев по Грациа [22][23].
Получение чистых линий бактериофагов. Для получения чистых линий бактериофагов отбирали единичную хорошо изолированную бляшку с помощью стерильного наконечника микропипетки. Бляшку помещали в 5 мл BHI бульона одновременно с чувствительной культурой в экспоненциальной фазе роста и обогащали в течение 24 ч [23]. Данную процедуру повторяли три раза для получения морфологически однородных негативных колоний с последующей стерилизующей фильтрацией. Чистые линии бактериофагов помещали в стерильные пробирки и хранили для дальнейших исследований при 4 °C.
Оценка морфологии негативных колоний бактериофага. Метод агаровых слоев по Грациа использовали для исследования морфологии бляшек фагов, активных в отношении A. oris и Ag. actinomycetemcomitans [22][23]. В пробирки с BHI агаром (0,4%) добавляли по 1,0 мл разведений титруемого бактериофага и по 0,1 мл бактериальной суспензии, затем высевали на предварительно подготовленные чашки с BHI агаром (1,5%). Морфологию бляшек изучали после инкубирования в течение 18–22 ч в условиях роста микроорганизмов, описанных ранее.
Электронная микроскопия. Морфологию вирионов исследовали с помощью трансмиссионной электронной микроскопии. Каплю очищенных фагов с титром 10⁹ бляшкообразующих единиц в 1 мл фаголизата (БОЕ/мл) наносили на медную подложку с последующим отрицательным окрашиванием 2% водным раствором уранилацетата (рН 3,0) и исследовали с использованием просвечивающего электронного микроскопа JEM-1011 (JEOL, Япония). Электронные микрофотографии были сделаны с помощью установленной на микроскоп камеры Erlangshen ES500W (Gatan, США). Оценку морфологических параметров бактериофагов проводили с использованием программы ImageJ3.
Определение оптимального значения множественности инфекции. Оптимальное значение множественности инфекции (multiplicity of infection, MOI) [25] для бактериофагов vB_AorP_1/G-12, vB_AorP_2/Ch-28 и vB_AorP_3/Bl-35 устанавливали с использованием термостата (Binder, Германия) при температуре 37 °С и в условиях анаэробной станции Whitley A35 (Don Whitley Scientific, Великобритания), предусматривающих замещение воздуха специальной бескислородной газовой смесью (N2 — 80%, CO2 — 10%, H2 — 10%) при 37 °С. Показатель MOI фага vB_AacS_1/Dc-1 определяли в атмосфере 10% углекислого газа в CO2 инкубаторе МСО-175 (SANYO, Япония) при 37 °С. Штаммы-хозяева A. oris G-12, A. oris Ch-28, A. oris Bl-35 и Ag. actinomycetemcomitans Dc-1 культивировали в BHI бульоне до ранней фазы экспоненциального роста — 10⁸ КОЕ/мл. Шесть различных концентраций бактериофагов были добавлены в жидкую питательную среду к штаммам-хозяевам для формирования множественности инфекции — 0,0001; 0,001; 0,01; 0,1; 1; 10 БОЕ/КОЕ [25]. После просветления пробирок образцы отбирали, а титр фагов определяли, используя метод Грациа [22][23]. Анализ проводили в трех отдельных испытаниях и рассчитывали средние значения титров фагов, полученные на каждом этапе эксперимента.
Определение оптимального времени культивирования. Оптимальное время культивирования [25] фагов vB_AorP_1/G-12, vB_AorP_2/Ch-28 на соответствующих тест-штаммах A. oris G-12 и A. oris Ch-28 устанавливали при значении MOI, равном 1, в условиях анаэробной станции Whitley A35 при температуре 37 °С. Для фага vB_AorP_3/Bl-35 оптимальное время культивирования определяли на тест-штамме A. oris Bl-35 при значении MOI, равном 10, в условиях анаэробной станции Whitley A35 при 37 °С, а для фага vB_AacS_1/Dc-1 — на тест-штамме Ag. actinomycetemcomitans Dc-1 при MOI 0,1 в атмосфере 10% углекислого газа в CO2 инкубаторе при 37 °С. Опытным путем находили оптимальное соотношение между временем культивирования и активностью фагов [25]. Для этого каждые 2 ч отбирали образец для определения титра фага по методу Грациа [22][23]. Изучаемый диапазон составил 12 ч. Анализ проводили в трех повторностях.
Определение спектра литической активности фагов. Литический спектр бактериофагов исследовали на 15 тест-культурах A. oris и 2 тест-культурах Ag. actinomycetemcomitans методом спот-тестирования [24].
Определение специфичности бактериофагов. Специфичность бактериофагов, активных в отношении A. oris, изучали методом спот-тестирования культур родственных видов [24]: A. naeslundii, A. canis, A. georgiae, A. graevenitzii, A. israelii, A. neuii, A. odontolyticus, A. meyeri, A. weissii. Штаммы получены из коллекции микроорганизмов НПЦ «Микромир» (Россия).
Чувствительность фагов к температуре и рН. Температурную устойчивость выделенных бактериофагов определяли по изменению количества жизнеспособных фаговых частиц после инкубации в твердотельном термостате «Термит» («ДНК-Технология», Россия) при различных температурах (4, 25, 37, 50, 60, 70, 80 и 90 °С) в течение 1 ч [26]. Контрольные пробирки не прогревали. Количество оставшихся фаговых частиц определяли, используя метод Грациа [22][23]. Исследование проводили в трех повторностях.
В ходе экспериментов по изучению чувствительности фагов к различным значениям рН среды фаговые фильтраты инкубировали в буферных растворах с различными значениями рН (2, 4, 7 и 11) при 25 °С в течение 1 ч [24]. Количество оставшихся фаговых частиц определяли, используя метод Грациа [22][23].
Стабильность фаголизатов при длительном хранении. Стабильность фаголизатов, хранящихся при температуре 4 °С, изучали путем отслеживания изменения титра фагов после 6 мес. хранения [27] с применением метода титрования по Грациа.
Статистическая обработка данных. Полученные результаты обрабатывали с использованием стандартного пакета программ Microsoft Office Excel, рассчитывая среднее арифметическое и стандартную ошибку.
Результаты и обсуждение
Проведено выделение новых бактериофагов, активных в отношении A. oris и Ag. actinomycetemcomitans, из образцов слюны, зубного налета и содержимого пародонтальных карманов (рис. 1). Использование данных образцов биоматериала для выделения фагов в настоящей работе обусловлено тем, что они могут являться средой обитания микроорганизмов A. oris и Ag. actinomycetemcomitans. Анализ литературных источников показал, что явление лизогении широко распространено среди штаммов Ag. actinomycetemcomitans, а выделенные бактериофаги в основном представляют собой умеренные миовирусы, полученные после различных индуцирующих воздействий на бактерию [6][16][28][29]. В настоящем исследовании новый бактериофаг, специфичный к Ag. actinomycetemcomitans, был выделен из объектов внешней среды без индуцирующего воздействия.
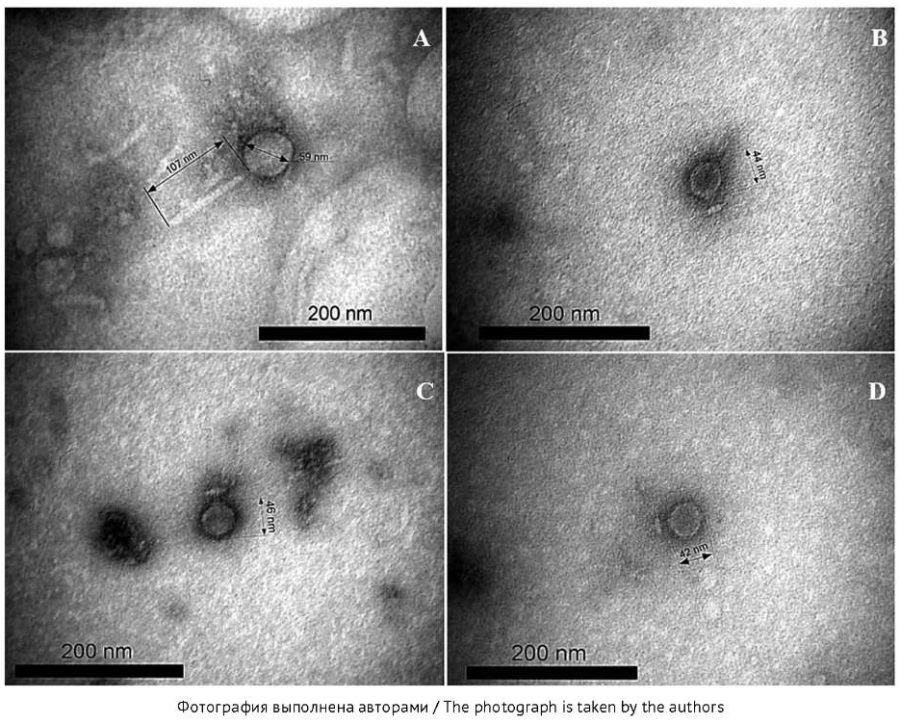
Рис. 1. Электронные микрофотографии фаговых частиц:
A — vB_AacS_1/Dc-1; B — vB_AorP_1/G-12;
С — vB_AorP_2/Ch-28; D — vB_AorP_3/Bl-35.
Контрастирование 2% раствором уранилацетата, увеличение ×250 000.
Fig. 1. Electron micrographs of bacteriophages:
vB_AacS_1/Dc-1 (A), vB_AorP_1/G-12 (B),
vB_AorP_2 /Ch-28 (C), and vB_AorP_3/Bl-35 (D).
Contrasting with 2% uranyl acetate solution, ×250 000.
Согласно данным трансмиссионной электронной микроскопии, изоляты фагов vB_AorP_1/G-12 (рис. 1B), vB_AorP_2/Ch-28 (рис. 1C), vB_AorP_3/Bl-35 (рис. 1D) имели икосаэдрический капсид и короткий несокращающийся хвостовой отросток. Бактериофаг vB_AacS_1/Dc-1 (рис. 1A) имел изометрическую головку и длинный несокращающийся хвостовой отросток. В соответствии с классификацией Международного комитета по таксономии вирусов (International Committee on Taxonomy of Viruses, ICTV)4 фаги бактерий A. oris были отнесены к подовирусам, а бактериофаг vB_AacS_1/Dc-1 — к сифовирусам. Оценка морфологии негативных колоний показала, что фаги vB_AorP_1/G-12, vB_AorP_2/Ch-28, vB_AorP_3/Bl-35 и vB_AacS_1/Dc-1 образуют полностью прозрачные бляшки округлой формы без ореола. Морфологические особенности вирионов фагов и морфология бляшек бактериофагов представлены в таблице 1.
Таблица 1. Морфологические особенности вирионов и морфология бляшек бактериофагов,
активных в отношении Actinomyces oris и Aggregatibacter actinomycetemcomitans
Table 1. Morphological characteristics of virions and plaques of bacteriophages
active against Actinomyces oris and Aggregatibacter actinomycetemcomitans
Морфология Morphology | Бактериофаг Bacteriophage | |||
vB_AorP_1/G-12 | vB_AorP_2/Ch-28 | vB_AorP_3/Bl-35 | vB_AacS_1/Dc-1 | |
Морфология капсида Capsid morphology | Икосаэдрический Icosahedral | Икосаэдрический Icosahedral | Икосаэдрический Icosahedral | Изометрический Isometric |
Морфология хвостового отростка Tail morphology | Короткий, несокращающийся Short, non-contractile | Короткий, несокращающийся Short, non-contractile | Короткий, несокращающийся Short, non-contractile | Длинный, несокращающийся Long, non-contractile |
Средний диаметр головки, нм Average head diameter, nm | 44,00±2,82 | 46,00±2,49 | 42,00±2,31 | 59,00±3,37 |
Длина хвостового отростка, нм Tail length, nm | – | – | – | 107,00±3,16 |
Размер прозрачной бляшки, мм Clear plaque size, mm | 0,8±0,1 | 1,0±0,2 | 4,0±0,2 | 1,2±0,2 |
Ореол бляшки Plaque halo | Отсутствует Absent | Отсутствует Absent | Отсутствует Absent | Отсутствует Absent |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Для получения чистых линий бактериофагов с высокими титрами важно определить следующие параметры: оптимальное значение MOI, представляющее собой среднее количество вирусных частиц на одну клетку, которое рассчитывается путем деления общего количества трансдуцирующих единиц на количество высеянных клеток; время культивирования системы «фаг–клетка»; стабильность фагов при абиотическом стрессе и при длительном хранении.
Проводили исследование MOI для бактериофагов vB_AorP_1/G-12, vB_AorP_2/Ch-28, vB_AorP_3/Bl-35 и vB_AacS_1/Dc-1 в диапазоне от 0,0001 до 10, чтобы определить оптимальные значения для получения максимальных титров каждого бактериофага. Условия для установления оптимальных значений MOI подобраны на основании культуральных свойств бактерий-хозяев. Результаты, представленные на рисунке 2, свидетельствуют о том, что для бактериофагов vB_AorP_1/G-12 и vB_AorP_2/Ch-28 оптимальное значение MOI равно 1, а самые высокие значения титра фагов получены в условиях анаэробной станции при 37 °C и составили (4,1±0,6)×10⁹ и (1,2±0,3)×10⁹ БОЕ/мл соответственно. Фаг vB_AorP_3/Bl-35 показал высокие значения титра и в условиях термостата, и анаэробной станции при MOI 10, однако наивысший титр достигнут в условиях анаэробной станции и составил (2,0±0,4)×10⁹ БОЕ/мл. Для бактериофага vB_AacS_1/Dc-1 оптимальное значение MOI в условиях CO2 инкубатора было 0,1, титр составил (4,5±0,5)×10⁹ БОЕ/мл (рис. 3). Эти значения MOI и условия культивирования использовали для дальнейших экспериментов, а также в технологии производства чистых линий бактериофагов.

Рис. 2. Результаты определения значения множественности инфекции для бактериофагов vB_AorP_1/G-12, vB_AorP_2/Ch-28 и vB_AorP_3/Bl-35 после 8 ч инкубации в условиях термостата (А) и анаэробной станции (В) при 37 °C. Ось X — значения множественности инфекции (MOI). Ось Y — значения титра бактериофагов vB_AorP_1/G-12, vB_AorP_2/Ch-28 и vB_AorP_3/Bl-35 в экспоненциальном виде, БОЕ/мл. Результаты основаны на трех повторностях экспериментов. Вертикальные маркеры погрешностей указывают отклонение от среднего значения.
Fig. 2. Results of determining the multiplicity of infection for vB_AorP_1/G-12, vB_AorP_2/Ch-28, and vB_AorP_3/Bl-35 after 8 hours of incubation in a thermostat (A) and an anaerobic station (B) at 37 °C. X-axis: multiplicity of infection (MOI). Y-axis: titres of vB_AorP_1/G-12, vB_AorP_2/Ch-28, and vB_AorP_3/Bl-35 in exponential form, PFU/mL. Results are based on triplicate experiments. Vertical error bars indicate the deviation from the mean.
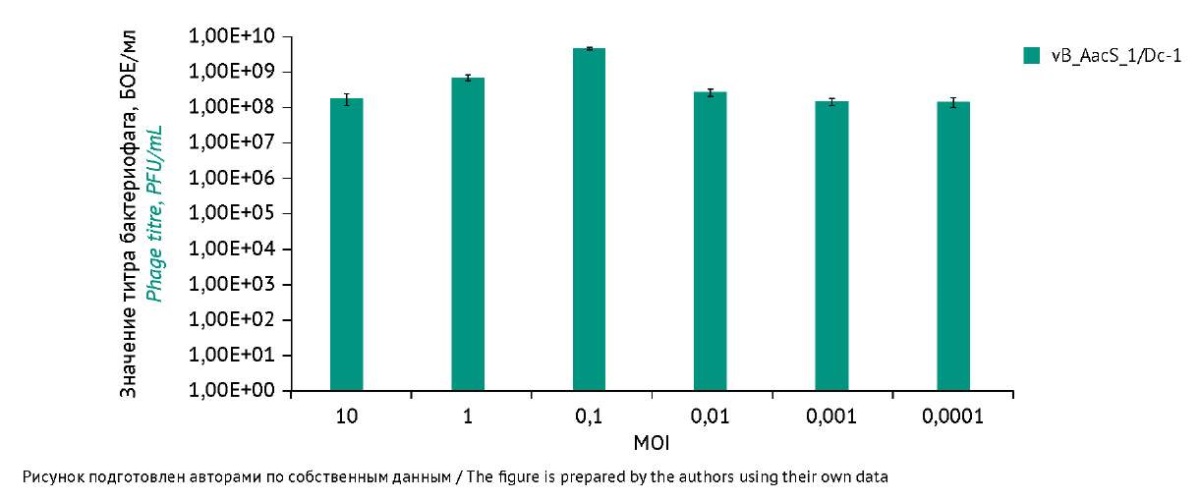
Рис. 3. Результаты определения значения множественности инфекции для бактериофага vB_AacS_1/Dc-1 после 10 ч инкубации в условиях CO2 инкубатора при 37 °C. Ось X — значения множественности инфекции (MOI). Ось Y — значения титра бактериофага vB_AacS_1/Dc-1 в экспоненциальном виде, БОЕ/мл. Результаты основаны на трех повторностях экспериментов. Вертикальные маркеры погрешностей указывают отклонение от среднего значения.
Fig. 3. Results of determining the multiplicity of infection for vB_AacS_1/Dc-1 after 10 hours of incubation in a CO2 incubator at 37 °C. X-axis: multiplicity of infection (MOI). Y-axis: titre of vB_AacS_1/Dc-1 in exponential form, PFU/mL. Results are based on triplicate experiments. Vertical error bars indicate the deviation from the mean.
Было установлено, что оптимальное время культивирования при температуре 37 °С для фагов vB_AorP_1/G-12, vB_AorP_2/Ch-28 и vB_AorP_3/Bl-35 составило 8–12 ч (рис. 4А–С). За это время происходил лизис тест-культуры (просветление среды по сравнению с контролем), значения титра фагов при этом были равны (3,4±1,1)×10⁹, (2,2±0,5)×10⁹, (1,8±0,6)×10⁹ БОЕ/мл соответственно. Для фага vB_AacS_1/Dc-1 оптимальное время культивирования при температуре 37 °С составило 10–12 ч, титр был равен (3,1±0,7)×10⁹ БОЕ/мл (рис. 4D). Полученные результаты зависимости значений титра фагов от времени культивирования были оптимальны для работы и использованы в дальнейших исследованиях, а также в технологии производства чистых линий бактериофагов. При исследовании литического спектра фагов обнаружено, что из 15 исследуемых штаммов A. оris бактериофаги vB_AorP_1/G-12, vB_AorP_2/Ch-28, vB_AorP_3/Bl-35 лизировали 10, 8 и 12 бактериальных штаммов соответственно. Изолят фага vB_AacS_1/Dc-1 проявлял литическую активность в отношении обоих тестируемых штаммов Ag. actinomycetemcomitans. Результаты исследования представлены в таблице 2.

Рис. 4. Соотношение между временем культивирования и активностью фагов при значении множественности инфекции (MOI), равном 1 (A — vB_AorP_1/G-12, B — vB_AorP_2/Ch-28), при значении MOI 10 (C — vB_AorP_3/Bl-35) и при значении MOI 0,1 (D — vB_AacS_1/Dc-1). Результаты основаны на трех повторностях экспериментов. Вертикальные маркеры погрешностей указывают отклонение от среднего значения.
Fig. 4. Phage activity as a function of incubation time at a multiplicity of infection of 1 (vB_AorP_1/G-12 (A) and vB_AorP_2/Ch-28 (B)), 10 (vB_AorP_3/Bl-35 (C)), and 0.1 (vB_AacS_1/Dc-1 (D)). Results are based on triplicate experiments. Vertical error bars indicate the deviation from the mean.
Таблица 2. Исследование чувствительности тест-штаммов
Actinomyces oris и Aggregatibacter actinomycetemcomitans к бактериофагам in vitro
Table 2. In vitro study of Actinomyces oris and Aggregatibacter actinomycetemcomitans
test strain sensitivity to bacteriophages
Бактериофаг Bacteriophage | Тест-штамм Test culture | Число исследованных штаммов, N Number of tested strains, N | Число чувствительных штаммов, n (%) Number of sensitive strains, n (%) |
vB_AorP_1/G-12 | A. oris | 15 | 10 (66,7%) |
vB_AorP_2/Ch-28 | A. oris | 15 | 8 (53,3%) |
vB_AorP_3/Bl-35 | A. oris | 15 | 12 (80%) |
vB_AacS_1/Dc-1 | Ag. actinomycetemcomitans | 2 | 2 (100%) |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Результаты исследования специфичности трех выделенных изолятов бактериофагов
vB_AorP_1/G-12, vB_AorP_2/Ch-28 и vB_AorP_3/Bl-35
свидетельствуют о том, что фаги проявляют свою активность и в отношении бактерии A. naeslundii, играющей важную роль в инициации и прогрессировании образования зубного налета (табл. 3) [30][31].
Таблица 3. Исследование специфичности бактериофагов,
активных в отношении Actinomyces oris, на культурах родственных видов in vitro
Table 3. In vitro study of the specificity of bacteriophages
active against Actinomyces oris in cultures of related species
Бактериофаг Bacteriophage | Тест-штамм Test culture | Число исследованных штаммов, N Number of tested strains, N | Число чувствительных штаммов, n (%) Number of sensitive strains, n (%) |
vB_AorP_1/G-12 | A. naeslundii | 9 | 9 (100%) |
A. odontolyticus | 22 | 0 (0%) | |
A. neuii | 2 | 0 (0%) | |
A. graevenitzii | 3 | 0 (0%) | |
A. canis | 1 | 0 (0%) | |
A. georgiae | 1 | 0 (0%) | |
A. israelii | 1 | 0 (0%) | |
A. meyeri | 1 | 0 (0%) | |
A. weissii | 1 | 0 (0%) | |
vB_AorP_2/Ch-28 | A. naeslundii | 9 | 6 (66,7%) |
A. odontolyticus | 22 | 0 (0%) | |
A. neuii | 2 | 0 (0%) | |
A. graevenitzii | 3 | 0 (0%) | |
A. canis | 1 | 0 (0%) | |
A. georgiae | 1 | 0 (0%) | |
A. israelii | 1 | 0 (0%) | |
A. meyeri | 1 | 0 (0%) | |
A. weissii | 1 | 0 (0%) | |
vB_AorP_3/Bl-35 | A. naeslundii | 9 | 5 (55,6%) |
A. odontolyticus | 22 | 0 (0%) | |
vB_AorP_3/Bl-35 | A. neuii | 2 | 0 (0%) |
A. graevenitzii | 3 | 0 (0%) | |
A. canis | 1 | 0 (0%) | |
A. georgiae | 1 | 0 (0%) | |
A. israelii | 1 | 0 (0%) | |
A. meyeri | 1 | 0 (0%) | |
A. weissii | 1 | 0 (0%) |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Четыре исследуемых фага продемонстрировали хороший потенциал сохранения литической активности в условиях абиотического стресса. Изоляты фагов vB_AorP_1/G-12 и vB_AacS_1/Dc-1 показали самую высокую термостойкость (60 мин при 80 °C) по сравнению с другими фагами (vB_AorP_2/Ch-28 и vB_AorP_3/Bl-35), которые были полностью инактивированы через 60 мин при 80 °C (рис. 5).
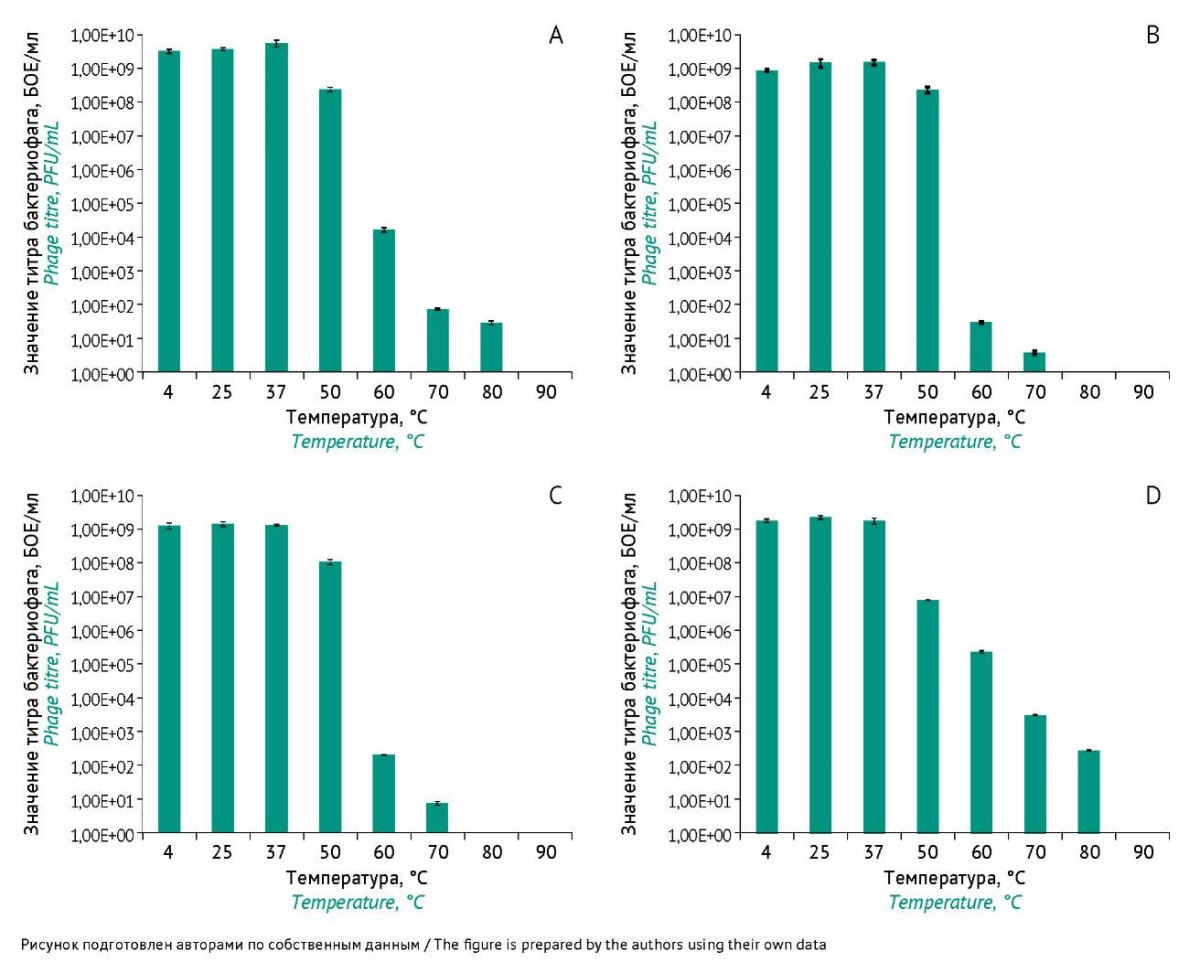
Рис. 5. Устойчивость к тепловому воздействию бактериофагов:
A — vB_AorP_1/G-12, B — vB_AorP_2/Ch-28, C — vB_AorP_3/Bl-35,
D — vB_AacS_1/Dc-1. Результаты основаны на трех повторностях экспериментов.
Вертикальные маркеры погрешностей указывают отклонение от среднего значения.
Fig. 5. Thermal resistance of bacteriophages:
vB_AorP_1/G-12 (A), vB_AorP_2/Ch-28 (B), vB_AorP_3/Bl-35 (C), and vB_AacS_1/Dc-1 (D).
Results are based on triplicate experiments.
Vertical error bars indicate the deviation from the mean.
При анализе устойчивости бактериофагов к различным значениям pH (табл. 4) среды было установлено, что при значении pH 2,0 выявлено инактивирующее воздействие на все фаги, активные в отношении A. oris. Изоляты фагов vB_AorP_1/G-12, vB_AorP_2/Ch-28 при значении pH 11,0 были полностью инактивированы, в то время как изолят фага vB_AorP_3/Bl-35 при этом же значении pH сохранял свою активность ((1,2±0,1)×10¹ БОЕ/мл). Бактериофаг vB_AacS_1/Dc-1 сохранял активность при всех изучаемых значениях pH.
Таблица 4. Исследование стабильности выделенных изолятов бактериофагов
при различных значениях pH
Table 4. Stability study of the isolated bacteriophages at different pH values
pH | Значение титра бактериофага, БОЕ/мл Phage titre, PFU/mL | |||
vB_AorP_1/G-12 | vB_AorP_2/Ch-28 | vB_AorP_3/Bl-35 | vB_AacS_1/Dc-1 | |
2 | 0 | 0 | 0 | (1,0±0,1)×10¹ |
4 | (1,0±0,05)×10⁵ | (5,0±0,5)×10⁵ | (3,0±0,3)×10¹ | (2,0±0,8)×10⁴ |
7 | (2,8±0,6)×10⁹ | (1,5±1,6)×10⁹ | (9,2±1,5)×10⁸ | (2,1±0,7)×10⁹ |
11 | 0 | 0 | (1,2±0,1)×10¹ | (1,0±0,3)×10¹ |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Активность фаговых лизатов, хранившихся при температуре 4 °C, исследовали по истечении 6 мес. Результаты показали, что значения титра не изменяются после хранения в течение 6 мес. при температуре 4 °C (табл. 5).
Таблица 5. Активность бактериофагов после хранения при 4 °C в течение 6 мес.
Table 5. Viability of bacteriophages after storage at 4 °C for 6 months
Бактериофаг Bacteriophage | Значение титра фага до хранения, БОЕ/мл Phage titre before storage, PFU/mL | Значение титра фага после 6 мес. хранения, БОЕ/мл Phage titre in 6 months, PFU/mL |
vB_AorP_1/G-12 | (3,4±1,1)×10⁹ | (3,5±0,3)×10⁹ |
vB_AorP_2/Ch-28 | (2,2±0,5)×10⁹ | (1,3±0,5)×10⁹ |
vB_AorP_3/Bl-35 | (1,8±0,6)×10⁹ | (1,0±0,8)×10⁹ |
vB_AacS_1/Dc-1 | (3,1±0,7)×10⁹ | (1,2±1,3)×10⁹ |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Заключение
Выделены три новых бактериофага, активных в отношении A. oris (vB_AorP_1/G-12, vB_AorP_2/Ch-28, vB_AorP_3/Bl-35), и один бактериофаг, активный в отношении Ag. actinomycetemcomitans (vB_AacS_1/Dc-1). Изучены биологические свойства бактериофагов, такие как морфология вирионов фагов и фаговых бляшек, литическая активность, спектр хозяев, множественность инфекции, время культивирования системы «фаг–клетка», специфичность. Исследуемые фаги продемонстрировали стабильность при абиотическом стрессе и длительном хранении. Таким образом, выделенные бактериофаги являются перспективными для дальнейших научных исследований на клинических штаммах, а также для проведения полногеномного секвенирования.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Т.А. Кочетова — сбор и анализ литературных данных, планирование экспериментов, выполнение экспериментальных работ (исследование специфичности и стабильности выделенных фагов, подбор оптимальных параметров культивирования системы «фаг–клетка») и статистическая обработка данных, обсуждение результатов исследования, написание текста рукописи; В.В. Юскевич — обобщение и обсуждение результатов исследования; Ф.М. Зурабов — критический анализ результатов исследования; Г.Т. Садикова — выполнение экспериментальных работ (исследование литической активности, спектра хозяев, морфологии фаговых бляшек); П.В. Медведев — электронно-микроскопические исследования бактериофагов; В.М. Попова — обсуждение результатов исследования, утверждение окончательной версии рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. T.A. Kochetova collected and analysed literature data, planned and conducted the experiments (studied the specificity and stability of isolated phages and selected optimal parameters for cultivating the phage–cell system), carried out statistical data processing, discussed the study results, and drafted the manuscript. V.V. Yuskevich generalised and discussed the study results. F.M. Zurabov critically analysed the study results. G.T. Sadykova performed the experiments (studied the lytic activity, the host spectrum, and the morphology of phage plaques). P.V. Medvedev performed electron microscopy of bacteriophages. V.M. Popova discussed the study results and approved the final version of the manuscript for publication.
1. Зайцев АВ, Зурабов АЮ, Говоров АВ, Васильев АО, Арефьева ОА, Зурабов ФМ и др. Бактериофаги в урологии: методические рекомендации. М.: АБВ-пресс; 2022.
2. Лабинская АС, Блинкова ЛП, Ещина АС, ред. Общая и санитарная микробиология с техникой микробиологических исследований: учебное пособие. М.: Медицина; 2004.
3. https://imagej.net/ij/
4. https://ictv.global/taxonomy
Список литературы
1. Periasamy S, Kolenbrander PE. Central role of the early colonizer Veillonella sp. in establishing multispecies biofilm communities with initial, middle, and late colonizers of enamel. J Bacteriol. 2010;192(12):2965–72. https://doi.org/10.1128/JB.01631-09
2. Wu C, Mishra A, Reardon ME, Huang IH, Counts SC, Das A, Ton-That H. Structural determinants of Actinomyces sortase SrtC2 required for membrane localization and assembly of type 2 fimbriae for interbacterial coaggregation and oral biofilm formation. J Bacteriol. 2012;194(10):2531–9. https://doi.org/10.1128/JB.00093-12
3. Sterzenbach T, Helbig R, Hannig C, Hannig M. Bioadhesion in the oral cavity and approaches for biofilm management by surface modifications. Clin Oral Investig. 2020;24(12):4237–60. https://doi.org/10.1007/s00784-020-03646-1
4. Das V, Vinod V, Biswas L, Kumar A, Biswas R. An update on possible alternative therapeutics for future periodontal disease management. J Appl Microbiol. 2023;134(1):lxac039. https://doi.org/10.1093/jambio/lxac039
5. Mombelli A. Microbial colonization of the periodontal pocket and its significance for periodontal therapy. Periodontol 2000. 2018;76(1):85–96. https://doi.org/10.1111/prd.12147
6. Szafrański SP, Winkel A, Stiesch M. The use of bacteriophages to biocontrol oral biofilms. J Biotechnol. 2017;250:29–44. https://doi.org/10.1016/j.jbiotec.2017.01.002
7. Tagliaferri TL, Jansen M, Horz HP. Fighting pathogenic bacteria on two fronts: phages and antibiotics as combined strategy. Front Cell Infect Microbiol. 2019;9:22. https://doi.org/10.3389/fcimb.2019.00022
8. Łusiak-Szelachowska M, Weber-Dąbrowska B, Górski A. Bacteriophages and lysins in biofilm control. Virol Sin. 2020;35(2):125–33. https://doi.org/10.1007/s12250-019-00192-3
9. Suzuki I, Shimizu T, Senpuku H. Role of SCFAs for fimbrillin-dependent biofilm formation of Actinomyces oris. Microorganisms. 2018;6(4):114. https://doi.org/10.3390/microorganisms6040114
10. Mishra A, Wu C, Yang J, Cisar JO, Das A, Ton-That H. The Actinomyces oris type 2 fimbrial shaft FimA mediates co-aggregation with oral streptococci, adherence to red blood cells and biofilm development. Mol Microbiol. 2010;77(4):841–54. https://doi.org/10.1111/j.1365-2958.2010.07252.x
11. Sanchez BC, Chang C, Wu C, Tran B, Ton-That H. Electron transport chain is biochemically linked to pilus assembly required for polymicrobial interactions and biofilm formation in the gram-positive actinobacterium Actinomyces oris. mBio. 2017;8(3):e00399-17. https://doi.org/10.1128/mBio.00399-17
12. Kachlany SC. Aggregatibacter actinomycetemcomitans leukotoxin: from threat to therapy. J Dent Res. 2010;89(6):561–70. https://doi.org/10.1177/0022034510363682
13. Danforth DR, Tang-Siegel G, Ruiz T, Mintz KP. A nonfimbrial adhesin of Aggregatibacter actinomycetemcomitans mediates biofilm biogenesis. Infect Immun. 2018;87(1):e00704-18. https://doi.org/10.1128/IAI.00704-18
14. Nambu T, Mashimo C, Maruyama H, Taniguchi M, Huang Y, Takigawa H, et al. Complete genome sequence of Actinomyces oris strain K20, isolated from an oral apical lesion. Microbiol Resour Announc. 2022;11(8):e0054122. https://doi.org/10.1128/mra.00541-22
15. Phichaphop C, Apiwattanakul N, Wanitkun S, Boonsathorn S. Bacterial endocarditis caused by Actinomyces oris: first reported case and literature review. J Investig Med High Impact Case Rep. 2020;8:2324709620910645. https://doi.org/10.1177/2324709620910645
16. Tang-Siegel GG, Chen C, Mintz KP. Increased sensitivity of Aggregatibacter actinomycetemcomitans to human serum is mediated by induction of a bacteriophage. Mol Oral Microbiol. 2023:38(1):58–70. https://doi.org/10.1111/omi.12378
17. Hbibi A, Bouziane A, Lyoussi B, Zouhdi M, Benazza D. Aggregatibacter actinomycetemcomitans: from basic to advanced research. Adv Exp Med Biol. 2022;1373:45–67. https://doi.org/10.1007/978-3-030-96881-6_3
18. Gholizadeh P, Pormohammad A, Eslami H, Shokouhi B, Fakhrzadeh V, Kafil HS. Oral pathogenesis of Aggregatibacter actinomycetemcomitans. Microb Pathog. 2017;113:303–11. https://doi.org/10.1016/j.micpath.2017.11.001
19. Романова НА, Феоктистова НА, Золотухин СН, Васильев ДА, Алешкин АВ. Сравнительная эффективность методов выделения фагов бактерий Bacillus megaterium. Вестник ветеринарии. 2013;(1):26–7. EDN: PLHIWV
20. Лурия С, Дарнелл Дж. Общая вирусология. М.: Мир; 1970.
21. Kropinski AM, Prangishvili D, Lavigne R. Position paper: the creation of a rational scheme for the nomenclature of viruses of Bacteria and Archaea. Environ Microbiol. 2009;11(11):2775–7. https://doi.org/10.1111/j.1462-2920.2009.01970.x
22. Адамс М. Бактериофаги. М.: Медгиз; 1961.
23. Гольдфарб ДМ. Бактериофагия. М.: Медгиз; 1961.
24. Peng SY, Chen LK, Wu WJ, Paramita P, Yang PW, Li YZ, Lai MJ, Chang KC. Isolation and characterization of a new phage infecting Elizabethkingia anophelis and evaluation of its therapeutic efficacy in vitro and in vivo. Front Microbiol. 2020;11:728. https://doi.org/10.3389/fmicb.2020.00728
25. Сульдина ЕВ. Разработка ускоренной схемы идентификации листерий с помощью фагового биопрепарата L.m 4УЛГАУ. Вестник Ульяновской государственной сельскохозяйственной академии. 2020;(4):191–7. https://doi.org/10.18286/1816-4501-2020-4-191-197
26. Орловская ПИ, Гирилович НИ, Пилипчук ТА, Мандрик-Литвинкович МН, Коломиец ЭИ. Влияние физико-химических факторов на выживаемость бактериофагов фитопатогенных бактерий. В кн.: Коломиец ЭИ, ред. Микробные биотехнологии: фундаментальные и прикладные аспекты. Минск: Беларуская навука; 2021. С. 204–11. https://doi.org/10.47612/2226-3136-2021-13-204-211
27. Кочетова ТА, Юскевич ВВ, Садикова ГТ, Попова ВМ. Выделение и изучение биологических свойств бактериофагов, специфичных к Bordetella bronchiseptica. Ветеринария сегодня. 2022;11(3):273–9. https://doi.org/10.29326/2304-196X-2022-11-3-273-279
28. Stevens RH, Preus HR, Dokko B, Russell DT, Furgang D, Schreiner HC, et al. Prevalence and distribution of bacteriophage phi Aa DNA in strains of Actinobacillus actinomycetemcomitans. FEMS Microbiol Lett. 1994;119(3):329–37. https://doi.org/10.1111/j.1574-6968.1994.tb06909.x
29. Loftus A, Delisle AL. Inducible bacteriophages of Actinobacillus actinomycetemcomitans. Curr Microbiol. 1995;30(5):317–21. https://doi.org/10.1007/BF00295508
30. Dige I, Raarup MK, Nyengaard JR, Kilian M, Nyvad B. Actinomyces naeslundii in initial dental biofilm formation. Microbiology (Reading). 2009;155(Pt 7):2116–26. https://doi.org/10.1099/mic.0.027706-0
31. Arai T, Ochiai K, Senpuku H. Actinomyces naeslundii GroEL-dependent initial attachment and biofilm formation in a flow cell system. J Microbiol Methods. 2015;109:160–6. https://doi.org/10.1016/j.mimet.2014.12.021
Об авторах
Т. А. КочетоваРоссия
Кочетова Татьяна Андреевна
Кисельный Нижний пер., д.5/23, стр.1, Москва, 107031
В. В. Юскевич
Россия
Юскевич Виктория Викторовна, канд. биол. наук
Кисельный Нижний пер., д.5/23, стр.1, Москва, 107031
Ф. М. Зурабов
Россия
Зурабов Федор Михайлович
Кисельный Нижний пер., д.5/23, стр.1, Москва, 107031
Г. Т. Садикова
Россия
Садикова Гульнур Тахавиевна
Кисельный Нижний пер., д.5/23, стр.1, Москва, 107031
П. В. Медведев
Россия
Медведев Павел Витальевич
Кисельный Нижний пер., д.5/23, стр.1, Москва, 107031
В. М. Попова
Россия
Попова Валентина Михайловна, канд. мед. наук
Кисельный Нижний пер., д.5/23, стр.1, Москва, 107031
Дополнительные файлы
Рецензия
Для цитирования:
Кочетова Т.А., Юскевич В.В., Зурабов Ф.М., Садикова Г.Т., Медведев П.В., Попова В.М. Выделение новых бактериофагов Actinomyces oris и Aggregatibacter actinomycetemcomitans и исследование их биологических характеристик in vitro. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):103-116. https://doi.org/10.30895/2221-996X-2024-24-1-103-116
For citation:
Kochetova T.A., Yuskevich V.V., Zurabov F.M., Sadykova G.T., Medvedev P.V., Popova V.M. Isolation of novel Actinomyces oris and Aggregatibacter actinomycetemcomitans bacteriophages and study of their biological characteristics in vitro. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):103-116. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-103-116


































