Перейти к:
Получение рекомбинантного флагеллина C Pseudomonas aeruginosa и изучение его иммунобиологических свойств
https://doi.org/10.30895/2221-996X-2024-24-1-91-102
Резюме
АКТУАЛЬНОСТЬ. Учитывая множественную устойчивость к антимикробным препаратам Pseudomonas aeruginosa – одного из основных возбудителей очаговых и генерализованных форм гнойно-воспалительных заболеваний у людей с ослабленным иммунитетом, актуальной представляется разработка эффективных профилактических вакцин против P. aeruginosa, а также усиление защитных свойств вакцин путем подбора адъювантов. Является перспективным использование флагеллина жгутиков P. aeruginosa как индуктора системы врожденного иммунитета за счет взаимодействия с толл-подобным рецептором 5 типа (TLR5) и активатора Т-клеточного иммунного ответа в качестве компонента или адъюванта при разработке вакцин.
ЦЕЛЬ. Получение рекомбинантного флагеллина С Р. aeruginosa и изучение его иммуногенных, протективных и адъювантных свойств.
МАТЕРИАЛЫ И МЕТОДЫ. Нуклеотидную последовательность гена fliC синтезировали с помощью ПЦР на основе матричной ДНК Р. aeruginosa РА-103 и встраивали в плазмиду pQE-30 для последующей экспрессии в клетках Escherichia coli М15. Очистку рекомбинантного флагеллина С (FliC) Р. aeruginosa проводили в два этапа: выделение телец включения и их последующее растворение в буферных растворах, содержащих мочевину и гуанидин гидрохлорид. Мышей иммунизировали внутрибрюшинно двукратно с двухнедельным интервалом с использованием очищенного рекомбинантного белка FliC (доза – 50 мкг на животное) и его комбинацией с поверхностным антигеном Klebsiella pneumoniae (соотношение 1:1). Образцы сыворотки крови иммунизированных мышей исследовали с помощью иммуноферментного анализа (ИФА) на наличие специфических антител к FliC. Защитные свойства FliC оценивали при экспериментальном внутрибрюшинном заражении мышей культурами Р. aeruginosa РА-103 и K. pneumoniae № 204.
РЕЗУЛЬТАТЫ. Получен штамм-продуцент рекомбинантного флагеллина С. Проведена наработка рекомбинантного белка FliC и его очистка (степень чистоты 97,6%). При анализе образцов сыворотки иммунизированных мышей в ИФА и оценке защитных свойств от экспериментально вызываемой инфекции показано, что очищенный рекомбинантный белок FliC обладал иммуногенными свойствами. В группе мышей, иммунизированных FliC, индекс эффективности защитных свойств при инфицировании P. aeruginosa соответствовал 3,0, что свидетельствует о протективном эффекте FliС. Рекомбинантный белок FliC проявлял адъювантные свойства при сочетанном использовании с поверхностным антигеном K. pneumoniae при инфицировании K. pneumonia – индекс эффективности составил 6,1.
ВЫВОДЫ. Очищенный рекомбинантный флагеллин С Р. aeruginosa обладал протективной активностью при экспериментальной синегнойной инфекции у мышей и проявлял адъювантные свойства при сочетанном введении с поверхностным антигеном K. pneumoniae, увеличивая его иммуногенность. Использование рекомбинантного флагеллина С перспективно для создании кандидатной вакцины против синегнойной инфекции.
Ключевые слова
Для цитирования:
Жеребцов А.П., Калошин А.А., Михайлова Н.А. Получение рекомбинантного флагеллина C Pseudomonas aeruginosa и изучение его иммунобиологических свойств. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):91-102. https://doi.org/10.30895/2221-996X-2024-24-1-91-102
For citation:
Zherebtsov A.P., Kaloshin A.A., Mikhailova N.A. Production and immunological characterisation of recombinant flagellin C of Pseudomonas aeruginosa. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):91-102. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-91-102
Введение
Синегнойная палочка (Pseudomonas aeruginosa) — аэробная грамотрицательная бактерия палочковидной формы с одним или двумя полярно расположенными жгутиками. P. aeruginosa обладает многочисленными факторами патогенности. В Российской Федерации P. aeruginosa является одним из основных микробных возбудителей нозокомиальных инфекций [1][2] и вызывает большое количество внутрибольничных осложнений, которые характеризуются высокой летальностью. Из-за природной и приобретенной резистентности P. aeruginosa к антибиотикам доступный выбор эффективных антисинегнойных препаратов сокращается [3–5], в связи с чем проблема разработки эффективных терапевтических препаратов для защиты от данной инфекции приобретает высокую медико-социальную значимость.
Одним из важных факторов патогенности P. aeruginosa является белок флагеллин — структурный компонент жгутика бактериальных клеток. Жгутик P. aeruginosa состоит из базального тела, крючка и нити и по структуре представляет собой многочисленные спирально расположенные копии белка флагеллина. Помимо роли в передвижении жгутик имеет решающее значение в некоторых других аспектах выживания, размножения и патогенности бактерий, таких как адгезия, секреция факторов вирулентности и образование биопленок [6]. Флагеллин является индуктором системы врожденного иммунитета за счет взаимодействия с толл-подобным рецептором 5 типа (toll-like receptor 5, TLR5) [7][8]. TLR5 после связывания с флагеллином бактерий и последующей активации NF-kB через адаптерный белок MyD88 вызывает продукцию противовоспалительных цитокинов. В экспериментальных исследованиях на мышах при введении флагеллина Salmonella typhimurium выявлен защитный эффект в отношении токсических воздействий бактерий, вирусов и радиации [9]. Кроме того, показана способность флагеллина вызывать активацию иммунного ответа и выступать в роли адъюванта при разработке вакцин; различные типы флагеллинов S. typhimurium продемонстрировали иммуногенный эффект для разных вакцин-кандидатов [10]. Флагеллин С (FliC) P. aeruginosa считается перспективным для включения в состав различных кандидатных вакцин [11], однако свойства флагеллина С остаются до конца неизученными.
Таким образом, исследование рекомбинантного флагеллина в качестве компонента вакцины против P. aeruginosa для стимуляции специфического иммунитета, а также в качестве адъюванта для усиления протективных свойств компонентов гибридных белков имеет важное значение. При этом иммуностимулирующие домены флагеллина возможно не только использовать в составе антисинегнойной вакцины, но и применять в составе других препаратов. Особый интерес вызывает исследование адъювантных свойств флагеллина С в сочетанной иммунизации с поверхностным антигеном Klebsiella pneumoniae, представляющим собой белки наружной мембраны и ЛПС, который успешно применяется в вакцинном препарате Иммуновак-ВП-4 [12].
Цель работы — получение рекомбинантного флагеллина С Р. aeruginosa и изучение его иммуногенных, протективных и адъювантных свойств.
Материалы и методы
Клонирование гена fliC
Полноразмерную нуклеотидную последовательность гена флагеллина С, fliC, синтезировали с помощью ПЦР на основе матричной ДНК штамма P. aeruginosa РА-103 (коллекция лаборатории протективных антигенов ФГБНУ НИИВС им И.И. Мечникова). Подбор праймеров проводили с использованием полноразмерной последовательности ДНК штамма P. aeruginosa РА-103 (база данных GenBank1).
Амплифицированный ген fliC встраивали в плазмиду pTZ57R с помощью коммерческого набора InsT/Aclone PCR Product Cloning Kit (Fermentas, Литва). Далее клонированный ген fliC вырезали из промежуточной плазмиды и встраивали по сайтам рестрикции BamHI и HindIII в плазмиду pQE-30 (Qiagen).
Получение штамма-продуцента рекомбинантного белка FliC
Полученной конструкцией трансформировали клетки штамма E. coli М15 (Qiagen). Отбор клонов проводили при помощи рестриктного анализа и секвенирования. Для индукции экспрессии добавляли изопропил-β-D-1-тиогалактопиранозид, ИПТГ (Amresco, США). Белковые продукты анализировали с использованием электрофореза в полиакриламидном геле (ПААГ) по методу Лэммли; окрашивание геля проводили красителем Кумасси R-250. В качестве белковых маркеров использовали набор белков с молекулярными массами 20, 25, 35, 50, 85, 120 кДа (Thermo Fisher Scientific, США).
Получение телец включения
Осадок бактериальной биомассы, полученной из 1 л культуральной жидкости, растворяли в литическом буфере (фосфатно-солевой буфер, 5 мM ЭДТА, 7 мM β-меркаптоэтанол, рН 7,0). Суспензию подвергали ультразвуковой дезинтеграции с использованием гомогенизатора ультразвукового Cole–Parmer 130-Watt Ultrasonic Processors (Cole–Parmer, США) в режиме максимальной мощности — 130 Вт. Далее проводили центрифугирование (Avanti J-E, Beckman Coulter, США) нерастворившейся фракции при скорости 10000 об/мин при 4 °С в течение 10 мин и затем удаляли супернатант. Полученный осадок ресуспендировали в растворе, содержащем 10 мМ NaCl, 6 мМ MgCl2, 10 мM CaCl2, 40 мМ Tris-HCl, pH 8,0, добавляли 10 мг/л РНКазы А (Sigma, США) и 10 мг/мл ДНКазы I (Sigma, США) и инкубировали 15 мин при температуре 37 °C. Полученную суспензию центрифугировали при скорости 10000 об/мин при 4 °С 10 мин с последующим удалением супернатанта. Осадок ресуспендировали в 20 мл отмывочного фосфатного буфера, содержащего 5 мМ ЭДТА, 20% сахарозы и 1% Triton Х-100, и инкубировали 10 мин при 4 °C. Затем центрифугировали со скоростью 10000 об/мин в течение 30 мин при 4 °C и собирали осадок, содержащий тельца включения.
Очистка рекомбинантного белка FliC
Для очистки рекомбинантного белка FliC, содержащегося в тельцах включения, была разработана оригинальная технология [13], основными этапами которой являются: удаление примесей, растворимых в буфере, содержащем 8 M мочевину; растворение рекомбинантного белка FliC в буфере, содержащем 6 M гуанидина хлорида; перевод рекомбинантного белка FliC в нативные условия при помощи диализа. Для проведения очистки применяли следующие буферные растворы: 8 М мочевина, 100 мМ NaH2PO4, 10 мМ Tris-HCl, рН 8,0; 4 M мочевина, 0,1 M NaH2PO4, 0,01 M Tris-HCl, рН 8,0; 6 M гуанидин гидрохлорид, 0,1 M NaH2PO4, 0,01 M Tris-HCl, рН 8,0. В нативные условия рекомбинантный белок FliC переводили с помощью диализа (диаметр пор мембраны 12,5 кДа) против 50 мМ Tris-HCl, pH 9,0 с шестью сменами буфера с интервалами 4 ч.
Определение концентрации эндотоксинов
Определение концентрации эндотоксинов в препаратах проводили с использованием количественного хромогенного ЛАЛ-теста (Hycult Biotech, Нидерланды) по конечной точке согласно требованиям Государственной фармакопеи Российской Федерации ОФС.1.2.4.0006.152.
Определение степени чистоты полученной белковой фракции рекомбинантного белка FliC
Оценка чистоты полученной белковой фракции рекомбинантного белка FliC проводилась при помощи обработки результатов электрофореза в ПААГ с использованием программного обеспечения Phoretix 1D (Total Lab, Великобритания).
Иммунизация мышей рекомбинантным белком FliС
Экспериментальные работы проводили на беспородных мышах-самках массой 14–16 г (питомник «Филиал Андреевка ФГБУН НЦБМТ ФМБА России»). Протокол исследования с использованием лабораторных животных был одобрен Локальным советом по этике при ФГБНУ НИИВС им. И.И. Мечникова (протокол учреждения № 7 от 29.09.2022).
Изучение протективных и адъювантных свойств рекомбинантного белка FliС проводили в опытах по иммунизации животных, которых далее подвергали инфицированию K. pneumoniae № 204 и P. aeruginosa РА-103 (из коллекции лаборатории протективных антигенов ФГБНУ НИИВС им. И.И. Мечникова). Для постановки экспериментов были сформированы 4 опытные группы мышей численностью по 40 особей, которым двукратно внутрибрюшинно с интервалом в 14 сут вводили тестируемые препараты: группа 1 — рекомбинантный белок FliС в дозе 50 мкг на животное; группа 2 — смесь рекомбинантного белка FliС и поверхностного антигена K. pneumoniae (предоставлен лабораторией протективных антигенов ФГБНУ НИИВС им. И.И. Мечникова) в дозах по 50 мкг на животное; группа 3 — поверхностный антиген K. pneumoniae в дозе 50 мкг на животное; группа 4 — смесь рекомбинантного белка FliС и поверхностного антигена K. pneumoniae в дозах по 50 мкг на животное. Две контрольные группы (группы 5 и 6) включали по 40 мышей.
Исследование гуморального иммунного ответа при иммунизации рекомбинантным белком FliС
Через 14 сут после иммунизации у пяти мышей из каждой группы брали кровь и в сыворотке определяли титры специфических антител к рекомбинантному белку FliС с использованием иммуноферментного анализа (ИФА). В лунках 96-луночного планшета (Costar, США) сорбировали рекомбинантный белок FliC в концентрации 10 мг/мл в течение ночи при 4 °С. При анализе использовали конъюгат антител кролика к IgG, IgA, IgM мыши с пероксидазой хрена в рабочих разведениях 1:5000 (ИМТЕК, Россия). В качестве субстрата применяли тетраметилбензидин. Определение оптической плотности проводили на спектрофотометре Multiskan FC (Thermo Fisher Scientific, США) при длине волны 450 нм. За положительный титр принимали разведения сыворотки, при которых фиксировали показатели оптической плотности (ОП), превышающие в два раза значения в контрольных лунках.
Экспериментальное инфицирование мышей
Экспериментальное инфицирование культурами P. aeruginosa PA-103 или K. pneumoniae № 204 проводили через две недели после курса иммунизации. Вирулентные культуры вводили мышам внутрибрюшинно, используя по пять доз (с двукратным шагом) для каждой группы. Животным опытных групп (1–4) вводили 12,5; 25; 50; 100 и 200 млн микробных клеток (м.к.) на одну мышь. Животным контрольных групп (5 и 6) вводили 6,25; 12,5; 25; 50 и 100 млн м.к. на одну мышь. Животных групп 1, 2 и 5 инфицировали P. aeruginosa PA-103, а животных групп 3, 4, и 6 — K. pneumoniae № 204. Через 7 сут после заражения проводили подсчет павших животных и рассчитывали ЛД50 (доза, вызывающая гибель 50% экспериментальных животных). Оценивали протективные и адъювантные свойства рекомбинантного FliC, основываясь на показателе ЛД50 и индексе эффективности в исследуемых группах.
Статистическая обработка результатов
ЛД50 вычисляли по формуле Кербера в модификации согласно руководству И.П. Ашмарина и А.А. Воробьева [14] (1):
 (1)
(1)
где А — максимальная инфекционная доза в опыте; В — количество животных, павших в группе; С — общее количество животных в группе; число в нижнем индексе означает номер заражающей дозы. Определение доверительных интервалов ЛД50 при p=0,95 проводили согласно руководству И.П. Ашмарина и А.А. Воробьева [14].
Индекс эффективности защитных свойств рассчитывали как отношение значения ЛД50 в опытной группе (группа иммунизированных инфицированных мышей) к значению ЛД50 контрольной группы (группа неиммунизированных инфицированных мышей).
Результаты и обсуждение
Получение рекомбинантного белка FliС
С целью получения рекомбинантного флагеллина С P. aeruginosa полноразмерную последовательность гена fliС синтезировали с помощью ПЦР на основе матричной ДНК штамма P. aeruginosa РА-103. Прямой праймер (5’-GGA TCC GCC TTG ACC GTC AAC ACC AAC ATC G) имел дополнительный сайт рестрикции BamHI, а обратный праймер (5’-AAG CTT AGC GCA GCA GGC TCA GAA CCG AC) — дополнительный сайт рестрикции HindIII, что было необходимо для встраивания в бактериальный экспрессионный плазмидный вектор pQE-30. С помощью ПЦР синтезировали амплификат с заданными размерами: чуть больше 1000 п.н. Этот амплификат включал ген fliС (без первого ATG кодона) с размером 1161 п.н. и два сайта рестрикции с размерами 6 п.н.
На первом этапе амплифицированный ген fliС клонировали, встраивая его в плазмиду pTZ57R с получением генно-инженерной конструкции pTZ57R-FliC. На следующем этапе ген fliС вырезали из промежуточной конструкции pTZ57R-FliС по сайтам рестрикции BamHI и HindIII, а затем по тем же сайтам рестрикции встраивали в плазмидный вектор pQE-30, предназначенный для регулируемой экспрессии в клетках E. coli штамма М15. В результате была получена рекомбинантная конструкция pQE-30-FliС (рис. 1), в которой целевой ген оказался под контролем модифицированного промотора бактериофага Т5.
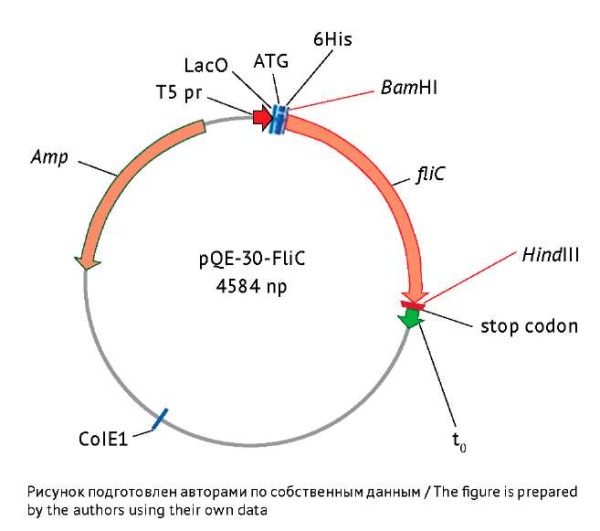
Рис. 1. Схема генно-инженерной конструкции pQE-30-FliC для синтеза рекомбинантного белка FliC. BamHI, HindIII — сайты рестрикции; 6His — регион, кодирующий шесть гистидинов; ATG — стартовый кодон, кодирующий метионин; LacO — лактозный оперон; T5 pr — модифицированный промотор бактериофага Т5; Amp — ген устойчивости к ампициллину; t0 — регион остановки транскрипции; ColE1 — участок инициации плазмидной репликации; np — пар нуклеотидов; stop codon — стоп-кодон.
Fig. 1. Scheme of the engineered pQE-30-FliC construct for recombinant FliС production. BamHI, HindIII, restriction sites; 6His, region encoding six histidine residues; ATG, start codon encoding methionine; LacO, lactose operon; T5 pr, modified T5 phage promoter; Amp, ampicillin resistance gene; t0, transcription termination site; ColE1, plasmid origin of replication; np, nucleotide pairs.
При электрофоретическом анализе белковых продуктов, полученных при культивировании клеток E. coli с конструкцией pQE-30-FliС после индукции экспрессии (добавление ИПТГ), был идентифицирован рекомбинантный белок c молекулярной массой 40 кДа, что соответствовало расчетным данным (40,7 кДа) (рис. 2). На рисунке 3 представлена аминокислотная последовательность рекомбинантного белка FliС, рассчитанная исходя из результатов секвенирования.
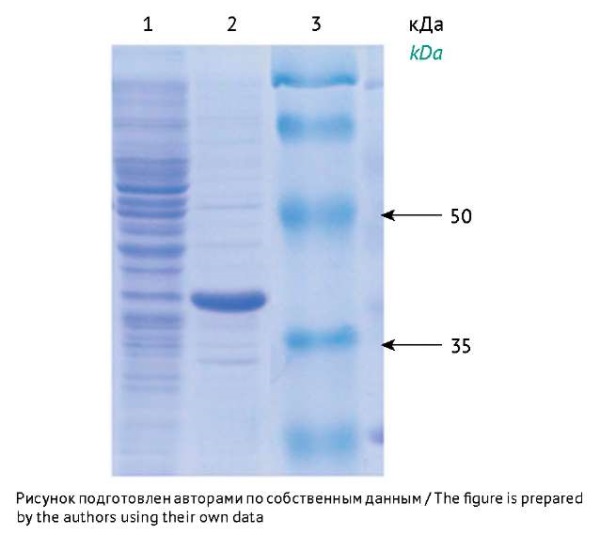
Рис. 2. Электрофореграмма образцов, полученных в результате экспрессии гена fliС, встроенного в плазмиду pQE-30 в клетках E. coli штамма М15. Дорожки на электрофореграмме: 1 — образец, содержащий белки из клеток штамма-продуцента FliС, полученные при наращивании биомассы продуцента в отсутствие индуктора (изопропил-β-D-1-тиогалактопиранозид, ИПТГ); 2 — образец, содержащий белки штамма-продуцента FliС, полученные при наращивании биомассы в присутствии индуктора ИПТГ; 3 — маркер молекулярной массы белка (стрелками отмечены молекулярные массы двух маркерных белков).
Fig. 2. Electropherogram of samples resulting from the expression of the fliС gene sequence inserted into the pQE-30 plasmid in E. coli M15 cells. Electropherogram lanes: 1, proteins from the FliС-producing strain cells obtained while growing producer biomass without expression induction (without the addition of isopropyl-β-D-1-thiogalactopyranoside, IPTG); 2, proteins from the FliС-producing strain cells obtained with IPTG; 3, protein molecular weight markers (molecular weights of two markers are indicated with arrows).

Рис. 3. Аминокислотная последовательность рекомбинантного белка FliС.
Подчеркнута дополнительная последовательность, содержащая 6 гистидинов.
Fig. 3. Amino acid sequence of the recombinant FliС protein.
The underscore marks the additional sequence of 6 histidines.
Очистка рекомбинантного белка FliС
Очистка рекомбинантного белка флагеллина С включала два этапа. На первом этапе получали тельца включения, для чего биомассу, содержащую целевой рекомбинантный продукт, подвергали ультразвуковой дезинтеграции и осаждали нерастворимую фракцию с помощью центрифугирования. При электрофоретическом анализе образца супернатанта было показано, что в нем в основном присутствовали белки клеток штамма-продуцента и не содержалось существенных количеств рекомбинантного белка FliС (рис. 4, дорожка 1). Осадок ресуспендировали, подвергали ферментативной обработке РНКазой и ДНКазой с последующей с ультразвуковой дезинтеграцией и центрифугировали для получения осадка, содержащего FliС. При электрофоретическом анализе образца супернатанта было выявлено, что в нем также в основном присутствовали белки клеток штамма-продуцента (рис. 4, дорожка 2). Для лучшего удаления примеси белков клеток штамма-продуцента осадок ресуспендировали в отмывочном буфере с последующим центрифугированием. Полученный на этой стадии супернатант содержал незначительное количество целевого рекомбинантного продукта, но при этом происходило удаление большей части примесных белков (рис. 4, дорожка 3). В то же время осадок содержал тельца включения, состоящие в основном из рекомбинантного белка FliС (рис. 4, дорожка 4).
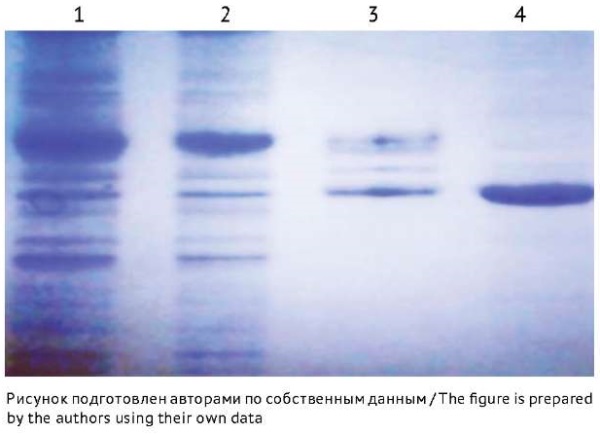
Рис. 4. Электрофореграмма образцов телец включения, содержащих рекомбинантный белок FliС с молекулярной массой 40 кДа. Дорожки на электрофореграмме: 1, 2, 3 — образцы супернатантов, полученных в процессе очистки телец включения; 4 — образец телец включения, содержащих рекомбинантный белок FliС.
Fig. 4. Electropherogram of inclusion body samples containing recombinant FliC with a molecular weight of 40 kDa. Electropherogram lanes: 1, 2, 3, supernatants obtained during the purification of inclusion bodies; 4, inclusion bodies containing recombinant FliC.
Для разработки оптимального метода очистки была проведена оценка растворимости рекомбинантного белка FliС, содержащегося в тельцах включения (рис. 5). Было установлено, что целевой рекомбинантный продукт тяжело поддавался растворению при инкубации в буфере с 8 М мочевиной. Так, через один час инкубации в буфере с мочевиной в режиме постоянного интенсивного перемешивания наблюдалось небольшое количество растворенного FliС. Через 12 ч в растворенное состояние переходила примерно половина рекомбинантного белка FliС (рис. 5А). На следующем этапе проводилось исследование растворимости FliС из телец включения при инкубации в буфере, содержащем 6 М гуанидин гидрохлорид. Было показано, что через час инкубации половина рекомбинантного белка FliС перешла в растворимую форму, а через 12 ч наблюдалось его полное растворение (рис. 5B).

Рис. 5. Анализ растворимости рекомбинантного белка FliС из телец включения в буферных растворах (A — буфер, содержащий 8 М мочевину; В — буфер, содержащий 6 М гуанидина гидрохлорида) по данным электрофореза. Дорожки на электрофореграмме: 1, 2, 3, 4 — образцы, полученные при растворении рекомбинантного белка FliС из телец включения при инкубации в буферном растворе в течение 15 мин, 30 мин, 1 ч и 12 ч соответственно; а — образцы осадков после центрифугирования; b — образцы супернатантов после центрифугирования.
Fig. 5. Electrophoresis-based analysis of the solubility of recombinant FliC from inclusion bodies in buffer solutions (A, buffer containing 8 M urea; B, buffer containing 6 M guanidine hydrochloride). Electropherogram lanes: 1, 2, 3, 4, recombinant FliC from inclusion bodies that dissolved in buffer solutions after incubation for 15 minutes, 30 minutes, 1 hour, and 12 hours, respectively; a, sediments after centrifugation; b, supernatants after centrifugation.
Супернатант, полученный после растворения рекомбинантного белка FliС из телец включения в буферном растворе, содержащем 6 М гуанидин гидрохлорид, использовали далее для проведения аффинной хроматографии с использованием никель-сефарозы. Однако применение данного метода очистки FliС оказалось неудачным, что, возможно, связано с высокой гидрофобностью белка. В связи с этим далее использовали альтернативный метод очистки рекомбинантного белка FliС. При разработке метода на первом этапе было проведено исследование растворимости FliС из телец включения в буфере, содержащем мочевину с разной концентрацией (8, 4 и 2 М). Инкубацию телец включения в этих условиях проводили в течение 30 мин. После инкубации осаждали нерастворимые компоненты с помощью центрифугирования. Было показано, что в описанных условиях инкубации весь рекомбинантный белок FliС оставался в нерастворимом состоянии (рис. 6).

Рис. 6. Анализ растворимости рекомбинантного белка FliС из телец включения в буферных растворах с различной концентрацией мочевины по данным электрофореза. Дорожки на электрофореграмме: 1, 2, 3 — образцы, полученные при растворении рекомбинантного белка FliС из телец включения при инкубации в буферном растворе, содержащем мочевину в концентрации 8 М, 4 М и 2 М соответственно; а — образцы осадков после центрифугирования; b — образцы супернатантов после центрифугирования.
Fig. 6. Electrophoresis-based analysis of the solubility of recombinant FliC from inclusion bodies in buffer solutions containing urea at different concentrations. Electropherogram lanes: 1, 2, 3, recombinant FliC from inclusion bodies that dissolved after incubation in buffer solutions containing urea at a concentration of 8 M, 4 M, and 2 M, respectively; a, sediments after centrifugation; b, supernatants after centrifugation.
Поскольку рекомбинантный белок FliС из телец включения не растворялся в буферном растворе мочевины, то это свойство было решено использовать для удаления примесей других белков, которые могут содержаться в тельцах включения. Для этого вначале тельца включения ресуспендировали в буферном растворе с 4 М мочевиной и инкубировали 30 мин (рис. 7, дорожка 1) с последующим центрифугированием. При этом, как было показано (рис. 7, дорожка 2), супернатант не содержал потерь целевого продукта. Далее FliС растворяли в течение 12 ч в буферном растворе с 6 М гуанидин гидрохлоридом с последующим центрифугированием и удалением нерастворимого осадка. Полученный супернатант, содержащий FliС (рис. 7, дорожка 4), подвергался диализу против 50 мМ Tris-HCl, pH 9,0. Степень чистоты рекомбинантного белка FliC составила 97,6%.

Рис. 7. Электрофореграмма образцов при получении очищенного препарата рекомбинантного белка FliС. Дорожки на электрофореграмме: 1 — образец телец включения, ресуспендированных в буферном растворе с 4 М мочевиной; 2 — образец супернатанта после центрифугирования ресуспендированных в буферном растворе с 4 М мочевиной телец включения; 3 — образец телец включения после инкубации в буферном растворе с 6 М гуанидин гидрохлоридом; 4 — образец супернатанта, содержащего рекомбинантный белок FliС, после осаждения обработанных буферным раствором с 6 М гуанидин гидрохлоридом телец включения.
Fig. 7. Electropherogram of samples obtained during the purification of recombinant FliC. Electropherogram lanes: 1, inclusion bodies resuspended in buffer containing 4 M urea; 2, supernatant after centrifugation of inclusion bodies resuspended in buffer containing 4 M urea; 3, inclusion bodies after incubation in buffer containing 6 M guanidine hydrochloride; 4, supernatant containing recombinant FliC after precipitation of inclusion bodies treated with buffer containing 6 M guanidine hydrochloride.
Изучение иммунобиологических свойств рекомбинантного белка FliС
Очищенный рекомбинантный белок FliС использовали для иммунизации мышей, вводя препарат внутрибрюшинно двукратно с двухнедельным интервалом в дозе 50 мкг на одно животное. Также иммунизировали мышей смесью рекомбинантного белка FliC и поверхностного антигена K. pneumoniae в соотношении 1:1. Отдельной группе мышей (группа 3) вводили поверхностный антиген K. pneumoniae.
В образцах сыворотки крови иммунизированных мышей выявлены высокие титры специфических антител. Установлено, что в группе животных, которым вводили рекомбинантный белок FliС, титр антител составлял 1:512000. В сыворотках мышей, иммунизированных смесью рекомбинантного белка FliС и поверхностного антигена K. pneumonia, титр антител соответствовал 1:128000. В сыворотках контрольных интактных (неиммунизированных) мышей титр антител составлял 1:100, что соответствовало фоновым значениям.
С целью оценки протективных и адъювантных свойств исследуемых антигенов проводили экспериментальное инфицирование мышей контрольных и опытных групп культурами P. aeruginosa РА-103 или K. pneumoniae № 204. Значение ЛД50 для контрольной группы животных, инфицированных P. aeruginosa, составило 29,7 млн м.к., а для контрольной группы животных, инфицированных K. pneumoniae — 35,0 млн м.к. (табл. 1, 2).
Таблица 1. Протективные свойства рекомбинантного белка FliС
при инфицировании мышей P. aeruginosa РА-103
Table 1. Protective properties of recombinant FliC
in mice challenged with P. aeruginosa PA-103
Группа животных Group of animals | Доза заражения, млн м.к. Challenge dose, mln m.c. | Количество мышей, павших/всего Number of mice, died/total | ЛД50, млн м.к. LD50, mln m.c. | ИЭ EI |
Группа 1. Мыши, иммунизированные рекомбинантным белком FliС Group 1. Animals immunised with recombinant FliC | 200 100 50 25 12,5 | 7/8 5/8 1/8 0/8 0/8 | 91,7 (60,3–147,9) | 3,1 |
Группа 2. Мыши, иммунизированные рекомбинантным белком FliС и поверхностным антигеном K. pneumoniae Group 2. Animals immunised with recombinant FliC and the surface antigen of K. pneumoniae | 200 100 50 25 12,5 | 4/8 2/8 0/8 0/8 0/8 | 154,0 (117,5–354,8) | 5,6 |
Группа 5. Контроль (неиммунизированные мыши) Group 5. Control animals (non-immunised mice) | 100 50 25 12,5 6,25 | 8/8 6/8 3/8 1/8 0/8 | 29,7 (19,5–44,7) | – |
Таблица составлена авторами по собственным данным/The table is prepared by the authors using their own data
Примечание. ЛД50 — доза, вызывающая гибель 50% экспериментальных животных; ИЭ — индекс эффективности; м.к. — микробные клетки.
Note. LD50, dose causing the death of 50% of test animals; EI, efficacy index; m.c., microbial cells.
Таблица 2. Протективные свойства рекомбинантного белка FliС
при инфицировании мышей K. pneumoniae № 204
Table 2. Protective properties of recombinant FliC
in mice challenged with K. pneumoniae 204
Группа животных Group of animals | Доза заражения, млн м.к. Infection dose, mln m.c. | Количество мышей, павших/всего Number of mice, died/total | ЛД50, млн м.к. LD50, mln m.c. | ИЭ EI |
Группа 3. Мыши, иммунизированные поверхностным антигеном K. pneumoniae Group 3. Animals immunised with the surface antigen of K. pneumoniae | 200 100 50 25 12,5 | 4/8 3/8 2/8 0/8 0/8 | 129,6 (85,1–223,9) | 3,6 |
Группа 4. Мыши, иммунизированные рекомбинантным белком FliС и поверхностным антигеном K. pneumoniae Group 4. Animals immunised with recombinant FliC and the surface antigen of K. pneumoniae | 200 100 50 25 12,5 | 2/8 1/8 0/8 0/8 0/8 | 218,0 (166,0–501,2) | 6,1 |
Группа 6. Контроль (неиммунизированные мыши) Group 6. Control animals (non-immunised mice) | 100 50 25 12,5 6,25 | 8/8 5/8 3/8 0/8 0/8 | 35,0 (25,1–50,1) | – |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ЛД50 — доза, вызывающая гибель 50% экспериментальных животных; ИЭ — индекс эффективности; м.к. — микробные клетки.
Note. LD50, dose causing the death of 50% of test animals; EI, efficacy index; m.c., microbial cells.
В группе мышей, иммунизированных рекомбинантным белком FliС и инфицированных P. aeruginosa (группа 1), значение ЛД50 составило 91,7 млн м.к., а индекс эффективности соответствовал 3,1, что свидетельствовало о протективном эффекте в отношении P. aeruginosa (табл. 1). При исследовании адъювантных свойств рекомбинантного белка FliС показано, что он способствовал усилению защитных свойств поверхностного антигена K. pneumoniae при экспериментальном инфицировании K. pneumonia мышей, иммунизированных комбинацией FliС + поверхностный антиген K. pneumonia (группа 4). Значение ЛД50 в этой группе составило 218,0 млн м.к. (индекс эффективности — 6,1), в то время как при иммунизации только поверхностным антигеном K. pneumoniae (группа 3) значение ЛД50 было равно 129,6 млн м.к. (индекс эффективности — 3,6) (табл. 2). Следует отметить, что поверхностный антиген K. pneumoniae также способствовал усилению протективного эффекта рекомбинантного белка FliС в группе мышей, инфицированных P. aeruginosa (группа 2), — сочетанная иммунизация приводила к увеличению значения ЛД50, которое составило 154,0 (индекс эффективности — 5,6) (табл. 1).
Поскольку рекомбинантный белок FliC был синтезирован в клетках E. coli, то конечный продукт мог содержать примесь бактериальных эндотоксинов, в частности липополисахарида (ЛПС) клеточной стенки бактерий E. coli. Известно, что ЛПС способен активировать TLR4, проявляя адъювантные свойства и повышая уровень иммунного ответа [15]. Для оценки содержания эндотоксина в препарате рекомбинантного белка FliC проводили определение его концентрации с использованием ЛАЛ-теста. В результате исследования было показано, что содержание эндотоксина в препарате составило 390 ЕЭ/мл (в одной иммунизирующей дозе — 19,5 ЕЭ/мл). Согласно требованиям Государственной фармакопеи Российской Федерации3 значение пороговой пирогенной дозы составляет не более 5 ЕЭ/кг/ч, что позволяет применять препарат рекомбинантного белка FliC (в дозе 0,5 мл) у пациентов с массой тела от 2 кг. В то же время следует отметить, что в препарате поверхностного антигена K. pneumoniae, содержащего ЛПС [16], который проявлял адъювантные свойства, содержание эндотоксина было более чем 39 000 ЕЭ/мл.
Заключение
В результате проведенных исследований получен штамм-продуцент рекомбинантного белка флагеллина С (FliС) P. aeruginosa. Разработан оригинальный метод очистки белка, который включал в себя несколько последовательных этапов: получение телец включения, удаление примесей с использованием буферных растворов мочевины и гуанидин гидрохлорида, диализ. Степень чистоты FliС составила 97,6%.
Полученный рекомбинантный белок FliС P. aeruginosa обладал протективной активностью в случае заражении мышей P. aeruginosa, а также проявлял адъювантные свойства при сочетанной иммунизации с поверхностным антигеном K. pneumoniae, увеличивая его иммуногенность у мышей, инфицированных K. pneumoniae.
Таким образом, разработка вакцины на основе рекомбинантной формы флагеллина С является перспективным подходом для иммунопрофилактики P. aeruginosa. В этой связи важным представляется дальнейшая оптимизация подходов, направленных на удаление из препарата рекомбинантного белка FliС P. aeruginosa остаточной примеси ЛПС, а также исследование его адъювантных свойств при совместном применении с другими антигенами.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.П. Жеребцов — отбор клонов штамма-продуцента; культивирование клеток-продуцентов; отработка методов очистки рекомбинантного белка FliС; участие в экспериментах по иммунизации животных и оценке иммунобиологических свойств FliС; сбор и анализ результатов исследования; анализ и обобщение данных литературы; статистическая обработка данных; написание, редактирование, оформление текста рукописи; работа с графическим материалом; А.А. Калошин — разработка дизайна и концепции экспериментального исследования (формулирование идеи, исследовательских целей и задач); анализ баз данных с подбором праймеров для ПЦР; синтез и клонирование рекомбинантного гена fliС; участие в отработке методов очистки рекомбинантного белка FliС; интерпретация результатов исследования; написание, редактирование и оформление текста рукописи; работа с графическим материалом; Н.А. Михайлова — разработка дизайна и концепции экспериментального исследования (формулирование идеи, исследовательских целей и задач); критический пересмотр содержания текста; утверждение окончательной версии рукописи для публикации.
Соответствие принципам этики. Протокол исследования с использованием лабораторных животных был одобрен Локальным советом по этике при ФГБНУ НИИВС имени И.И. Мечникова (протокол учреждения № 7 от 29.09.2022).
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. A.P. Zherebtsov selected producer strain clones; cultivated producer-cells; refined recombinant FliС purification methods; participated in animal immunisation experiments and immunological characterisation of the recombinant protein; collected and analysed the study results; analysed and summarised literature data; carried out statistical data analysis; drafted, edited, and formatted the manuscript; and worked with the graphical material. A.A. Kaloshin designed and conceptualised the experimental research (formulated the idea, aims, and objectives), analysed databases and selected PCR primers; synthesised and cloned the recombinant FliС gene; participated in refining the methods for recombinant FliС purification; interpreted the study results; drafted, edited, and formatted the manuscript; and worked with the graphical material. N.A. Mikhailova designed and conceptualised the experimental research (formulated the idea, aims, and objectives), critically revised the manuscript, and approved the final version for publication.
Ethics approval. The animal study protocol was approved by the Local Ethics Council at the I. Mechnikov Research Institute of Vaccines and Sera (Institution Protocol No. 7 dated 29 September 2022).
1. https://www.ncbi.nlm.nih.gov/nuccore/647734823
2. ОФС.1.2.4.0006.15 Бактериальные эндотоксины. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
3. ОФС.1.2.4.0006.15 Бактериальные эндотоксины. Государственная фармакопея Российской Федерации. XIV изд. Т. 1; 2018.
Список литературы
1. Колесова ТС. Этиологическая роль синегнойной палочки при различных оппортунистических и внутрибольничных инфекциях. Современная медицина: актуальные вопросы. 2017;(3):134–40. EDN: YHZVON
2. Лазарева АВ, Чеботарь ИВ, Крыжановская ОА, Чеботарь ВИ, Маянский НА. Pseudomonas aeruginosa: патогенность, патогенез и патология. Клиническая микробиология и антимикробная химиотерапия. 2015;17(3):170–86. EDN: UHPUWP
3. Pang Z, Raudonis R, Glick BR, Lin TJ, Cheng Z. Antibiotic resistance in Pseudomonas aeruginosa: mechanisms and alternative therapeutic strategies. Biotechnol Adv. 2019;37(1):177–92. https://doi.org/10.1016/j.biotechadv.2018.11.013
4. Карпунина ТИ, Кузнецова МВ, Николаева НВ, Демаков ВА. Эпидемиологические аспекты нозокомиальной синегнойной инфекции в многопрофильном хирургическом стационаре. Сибирский медицинский журнал. 2009;24(4–1):70–3. EDN: KZFTAP
5. Parkins MD, Somayaji R, Waters VJ. Epidemiology, biology, and impact of clonal Pseudomonas aeruginosa infections in cystic fibrosis. Clin Microbiol Rev. 2018;31(4):e00019-18. https://doi.org/10.1128/cmr.00019-18
6. Nedeljković M, Sastre DE, Sundberg EJ. Bacterial flagellar filament: a supramolecular multifunctional nanostructure. Int J Mol Sci. 2021;22(14):7521. https://doi.org/10.3390/ijms22147521
7. Hajam IA, Dar PA, Shahnawaz I, Jaume JC, Lee JH. Bacterial flagellin – a potent immunomodulatory agent. Exp Mol Med. 2017;49(9):e373. https://doi.org/10.1038/emm.2017.172
8. Духовлинов ИВ, Богомолова ЕГ, Федорова ЕА. и др. Исследование протективной активности кандидатной вакцины против ротавирусной инфекции на основе рекомбинантного белка FliCVP6VP8. Медицинская иммунология. 2016;18(5):417–24. https://doi.org/10.15789/1563-0625-2016-5-417-424
9. Софронов ГА, Мурзина ЕВ, Болехан ВН, Веселова ОМ, Симбирцев АС. Перспективные направления использования препаратов на основе рекомбинантного флагеллина. Медицинский академический журнал. 2017;17(2):7–20. EDN: WUERXU
10. Cui B, Liu X, Fang Y, Zhou P, Zhang Y, Wang Y. Flagellin as a vaccine adjuvant. Expert Rev Vaccines. 2018;17(4):335–49. https://doi.org/10.1080/14760584.2018.1457443
11. Felgner S, Spöring I, Pawar V, Kocijancic, Preusse M, Falk C, Rohde M, et al. The immunogenic potential of bacterial flagella for Salmonella-mediated tumor therapy. Int J Cancer. 2020;147(2):448–60. https://doi.org/10.1002/ijc.32807
12. Егорова НБ, Курбатова ЕА, Ахматова НК, Грубер ИМ. Поликомпонентная вакцина Иммуновак-ВП-4 и иммуно-терапевтическая концепция ее использования для профилактики и лечения заболеваний, вызываемых условно патогенными микроорганизмами. Журнал микробиологии, эпидемиологии и иммунобиологии. 2019;96(1):43–9. https://doi.org/10.36233/0372-9311-2019-1-43-49
13. Калошин АА, Жеребцов АП, Михайлова НА. Рекомбинантная плазмидная ДНК PPA-FLICC, кодирующая синтез рекомбинантного флагеллина-С Pseudomonas aeruginosa, штамм Escherichia coli PA-FLICC – продуцент гибридного рекомбинантного белка и способ получения указанного белка. Патент Российской Федерации № 2793753; 2023. EDN: RAOQAM.
14. Ашмарин ИП, Воробьев АА. Статистические методы в микробиологических исследованиях. Ленинград: Медгиз; 1962.
15. Xu SF, Wang P, Liang ZX, Sun JP, Zhao XW, Li AM, Chen LA. Investigation of inflammatory responses of pulmonary microvascular endothelial cells induced by lipopolysaccharide and mechanism. Zhonghua Jie He He Hu Xi Za Zhi. 2011;34(11):816–20 (In Chinese.). PMID: 22333467.
16. Follador R, Heinz E, Wyres KL, Ellington MJ, Kowarik M, Holt KE, Thomson NR. The diversity of Klebsiella pneumonia surface polysaccharides. Microb Genom. 2016;2(8):e000073. https://doi.org/10.1099/mgen.0.000073
Об авторах
А. П. ЖеребцовРоссия
Жеребцов Антон Павлович
Малый Казенный пер., д. 5А, Москва, 105064
А. А. Калошин
Россия
Калошин Алексей Алексеевич, канд. биол. наук
Малый Казенный пер., д. 5А, Москва, 105064
Н. А. Михайлова
Россия
Михайлова Наталья Александровна, д-р мед. наук, проф.
Малый Казенный пер., д. 5А, Москва, 105064
Дополнительные файлы
Рецензия
Для цитирования:
Жеребцов А.П., Калошин А.А., Михайлова Н.А. Получение рекомбинантного флагеллина C Pseudomonas aeruginosa и изучение его иммунобиологических свойств. БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):91-102. https://doi.org/10.30895/2221-996X-2024-24-1-91-102
For citation:
Zherebtsov A.P., Kaloshin A.A., Mikhailova N.A. Production and immunological characterisation of recombinant flagellin C of Pseudomonas aeruginosa. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):91-102. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-91-102


































