Перейти к:
Применение альтернативных методов оценки качества вакцины туляремийной живой и вакцины бруцеллезной живой по показателю «Подлинность»
https://doi.org/10.30895/2221-996X-2024-24-1-61-75
Резюме
АКТУАЛЬНОСТЬ. Применение российских диагностических препаратов для оценки качества вакцин, поиск альтернативных методов, в том числе серологических исследований (испытаний), особенно актуальны в современных условиях санкций.
ЦЕЛЬ. Показать возможность применения для оценки качества вакцины бруцеллезной живой и вакцины туляремийной живой по показателю «Подлинность» в серологических исследованиях (испытаниях) альтернативных методов: иммуноферментного анализа (ИФА), реакции агглютинации (РА), реакции непрямой гемагглютинации (РНГА).
МАТЕРИАЛЫ И МЕТОДЫ. Применяли фармакопейный стандартный образец (ФСО) мутности бактериальных взвесей 10 МЕ; вакцину бруцеллезную живую (вакцинный штамм Brucella abortus 19 BА) — ФСО и две коммерческие серии; вакцины туляремийные живые (вакцинный штамм Francisella tularensis 15 НИИЭГ) — ФСО и образец кандидата в ФСО. Все ФСО аттестованы ФГБУ «НЦЭСМП» Минздрава России. Использовали российские коммерческие диагностические препараты для серологических исследований: сыворотки диагностические — поливалентную бруцеллезную сухую для РА и туляремийную сухую для РА; диагностикум эритроцитарный туляремийный иммуноглобулиновый жидкий; тест-системы диагностические для выявления в ИФА возбудителей бруцеллеза и туляремии. Статистический анализ ИФА проводили в программе Microsoft Excel (P=0,95), РА и РНГА оценивали качественно.
РЕЗУЛЬТАТЫ. Получены положительные результаты для всех исследуемых серий: вакцины бруцеллезной живой — в РА, вакцины туляремийной живой — в развернутой РА. Во всех испытаниях в РНГА вакцины туляремийной живой (концентрация 6,25×10⁶ м.к./мл, как в положительном контроле) наблюдалась гемагглютинация. Во всех испытаниях методом ИФА значения оптической плотности (D) обеих вакцин и положительного контроля были приближены: для вакцины туляремийной живой и вакцины бруцеллезной живой (цельные, концентрацией 1,0×10⁹ м.к./мл) D=2,133±0,273 (в контроле 1,942±0,056) и D=0,127±0,013 (в контроле 0,123±0,007) соответственно. Результаты свидетельствуют о наличии в образцах бруцеллезного или туляремийного микроба, что подтверждает подлинность вакцин.
ВЫВОДЫ. Серологические испытания методами ИФА, РА и РНГА с использованием российских диагностических препаратов показали возможность их применения для оценки качества вакцины бруцеллезной живой и вакцины туляремийной живой по показателю «Подлинность». Простой визуальный учет результатов, невысокая стоимость, экономия времени и относительно большой срок годности диагностических препаратов позволяют рекомендовать РА с российскими диагностическими сыворотками как альтернативный метод для оценки качества вакцины бруцеллезной живой и вакцины туляремийной живой по показателю «Подлинность». Вследствие трудоемкости и неэкономичности методов ИФА и РНГА рекомендовать их для оценки качества вакцин нецелесообразно. Результаты могут служить основанием для внесения метода РА в нормативные документы на вакцину бруцеллезную живую и вакцину туляремийную живую в качестве альтернативного метода.
Ключевые слова
Для цитирования:
Касина И.В., Алексеева С.А., Немировская Т.И. Применение альтернативных методов оценки качества вакцины туляремийной живой и вакцины бруцеллезной живой по показателю «Подлинность». БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):61-75. https://doi.org/10.30895/2221-996X-2024-24-1-61-75
For citation:
Kasina I.V., Alekseeva S.A., Nemirovskaya T.I. Application of alternative identification methods for live tularaemia and brucellosis vaccines. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):61-75. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-61-75
Введение
Подлинность биологического лекарственного препарата — один из основных показателей его качества, который подтверждается при помощи различных лабораторных методов в соответствии с требованиями Государственной фармакопеи Российской Федерации1 (ГФ РФ). Согласно этим требованиям для вакцины туляремийной живой2 и вакцины бруцеллезной живой3 испытание качества по показателю «Подлинность» проводится иммунофлуоресцентным методом при помощи коммерческих диагностических препаратов — иммуноглобулинов флуоресцирующих. Альтернативные методы испытаний в ГФ РФ не предусмотрены.
В продолжение поиска перспективных направлений по совершенствованию экспертизы качества биопрепаратов против особо опасных инфекционных заболеваний нами была предпринята попытка использования коммерческих тест-систем и диагностических препаратов отечественного производства (в качестве альтернативы иммуноглобулинам диагностическим флуоресцирующим) для определения показателя «Подлинность» вакцины туляремийной живой и вакцины бруцеллезной живой. Ранее нами опубликованы результаты успешного применения иммунохроматографической тест-системы (ИХ-тест) для испытания качества вакцины туляремийной живой по показателю «Подлинность» [1]. Далее был проведен анализ отечественных коммерческих диагностических препаратов и тест-систем, предназначенных для выявления и идентификации антигенов возбудителей туляремии (Francisella tularensis) и бруцеллеза (Brucella abortus) [2–7]. В качестве возможной альтернативы в испытаниях туляремийной и бруцеллезной вакцин по показателю «Подлинность» выбраны коммерческие диагностические препараты, основанные на реакции агглютинации (РА), реакции непрямой гемагглютинации (РНГА) и иммуноферментного анализа (ИФА) Данные препараты успешно применяются в лабораторной диагностике бруцеллеза и туляремии [8–10].
Цель работы — показать возможность применения для оценки качества вакцины бруцеллезной живой и вакцины туляремийной живой по показателю «Подлинность» в серологических исследованиях (испытаниях) альтернативных методов иммуноферментного анализа, реакции агглютинации, реакции непрямой гемагглютинации.
Для выполнения поставленной цели необходимо решение следующих задач:
- выявление бруцеллезного антигена в вакцине бруцеллезной живой в РА и ИФА с помощью российских диагностических препаратов;
- выявление туляремийного антигена в вакцине туляремийной живой в РА, РНГА и ИФА с помощью российских диагностических препаратов.
Материалы и методы
Материалы
В этой работе авторский коллектив впервые для испытания вакцины туляремийной живой и вакцины бруцеллезной живой по показателю «Подлинность» применил коммерческие диагностические препараты, предназначенные для выявления антигенов возбудителя туляремии или бруцеллеза и основанные на альтернативных методах серологических исследований (испытаний).
В исследованиях использовали следующие материалы:
- вакцина бруцеллезная живая, лиофилизат для приготовления суспензии для подкожного введения и накожного скарификационного нанесения, серия О119 и О120 (АО «НПО «Микроген», Россия) на основе вакцинного штамма B. abortus 19 ВА;
- фармакопейный стандартный образец вакцины бруцеллезной живой, ФСО 3.2.00396 (ОСО 42-28-396, 2021) серии 7 (далее — ФСО вакцины бруцеллезной) (ФГБУ «НЦЭСМП» Минздрава России);
- сыворотка диагностическая поливалентная бруцеллезная сухая для РА по ТУ 9388-011-01898090-2011 (далее — сыворотка бруцеллезная), рег. № ФСР 2012/13323, серия 10 (ФКУЗ «Иркутский научно-исследовательский противочумный институт» Роспотребнадзора, Россия); сыворотка получена из крови кроликов, гипериммунизированных культурой бруцеллезного микроба (вакцинный штамм B. abortus 19 ВА), инактивированной формалином или кипячением;
- набор реагентов «Тест-система диагностическая для выявления возбудителя бруцеллеза в ИФА» (ИФА-Бру-СтавНИПЧИ) по ТУ 9398-011-01897080-2009, рег. № ФСР 2010/06745, серия 1-21 (ФКУЗ «Ставропольский научно-исследовательский противочумный институт» Роспотребнадзора (ФКУЗ Ставропольский противочумный институт Роспотребнадзора, Россия);
- фармакопейный стандартный образец вакцины туляремийной живой ФСО 3.2.00398 (ОСО 42-28-398), серия 011-011221 (ФГБУ «НЦЭСМП» Минздрава России) (далее — ФСО вакцины туляремийной); на основе вакцинного штамма F. tularensis 15 НИИЭГ;
- кандидат в фармакопейный стандартный образец вакцины туляремийной живой ФСО 3.2.00398 (ОСО 42-28-398) серии 012;
- фармакопейный стандартный образец мутности бактериальных взвесей 10 МЕ ФСО 3.1.00085 (ОСО 42-28-85) (ФГБУ «НЦЭСМП» Минздрава России) (далее — ФСО мутности 10 МЕ) для определения мутности бактериальных взвесей методом визуального сравнения;
- сыворотка диагностическая туляремийная сухая для РА по ТУ 8852-003-01898090-2010 (рег. № ФСР 2011/10029) серия 203 (ФКУЗ «Иркутский научно-исследовательский противочумный институт» Роспотребнадзора, Россия); сыворотка получена из крови лошади, гипериммунизированной вирулентной инактивированной культурой F. tularensis;
- набор реагентов «Тест-система диагностическая для выявления возбудителя туляремии методом ИФА» (ИФА-Тул-СтавНИПЧИ) по ТУ 9398-010-01897080-2009 (рег. № ФСР 2010/06744) серия 2-22 (ФКУЗ Ставропольский противочумный институт Роспотребнадзора, Россия);
- набор реагентов «Диагностикум эритроцитарный туляремийный иммуноглобулиновый жидкий» (РНГА-Тул-Иг-СтавНИПЧИ) по ТУ 9388-023-01897080-2010 (рег. № ФСР 2011/10271) серия 2-22 (ФКУЗ Ставропольский противочумный институт Роспотребнадзора, Россия); представляет собой туляремийные иммуноглобулины, сорбированные на активированных эритроцитах крови барана.
Оборудование
Регистрацию результатов ИФА проводили при помощи микропланшетного спектрофотометра SPECTROstar® Nano производителя BMG LABTECH (Германия) при длине волны λ=492 нм.
Методы
Серологические исследования (испытания) образцов вакцин проводили с применением альтернативных методов ИФА РА, РНГА, с использованием российских диагностических препаратов и тест-систем в соответствии с инструкциями производителей. Как вакцина туляремийная живая, так и вакцина бруцеллезная живая представляют собой лиофилизированные в стабилизирующей среде взвеси живых микробных клеток вакцинных штаммов Francisella tularensis 15 НИИЭГ и B. abortus 19 ВА в определенной концентрации. В ходе работы их восстанавливали в 0,9% растворе NaCl до нужных концентраций, указанных в инструкциях по применению каждого диагностического набора, или использовали в цельном (неразбавленном) виде. Далее образцы испытывали в соответствии с инструкциями.
1. Выявление бруцеллезного антигена в вакцине бруцеллезной живой альтернативными методами
1.1. Реакция агглютинации c применением российского диагностического препарата — сыворотки поливалентной бруцеллезной сухой. Метод основан на взаимодействии клеток бруцеллезного микроба с антителами, содержащимися в поливалентной бруцеллезной сыворотке, с образованием агглютината, видимого невооруженным глазом, в РА на стекле и в пробирке.
Рабочий титр сыворотки (серия 10) в РА на стекле — 1:25, в развернутой (в пробирках) РА — 1:800.
Реакцию агглютинации на стекле считают положительной при появлении в течение 2–3 мин агглютината, ясно видимого невооруженным глазом. При отрицательной реакции смесь сыворотки с культурой остается равномерно мутной. Контроль культуры должен оставаться равномерно мутным.
Результаты развернутой реакции агглютинации (в пробирках) оценивают визуально и считают положительными, если ясно видна невооруженным глазом крупно- или мелкозернистая агглютинация при полном просветлении надосадочной жидкости (картина соответствует 4 крестам по 4-крестовой системе оценки4) и при легкой опалесценции надосадочной жидкости (3 креста). Исследуемая культура может быть отнесена к бруцеллам, если дает положительную РА не менее чем на 2 креста (слабая агглютинация, надосадочная жидкость непрозрачная) в разведении сыворотки не менее 1:800 при отрицательных контрольных реакциях. В контрольных пробирках (контроль культуры и контроль сыворотки) не должно быть агглютината и хлопьев. Если в контрольной пробирке с культурой и 0,9% раствором NaCl обнаруживается агглютинат, реакция оценивается как неспецифическая.
В описываемом исследовании использовали взвеси вакцины бруцеллезной цельной неразведенной, приготовленной по ФСО мутности 10 МЕ, что соответствует концентрации микробных клеток в 1 мл (м.к./мл) вакцины, равной 1,7×10⁹ м.к./мл. Для приготовления нужных взвесей вакцину восстанавливали в 1 мл 0,9% раствора NaCl, затем разводили в 0,9% раствора NaCl до нужных концентраций микробных клеток. Испытания проводили 3 аналитика: 3 серии вакцин, каждая в 3-х повторностях.
1.2. Метод иммуноферментного анализа с применением тест-системы «ИФА-Бру-СтавНИПЧИ». Метод основан на непрямом варианте ИФА: при постановке опыта бруцеллезный антиген, содержащийся в исследуемом материале, специфически взаимодействует с бруцеллезными иммуноглобулинами, сорбированными на планшете. Образовавшийся комплекс «антиген – антитело» выявляют с помощью конъюгата (бруцеллезные антитела, иммобилизированные и меченые пероксидазой хрена). Тест-система выявляет штаммы бруцеллезного микроба в концентрации 1,0×10⁶ м.к./мл и не выявляет гетерологичных штаммов в концентрации 1,0×10⁸ м.к./мл.
Поскольку целью ставилось подтверждение подлинности бруцеллезного штамма в вакцине, а не выявление его в минимальных концентрациях в диагностических целях, то для испытания готовили взвеси вакцины в 0,9% растворе NaCl по ФСО мутности 10 МЕ, соответствующие концентрациям микробных клеток (бруцелл) — 1,7×10⁹ и 1,0×10⁹ м.к./мл, и взвесь цельной вакцины. Для приготовления нужных взвесей вакцину восстанавливали в 1 мл 0,9% раствора NaCl, затем разводили в 0,9% раствора NaCl до нужных концентраций микробных клеток. Опыты ставили в соответствии с инструкцией по применению набора. Испытание проводили на 2-х образцах каждой серии вакцины, все в 2-х повторностях.
Регистрацию и расчет результатов ИФА проводили с помощью микропланшетного спектрофотометра SPECTROstar® Nano при длине волны λ=492 нм. Длительность процедуры измерения оптической плотности не превышала 15 мин. Результаты считали положительными, если оптическая плотность образцов в 2 и более раз превышала оптическую плотность отрицательного контроля.
2. Выявление туляремийного антигена в вакцине туляремийной живой альтернативными методами
2.1. Реакция агглютинации с применением сыворотки туляремийной. Метод основан на взаимодействии антигенов туляремийного микроба с антителами, содержащимися в туляремийной сыворотке, с образованием агглютината, видимого невооруженным глазом, в развернутой РА (в пробирках).
Значение рабочего титра сыворотки серии 203 в развернутой (в пробирках) РА составило 1:3200. Реакцию считают положительной, если ясно видна невооруженным глазом крупно- или мелкозернистая агглютинация (не менее, чем на 2 креста). Исследуемая культура может быть отнесена к туляремийному микробу, если РА с сывороткой оценивается не менее чем на 2 креста со значениями титра до 1:3200 или 1:1600 для данной серии. В контрольных пробирках (контроль культуры и контроль сыворотки) не должно быть агглютината и хлопьев. Если в контрольных пробирках обнаруживается агглютинат, реакция оценивается как неспецифическая.
Вакцину туляремийную живую разводили по ФСО мутности 10 МЕ до концентрации туляремийного микроба, равной 5,0×10⁹ м.к./мл. К 0,5 мл каждого разведения сыворотки добавляли по 0,5 мл вакцинной взвеси, получая разведения сыворотки от 1:100 до 1:3200 (рабочее разведение сыворотки). Одновременно ставили контрольные опыты: контроль антигена и контроль сыворотки. Испытания проводили 3 аналитика. Для РА развернутым методом (в пробирках) каждый аналитик использовал 3 образца каждой из 2-х испытуемых серий вакцины туляремийной живой (ФСО 3.2.00398 и кандидат в ФСО 3.2.00398) и 3 образца сыворотки туляремийной серии 203.
2.2. Метод иммуноферментного анализа с применением тест-системы «ИФА-Тул-СтавНИПЧИ». При постановке метода непрямого ИФА туляремийный антиген, содержащийся в исследуемом материале, специфически взаимодействовал с туляремийными иммуноглобулинами, сорбированными на планшете. Образовавшийся комплекс «антиген – антитело» выявляют с помощью конъюгата (туляремийные антитела, иммобилизированные и меченые пероксидазой хрена). Тест-система выявляет штаммы туляремийного микроба в концентрации 1,0×10⁶ м.к./мл и не выявляет гетерологичные штаммы в концентрации 1,0×10⁸ м.к./мл.
Для испытания приготовили взвеси вакцины с концентрацией микробных клеток (вакцинный штамм F. tularensis 15 НИИЭГ) в 0,9% растворе NaCl по ФСО мутности 10 МЕ, равной 5,0×10⁹ и 1,0×10⁹ м.к./мл, инактивированные нагреванием в соответствии с инструкцией по применению на тест-систему, и неинактивированные. Пробы вакцины исследовали в соответствии с инструкцией по применению набора. Испытание каждого разведения 2-х серий вакцины проводили в 2-х повторностях.
Регистрацию результатов ИФА проводили на микропланшетном спектрофотометр SPECTROstar® Nano при длине волны λ=492 нм. Длительность процедуры измерения оптической плотности не превышала 15 мин. Результаты считали положительными, если оптическая плотность образцов в 2 и более раз была больше оптической плотности отрицательного контроля.
2.3. Реакция непрямой гемагглютинации с применением набора «РНГА-Тул-Иг-СтавНИПЧИ». При постановке РНГА туляремийный антиген, содержащийся в исследуемом материале, специфически взаимодействует с туляремийными иммуноглобулинами, сорбированными на активированных эритроцитах барана. Эритроциты выпадают на дно лунок равномерным слоем в виде «зонтика», занимая не менее 2/3 диаметра сферической поверхности в лунке (в ряде случаев отмечается фестончатое оплывание краев агглютината). При отрицательном результате эритроциты выпадают на дно лунки в виде пуговки или узкого колечка с ровным краем. Диагностикум выявляет в РНГА штаммы туляремийного микроба в разведении 3,12×10⁶ м.к./мл (макрометод) и в разведении 6,25×10⁶ м.к./мл (микрометод) и не выявляет гетерологичные штаммы в разведении 1,0×10⁸ м.к./мл. Определение специфичности РНГА проводили в реакции торможения непрямой гемагглютинации (РТНГА). В качестве положительного контроля выступала прилагаемая к набору инактивированная взвесь туляремийного микроба в концентрации 1,0×10⁹ м.к./мл, которую перед постановкой испытания разводили 0,9% раствором NaCl до концентрации 5,0×10⁷ м.к./мл.
Для испытания в РНГА и РТНГА (для подтверждения специфичности РНГА) готовили взвеси вакцины туляремийной по ФСО мутности 10 МЕ, соответствующей концентрации 5,0×10⁹ м.к./мл, затем их разводили в 0,9% растворе NaCl до концентрации 5,0×10⁷ м.к./мл. В испытании применяли взвеси вакцины: инактивированные в соответствии с инструкцией по применению на диагностикум и неинактивированные. Три аналитика проводили испытание 2-х серий вакцины (ФСО 3.2.00398 и кандидат в ФСО 3.2.00398) на 2-х образцах (инактивированные и неинактивированные вакцины), все в 2-х повторностях.
Статистическая обработка данных
Методы РА и РНГА дают качественные реакции образования комплексов «антиген – антитело», результаты оценивали визуально, поэтому статистическую обработку не проводили.
Результаты, полученные методом ИФА, оценивали статистически при помощи программы Microsoft Office Excel. Определяли погрешности значений результатов ИФА с доверительной вероятностью 95%.
Результаты и обсуждение
1. Результаты оценки качества вакцины бруцеллезной живой по показателю «Подлинность» альтернативными методами
1.1. Реакция агглютинации с применением российского диагностического препарата — сыворотки диагностической поливалентной бруцеллезной сухой. При испытании цельной (неразведенной) вакцины бруцеллезной живой с помощью сыворотки бруцеллезной в разведении 1:25 были получены положительные результаты РА на стекле для всех исследуемых серий. В течение 2–3 мин во всех постановках появился агглютинат, ясно видимый невооруженным глазом. В контроле смесь вакцины и 0,9% раствора NaCl осталась равномерно мутной (рис. 1, табл. 1).
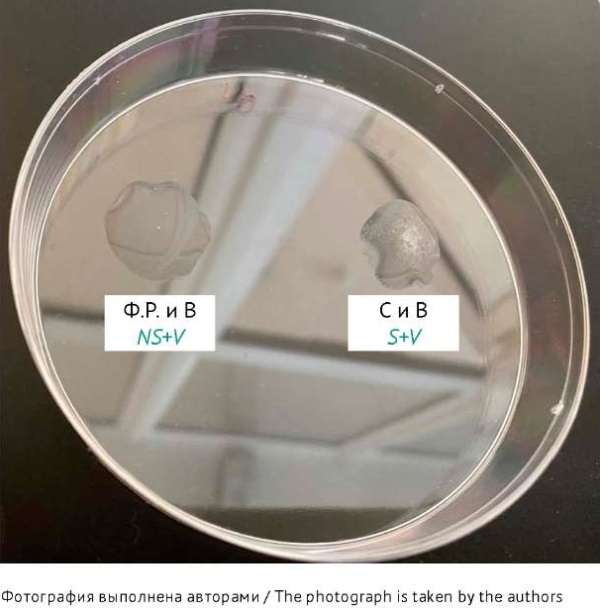
Рис. 1. Результаты испытания вакцины бруцеллезной живой по показателю «Подлинность» в реакции агглютинации на стекле. Учет через 2–3 мин. Ф.Р. и В — контроль: 0,9% раствор NaCl (Ф.Р.) со взвесью восстановленной цельной вакцины (В), видно отсутствие агглютинации; С и В — опыт: взвесь восстановленной цельной вакцины (В) с диагностическим препаратом сыворотки (С) бруцеллезной в разведении 1:25, наблюдается крупнозернистая агглютинация при полном просветлении жидкости.
Fig. 1. Results of live brucellosis vaccine identification by slide agglutination with examination after 2–3 min. NS+V, control sample (0.9% NaCl solution (NS) with undiluted reconstituted vaccine suspension (V)); no agglutination. S+V, test sample (reconstituted undiluted vaccine suspension (V) with brucellosis serum diagnostic reagent (S) at a dilution of 1:25); coarse agglutination with complete liquid clarification.
Таблица 1. Результаты оценки качества вакцины бруцеллезной живой
по показателю «Подлинность» в реакции агглютинации на стекле
Table 1. Results of live brucellosis vaccine identification by slide agglutination
Повторность* Replicate* | Визуальная оценка РА** Visual evaluation of agglutination** | |||||||
ФСО RS | О119 | О120 | Контроль*** Control*** | |||||
Ц UD | 10 МЕ 10 IU | Ц UD | 10 МЕ 10 IU | Ц UD | 10 МЕ 10 IU | Кц CUD | К10 МЕ C10 IU | |
1 | + | – | + | – | + | – | – | – |
2 | + | – | + | – | + | – | – | – |
3 | + | – | + | – | + | – | – | – |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. РА — реакция агглютинации; ФСО — ФСО 3.2.00396 вакцины бруцеллезной живой (I аналитик); О119 (II аналитик), О120 (III аналитик) — коммерческие серии вакцины бруцеллезной живой; Ц — восстановленная цельная (неразбавленная) вакцина бруцеллезная живая; 10 МЕ — взвесь вакцины, приготовленная по ФСО мутности бактериальных взвесей 10 МЕ, что соответствует концентрации микробных клеток (м.к.) 1,7×10⁹ м.к./мл; Кц — контроль цельной вакцины; К — контроль разбавленной вакцины (10 МЕ); «—» — результаты РА через стандартное оценочное время (2–3 мин) не проявились (только через 30 мин).
* в каждой повторности — 1 образец вакцины и 1 образец сыворотки диагностической поливалентной бруцеллезной в разведении 1:25.
** оценка через 2–3 мин от начала опыта.
*** 0,9% раствор NaCl со взвесью вакцины бруцеллезной живой.
Note. RS, pharmacopoeial reference standard No. 3.2.00396 for live brucellosis vaccine (analyst I); O119 (analyst II) and O120 (analyst III), commercial batches of live brucellosis vaccine; UD, undiluted reconstituted live brucellosis vaccine; 10 IU, vaccine suspension prepared using the pharmacopoeial reference standard (RS) for the bacterial suspension opacity of 10 international opacity units (IU), which corresponds to a microbial concentration of 1.7×10⁹ cells/mL; CUD, control, undiluted vaccine; C, control, diluted vaccine (10 IU); —, agglutination appeared only after 30 min, not after the standard evaluation time of 2–3 min.
* Each replicate included 1 sample of live brucellosis vaccine and 1 sample of diagnostic polyvalent brucellosis serum at a dilution of 1:25.
** The result was evaluated after 2–3 min from the beginning of the experiment.
*** This control sample constituted of 0.9% NaCl and suspended live brucellosis vaccine.
В испытании образцов разведенных вакцин, соответствующих 10 МЕ по ФСО мутности, во всех образцах появился агглютинат, ясно видимый невооруженным глазом. Однако, в отличие от опытов с неразведенной вакциной, РА в случаях разведения прошла с большой задержкой по времени: положительные результаты для всех исследуемых серий были получены только через 30 мин. Исходя из полученных результатов авторы рекомендуют проводить РА на стекле со взвесью неразведенной восстановленной вакцины (табл. 1). В контроле (вакцина и 0,9% раствор NaCl) смесь остается равномерно мутной.
При постановке развернутой РА (в пробирках) получены положительные результаты РА со всеми образцами бруцеллезной вакцины и сыворотки (табл. 2). Наблюдалась крупнозернистая агглютинация (4 креста) при полном просветлении надосадочной жидкости в титре сыворотки 1:400, а также мелкозернистая агглютинация при легкой опалесценции надосадочной жидкости (3 креста) в рабочем разведении сыворотки бруцеллезной 1:800. Как следует из инструкции по применению сыворотки бруцеллезной, исследуемая культура может быть отнесена к бруцеллам, если дает положительную РА в разведении не менее 1:800 при отрицательных контрольных реакциях.
Таблица 2. Результаты оценки качества вакцины бруцеллезной живой
по показателю «Подлинность» в развернутой реакции агглютинации (в пробирках)
Table 2. Results of live brucellosis vaccine identification by tube agglutination
Повторность* Replicate* | Визуальная оценка РА** Visual evaluation of agglutination** | Контроль*** Control*** | |||||||||||
ФСО RS | О119 | О120 | |||||||||||
Титр сыворотки Serum titre | |||||||||||||
1:100 | 1:200 | 1:400 | 1:800 | 1:100 | 1:200 | 1:400 | 1:800 | 1:100 | 1:200 | 1:400 | 1:800 | ||
1 | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | – |
2 | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | – |
3 | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | – |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. РА — реакция агглютинации; ФСО — фармакопейный стандартный образец ФСО 3.2.00396 вакцины бруцеллезной живой (I аналитик); О119 (II аналитик), О120 (III аналитик) — коммерческие серии вакцины бруцеллезной живой;
«—» — отсутствие РА.
* Для РА брали по 1 образцу вакцины бруцеллезной живой и сыворотки диагностической поливалентной бруцеллезной (вакцинный штамм Brucella abortus 19 ВА).
** Оценка по 4-крестовой схеме: «4+» — крупно- или мелкозернистая агглютинация при полном просветлении надосадочной жидкости, «3+» — легкая опалесценция надосадочной жидкости.
*** 0,9% раствор NaCl со взвесью неразбавленной восстановленной вакцины бруцеллезной живой.
Note. RS, pharmacopoeial reference standard No. 3.2.00396 for live brucellosis vaccine (analyst I); O119 (analyst II) and O120 (analyst III), commercial batches of live brucellosis vaccine; —, no agglutination.
* Experiments included 1 sample of live brucellosis vaccine and 1 sample of diagnostic polyvalent brucellosis serum (Brucella abortus 19 BА).
** The test used the standard 4+ agglutination grading system: 4+, coarse or fine agglutination with complete supernatant clarification, 3+, slight supernatant opalescence.
*** This control sample consisted of 0.9% NaCl and suspended undiluted reconstituted live brucellosis vaccine.
В контрольных пробирках (контроль культуры и контроль сыворотки) агглютината и хлопьев не обнаружено. В контрольных по сыворотке опытах раствор оставался прозрачным, в контрольных по вакцине — взвесь осталась равномерно мутной.
На основе полученных результатов можно сделать вывод, что использование РА позволяет подтвердить подлинность B. abortus в вакцине бруцеллезной живой.
1.2. Иммуноферментный анализ с применением тест-системы «ИФА-Бру-СтавНИПЧИ». В ходе проведения испытаний вакцины бруцеллезной живой методом ИФА (табл. 3) значения оптической плотности во всех анализах практически совпали с результатами положительного контроля, входящего в набор реагентов «Тест-система диагностическая для выявления возбудителя бруцеллеза в ИФА» (ИФА-Бру-СтавНИПЧИ). Оптическая плотность исследуемых образцов вакцины и положительного контроля в 2 и более раз превышала оптическую плотность отрицательного контроля, что свидетельствует о наличии в образцах бруцеллезного микроба и подтверждает подлинность вакцины бруцеллезной живой. Разные исследуемые концентрации бруцеллезного микроба в вакцине не влияют на значения оптической плотности, поскольку реакция качественная (подтверждает наличие бруцеллезного антигена, а не определяет его концентрацию).
Таблица 3. Результаты оценки качества вакцины бруцеллезной живой
по показателю «Подлинность» методом иммуноферментного анализа
Table 3. Results of live brucellosis vaccine identification by immunoenzyme assay
Образец вакцины Vaccine sample | Оптическая плотность образцов, опт. ед. Optical density of samples, optical density units | ||||||||||||||
ФСО RS | О119 | О120 | К+ C+ | К– C– | |||||||||||
Повторность Replicate | |||||||||||||||
1 | 2 | Хср±2S Xmean±2S | 1 | 2 | Хср±2S Xmean±2S | 1 | 2 | Хср±2S Xmean±2S | 1 | 2 | Хср±2S Xmean±2S | 1 | 2 | Хср±2S Xmean±2S | |
А | 0,126 | 0,113 | 0,125±0,014 (3,470 от К– / relative to C–) | 0,112 | 0,131 | 0,124±0,014 (3,450 от К– / relative to C–) | 0,121 | 0,134 | 0,128±0,009 (3,600 от К– / relative to C–) | 0,125 | 0,127 | 0,123±0,007 | 0,036 | 0,034 | 0,036±0,003 |
0,132 | 0,130 | 0,122 | 0,129 | 0,127 | 0,128 | 0,117 | 0,122 | 0,038 | 0,035 | ||||||
В | 0,121 | 0,114 | 0,122±0,006 (3,400 от К– / relative to C–) | 0,133 | 0,128 | 0,127±0,013 (3,500 от К– / relative to C–) | 0,127 | 0,134 | 0,132±0,012 (3,700 от К– / relative to C–) | – | – | – | – | ||
0,126 | 0,126 | 0,130 | 0,115 | 0,136 | 0,132 | – | – | – | – | ||||||
С | 0,134 | 0,122 | 0,127±0,008 (3,500 от К– / relative to C–) | 0,130 | 0,113 | 0,123±0,011 (3,400 от К– / relative to C–) | 0,109 | 0,110 | 0,117±0,013 (3,300 от К– / relative to C–) | – | – | – | – | ||
0,127 | 0,124 | 0,125 | 0,123 | 0,123 | 0,125 | – | – | – | – | ||||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ФСО — фармакопейный стандартный образец ФСО 3.2.00396 вакцины бруцеллезной живой; О119, О120 — коммерческие серии вакцины бруцеллезной живой (вакцинный штамм Brucella abortus 19 ВА); К+ — положительный контроль со взвесью инактивированной культуры B. abortus 19 ВА из диагностической тест-системы, концентрация микробных клеток (м.к.) 1,0×10⁹ м.к./мл; К– — отрицательный контроль с рабочими растворами диагностической тест-системы; Хср — среднее значение показателя по объединенной выборке, 2S — два стандартных отклонения результатов испытаний; А — разведенная вакцина концентрацией 1,0×10⁹ м.к./мл (как в положительном контроле); В — вакцина разведенная концентрацией 1,7×10⁹ м.к./мл (по ФСО мутности бактериальных взвесей 10 МЕ); С — образцы вакцин цельных восстановленных концентрацией: ФСО — 5,5×10¹⁰ м.к./мл, О119 — 7,0×10¹⁰ м.к./мл, О120 — 5,8×10¹⁰ м.к./мл.
«–» — различия в результатах контролей (из набора тест-системы) ничтожно малы и статистические незначимы, поэтому считали результаты одинаковыми для всех опытов (данные представлены в верхних ячейках) со всеми образцами вакцины бруцеллезной живой.
Note. RS, pharmacopoeial reference standard No. 3.2.00396 for live brucellosis vaccine; O119 and O120, commercial batches of live brucellosis vaccine (Brucella abortus 19 BА); C+, positive control, suspended inactivated B. abortus 19 ВА culture from the diagnostic test kit at a concentration of 1.0×10⁹ cells/mL; C–, negative control, working solutions from the diagnostic test kit; Xmean, mean value for the combined sample; S, standard deviation for the test results; A, diluted vaccine at a concentration of 1.0×10⁹ cells/mL (at the same concentration as positive control samples); B, diluted vaccine at a concentration of 1.7×10⁹ cells/mL (according to the pharmacopoeial RS for bacterial suspension opacity of 10 IU); C, undiluted vaccine at concentrations of 5.5×10¹⁰ cells/mL (RS No. 3.2.00396), 7.0×10¹⁰ cells/mL (O119), and 5.8×10¹⁰ cells/mL (O120).
– Since the difference between the control (test kit) results was negligible and statistically insignificant, the results of all experiments with live brucellosis vaccine samples were considered virtually the same (see the upper cell of the corresponding column).
2. Результаты оценки качества вакцины туляремийной живой по показателю «Подлинность» альтернативными методами
2.1. Реакция агглютинации с применением диагностического препарата — сыворотки туляремийной сухой. Как видно из таблицы 4, в случае применения РА для всех образцов вакцины в исследуемой концентрации 5,0×10⁹ м.к./мл были получены положительные результаты. При испытании ФСО вакцины туляремийной живой в титре сыворотки 1:1600 всеми аналитиками наблюдалась крупнозернистая агглютинация при полном просветлении надосадочной жидкости (4 креста), в рабочем разведении сыворотки туляремийной 1:3200 — мелкозернистая агглютинация при легкой опалесценции надосадочной жидкости (3 креста). При испытании кандидата в ФСО вакцины туляремийной живой наблюдалась мелкозернистая агглютинация при легкой опалесценции надосадочной жидкости (3 креста) как в титре сыворотки 1:1600, так и в рабочем разведении 1:3200.
Таблица 4. Результаты оценки качества вакцины туляремийной живой по показателю «Подлинность» в развернутой реакции агглютинации
Table 4. Results of live tularaemia vaccine identification by tube agglutination
Образец Sample | Повторность* Replicate* | Визуальная оценка РА** Visual evaluation of agglutination** | |||||||||||
ФСО RS | Кандидат в ФСО Candidate RS | ||||||||||||
Титр сыворотки Serum titre | |||||||||||||
1:100 | 1:200 | 1:400 | 1:800 | 1:1600 | 1:3200 | 1:100 | 1:200 | 1:400 | 1:800 | 1:1600 | 1:3200 | ||
I | 1 | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 3+ | 3+ |
2 | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 3+ | 3+ | |
3 | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 3+ | 3+ | |
II | 1 | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 3+ | 3+ |
2 | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 3+ | 3+ | |
3 | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 3+ | 3+ | |
III | 1 | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 3+ | 3+ |
2 | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 3+ | 3+ | |
3 | 4+ | 4+ | 4+ | 4+ | 4+ | 3+ | 4+ | 4+ | 4+ | 4+ | 3+ | 3+ | |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ФСО — фармакопейный стандартный образец вакцины туляремийной живой ФСО 3.2.00398 (ОСО 42-28-398) серии 011-011222; кандидат в ФСО — кандидат в ФСО вакцины туляремийной живой ФСО 3.2.00398 серии 012; РА — реакция агглютинации.
* постановка РА: по 1 образцу вакцины туляремийной живой и сыворотки диагностической туляремийной сухой.
** оценка по 4-крестовой схеме: 4+ (4 креста) — крупно- или мелкозернистая агглютинация при полном просветлении надосадочной жидкости, 3+ (3 креста ) — легкая опалесценция надосадочной жидкости.
Note. RS, pharmacopoeial reference standard No. 3.2.00398 for live tularaemia vaccine (industry reference material No. 42-28-398), batch 011-011222; candidate RS, candidate pharmacopoeial RS No. 3.2.00398 for live tularaemia vaccine, batch 012.
* Agglutination experiments included 1 sample of live tularaemia vaccine and 1 sample of dry diagnostic tularaemia serum.
** The test used the standard 4+ agglutination grading system: 4+, coarse or fine agglutination with complete supernatant clarification, 3+, slight supernatant opalescence.
Согласно инструкции по применению сыворотки туляремийной исследуемая культура может быть отнесена к туляремийному микробу, если выявлена положительная РА в разведении не менее 1:1600 при отрицательных контрольных реакциях. В контрольных пробирках (контроль культуры и контроль сыворотки) агглютината и хлопьев не обнаружено. Образец в контроле сыворотки оставался прозрачным, в контроле взвеси вакцины в исследуемой концентрации 5,0×10⁹ м.к./мл — равномерно мутным. Соответственно, в РА была подтверждена подлинность туляремийного штамма в исследуемом образце вакцины туляремийной живой.
2.2. Метод иммуноферментного анализа с применением тест-системы «ИФА-Тул-СтавНИПЧИ». При испытании вакцины туляремийной живой в ИФА (табл. 5) значения оптической плотности исследуемых образцов вакцины во всех анализах практически совпали с результатами положительного контроля, входящего в набор «Тест-система диагностическая для выявления возбудителя туляремии» (ИФА-Тул-СтавНИПЧИ). Оптическая плотность образцов вакцины и положительного контроля в 2 и более раз превышала оптическую плотность отрицательного контроля, что свидетельствует о наличии в образцах туляремийного микроба и подтверждает подлинность вакцины туляремийной живой. Результаты по инактивированной и неинактивированной вакцинам не отличались, следовательно, можно проводить испытания с неинактивированной вакциной. Необходимо отметить, что изменение концентрации туляремийного микроба в вакцине не оказывало значительного влияния на показатели оптической плотности. Реакция была качественной и подтвердила наличие в исследуемых образцах туляремийного антигена.
Таблица 5. Результаты оценки качества вакцины туляремийной живой
по показателю «Подлинность» методом иммуноферментного анализа
Table 5. Results of live tularaemia vaccine identification by immunoenzyme assay
Концентрация вакцины, м.к./мл Vaccine concentration, cells/mL | Тип вакцины Vaccine type | Оптическая плотность образцов, опт. ед. Optical density of samples, optical density units | |||||||||||||
ФСО RS | Кандидат в ФСО Candidate RS | К+ C+ | К– C– | ||||||||||||
Повторность Replicate | |||||||||||||||
1 | 2 | 3 | Хср±2S Xmean±2S | 1 | 2 | 3 | Хср±2S Xmean±2S | 1 | 2 | Хср±2S Xmean±2S | 1 | 2 | Хср±2S Xmean±2S | ||
1×10⁹ | И NA | 2,298 | 2,283 | 2,112 | 2,133±0,273 (25,1 от К– / relative to C–) | 1,871 | 1,872 | 1,903 | 1,933±0,129 (22,7 от К– / relative to C–) | 1,903 | 1,966 | 1,942±0,056 | 0,086 | 0,084 | 0,086±0,013 |
2,127 | 2,010 | 1,966 | 2,036 | 1,945 | 1,971 | ||||||||||
нИ A | 2,189 | 2,186 | 2,172 | 2,080±0,246 (23,6 от К– / relative to C–) | 2,047 | 2,025 | 1,867 | 1,978±0,160 (22,5 от К– / relative to C–) | 1,921 | 1,976 | 1,949±0,078 | 0,097 | 0,078 | 0,088±0,027 | |
1,966 | 2,065 | 1,905 | 1,898 | 2,058 | 1,975 | ||||||||||
10 МЕ (5×10⁹) 10 IU (5×10⁹) | И NA | 2,225 | 2,176 | 2,313 | 2,067±0,405 (24,3 от К– / relative to C–) | 2,051 | 2,059 | 2,199 | 1,973±0,306 (23,2 от К– / relative to C–) | – | – | – | – | – | – |
2,013 | 1,829 | 1,848 | 1,883 | 1,821 | 1,827 | – | – | – | – | – | – | ||||
нИ A | 2,216 | 2,150 | 2,207 | 2,068±0,274 (23,5 от К– / relative to C–) | 2,280 | 2,064 | 2,158 | 2,050±0,318 (23,3 от К– / relative to C–) | – | – | – | – | – | – | |
1,967 | 1,936 | 1,934 | 1,969 | 2,007 | 1,819 | – | – | – | – | – | – | ||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ФСО — фармакопейный стандартный образец вакцины туляремийной живой ФСО 3.2.00398 (ОСО 42-28-398) серии 011-011222 (3 повторности); К+ — положительный контроль (взвесь инактивированной культуры Francisella tularensis из набора тест-системы, концентрация микробных клеток (м.к.) на 1 мл вакцины 1,0×10⁹ м.к./мл; К– — отрицательный контроль (рабочие растворы тест-системы); тип вакцины туляремийной живой: И — инактивированные (по 2 аналитика); нИ — неинактивированные (по 2 аналитика); Хср — среднее значение показателя по объединенной выборке, 2S — два стандартных отклонения результатов испытаний.
«–» — различия в результатах контролей (из набора тест-системы) ничтожно малы и статистические незначимы, поэтому считали результаты одинаковыми для всех опытов (данные представлены в верхних ячейках) со всеми образцами вакцины туляремийной живой.
Note. RS, pharmacopoeial reference standard No. 3.2.00398 for live tularaemia vaccine (industry reference material No. 42-28-398), batch 011-011222 (3 replicates); C+, positive control, suspended inactivated Francisella tularensis culture from the diagnostic test kit at a concentration of 1.0×10⁹ cells/mL; C–, negative control, working solutions from the diagnostic test kit; NA, inactivated vaccine (2 analysts); A, not inactivated vaccine (2 analysts); Xmean, mean value for the combined sample; S, standard deviation for the test results.
– Since the difference between the control (test kit) results was negligible and statistically insignificant, the results of all experiments with live brucellosis vaccine samples were considered virtually the same (see the upper cell of the corresponding column).
2.3. Реакция непрямой гемагглютинации с применением набора «РНГА-Тул-Иг-СтавНИПЧИ». В таблице 6 представлены результаты испытания вакцины туляремийной живой в РНГА при помощи набора реагентов «Диагностикум эритроцитарный туляремийный иммуноглобулиновый жидкий» (РНГА-Тул-Иг-СтавНИПЧИ) в сравнении с положительным контролем. Все 3 аналитика наблюдали положительную гемагглютинацию в образцах вакцины с концентрациями 2,5×10⁷, 1,25×10⁷ м.к./мл, а также 6,25×10⁶ м.к./мл (как в положительном контроле набора реагентов). Данные результаты свидетельствуют о наличии в исследуемых образцах туляремийного микроба, что, в свою очередь, подтверждает подлинность вакцины туляремийной живой. Специфичность РНГА была подтверждена постановкой РТНГА. В контрольных лунках был получен отрицательный результат (эритроциты выпали на дно лунки в виде пуговки).
Таблица 6. Результаты оценки качества вакцины туляремийной живой
по показателю «Подлинность» в реакции непрямой гемагглютинации (микрометодом)
Table 6. Results of live tularaemia vaccine identification by micro-indirect haemagglutination
Аналитик Analyst | Повторность, a/b Replicate, a/b | Визуальная оценка РНГА* Visual evaluation of indirect haemagglutination* | |||||||
ФСО RS | Кандидат в ФСО Candidate RS | ||||||||
Концентрация вакцины, м.к./мл Vaccine concentration, cells/mL | К– C– | Концентрация вакцины, м.к./мл Vaccine concentration, cells/mL | К– C– | ||||||
2,5×10⁷ | 1,25×10⁷ | 6,25×10⁶ | 2,5×10⁷ | 1,25×10⁷ | 6,25×10⁶ | ||||
I | 1/1 | + | + | + | – | + | + | + | – |
1/2 | + | + | + | – | + | + | + | – | |
2/1 | + | + | + | – | + | + | + | – | |
2/2 | + | + | + | – | + | + | + | – | |
II | 1/1 | + | + | + | – | + | + | + | – |
1/2 | + | + | + | – | + | + | + | – | |
2/1 | + | + | + | – | + | + | + | – | |
2/2 | + | + | + | – | + | + | + | – | |
III | 1/1 | + | + | + | – | + | + | + | – |
1/2 | + | + | + | – | + | + | + | – | |
2/1 | + | + | + | – | + | + | + | – | |
2/2 | + | + | + | – | + | + | + | – | |
К+ C+ | 1 | + | + | + | Не применимо N/A | + | + | + | Не применимо N/A |
2 | + | + | + | + | + | + | |||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. а — номер образца вакцины; b — номер опыта; РНГА — реакция непрямой агглютинации (микрометод); ФСО — фармакопейный стандартный образец ФСО 3.2.00398 вакцины туляремийной живой; К– — отрицательный контроль (разводящая жидкость из набора); К+ — взвесь инактивированной культуры туляремийного микроба (вакцинный штамм Francisella tularensis 15 НИИЭГ) с концентрацией микробных клеток (м.к.) 1,0×10⁹ м.к./мл.
* Критерии оценки: «+» — положительный результат РНГА: эритроциты выпадают на дно лунок равномерным слоем в виде зонтика, занимая не менее 2/3 диаметра сферической поверхности в лунке (в ряде случаев — фестончатое оплывание краев агглютината); «–» — отрицательный результат РНГА: эритроциты выпадают на дно лунки в виде пуговки или узкого колечка с ровным краем.
Note. a, vaccine sample number; b, experiment number; RS, pharmacopoeial reference standard No. 3.2.00398 for live tularaemia vaccine; C–, negative control (diluent from the kit); C+, suspended inactivated culture of tularaemia microbe (Francisella tularensis 15 NIIEG) at a concentration of 1.0×10⁹ cells/mL; N/A, not applicable.
* Evaluation criteria: +, positive result with erythrocytes settling to the bottom of the wells as a uniform umbrella-like mat occupying at least 2/3 of the spherical well surface (in some cases, the edges can be scalloped); –, negative result with erythrocytes settling to the bottom of the wells as a button or a narrow ring with smooth edges.
Сравнительный анализ альтернативных методов в оценке качества вакцин
Результаты проведенных сравнительных серологических исследований (испытаний) альтернативными методами — РА, РНГА, ИФА — показали принципиальную возможность применения данных методов для определения показателя «Подлинность» вакцины бруцеллезной живой и вакцины туляремийной живой, причем с использованием коммерческих тест-систем и диагностических препаратов отечественного производства. Однако анализ полученных результатов не позволяет рекомендовать ИФА для определения показателя «Подлинность» указанных вакцин, так как данный метод трудоемок и менее экономичен, чем РА. Для проведения ИФА требовалось приготовление большого количество рабочих растворов, дополнительная сенсибилизация и инкубирование планшетов, использование считывающего оборудования. Метод ИФА более удобен для применения в лабораторной диагностике для идентификации туляремийного и бруцеллезного микробов в биологическом и клиническом материале, исследования объектов внешней среды, так как одновременно позволяет тестировать 46 образцов, подозрительных на содержание F. tularensis и B. abortus.
Метод РНГА менее удобен, информативен и экономичен, чем РА, поэтому его применение более целесообразно в лабораторной диагностике туляремийного микроба, так как одновременно позволяет исследовать до 100 образцов, подозрительных на содержание F. tularensis.
Результаты экспериментов позволяют сделать вывод, что РА может быть оптимальным альтернативным методом испытания по показателю «Подлинность» вакцины бруцеллезной живой и вакцины туляремийной живой. Основные преимущества данного метода:
- простота и удобство применения без использования дополнительного оборудования и трудоемкой пробоподготовки, экономия времени;
- специфичность метода, обеспечивающая получение достоверных результатов;
- экономичность— невысокая цена, длительный срок годности диагностического препарата (5 лет — для сыворотки туляремийной, 3 года — для сыворотки бруцеллезной).
Выводы
- Результаты проведенных серологических испытаний с использованием метода иммуноферментного анализа, реакции агглютинации и реакции непрямой гемагглютинации показали принципиальную возможность применения этих альтернативных методов для оценки качества вакцины бруцеллезной живой и вакцины туляремийной живой по показателю «Подлинность» и, что особенно важно в современных условиях, с применением российских диагностических препаратов.
- Реакция агглютинации на стекле или при развернутой постановке (в пробирках) с использованием диагностического препарата — сыворотки поливалентной бруцеллезной сухой, а также реакция агглютинации с развернутой постановкой с применением сыворотки диагностической туляремийной сухой позволяют упростить испытания по показателю «Подлинность» без потери качества и могут служить эффективными альтернативными методами оценки качества вакцин.
- Применение методов иммуноферментного анализа и реакции непрямой гемагглютинации по сравнению с реакцией агглютинации менее предпочтительно по причине их неэкономичности и трудоемкости. Рекомендовать их для оценки качества по показателю «Подлинность» как вакцины бруцеллезной живой, так и вакцины туляремийной живой в настоящее время нецелесообразно.
- Метод реакции агглютинации может быть рекомендован для внесения в требования нормативных документов на вакцину бруцеллезную живую и вакцину туляремийную живую в качестве альтернативного метода при проведении оценки качества вакцин по показателю «Подлинность».
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: И.В. Касина — разработка дизайна и концепции экспериментального исследования, теоретическое обоснование и экспериментальная работа по оценке качества вакцины по показателю «Подлинность» вакцины туляремийной живой, обобщение экспериментальных данных, анализ и интерпретация результатов исследования, написание и критический пересмотр текста рукописи; С.А. Алексеева — экспериментальная работа по оценке качества вакцины по показателю «Подлинность» вакцины бруцеллезной живой, анализ и интерпретация результатов исследования, написание текста рукописи; Т.И. Немировская — общее руководство, критический анализ текста рукописи, утверждение окончательной версии статьи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. I.V. Kasina conceptualised and designed the study, provided a theoretical justification for the study, conducted identification experiments for the live tularaemia vaccine, summarised experimental data, analysed and interpreted the study results, drafted and critically revised the manuscript. S.A. Alekseeva conducted identification experiments for the live brucellosis vaccine, analysed and interpreted the study results, and drafted the manuscript. T.I. Nemirovskaya provided general guidance, critically revised the manuscript, and approved the final version for publication.
1. ОФС.7.1.0018.18 Иммунобиологические лекарственные препараты. Государственная фармакопея Российской Федерации. ХIV изд. Т. 2. М.; 2018.
2. ФС.3.3.1.0019.15 Вакцина туляремийная живая. Государственная фармакопея Российской Федерации. XIV изд. Т. 4. М.; 2018.
3. ФС.3.3.1.0011.15 Вакцина бруцеллезная живая. Государственная фармакопея Российской Федерации. XIV изд. Т. 4. М.; 2018.
4. Оценка реакции агглютинации по 4-крестовой схеме: 4 креста (++++) — полное просветление надосадочной жидкости, крупно- или мелкозернистая агглютинация на дне в виде зонтика; 3 креста (+++) — легкая опалесценция, неполное просветление и надосадочной жидкости, хорошо выраженный зонтик агглютината; 2 креста (++) — неполное просветление жидкости, слабая агглютинация — зонтик умеренно выражен; 1 крест (+) — следы агглютинации, надосадочная жидкость непрозрачная; «–» — отрицательный результат: агглютинация не наблюдается, жидкость равномерно мутная.
Список литературы
1. Касина ИВ, Алексеева СА, Бердникова ЗЕ, Немировская ТИ, Алехина АС. Перспективы совершенствования экспертизы качества вакцины туляремийной живой. Биопрепараты. Профилактика, диагностика, лечение. 2017;17(4):240–7. EDN: ZXGLLX
2. Онищенко ГГ, Кутырев ВВ, ред. Лабораторная диагностика опасных инфекционных болезней. Практическое руководство. М.: ЗАО «Шико»; 2013. EDN: SHFBUN
3. Шепелин ИА, Миронов АЮ, Шепелин КА. Возбудители особо опасных бактериальных инфекций. Справочник бактериолога. М.: ЗАО «А-Принт»; 2016. EDN: WJJXGZ
4. Андреевская НМ, Михайлова ВА, Каретникова ЭС, Атлас АГ, Михайлов ЛМ, Калиновский АИ и др. Изучение и испытание экспериментально-производственных серий поливалентной бруцеллезной сыворотки. Acta Biomedica Scientifica. 2012;5(1):187–9. EDN: PIWDND
5. Аракелян ПК, Разницына ГВ, Димов СК, Гаус НФ. Способ изготовления бруцеллезной диагностической сыворотки. Патент Российской Федерации № 2549434; 2015. EDN: WAEEMV
6. Курчева СА, Тюменцева ИС, Афанасьев ЕН, Жданова ЕВ, Старцева ОЛ, Жарникова ИВ и др. Разработка диагностической тест-системы для выявления специфических антител к возбудителю бруцеллеза в непрямом методе иммуноферментного анализа. Современные проблемы науки и образования. 2016;(2):e64. EDN: VUCUXD
7. Еремкин АВ, Елагин ГД, Печенкин ДВ, Фоменков ОО, Богачева НВ, Кытманов АА и др. Разработка иммуноферментной и иммунохроматографической моноклональных тест-систем для выявления возбудителя туляремии. Клиническая лабораторная диагностика. 2016;61(3):184–7. EDN: VXLOFZ
8. Губарева ТИ, Уланова ГИ. Анализ эффективности применения методов лабораторного исследования на природно-очаговые инфекции. В кн.: Важнейшие вопросы инфекционных и паразитарных болезней. VI сборник научных работ. Ижевск; 2018. С. 26–8. EDN: YYQXRR
9. Жарникова ИВ, Курчева СА, Русанова ДВ, Жарникова ТВ. Аналитические характеристики диагностических препаратов для иммуноанализа особо опасных инфекций. Вестник биотехнологии и физико-химической биологии им. Ю.А. Овчинникова. 2020;16(3):36–42 (In Russ.). EDN: NMWSEM
10. Кретенчук ОФ. Отечественные средства диагностики особо опасных инфекций на основе моноклональных антител. Проблемы особо опасных инфекций. 2021;(4):35–45. https://doi.org/10.21055/0370-1069-2021-4-35-45
Об авторах
И. В. КасинаРоссия
Касина Ирина Владимировна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, 127051, Москва
С. А. Алексеева
Россия
Алексеева Светлана Александровна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, 127051, Москва
Т. И. Немировская
Россия
Немировская Татьяна Ивановна, канд. мед. наук
Петровский б-р, д. 8, стр. 2, 127051, Москва
Дополнительные файлы
Рецензия
Для цитирования:
Касина И.В., Алексеева С.А., Немировская Т.И. Применение альтернативных методов оценки качества вакцины туляремийной живой и вакцины бруцеллезной живой по показателю «Подлинность». БИОпрепараты. Профилактика, диагностика, лечение. 2024;24(1):61-75. https://doi.org/10.30895/2221-996X-2024-24-1-61-75
For citation:
Kasina I.V., Alekseeva S.A., Nemirovskaya T.I. Application of alternative identification methods for live tularaemia and brucellosis vaccines. Biological Products. Prevention, Diagnosis, Treatment. 2024;24(1):61-75. (In Russ.) https://doi.org/10.30895/2221-996X-2024-24-1-61-75


































